Молекулярная биология, 2022, T. 56, № 6, стр. 1095-1103
Высокая гетерогенность вируснейтрализующей и RBD-связывающей активности сывороточных антител у реконвалесцентов COVID-19
Е. А. Астахова a, b, М. Г. Бязрова a, b, c, Г. М. Юсубалиева d, В. Ф. Ларичев e, В. П. Баклаушев d, А. В. Филатов a, b, *
a Государственный научный центр “Институт иммунологии” Федерального медико-биологического агентства
115522 Москва, Россия
b Кафедра иммунологии биологического факультета Московского государственного университета
им. М.В. Ломоносова
119234 Москва, Россия
c Российский университет дружбы народов (РУДН) Министерства науки и высшего образования
Российской Федерации
117198 Москва, Россия
d Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства
115682 Москва, Россия
e Национальный исследовательский центр эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи Министерства здравоохранения Российской Федерации
123098 Москва, Россия
* E-mail: avfilat@yandex.ru
Поступила в редакцию 04.06.2022
После доработки 05.07.2022
Принята к публикации 05.07.2022
- EDN: LKSJWR
- DOI: 10.31857/S0026898422060064
Аннотация
К важным иммунологическим характеристикам переболевших COVID-19, а также вакцинированных относятся показатели гуморального ответа. Широкое распространение получил анализ уровня вируссвязывающих антител. Наиболее точным предиктором эффективной иммунной защиты от симптомного течения инфекции SARS-CoV-2 считается титр вируснейтрализующих антител. Мы оценили вируснейтрализующую активность плазмы лиц (n = 111), переболевших COVID-19 в период с апреля по сентябрь 2020 года. Для анализа использовали три независимых метода: конвенциональный с живым вирусом, с псевдотипированными белком шипа вирусоподобными частицами и суррогатный тест нейтрализации вируса (cVNT, pVNT и sVNT соответственно). Для сравнения измеряли уровни антител IgG, IgA и IgM против рецепторсвязывающего домена (RBD) белка шипа SARS-CoV-2. Уровни вируссвязывающих, а также вируснейтрализующих антител в постановке как cVNT, так и pVNT имели большой разброс. Высокая корреляция выявлена при сравнении результатов cVNT и pVNT, а результаты sVNT хорошо согласовывались как с cVNT, так и с pVNT. В наибольшей степени с результатами cVNT, pVNT и sVNT коррелировал уровень IgG-антител. Полученные результаты могут использоваться при отборе плазм, наилучшим образом подходящих для трансфузии и лечения острого течения COVID-19. Кроме того, данные по вируснейтрализующей активности плазмы важны для выбора потенциальных доноров для выделения SARS-CoV-2-специфичных В-лимфоцитов ‒ с целью дальнейшего получения моноклональных вируснейтрализующих антител.
В условиях нынешней пандемии COVID-19 большое значение придается серологическому анализу биологических образцов. Гуморальный иммунный ответ ‒ важная характеристика как для переболевших естественным путем, так и вакцинированных людей [1]. Мониторинг уровней антител против SARS-CoV-2 необходим для прогнозирования риска повторного заражения и оценки эффективности вакцинации. Кроме того, эти показатели используют для ретроспективного отслеживания контактов заболевших пациентов, оценки числа бессимптомных носителей, а также уровня коллективного иммунитета.
В серологических анализах на SARS-CoV-2 в качестве антигенов обычно используют два вирусных белка: нуклеопротеин (N) или белок шипа (S). SARS-CoV-2 связывается со своим рецептором на хозяйской клетке через рецепторсвязывающий домен (RBD) S-белка, поэтому именно RBD рассматривают как основную мишень для нейтрализующих антител [2]. В силу этого данные по S- и RBD-связывающим антителам могут косвенно указывать на нейтрализующую активность сыворотки. Высокий уровень вируснейтрализующих антител ‒ хороший предиктор эффективной иммунной защиты от симптоматичного течения COVID-19 [3, 4], поэтому определение вируссвязывающих антител необходимо дополнять прямым измерением уровня вируснейтрализующих антител. Заметим, что анализ на вируссвязывающие антитела достаточно хорошо отработан и широко распространен в лабораторной практике, в то время как определение вируснейтрализующих антител доступно только специализированным лабораториям.
На начальных этапах пандемии SARS-CoV-2, когда остро ощущалось отсутствие надежных терапевтических средств для лечения COVID-19, трансфузия плазмы реконвалесцентов была единственным возможным вариантом этиотропной терапии. Переливание плазмы, полученной от доноров, переболевших COVID-19, потенциально может обеспечить немедленную пассивную иммунизацию и защиту организма от инфекции SARS-CoV-2. Однако практические итоги плазмотерапии оказались очень неоднозначными. Наиболее успешным считается применение конвалесцентной плазмы на ранних этапах заболевания ‒ вскоре после госпитализации. К решающим факторам также относится использование плазмы с высоким титром антител к S-белку или RBD. При правильно подобранных параметрах трансфузия конвалесцентной плазмы обеспечивала более чем двукратное, по сравнению с контрольными группами, увеличение выживаемости пациентов [5]. Все это указывает на то, что плазму, предназначенную для трансфузии, необходимо строго контролировать по вируснейтрализующей активности.
Известно несколько методов определения вируснейтрализующей активности сывороток, каждый из которых подразделяют на несколько субвариантов. Это, в первую очередь, метод с использованием нативного живого вируса SARS-CoV-2 ‒ конвенциональный вируснейтрализующий тест (cVNT; conventional virus neutralization test), ‒ с использованием вирусоподобных частиц, псевдотипированных S-белком (pVNT; pseudovirus-based virus neutra-lization test) [6], и, наконец, суррогатный VNT (sVNT) [7].
Цель исследования состояла в сравнении вируснейтрализующей активности образцов плазмы реконвалесцентов, определенной тремя различными методами: cVNT, pVNT и sVNT. Предпринята попытка оценить вариабельность вируснейтрализующей активности образцов плазмы и сравнить ее с вируссвязывающей активностью тех же проб.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика пациентов. В исследование были включены добровольцы (n = 111), которые в период с апреля по сентябрь 2020 года переболели COVID-19. Бóльшая часть пациентов (86%) проходила стационарное лечение в ФНКЦ ФМБА России, остальные ‒ в других медицинских учреждениях г. Москвы или на дому. Всем участникам был поставлен диагноз COVID-19 на основании ПЦР-тестирования и/или клинических данных. Через 1‒3 месяца после перенесенного COVID-19 добровольцы сдали плазму крови в ФНКЦ ФМБА России для последующего переливания больным пациентам. Заготовку плазмы проводили методом плазмафереза, объем заготавливаемой плазмы составлял 640 мл для каждого донора. В проведенном нами исследовании использованы 100-микролитровые аликвоты плазмы.
Пациенты, выздоровевшие от COVID-19, были в возрасте от 18 до 52 лет (медиана ‒ 38 лет, межквартильный диапазон (interquartile range, IQR) ‒ 21–43 лет); из них 68 мужчин (61.2%) и 43 женщины (38.8%). В группу сравнения были включены здоровые доноры (n = 25). Группа сравнения по возрасту и по соотношению мужчин и женщин соответствовала группе переболевших. Венозную кровь здоровых добровольцев собирали в гепаринизированные пробирки (“Sarstedt, Nümbrecht”, Германия), после чего пробирки центрифугировали 10 мин при 300 g и отбирали плазму. Образцы плазмы (аликвоты по 100 мкл) замораживали и хранили при ‒70°C.
Определение анти-RBD-антител методом иммуноферментного анализа (ИФА). Концентрацию анти-RBD-антител в плазме определяли методом ИФА с использованием коммерческих планшетов, сенсибилизированных RBD (#K153G, “Хема Медика”, Россия) в соответствии с инструкцией производителя. В качестве проявляющих реагентов использовали антитела против IgG, IgA и IgM человека, конъюгированные с пероксидазой хрена (Cat. No. 109-036-088, 109-035-129, 109-035-011, “Jackson Immuno Research”, США). Реакцию ИФА проявляли при добавлении в каждую лунку 100 мкл субстрата пероксидазы ‒ 3,3',5,5'-тетраметил бензидина (ТМВ) ‒ и инкубировали до появления синего окрашивания. Реакцию останавливали добавлением 100 мкл стоп-реагента. Оптическую плотность полученного раствора измеряли с помощью фотометра BioRad iMark Microplate Absorbance Reader (“Bio-Rad”, США).
Все образцы титровали для нахождения линейного участка на графике зависимости оптической плотности (OD450) от разведения плазмы. Для определения концентрации антител использовали точку, находившуюся в середине линейного участка кривой титрования. Концентрацию анти-RBD-антител IgG определяли в абсолютных единицах (нг/мл), используя в качестве стандарта человеческое моноклональное антитело 34B12 с известной концентрацией (любезно предоставлено д.б.н. А.В. Тараниным, Институт молекулярной и клеточной биологии СО РАН, Новосибирск [8]). Концентрацию анти-RBD-антител IgA и IgM определяли в относительных единицах, используя в качестве стандарта плазму одного из доноров.
Определение вируснейтрализующих антител методом cVNT. Анализ проводили на клетках Vero E6, которые инфицировали аутентичным SARS-CoV-2 (штамм hCoV-19/Russia/Moscow-PMVL-12/2020) в дозе 100 ТЦИД50 (50%-ная тканевая цитопатическая инфекционная доза). Результаты цитопатической реакции регистрировали через 96 ч в инвертируемом микроскопе. Цитопатический эффект оценивали визуально. Вируснейтрализующую активность образцов плазмы определяли по подавлению цитопатического действия вируса. Цитопатический эффект вируса в отсутствие плазмы был принят за 100%. Плазму титровали, начиная с разведения 1 : 10. За титр антител принимали наибольшее разведение плазмы, при котором еще не развивался цитопатический эффект на 100 ТЦИД50 вируса. Опыты по нейтрализации сопровождались контролем рабочей дозы вируса, токсичности и стерильности сывороток.
Определение вируснейтрализующих антител методом pVNT. Этот анализ проводили на клетках HEK-293, стабильно трансфицированных плазмидой, экспрессирующей ангиотензинконвертирующий фермент-2 (ACE2). К клеткам-мишеням добавляли лентивирусные вирусоподобные частицы (VLPs), псевдотипированные S-белком SARS-CoV-2. VLPs несли репортный ген зеленого флуоресцентного белка (GFP), который экспрессировался в инфицированных клетках. Дозу VLPs подбирали таким образом, чтобы в отсутствие антител было инфицировано 50% клеток-мишеней ‒ их детектировали по флуоресценции GFP с помощью проточного цитометра CytoFLEX S (“Beckman Coulter”, США). При полном ингибировании инфекции клетки-мишени не давали флуоресцентного сигнала. Для каждой сыворотки делали 5 последовательных разведений, начиная с 1 : 4, с шагом 5. Результаты представляли как разведение сыворотки, при котором наблюдали 50%-ное ингибирование (ID50) заражения клеток, рассчитанное по графику титрования Sigmoidal, 5PL, в программе GraphPad Prism (США).
Определение вируснейтрализующих антител методом sVNТ. Этот анализ проводили с использованием набора SARS-CoV-2 ВНАФА К533 (#2104, “Хема Медика”) в соответствии с рекомендациями производителя. Образцы плазмы разводили в 10 раз буфером для образцов и добавляли к ним раствор конъюгата RBD с пероксидазой хрена (RBD-HRP) в соотношении 1 : 10 (v/v). Смесь инкубировали 30 мин при 37°C, после чего 100 мкл реакционной смеси переносили в планшет, сенсибилизированный АСЕ2, и инкубировали еще 30 мин при 37°C. Лунки 5 раз промывали буфером для отмывки. Реакцию проявляли и регистрировали также, как описано выше при выполнении ИФА. Данные анализировали с помощью программного обеспечения Zemfira 4.0.
Статистическая обработка результатов. Полученные данные обрабатывали с использованием программного обеспечения GraphPad Prism версия 8.4.3 (GraphPad, США). Значимость различий между выборками оценивали с помощью критерия Манна‒Уитни. Различия сравниваемых параметров считали статистически значимыми при p < 0.05. На графиках показаны медианы (средняя линия), третий и первый квартили (прямоугольники), усы показывают 1.5-кратный межквартильный размах. Количественную оценку статистической связи между параметрами проводили, рассчитывая коэффициенты линейной регрессии, а также ранговой корреляции по Спирмену (r).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исследовании приняли участие пациенты, которые переболели COVID-19 в период с апреля по сентябрь 2020 года. В это время в России циркулировал Уханьский штамм SARS-CoV-2 или его вариант с заменой D614G в S-белке [9–11].
Уровень RBD-связывающих антител
Прежде всего в плазме пациентов, перенесших COVID-19, определяли уровень RBD-связывающих антител. На рис. 1 представлены результаты количественного определения IgG и полуколичественного определения уровней IgA и IgM анти-RBD-антител. В качестве отрицательного контроля приведены результаты, полученные для здоровых доноров.
Рис. 1.
Распределение уровней антител IgG (а), IgA (б) и IgM (в) к RBD белка шипа SARS-CoV-2 у пациентов, переболевших COVID-19. Слева коробчатые, а справа скрипичные диаграммы. Каждая точка представляет образец плазмы. Серыми точками обозначены образцы, полученные от пациентов, переболевших COVID-19; белыми точками – от здоровых добровольцев. Горизонтальные пунктирные линии обозначают порог отсечения.

Для IgG-антител у выздоровевших пациентов медиана равнялась 1819.7 нг/мл (IQR 635.3–4753.4), в то время как для здоровых доноров она составляла 16.9 нг/мл (IQR 2.0–27.4) (p < 0.0001). Для IgA-антител эти величины равнялись 118.0 отн. ед. (IQR 52.72–208.9) и 13.5 отн. ед. (IQR 3.9–18.3) соответственно (p < 0.0001); для IgM-антител ‒ 251.8 отн. ед. (IQR 103.5–669.9) и 10.3 отн. ед. (IQR 1.44–20.41) соответственно (p < < 0.0001).
Анализ распределения уровня антител по выборке пациентов показал высокую гетерогенность этого параметра. Содержание RBD-связывающих антител довольно широко варьировало, изменяясь в пределах 5, 3 и 4 порядков соответственно для антител IgG, IgA и IgM. При этом характер распределения RBD-специфических антител IgG и IgM заметно отличался от нормального, что было подтверждено анализом по методу Д’Агостино-Пирсона (p < 0.0001). Мы предположили, что причина отклонения от нормального распределения заключается в наличии нескольких нулевых значений RBD-специфических антител IgG и IgM. При исключении нулевых значений из выборок распределение значений по антителам IgG и IgM приобретало соответственно нормальный характер и приближалось к нормальному (р = 0.8170 и р = 0.0504). Для IgA-антител исходное распределение было близким к нормальному (p = 0.2911).
Уровень вируснейтрализующих антител
Вируснейтрализующую активность образцов плазмы определяли с помощью трех независимых методов: cVNT, pVNT и sVNT. У бóльшей части участников обнаружены вируснейтрализующие антитела: 101/111 (91%), 91/111 (82%) и 88/111 (79%) пациентов соответственно.
Уровни вируснейтрализующих антител, определенные методами cVNT и pVNT, отличались гетерогенностью (рис. 2), в то время как результаты sVNT варьировали в пределах двух порядков. Это вполне объяснимо, так как результаты sVNT выражаются в процентах нейтрализации вируса, что, по определению, не превышает 100%. Реальное распределение результатов sVNT могло быть более широким, чего не наблюдалось, так как образцы плазмы с высокими титрами попадали в область насыщения.
Рис. 2.
Распределение уровней вируснейтрализующих антител у пациентов, переболевших COVID-19. Представлены результаты методов cVNT (а), pVNT (б) и sVNT (в). Горизонтальные пунктирные линии обозначают порог отсечения.
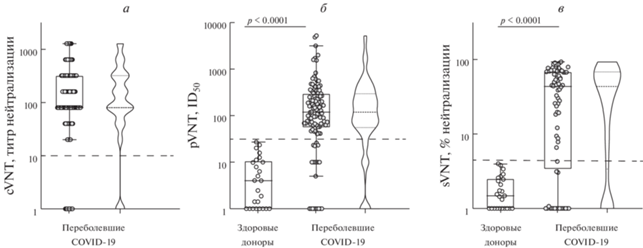
Распределение вируснейтрализующей активности образцов плазмы также, как и уровней RBD-связывающих антител, отклонялось от нормального вида. Одним из проявлений такого распределения было наличие точек с нулевой нейтрализующей активностью. Можно предположить, что нулевые точки появились в результате ошибочного включения в исследуемую группу лиц, которые не болели COVID-19. В таком случае образцы взятой у них плазмы давали бы нулевые значения сразу в нескольких тестах, но этого не наблюдалось. Вероятно, появление нулевых точек обусловлено различной чувствительностью и/или специфичностью используемых тест-систем.
Взаимосвязь уровней RBD-связывающих антител и вируснейтрализующей активности
С целью оценить взаимосвязь между результатами, полученными разными методами, мы провели корелляционный анализ. Прежде всего, оценили связь между данными по связыванию антител с RBD, с одной стороны, и вируснейтрализующей активностью ‒ с другой (рис. 3а). В наибольшей степени с результатами cVNT, pVNT и sVNT коррелировал уровень IgG-антител (r = 0.677, p < 0.0001; r = 0.624, p < 0.0001; r = 0.615, p < 0.0001 соответственно). Несколько меньшая корреляция обнаружена между cVNT, pVNT, sVNT и уровнем IgA-антител (r = 0.63, p < 0.0001; r = 0.581, p < 0,0001; r = 0.444, p < 0.0001 соответственно). Наконец, уровень IgM слабо коррелировал с sVNT (r = = 0.367, p = 0.001) при хорошей корреляции с cVNT и pVNT (r = 0.671, p < 0.0001; r = 0.716, p < 0.0001 соответственно).
Рис. 3.
Корреляционный анализ активности образцов плазмы реконвалесцентов. а – Сравнение результатов тестов по нейтрализации вируса: cVNT, pVNT и sVNT ‒ с данными по определению IgG-, IgA- и IgM-антител против RBD. б ‒ Сравнение результатов тестов по нейтрализации вируса: cVNT, pVNT и sVNT ‒ между собой. в – Тепловая карта коэффициентов корреляции по Спирмену. Прямыми представлены линии тренда линейной регрессии. На субпанелях цифрами указаны коэффициенты линейной регрессии, а также ранговой корреляции по Спирмену (r). Отклики с низкими значениями при представлении на логарифмических шкалах принимали равными 1.
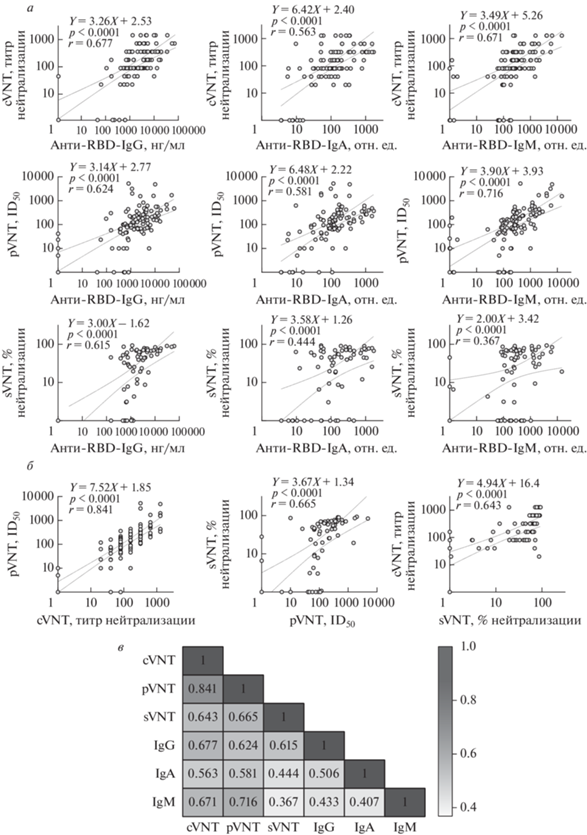
Сравнение результатов, полученных различными модификациями тестов по нейтрализации вируса, представлено на рис. 3б. Как и ожидалось, наиболее высокая корреляция результатов выявлена для cVNT и pVNT (r = 0.841, p < 0.0001), несколько слабее ‒ для cVNT и sVNT (r = 0.643, p < < 0.0001) и pVNT и sVNT (r = 0.665, p < 0.001).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наиболее адекватным подходом к определению вируснейтрализующей активности плазмы считается использование живого вируса, в том числе и SARS-CoV-2. Именно поэтому метод cVNT относится к наиболее точным и информативным, так как позволяет выявлять действие антител, нейтрализующих вирус по различным механизмам [12]. Метод cVNT основан на использовании компетентного к репликации вируса, в связи с чем его проводят в лабораториях с уровнем биобезопасности не ниже BSL3 (по Международной классификации уровня биобезопосности), а это сильно ограничивает его применение. К недостаткам cVNT также можно отнести субъективность при оценке цитопатического эффекта клеток-мишеней и дискретный характер получаемых данных. Если первый недостаток нивелируется многолетним опытом и квалификацией исследователя, то отсутствие непрерывности получаемых результатов затрудняет их последующий статистический анализ.
Вирусоподобные частицы, псевдотипированные S-белком SARS-CoV-2, хорошо имитируют начальные этапы жизненного цикла вируса: его связывание и слияние с клеткой-мишенью [6]. Метод pVNT значительно проще в исполнении, чем cVNT, и позволяет работать в лабораториях с уровнем биобезопасности BSL2. Вследствие этих обстоятельств pVNT получил широкое распространение в исследовательских лабораториях.
Следует заметить, что как при выполнении cVNT, так и pVNT необходимы живые клетки; кроме того, немаловажный фактор ‒ квалификация исполнителя. В связи с этими ограничениями вышеуказанные методы не получили широкого распространения в клинико-диагностической практике. В качестве дополнительного метода мы использовали так называемый суррогатный вируснейтрализующий тест – sVNТ [7]. Его можно отнести к экспресс-тестам, так как он позволяет оценить вируснейтрализующее действие образцов плазмы всего за 1‒2 ч, в то время как выполнение cVNT и pVNT занимает несколько суток. К недостаткам sVNT можно отнести ограниченную специфичность: им можно выявить только те антитела, которые работают исключительно по механизму блокировки связывания RBD и АСЕ2 [7].
Обращает на себя внимание, что у небольшой доли реконвалесцентов практически отсутствовали вируснейтрализующие антитела. Это наблюдение согласуется с ранее опубликованными данными о том, что 2% выздоровевших после COVID-19 пациентов не продуцируют нейтрализующие антитела [13]. Характерно, что наибольшее число таких пациентов (n = 23) выявлено при использовании sVNT ‒ теста, который детектирует только RBD-нейтрализующие антитела. Можно предположить, что некоторые образцы плазмы этой группы переболевших содержали нейтрализующие антитела, которые связываются с S-белком вне области RBD [14]. Действительно, ранее показано, что антитела к N-концевому домену или S2-области S-белка также могут участвовать в нейтрализации вируса [15].
Несмотря на отмеченные отличия, выявленные нами, а также в некоторых других исследованиях, различные варианты методов нейтрализации вируса хорошо коррелируют между собой [16–18]. Наиболее высокий коэффициент корреляции выявлен между значениями, полученными в тестах cVNT и pVNT (r = 0.841). Это означает, что тест сVNT в большинстве случаев может быть заменен тестом pVNT при оценке SARS-CoV-2-нейтрализующей активности антител в плазме доноров. С определенными оговорками все три теста могут быть использованы для оценки нейтрализующей активности образцов плазмы. Сравнение результатов по вируснейтрализующей активности и содержанию RBD-специфичных антител позволяет оценить вклад различных изотипов в нейтрализующую способность конкретного образца плазмы. В каждом из использованных тестов нейтрализации наиболее высокие коэффициенты корреляции получены для антител IgG. Это указывает на превалирующую роль антител IgG, а не IgM и IgA при блокировке взаимодействия RBD вируса с его рецептором ‒ АСЕ2. Интересно сравнить полученные результаты с опубликованными данными для других групп реконвалесцентов, а также для появляющихся вариантов SARS-CoV-2.
Заметим, что недавно наши соотечественники, D. Kolesov и соавт. [14], опубликовали работу, близкую к представленной здесь. Их исследование выполнено тоже на московской популяции и с участием пациентов, переболевших Уханьским или близкими вариантами SARS-CoV-2 [14]. Однако в проведенном нами исследовании получены более низкие коэффициенты корреляции между результатами cVNT, sVNT и анти-RBD-теста. Возможно, это связано с различными форматами sVNT. Можно также отметить, что полученный нами коэффициент корреляции между sVNT и анти-RBD-тестом сравним с таковым для вакцинированных лиц [17].
На достаточно большой и разнородной выборке образцов плазмы реконвалесцентов нами обнаружена их высокая гетерогенность. Наибольшее внимание привлекают образцы с высокой вируснейтрализующей активностью ‒ титры превышали 1000 в cVNT, а значения ID50 были выше 1000 в pVNT. Эти образцы плазмы можно отнести к наиболее перспективным для последующей трансфузии пациентам в острой фазе COVID-19. В процентном выражении доля таких образцов невелика (не более 5%). В выборке преобладали образцы плазмы с умеренным количеством вируснейтрализующих антител (титры в диапазоне от 90 до 300 в cVNT и значения ID50 в диапазоне от 100 до 1000 в pVNT). Ранее предполагалось, что гетерогенность по вируснейтрализующей активности плазмы/сыворотки крови среди переболевших COVID-19 может быть связана с тяжестью перенесенного заболевания [19, 20], а также с разными сроками взятия образцов. Вариабельность вируснейтрализующей активности образцов плазмы наиболее отчетливо проявлялась при сравнении различных мутантных вариантов SARS-CoV-2 [16]. Низкая вируснейтрализующая активность плазмы/сыворотки крови у некоторых переболевших COVID-19 может быть одной из причин повторного заражения [21].
Таким образом, сравнение тестов по оценке вируснейтрализующей активности образцов плазмы реконвалесцентов COVID-19 позволяет не только ответить на вопрос о взаимной заменимости того или иного теста, но также выявить образцы, в которых содержатся антитела против SARS-CoV-2, работающие по разным механизмам нейтрализации. Представляется важным использование подобных тест-систем для предварительного отбора доноров для сортировки единичных SARS-CoV-2-специфичных В-лимфоцитов ‒ с целью получения человеческих моноклональных вируснейтрализующих антител.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2021-1086, контракт RF—193021X0015, 15.ИП.21.0015).
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическими стандартами институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участников было получено информированное добровольное согласие. Протокол исследования был одобрен локальным этическим комитетом ФНКЦ ФМБА России (протокол заседания № 4 от 28.04.2020).
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Qi H., Liu B., Wang X., Zhang L. (2022) The humoral response and antibodies against SARS-CoV-2 infection. Nat. Immunol. 23(7), 1008‒1020. https://doi.org/10.1038/s41590-022-01248-5
Premkumar L., Segovia-Chumbez B., Jadi R., Martinez D.R., Raut R., Markmann A., Cornaby C., Bartelt L., Weiss S., Park Y., Edwards C.E., Weimer E., Scherer E.M., Rouphael N., Edupuganti S., Weiskopf D., Tse L.V., Hou Y.J., Margolis D., Sette A., de Silva A.M. (2020) The receptor binding domain of the viral spike protein is an immunodominant and highly specific target of antibodies in SARS-CoV-2 patients. Sci. Immunol. 5(48), eabc8413.
Cromer D., Steain M., Reynaldi A., Schlub T.E., Wheatley A.K., Juno J.A., Kent S.J., Triccas J.A., Khoury D.S., Davenport M.P. (2022) Neutralising antibody titres as predictors of protection against SARS-CoV-2 variants and the impact of boosting: a meta-analysis. Lancet Microbe. 3(1), e52–e61.
Khoury D.S., Cromer D., Reynaldi A., Schlub T.E., Wheatley A.K., Juno J.A., Subbarao K., Kent S.J., Triccas J.A., Davenport M.P. (2021) Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection. Nat. Med. 27(7), 1205–1211.
Баклаушев В.П., Аверьянов А.В., Сотникова А.Г., Перкина А.С., Иванов А.В., Юсубалиева Г.М., Новикова О.Н., Шикина В.Е., Дупик Н.В., Кедрова А.Г., Санжаров А.Е., Ширшова Е.В., Балионис О.И., Валуев-Эллистон В.Т., Закирова Н.Ф., Глазов Я.Н., Панюхина И.А., Соловьёв Н.А., Винокуров А.Г., Иванов Ю.В., Васильев В.Н., Клыпа Т.В., Троицкий А.В. (2020) Предварительные итоги исследования безопасности и эффективности плазмы реконвалесцентов в терапии COVID-19. Клиническая практика. 11(2), 38–50.
Bewley K.R., Coombes N.S., Gagnon L., McInroy L., Baker N., Shaik I., St-Jean J.R., St-Amant N., Buttigieg K.R., Humphries H.E., Godwin K.J., Brunt E., Allen L., Leung S., Brown P.J., Penn E.J., Thomas K., Kulnis G., Hallis B., Carroll M., Charlton S. (2021) Quantification of SARS-CoV-2 neutralizing antibody by wild-type plaque reduction neutralization, microneutralization and pseudotyped virus neutralization assays. Nat. Protoc. 16(6), 3114–3140.
Tan C.W., Chia W.N., Qin X., Liu P., Chen M.I., Tiu C., Hu Z., Chen V.C., Young B.E., Sia W.R., Tan Y.J., Foo R., Yi Y., Lye D.C., Anderson D.E., Wang L.F. (2020) A SARS-CoV-2 surrogate virus neutralization test based on antibody-mediated blockage of ACE2-spike protein–protein interaction. Nat. Biotechnol. 38(9), 1073–1078.
Gorchakov A.A., Kulemzin S.V., Guselnikov S.V., Baranov K.O., Belovezhets T.N., Mechetina L.V., Volkova O.Y., Najakshin A.M., Chikaev N.A., Chikaev A.N., Solodkov P.P., Larichev V.F., Gulyaeva M.A., Markhaev A.G., Kononova Y.V., Alekseyev A.Y., Shestopalov A.M., Yusubalieva G.M., Klypa T.V., Ivanov A.V., Taranin A.V. (2021) Isolation of a panel of ultra-potent human antibodies neutralizing SARS-CoV-2 and viral variants of concern. Cell Discov. 7(1), 96.
Gushchin V.A., Dolzhikova I.V., Shchetinin A.M., Odintsova A.S., Siniavin A.E., Nikiforova M.A., Pochtovyi A.A., Shidlovskaya E.V., Kuznetsova N.A., Burgasova O.A., Kolobukhina L.V., Iliukhina A.A., Kovyrshina A.V., Botikov A.G., Kuzina A.V., Grousova D.M., Tukhvatulin A.I., Shcheblyakov D.V., Zubkova O.V., Karpova O.V., Gintsburg A.L. (2021) Neutra-lizing activity of sera from Sputnik V-vaccinated people against variants of concern (VOC: B.1.1.7, B.1.351, P.1, B.1.617.2, B.1.617.3) and Moscow endemic SARS-CoV-2 variants. Vaccines (Basel). 9(7), 779.
Komissarov A.B., Safina K.R., Garushyants S.K., Fadeev A.V., Sergeeva M.V., Ivanova A.A., Danilenko D.M., Lioznov D., Shneider O.V., Shvyrev N., Spirin V., Glyzin D., Shchur V., Bazykin G.A. (2021) Genomic epidemiology of the early stages of the SARS-CoV-2 outbreak in Russia. Nat. Commun. 12(1), 649.
Matsvay A, Klink G.V., Safina K.R., Nabieva E., Garushyants S.K., Biba D., Bazykin G.A., Mikhaylov I.M., Say A.V., Zakamornaya A.I., Khakhina A.O., Lisitsa T.S., Ayginin A.A., Abramov I.S., Bogdan S.A., Kolbutova K.B., Oleynikova D.U., Avdeenko T.F., Shipulin G.A., Yudin S.M., Skvortsova V.I. (2021) Genomic epidemiology of SARS-CoV-2 in Russia reveals recurring cross-border transmission throughout 2020. medRxiv. 2021, https://doi.org/10.1101/2021.03.31.21254115
Saade C., Gonzalez C., Bal A., Valette M., Saker K., Lina B., Josset L., Trabaud M.A., Thiery G., Botelho-Nevers E., Paul S., Verhoeven P., Bourlet T., Pillet S., Morfin F., Trouillet-Assant S., Pozzetto B. (2021) Live virus neutralization testing in convalescent patients and subjects vaccinated against 19A, 20B, 20I/501Y.V1 and 20H/501Y.V2 isolates of SARS-CoV-2. Emerg. Microbes Infect. 10(1), 1499–1502.
Fafi-Kremer S., Bruel T., Madec Y., Grant R., Tondeur L., Grzelak L., Staropoli I., Anna F., Souque P., Fernandes-Pellerin S., Jolly N., Renaudat C., Ungeheuer M.N., Schmidt-Mutter C., Collongues N., Bolle A., Velay A., Lefebvre N., Mielcarek M., Meyer N., Fontanet A. (2020) Serologic responses to SARS-CoV-2 infection among hospital staff with mild disease in eastern France. EBioMedicine. 59, 102915.
Kolesov D.E., Sinegubova M.V., Dayanova L.K., Dolzhikova I.V., Vorobiev I.I., Orlova N.A. (2022) Fast and accurate surrogate virus neutralization test based on antibody-mediated blocking of the interaction of ACE2 and SARS-CoV-2 spike protein RBD. Diagnostics (Basel). 12(2), 393.
Jiang S., Hillyer C., Du L. (2020) Neutralizing antibodies against SARS-CoV-2 and other human coronaviruses. Trends Immunol. 41(5), 355–359.
Jaafar R., Boschi C., Aherfi S., Bancod A., Le Bideau M., Edouard S., Colson P., Chahinian H., Raoult D., Yahi N., Fantini J., La Scola B. (2021) High individual heterogeneity of neutralizing activities against the original strain and nine different variants of SARS-CoV-2. Viruses. 13(11), 2177.
Krüttgen A., Lauen M., Klingel H., Imöhl M., Kleines M. (2022) Two novel SARS-CoV-2 surrogate virus neutralization assays are suitable for assessing successful immunization with mRNA-1273. J. Virol. Methods. 299, 114297.
Wisnewski A.V., Liu J., Lucas C., Klein J., Iwasaki A., Cantley L., Fazen L., Campillo Luna J., Slade M., Redlich C.A. (2022) Development and utilization of a surrogate SARS-CoV-2 viral neutralization assay to assess mRNA vaccine responses. PLoS One. 17(1), e0262657.
Chen X., Pan Z., Yue S., Yu F., Zhang J., Yang Y., Li R., Liu B., Yang X., Gao L., Li Z., Lin Y., Huang Q., Xu L., Tang J., Hu L., Zhao J., Liu P., Zhang G., Chen Y., Ye L. (2020) Disease severity dictates SARS-CoV-2-specific neutralizing antibody responses in COVID-19. Signal. Transduct. Target. Ther. 5(1), 180.
Legros V., Denolly S., Vogrig M., Boson B., Siret E., Rigaill J., Pillet S., Grattard F., Gonzalo S., Verhoeven P., Allatif O., Berthelot P., Pélissier C., Thiery G., Botelho-Nevers E., Millet G., Morel J., Paul S., Walzer T., Cosset F.L., Pozzetto B. (2021) A longitudinal study of SARS-CoV-2-infected patients reveals a high correlation between neutralizing antibodies and COVID-19 severity. Cell. Mol. Immunol. 18(2), 318–327.
Gallais F., Gantner P., Bruel T., Velay A., Planas D., Wendling M.J., Bayer S., Solis M., Laugel E., Reix N., Schneider A., Glady L., Panaget B., Collongues N., Partisani M., Lessinger J. M., Fontanet A., Rey D., Hansmann Y., Kling-Pillitteri L., Fafi-Kremer S. (2021) Evolution of antibody responses up to 13 months after SARS-CoV-2 infection and risk of reinfection. EBioMedicine. 71, 103561.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


