Молекулярная биология, 2023, T. 57, № 1, стр. 71-84
Структура соматических мутаций в генах KRAS, BRAF, PIK3CA и клинические характеристики BЭБ-ассоциированного и микросателлитно-нестабильного рака желудка
А. М. Данишевич a, *, Н. И. Поспехова b, А. М. Строганова b, Д. А. Головина b, М. П. Никулин b, А. Е. Калинин b, С. Э. Николаев a, И. С. Стилиди b, Л. Н. Любченко c, d
a Московский клинический научно-практический центр им. А.С. Логинова
Департамента здравоохранения города Москвы
111123 Москва, Россия
b Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения России
115478 Москва, Россия
c Национальный медицинский исследовательский центр радиологии Министерства здравоохранения России
125284 Москва, Россия
d Научно-исследовательский центр урологии и интервенционной радиологии им. Н.А. Лопаткина
филиал “Национального медицинского исследовательского центра радиологии”
Министерства здравоохранения России
105425 Москва, Россия
* E-mail: danisham7@gmail.com
Поступила в редакцию 07.06.2022
После доработки 11.07.2022
Принята к публикации 26.07.2022
- EDN: AXIQHP
- DOI: 10.31857/S0026898423010044
Аннотация
Персонализация подходов к лечению рака желудка (РЖ) является актуальной проблемой, учитывая клиническую гетерогенность и агрессивное течение заболевания. В 2014 г. на основании молекулярных характеристик исследователи The Cancer Genome Atlas выделили четыре подтипа РЖ: Эпштейн‒Барр-позитивный (ВЭБ+), микросателлитно-нестабильный (МСН), хромосомно-нестабильный (ХН), геномно-стабильный (ГС). На сегодняшний день не существует унифицированной методики идентификации ХН и ГС подтипов, в то время как определение МСН и ВЭБ применяется в рутинной практике и имеет большое клиническое значение. Мы проанализировали статус МСН, провели качественный анализ наличия ДНК ВЭБ, а также поиск соматических мутаций в кодонах 12‒13 (экзон 2), 61 (экзон 3), 146 (экзон 4) гена KRAS, кодонах 597–601 (экзон 15) гена BRAF и кодонах 542‒546 (экзон 9), 1047‒1049 (экзон 20) гена PIK3CA в 159 образцах РЖ. ВЭБ выявлен в 8.2% образцов, МСН – в 13.2%. ВЭБ+ и МСН-фенотипы были взаимоисключающими. Средний возраст манифестации ВЭБ+ и MCH рака составил 54.8 и 62.1 г. соответственно. В 92.3% случаев ВЭБ+рак выявлен у мужчин, в 76.2% – в группе старше 50 лет, диффузный рак и аденокарцинома кишечного типа встречались в 6 (46.2%) и 5 (38.5%) случаях соответственно. МСН рак встречался в приблизительно равной доле у мужчин и женщин (n = 10; 47.6% /n = 11; 52.4%) с превалированием кишечного гистотипа (71.4%) и поражением малой кривизны (28.6%). В одном образце ВЭБ+ рака обнаружен вариант E545K в гене PIK3CA. Во всех образцах МСН опухолей выявлено сочетание клинически значимых вариантов генов KRAS и PIK3CA. Не обнаружено мутации V600E в гене BRAF, специфичной для МСН колоректального рака. Показано, что ВЭБ подтип связан с лучшим прогнозом: общая пятилетняя выживаемость при BЭБ+ и МСН раке составила 100.0 и 54.7% соответственно.
ВВЕДЕНИЕ
Рак желудка (РЖ) занимает лидирующие позиции в структуре онкологической заболеваемости. По данным Globocan IARC в 2020 г. в мире зарегистрировано 1089103 новых случаев РЖ, и это пятое место (6%) среди всех впервые выявленных злокачественных новообразований (ЗНО) [1]. Абсолютное число летальных исходов составило 768793 (7.8%), что также соответствует пятому месту в структуре смертности от ЗНО. Общая пятилетняя выживаемость пациентов с I‒IV стадией заболевания колеблется в пределах 10‒30%, медиана общей выживаемости ‒ менее 1 г. [2, 3].
В Российской Федерации в 2019 г. на долю опухолей желудка пришлось 5.7% (6 место) от всех впервые зарегистрированных ЗНО, абсолютное число заболевших составило 36171. В большинстве случаев (38.9%) РЖ выявляют на III‒IV (60.9%) стадиях заболевания, что объясняется значительной гетерогенностью клинических проявлений РЖ и отсутствием скрининговых программ [4].
Согласно классификации Lauren, выделяют два подтипа аденокарциномы желудка: кишечный (50%) и диффузный (33%) [5]. Остальные 17% относятся к смешанным и неклассифицируемым опухолям. Описанные подтипы имеют биологические и клинические различия, а также широко используются для прогноза заболевания [6].
Факторы риска РЖ. Известно, что до 50% случаев РЖ обусловлены социальным поведением и пищевыми привычками c преобладанием в рационе красного мяса, копченых продуктов, обработанного и соленого мяса [7‒9]. Значительный вклад в развитие РЖ (до 6.2% случаев) вносит бактерия Helicobacter pylori, признанная канцерогеном I класса. [10]. Инфицирование вирусом Эпштейна‒Барр (ВЭБ) приводит к 10-кратному увеличению риска РЖ и обуславливает до 10% неоплазм [11, 12].
В качестве немодифицируемого фактора риска РЖ рассматривается наследственная предрасположенность к раку в составе наследственных онкологических синдромов (НОС). Герминальные мутации удается выявить в 1‒3% случаев семейных форм РЖ. На сегодняшний день выделяют три основные формы наследственного РЖ: диффузный РЖ (ген CDH1), аденокарцинома желудка с проксимальным полипозом (ген АРС) и семейный РЖ кишечного типа (гены-кандидаты SMAD4, PMS1, PRSS1 и TP53) [13]. Описаны и другие НОС, ассоциированные с высоким риском РЖ: синдром Линча, синдром наследственного рака молочной железы и яичников, семейный аденоматозный полипоз, MYH-ассоциированный полипоз, ювенильный аденоматозный полипоз, синдром Пейтца‒Егерса, синдром Ли-Фраумени и др.
Молекулярная классификация РЖ. В результате полногеномного исследования опухолей желудка, оценки экспрессии, а также белковых паттернов в 2014 г. группой исследователей The Cancer Genome Atlas (TCGA) была разработана и опубликована молекулярная классификация РЖ, которая включает четыре подтипа [14]:
‒ Эпштейн‒Барр-позитивный (ВЭБ+),
‒ Микросателлитно-нестабильный (МСН),
‒ Хромосомно-нестабильный (ХН),
‒ Геномно-стабильный (ГС).
Каждый из этих подтипов имеет свои молекулярные и клинические характеристики, представляющие интерес для прогноза заболевания и перспективы индивидуализации лечения РЖ.
ВЭБ+ подтип РЖ. ВЭБ+ РЖ отличается значительным разнообразием генетических и эпигенетических нарушений, ответственных за регуляцию энергетического обмена и метаболизма [14]. Инфицирование ВЭБ индуцирует аберрантное гиперметилирование CpG-островков в промоторах 886 генов, поэтому ВЭБ+ РЖ отнесен к эпигенотипу с чрезвычайно высоким уровнем метилирования [15, 16]. Гиперметилирование промотора гена CDKN2A (p16INK4A) обнаружено во всех образцах ВЭБ+ [17]. Кроме того, выявлена высокая частота соматических мутаций в генах ARID1A (55%), BCOR (23%) [18] и PIK3CA (40‒80%) [19]. Как показали Bögerlо и соавт., до 14% первичных ВЭБ+ опухолей желудка характеризуются значительной внутриопухолевой гетерогенностью и могут содержать от трех до пяти вариантов онкогена PIK3CA, включая дикий тип [20]. Этот факт предполагает эффективность лечения ВЭБ+ РЖ ингибиторами PI3K. Dong и соавт. отметили ассоциацию сверхэкспрессии PIK3CA при ВЭБ+ РЖ с лучшей пятилетней выживаемостью в отличие от ВЭБ-негативных опухолей (57.8 против 33.4%, р < 0.001) [21].
Обнаружены также протяженные делеции генов PTEN, SMAD4, CDKN2A, ARID1A и вариация числа копий генов JAK2, CD274 и PDCD1LG2 и др. [8, 22].
Клинически большинство ВЭБ+ опухолей относятся к диффузному гистологическому типу по Lauren, они в 2‒4 раза чаще встречаются у мужчин (79‒81%) [23] и в 2 раза чаще поражают кардиальный отдел и тело желудка (62%) [24]. Средний возраст манифестации ВЭБ+ рака ‒ 53 года, что значительно ниже, чем при других подтипах РЖ [25, 26]. Кроме того, ВЭБ+ РЖ отличается наиболее благоприятным прогнозом, меньшим количеством пораженных лимфоузлов и лучшими показателями пятилетней выживаемости [26, 27].
МСН подтип РЖ. МСН диагностируется в 10‒37% опухолей желудка. Опухоли этого подтипа характеризуются многочисленными геномными нарушениями, которые возникают из-за дефекта системы репарации неспаренных оснований ДНК (MisMatch Repair system, MMR) [28‒30]. Большинство МСН опухолей желудка имеют спорадический характер [31, 32], до 15% случаев развиваются в результате герминальных мутаций в генах MMR (чаще в MLH1 и MSH2) при синдроме Линча [33, 34]. В случае спорадического рака МСН обусловлена гиперметилированием промотора и сайленсинга гена MLH1 [35]. МСН опухоли имеют гипермутированный фенотип с предполагаемой частотой 31.6 мутаций/млн.п.н. (в микросателлитно-стабильных опухолях – 3.3 мутации/млн.п.н.) [36]. В ходе исследования TCGA выявлено 37 наиболее часто мутирующих генов, участвующих в регуляции клеточного цикла (TP53, IGFIIR, TCF4), в процессах репарации ДНК (MSH6, MSH3, MED1, RAD50, BLM, ATR и MRE11), ремоделировании хроматина, апоптозе (RIZ, BAX, CASPASE5, FAS, BCL10 и APAF1), регуляции транскрипции и сигнальных систем клетки [14]. Corso и соавт. описали мутации в генах EGFR в 47.6% случаев РЖ, KRAS ‒ в 14.9%, PIK3CA ‒ в 14.3 и MLK3 ‒ в 3.2% [37]. При МСН раке, как и при ВЭБ+ РЖ, отмечена высокая частота нарушений в генах ARID1A (83%) и RNF43 (55%) [38]. Описаны соматические мутации (22%) или потеря экспрессии (35–54%) генов, ответственных за процессинг микроРНК [38, 39], и повышенная экспрессия генов митотической сети AURKA A/B, E2F, FOXM1, PLK1 и MYC [14]. Кроме того, выявлены частые изменения генов главного комплекса гистосовместимости, включая B2M и HLA-B [40].
Накопление соматических мутаций способствует образованию неоантигенов, способных вызывать иммунный ответ, что делает МСН опухоли чувствительными к терапии ингибиторами иммунных контрольных точек. Результаты рандомизированных исследований KEYNOTE-059, KEYNOTE-061, KEYNOTE-062 показали улучшение показателей выживаемости при применении пембролизумаба в монорежиме и в комбинации с химиотерапией. Таким образом, у пациентов с распространенным РЖ МСН может быть биомаркером эффективности пембролизумаба независимо от линии терапии [41].
Клинически МСН РЖ связан с женским полом, пожилым возрастом (средний возраст манифестации 60 лет) и дистальным расположением ЗНО. Кроме того, отмечено преобладание кишечного гистотипа (кишечный – 10.7%, диффузный – 2.9%, смешанный – 0.9% из всех случаев РЖ [42]) и более ранняя стадия заболевания вследствие низкой локальной инвазии и меньшего поражения лимфатических узлов [43]. В большинстве случаев МСН РЖ ассоциирован с лучшим прогнозом в отличие от ХН и ГС подтипов и наиболее низкой частотой рецидивирования (22%) [14, 44].
ХН подтип РЖ. ХН подтип составляет примерно 50% всех случаев РЖ и характеризуется выраженной анеуплоидией, потерей гетерозиготности, делецией и амплификацией ряда генов [45, 46]. Мутации генов рецепторных тирозинкиназ (RTK) VEGFA, EGFR, ERBB2, ERBB3, c-Met, FGFR2 найдены в 37% опухолей [46, 47]. Амплификация гена ERBB2 и иммуногистохимическая сверхэкспрессия белка HER2neu выявлена в 4‒24% опухолей желудка [48]. Амплификация гена KRAS обнаружена примерно в 10% ХН опухолей желудка и, по-видимому, ее присутствие исключает амплификацию других RTK [49]. В целом, амплификация RTK показала себя как предиктор плохого прогноза [50].
Также ХН РЖ отличается высокой частотой соматических мутаций антионкогена TP53; отмечено увеличение числа копий генов-медиаторов клеточного цикла CCNE1, CCND1 и CDK6 [14, 46, 47]. Кроме того, в ХН опухолях диагностированы редкие слияния генов AGTRAP‒BRAF, ERBB2‒CDK12, ERBB2‒NEUROD2, SLC34A2‒ROS1, SNX2‒PRDM6 и MLL3‒PRKAG2 [26]. Клиническое значение этих нарушений в контексте таргетной терапии еще предстоит выяснить.
В 50% случаев ХН подтип представлен интестинальным гистотипом с кардиальной/кардиоэзофагеальной локализацией опухоли и характеризуется относительно благоприятным прогнозом [14]. В отличие от других подтипов РЖ применение адъювантной химиотерапии при ХН РЖ показало увеличение трехлетней безрецидивной выживаемости пациентов после лекарственного лечения в сравнении с его отсутствием (58.7 и 33.5%) [26].
ГС подтип РЖ. ГС подтип отличается от ХН РЖ низкой степенью анеуплоидии и низкой частотой мутаций в гене TP53, к этому подтипу относятся до 15–20% аденокарцином желудка. Гены CDH1 и RHOA, ассоциированные с разрозненной моделью роста клеток и отсутствием межклеточной адгезии, несли патогенные варианты в 37 и 15% опухолей соответственно [14, 52]. Таким образом, до 73% диффузного РЖ можно отнести к ГС подтипу [53]. Кроме точечных мутаций, в ГС РЖ выявлено 170 различных структурных перестроек. В 62% ГС опухолей обнаружены химерные гены CLDN18‒ARHGAP. Также в образцах ГС РЖ отмечена активация микроРНК miR-21, приводящая к быстрой пролиферации, инвазии и метастазированию [54, 55].
Средний возраст манифестации ГС РЖ ‒ 52 г., этот подтип ассоциирован с поражением всех отделов желудка в равном соотношении и наихудшим прогнозом [14]. Применение адъювантной химиотерапии при ГС РЖ не влияло на прогноз [26].
На основе молекулярных характеристик РЖ разрабатываются различные прогностические модели течения РЖ и риска возникновения рецидива. Кроме того, эта классификация может служить основой для стратификации пациентов с целью индивидуализации лечения в будущем [26]. На данный момент не существует унифицированной методики идентификации ХН и ГС подтипов РЖ, в то время как определение МСН и вирусной нагрузки ВЭБ широко используется в рутинной практике и имеет большое клиническое значение. Соматические мутации в генах KRAS, BRAF, PIK3CA относятся к наиболее значимым маркерам, которые определяют при различных ЗНО и имеют прогностическое и предиктивное значение. На сегодняшний день проходят клинические испытания нескольких ингибиторов компонентов сигнального пути RTK/RAS у больных РЖ [84 ] . Таким образом, актуальным представляется анализ соматических нарушений этих генов.
В нашей работе оценена частота соматических мутаций в генах KRAS, BRAF, PIK3CA и определены клинико-молекулярные характеристики ВЭБ+ и MCH опухолей желудка у пациентов российской популяции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В исследование включены образцы опухолевой ткани и периферической крови 159 пациентов, проходивших лечение в НМИЦ онкологии им. Н.Н. Блохина Минздрава России по поводу РЖ I‒IV стадии в период с 2010 по 2020 гг. включительно. ДНК-диагностика 54 образцов свежей послеоперационной опухолевой ткани и 105 срезов FFPE выполнена в молекулярно-биологической лаборатории отдела морфологической и молекулярно-генетической диагностики опухолей НИИ клинической онкологии им. Н.Н. Трапезникова НМИЦ онкологии им. Н.Н. Блохина. Образцы опухолевой ткани отбирали во время оперативного вмешательства, быстро замораживали и хранили в морозильной камере при температуре –80°C. Отобранные препараты FFPE содержали не менее 20% опухолевых клеток по площади среза, периферическую кровь отбирали в пробирки с EDTA.
Выделение ДНК из послеоперационных образцов опухолевой ткани и срезов опухоли, заключенной в парафин, проводили с использованием коммерческого набора Сobas® DNA Sample Preparation Kit (“Roche”, Германия) согласно инструкции производителя. Геномную ДНК выделяли из лимфоцитов периферической крови с использованием набора Проба-ГС-Генетика (“ДНК-технология”, Россия) в соответствии с протоколом производителя. Качество ДНК оценивали, измеряя концентрацию и соотношение А260/А280 на спектрофотометре NanoDrop Lite (“Thermo Fisher Scientific”, США). Во всех 159 образцах РЖ определяли ДНК ВЭБ, статус МСН и кодирующую последовательность генов KRAS, BRAF и PIK3CA.
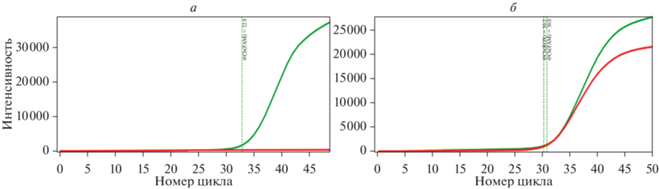
ДНК ВЭБ в образцах выявляли с использованием коммерческого набора реагентов для определения ДНК ВЭБ методом ПЦР в режиме реального времени “РеалБест” ДНК ВЭБ (комплект 1) (“Вектор Бест”, Россия) на приборе ДТ-96 (“НПФ ДНК-Технология”, Россия). Ложноположительные/ложноотрицательные результаты исключали, анализируя все образцы в двух повторностях. Результаты оценивали в соответствии с инструкцией производителя (pис. 1).
Рис. 1.
Качественная оценка наличия ДНК ВЭБ. а – Отсутствие ДНК ВЭБ. б – Наличие ДНК ВЭБ (зеленая кривая– график амплификации внутреннего контрольного образца, красная кривая – график амплификации ДНК ВЭБ).
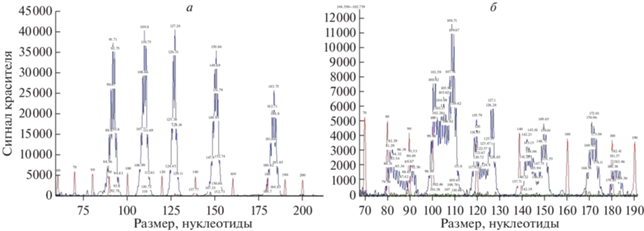
Статус МСН определяли методом фрагментного анализа с использованием пяти квазимономорфных мононуклеотидных маркеров NR21, NR24, NR27, BAT25, BAT26 на платформе Beckman Coulter Genome Lab GeXP (“Beckman Coulter”, США). При отсутствии нарушений или нестабильности одного маркера статус опухоли определяли как микросателлитно-стабильный (МСС), при нестабильности двух или более маркеров – как опухоль с МСН (рис. 2).
Рис. 2.
Оценка статуса микросателлитной нестабильности (МСН). а – Микросателлитно-стабильный статус опухоли. б – Микросателлитно-нестабильный статус опухоли.
Поиск соматических мутаций в кодонах 12–13 (экзон 2), 61 (экзон 3) и 146 (экзон 4) гена KRAS, в кодонах 597–601 (экзон 15) гена BRAF и кодонах 542–546 (экзон 9), 1047–1049 (экзон 20) гена PIK3CA выполнен путем анализа кривых плавления с высоким разрешением (High Resolution Melting, HRM) после проведения ПЦР в режиме реального времени с применением праймеров и зондов на амплификаторе Rotor-Gene (“QIAGEN”, Германия). Последовательности праймеров, зондов и условия ПЦР описаны ранее [65]. Присутствие выявленного варианта подтверждали путем очистки полученного ПЦР-продукта и прямого секвенирования по Сенгеру на платформе Beckman Coulter Genome Lab GeXP (“Beckman Coulter”) согласно инструкции производителя.
Статистический анализ проводили с помощью программного обеспечения GraphPad Prism 8.0.0 (GraphPad Software, США). Общую выживаемость определяли как время от момента постановки диагноза до смерти от любой причины или даты последнего наблюдения пациента и рассчитывали по методу Каплана–Мейера. Различия между общей выживаемостью пациентов трех групп оценивали при помощи теста лог-ранга критерия Мантеля–Кокса. Для попарных сравнений выживаемости группы пациентов использовали тест лог-ранга Мантеля–Кокса и критерий Бреслоу–Гехана–Вилкоксона. Выживаемость на определенных этапах исследования сравнивали с использованием точного теста Фишера.
Обследуемая группа состояла из 159 человек. Клинические характеристики пациентов представлены в табл. 1.
Таблица 1.
Клинические характеристики обследованных групп с различным статусом ВЭБ и МСН
| Клиническая характеристика | ВЭБ+-группа | МСН-группа | ВЭБ– + MCC-группа | |
|---|---|---|---|---|
| Общее количество случаев | 13 (8.2) | 21 (13.2) | 125 (78.6) | |
| Пол | Мужчины | 12 (92.3) | 10 (47.6) | 54 (43.2) |
| Женщины | 1 (7.7) | 11 (52.4) | 71 (56.8) | |
| Возраст манифестации, лет | 16–49 | 10 (76.9) | 5 (23.8) | 86 (71.2) |
| 50–83 | 3 (23.1) | 16 (76.2) | 39 (28.8) | |
| Среднее ± SD | 54.8 ± 11.9 | 62.1 ± 14.5 | 55.0 ± 14.7 | |
| Стадия | I | 2 (15.4) | 1 (4.8) | 17 (13.6) |
| II | 4 (30.8) | 6 (28.6) | 22 (17.6) | |
| III | 5 (38.5) | 8 (38.1) | 43 (34.4) | |
| IV | 2 (15.4) | 6 (28.6) | 43 (34.4) | |
| Гистологический тип по Lauren | Кишечный | 5 (38.5) | 15 (71.4) | 73 (58.4) |
| Диффузный | 6 (46.2) | 4 (19.0) | 60 (48.0) | |
| Смешанный | 2 (15.4) | 2 (9.5) | 12 (9.6) | |
| Локализация опухоли | Кардия | 3 (23.1) | 2 (9.5) | 30 (24.0) |
| Дно | 3 (23.1) | 1 (4.8) | 7 (5.6) | |
| Тело | 4 (30.7) | 5 (23.8) | 38 (30.4) | |
| Преддверие привратника | 1 (7.7) | 4 (19.0) | 13 (10.4) | |
| Привратник | 0 (0) | 1 (4.8) | 5 (4.0) | |
| Малая кривизна | 1 (7.7) | 3 (14.3) | 3 (2.4) | |
| Большая кривизна | 1 (7.7) | 0 (0) | 5 (4.0) | |
| Выходит за пределы указанных областей | 0 (0) | 5 (23.8) | 24 (19.2) | |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе исследования была проспективно собрана коллекция образцов послеоперационной опухолевой ткани 54 пациентов. В результате ПЦР-диагностики ДНК ВЭБ выявлена в трех образцах опухоли. На втором этапе с целью валидации результатов, полученных для трех ВЭБ+ и семи случайно отобранных ВЭБ-негативных (ВЭБ–) образцов, определяли вирусную нагрузку на срезах FFPE, в результате чего во всех случаях получено совпадение показателей. В дальнейшем присутствие ВЭБ оценивали ретроспективно на 107 срезах FFPE.
В результате проведенного исследования ДНК ВЭБ выявлена в 13 (8.2%) образцах. В большинстве случаев ВЭБ+ РЖ диагностирован у мужчин (n = 12; 92.3%). У 10 (76.9%) пациентов диагноз установлен после 50 лет, средний возраст манифестации РЖ 54.8 лет. Чаще ВЭБ+ опухоли располагались в теле желудка (n = 4; 30.7%), кардиально (n = 3; 23.0%) или поражали дно (n = 3; 23.0%). Диффузный рак и аденокарцинома кишечного типа встречались в практически равном соотношении – 6 (46.2%) и 5 (38.5%) случаев, в то время как смешанный тип наблюдался только у 2 (15.4%) обследованных. Распространенный рак (III–IV стадии) выявлен у 53.9% (n = 7), в остальных случаях (n = 6; 46.2%) диагноз установлен на I–II стадии. При III стадии отмечено поражение 3–6 регионарных лимфатических узлов (n = 1), 7 и более (n = 1), вовлечение висцеральной брюшины (n = 1), в двух случаях лимфатические узлы не оценены. Терминальная стадия (n = 2) характеризовалась метастатическим поражением в кости.
МСН статус опухоли обнаружен в 13.2% (n = 21) образцов РЖ. У мужчин и женщин МСН РЖ диагностирован в 10 (47.6%) и 11 (52.4%) образцах соответственно. В 76.2% (n = 16) заболевание манифестировало в возрасте старше 50 лет, средний возраст диагностики 62.1 ± 14.5 лет. У 6 (28.6%) обследованных установлено поражение малой кривизны, в 5 (23.8%) случаях – больше одной топографической области, реже тела желудка (n = 4; 19.0%) и преддверия привратника (n = 4; 19.0%). Кишечный и диффузный гистотипы были представлены в 71.4% (n = 15) и 19.0% (n = 4) образцов соответственно. В большинстве случаев диагноз установлен на прогрессирующих стадиях (n = 14; 66.7%). На III стадии МСН РЖ (n = 8; 38.1%) чаще наблюдалось поражение 1‒2 региональных лимфатических узлов (n = 3; 37.5%), реже 3–6 (n = 2; 25.0%), 7 и более лимфоузлов (n = 1, 12.5%), в двух (25.0%) случаях III стадия установлена вследствие вовлечения брюшины. Для IV стадии (n = 6, 28.6%) было характерно вторичное поражение легких (n = 1), костей (n = 2), печени (n = 3), яичников (n = 1) и лимфоузлов средостения (n = 1). В нашем исследовании ВЭБ+ и МСН РЖ были взаимоисключающими.
Оценка клинико-анамнестических данных. Анализ исследованных подгрупп по возрасту манифестации рака не выявил значимых различий (р = 0.0691, критерий Краскела–Уоллиса). Средний возраст манифестации РЖ в группе MCH составил 62.1 лет. У пациентов с ВЭБ+ и ВЭБ– + MСС рак диагностировали в более молодом возрасте – 54.8 и 55.0 лет соответственно. ВЭБ+ РЖ в 92.3% случаев выявлен у мужчин, в МСН-группе соотношение мужчин и женщин составило 47.6 и 52.4% соответственно. Опухоли ВЭБ+ в 76.2% выявлены у пациентов 50 лет и старше (критерий Фишера, p = 0.7560). Напротив, в случае МСН 76.9% обследованных были моложе 50 лет (критерий Фишера, p = 0.4351).
В отличие от I, II и IV стадий в группах ВЭБ+ и МСН чаще диагностировали III стадию заболевания – 38.5 и 38.1% соответственно. Диффузный рак при ВЭБ+ РЖ выявлен в 46.2% случаев, кишечный гистотип – в 38.5%. МСН РЖ чаще ассоциирован с кишечным гистотипом (71.4%). Подавляющее большинство ВЭБ+ опухолей располагалось в верхних отделах желудка (76.9%) и теле желудка (30.7%). МСН рак наблюдался во всех отделах и, как и ВЭБ+, чаще поражал тело желудка (23.8%), но не развивался на большой кривизне. Клинические характеристики обследованных групп в зависимости от статуса ВЭБ и МСН представлены в табл. 1.
Оценка общей выживаемости. Среднее время наблюдения за больными в общей группе от момента постановки диагноза составило 31.3 мес. (95%; ДИ: 27.6–35.1 мес.), медиана общей выживаемости (ОВ) – 55.0 мес. ОВ (1-, 3- и 5-летняя) составила 84.6, 69.6 и 54.3 мес. соответственно.
Статистически значимые различия в ОВ выявлены при сравнении групп с учетом возраста манифестации: до и после 50 лет – 33.39 vs. 63.81 мес. (р < 0.0001, U-критерий Манна–Уитни). Не выявлено значимых различий в ОВ в зависимости от пола пациентов (р = 0.9782, U-критерий Манна–Уитни). Значимые различия в ОВ выявлены на III и IV стадиях РЖ (р = 0.0139, критерий Данна). Других статистических отличий между стадиями заболевания не прослежено в связи с малочисленностью обследуемых групп. Также не найдено значимых различий в ОВ в зависимости от гистологического типа опухоли (р = 0.9641, критерий Краскела–Уоллиса) (рис. 3).
Рис. 3.
Анализ общей выживаемости (ОВ) в обследованной группе. а ‒ ОВ в зависимости от возраста манифестации РЖ. б – ОВ в зависимости от пола пациента. в ‒ ОВ в зависимости от стадии РЖ. г – ОВ в зависимости от гистологического подтипа РЖ.

Как показано на графиках (рис. 4), у пациентов с ВЭБ+ подтипом прогноз существенно лучше, чем в группах МСН (р = 0.0598, лог-ранг тест) и ВЭБ– + MСС (р = 0.0446, лог-ранг тест).
Рис. 4.
Показатели общей выживаемости пациентов с инфекцией ВЭБ, микросателлитно-нестабильным раком желудка и без них (из анализа исключены пациенты IV стадии заболевания). MСН РЖ – рак желудка с микросателлитной нестабильностью. ВЭБ+ – ВЭБ-ассоциированный рак желудка. ВЭБ– + MСС РЖ – ВЭБ-негативный микросателлитно-стабильный рак желудка.
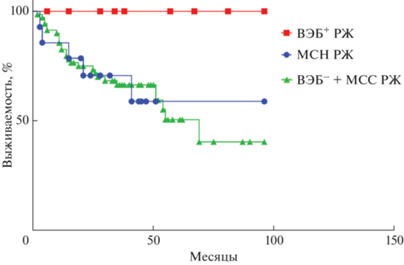
Статистически значимой разницы в показателях ОВ пациентов с МСН и ВЭБ– + MСС не наблюдалось (р = 0.6572, лог-ранг-тест). 50%-Выживаемость достигнута в группе больных ВЭБ– + MСС. Результаты анализа ОВ представлены в табл. 2.
Таблица 2.
12-, 36-, 60-месячная выживаемость больных I–III стадиями рака желудка (%) и медиана выживаемости
| N = 92 | 12 мес. | 36 мес. | 60 мес. | 96 мес. | Медиана, мес. |
| ВЭБ+ | 100 | 100 | 100 | 100 | Не достигнута |
| МСН | 84.6 | 68.4 | 54.7 | 54.7 | Не достигнута |
| ВЭБ– + МСС | 82.6 | 66.5 | 50.6 | 40.5 | 69 |
| Парные сравнения, 96-месячная выживаемость | |||||
| ВЭБ+ | МСН | ВЭБ– + МСС | |||
| ВЭБ+ | 0.0598 | 0.0446 | |||
| МСН | 0.0598 | 0.6572 | |||
| ВЭБ– + МСС | 0.0446 | 0.6572 | |||
| Парные сравнения, 12-месячная выживаемость | |||||
| ВЭБ+ | 0.4935 | 0.3408 | |||
| МСН | 0.4935 | >0.9999 | |||
| ВЭБ– + МСС | 0.3408 | >0.9999 | |||
| Парные сравнения, 36-месячная выживаемость | |||||
| ВЭБ+ | 0.1150 | 0.0557 | |||
| МСН | 0.1150 | >0.9999 | |||
| ВЭБ– + МСС | 0.0557 | >0.9999 | |||
| Парные сравнения, 60-месячная выживаемость | |||||
| ВЭБ+ | 0.0537 | 0.0264 | |||
| МСН | 0.0537 | >0.9999 | |||
| ВЭБ– + МСС | 0.0264 | >0.9999 | |||
Исследование соматических мутаций в генах KRAS, BRAF и PIK3CA. В ходе изучения статуса генов KRAS и PIK3CA выявлено 12 (7.5%) и 5 (2.5%) клинически значимых вариантов соответственно (рис. 5).
Рис. 5.
HRM-анализ соматических мутаций в генах KRAS, PIK3CA, и результаты прямого секвенирования по Сенгеру. а – Кривая плавления при анализе кодонов 12–13 гена KRAS (синий график – дикий тип, розовый – мутантный тип). б – Кривая плавления при анализе кодонов 1047–1049 гена PIK3СА (красный и зеленый графики – дикий тип, розовый – мутантный тип). в – Гетерозиготный вариант G12D в гене KRAS. г – Гетерозиготный вариант E545K в гене PIK3CA.

В кодонах 597–601 (экзон 15) гена BRAF мутаций не выявлено.
Все 13 (100%) образцов ВЭБ+ содержали ген KRAS дикого типа, лишь в одном случае (7.7%) в экзоне 20 гена PIK3CA выявлен вариант E545K. В отличие от ВЭБ+ опухолей, МСН-фенотип характеризовался большим количеством соматических мутаций: 4 (19.0%) варианта в кодонах 12–13 гена KRAS и 7 (33.3%) – в экзонах 9 и 20 гена PIК3CA (рис. 6).
Рис. 6.
Генотипические характеристики образцов. а – Распределение больных раком желудка с учетом инфицирования ВЭБ и статуса микросателлитной нестабильности. б – Количество соматических мутаций в генах KRAS и PIK3CA в зависимости от статуса ВЭБ и микросателлитной нестабильности. MСН – рак желудка с микросателлитной нестабильностью. ВЭБ+ – ВЭБ-ассоциированный рак желудка. ВЭБ– + MСС – ВЭБ-негативный микросателлитно-стабильный рак желудка.

Кроме того, во всех 4 (100%) образцах МСН опухолей с мутированным KRAS обнаружены вариаты гена PIK3CA (табл. 3).
Таблица 3.
Спектр выявленных клинически значимых вариантов в генах KRAS и PIK3CA
| Ген | ВЭБ+ | МСН | ВЭБ– + MСС |
|---|---|---|---|
| KRAS | – | – | G12A, 1* G12V, 1* G12D, 3* Q61E, 1 * |
| PIK3CA | Q546K, 1* | Q546K, 1* H1047R, 2* |
E545K, 1* H1047R, 2* |
| KRAS + PIK3CA | – | KRAS G13D + PIK3CA E542K, 2* KRAS G13D + PIK3CA H1047R, 1* KRAS G12V + PIK3CA H1047R, 1* |
– |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Экономичный и доступный метод ПЦР широко используется для выявления ВЭБ-инфекции в сыворотке, плазме и цельной крови. Однако, как сообщалось Deyhimi и соавт., при ПЦР-диагностике ВЭБ в солидных опухолях существует возможность получения ложноположительных результатов. Низкую специфичность ПЦР можно объяснить тем, что клетки памяти и/или неопухолевые лимфоциты, инфицированные ВЭБ, также могут попасть в образец для анализа. Таким образом, методы на основе ПЦР более чувствительны, но менее специфичны, чем метод гибридизации in situ (ISH) ‒ золотой стандарт диагностики ВЭБ в гистопатологических образцах [56]. С целью исключения из анализа нормальной ткани желудка мы проводили забор опухолевого материала с использованием метода макродиссекции под контролем патоморфолога. С той же целью ПЦР проведена в двух повторностях, в результате чего частота ВЭБ+ РЖ в нашей выборке составила 8.2%. Tavakoli и соавт. провели метаанализ данных 71 статьи и 2226 пациентов с РЖ из 26 стран и показали, что совокупная распространенность ВЭБ среди больных РЖ составила 8.77% [57]. По данным метаанализа, проведенного Camargo и соавт. (13 исследований с участием 4599 пациентов), средний возраст постановки диагноза ВЭБ+ РЖ составлял 58 лет с преобладанием мужчин (71%) [23]. Tavakoli и соавт. также отметили высокую частоту возникновения ВЭБ+ РЖ у лиц мужского пола. В нашем исследовании 92.3% ВЭБ+ РЖ также диагностирован у мужчин. Однако в нашей выборке отмечен более ранний возраст манифестации ВЭБ+ РЖ – 54.8 лет. Кроме того, Tavakoli и соавт. в 57% случаев отнесли ВЭБ+ РЖ к кишечному типу, тогда как в нашей группе наблюдалась тенденция к преобладанию диффузного типа над кишечным (46.2 vs. 38.5%).
По данным различных источников МСН РЖ диагностируется в 10–37% опухолей желудка [28‒30], что согласуется с частотой МСН опухолей в нашем исследовании (13.2%). Поскольку для оценки статуса МСН мы использовали эталонную панель Bethesda [58], разработанную преимущественно для диагностики статуса МСН при колоректальном раке, можно предположить, что частота МСН РЖ может быть несколько выше. Так, Ronald и соавт. оценили МСН аденокарциномы желудка методом NGS. Частота МСН РЖ составила 19.0%, уступая раку эндометрия (30.0%) и колоректальному раку (19.0%). Отмечена высокая частота МСН в широком спектре локусов, часто совпадающих с МСН локусами при раке толстой кишки [44]. Несмотря на то, что Su-Jin Shin и соавт. сообщили о большей частоте МСН-опухолей у женщин, в нашей группе 92.3% случаев диагностировано у пациентов мужского пола. Как и в других исследованиях, MСН фенотип был представлен кишечным гистотипом [31, 32].
Согласно TCGA, мутации в гене PIK3CA могут содержать до 80% ВЭБ+ опухолей, тогда как в исследованной нами выборке лишь в одном случае выявлен вариант E545K в экзоне 20. В исследовании TCGA отмечено, что в отличие от других подтипов РЖ, где наибольшая частота аберраций зарегистрирована в киназном домене гена PIK3CA (экзон 20), в ВЭБ+ опухолях мутации распределены по всему гену [14]. Таким образом, низкая частота соматических мутаций в гене PIK3CA при ВЭБ+ РЖ может быть связана с недостаточным количеством тестируемых экзонов и/или недостаточной чувствительностью HRM. Напротив, MСН РЖ отличается высокой частотой соматических мутаций (33.3%) в экзонах 9 и 20 гена PIK3CA, что значительно превышает показатели, полученные Polom и соавт. (8.1%) [59] и Corso и соавт. (14.3%) [37]. Расхождение показателей может быть связано с недостаточным объемом выборки, использованной нами.
Кроме того, в 100% наблюдений в нашей выборке с МСН отмечена высокая частота соматических мутаций в гене KRAS (19.0%) и их сочетание с мутациями в гене PIK3CA, что объясняется гипермутированным фенотипом МСН опухолей. Крупное международное многоцентровое исследование, изучающее статус генов KRAS и MMR у пациентов с местно-распространенным операбельным РЖ, подтвердило корреляцию между мутациями KRAS и механизмом dMMR [60]. По нашим результатам, а также по данным Barbi и соавт., мутация H1047R в гене PIK3CA обнаружена только в образцах МСН РЖ и связана со статусом МСН [61].
Отличительной особенностью нашего исследовании стало отсутствие мутаций в кодонах 597‒601 гена BRAF, патогномоничных для МСН колоректального рака, которые служат маркером исключения синдрома Линча [53]. Согласно проведенным ранее исследованиям, частота мутаций в гене BRAF колеблется в диапазоне 0‒11% [62].
Как значения ОВ, так и результаты опубликованных ранее исследований подтверждают связь ВЭБ+ подтипа с наилучшим прогнозом – 100% ОВ в течение 96 мес. наблюдения. Различия в ОВ при МСН и ВЭБ- + MСС раке не были статистически значимыми, что, вероятно, связано с малым количеством пациентов в группе МСН (n = 8, 5.3%). Polom и соавт. отметили более низкую пятилетнюю выживаемость пациентов с МСН и мутациями, чем у пациентов с геном PIK3CA дикого типа – 40.0 vs. 70.4% соответственно. В том же исследовании оценили различия в выживаемости пациентов с МСН и различными мутациями в PIK3CA. Оказалось, что пятилетняя выживаемость при мутации в экзоне 9 составила 0 и 80% ‒ при мутации в экзоне 20 [42].
На сегодняшний день в России стандарт молекулярной диагностики при РЖ включает исследование статуса HER2/neu, МСН и экспрессии PD-L1 в случае местнораспространенной неоперабельной или диссеминированной аденокарциномы. Оценка статуса МСН возможна также при операбельных формах РЖ для определения показаний к адъювантной химиотерапии [63]. Таким образом, индивидуализированное лечение доступно преимущественно пациентам с прогрессирующими стадиями РЖ. Ограниченный спектр рекомендованных ДНК-тестов определяет актуальность поиска и внедрения в клиническую практику новых молекулярных маркеров РЖ. Это позволит прогнозировать течение заболевания при первично операбельном РЖ, что в конечном счете сможет благоприятно отразиться на показателях выживаемости. Результаты многочисленных исследований показали, что ВЭБ+ и МСН являются прогностически благоприятными маркерами при РЖ. Вероятно, системы анализа статуса ВЭБ и МСН в гистопатологических образцах с помощью искусственного интеллекта, разрабатываемые в настоящий момент, сделают оценку данных нарушений менее затратной и более доступной [64]. Таким образом, дальнейшее изучение влияния статуса МСН и ВЭБ-инфицирования на возникновение и течение РЖ является актуальной задачей. Расхождение в данных о роли соматических мутаций в генах KRAS, PIK3CA и BRAF делают необходимым дальнейшее изучение прогностического и предиктивного значения этих маркеров.
Проведение исследования одобрено комитетом по биомедицинской этике НМИЦ онкологии им. Н.Н. Блохина Минздрава России, все пациенты подписали информированное согласие
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. (2021) Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: Cancer J. Clinicians. 71, 209–249.
Oba K., Paoletti X., Alberts S., Bang Y.J., Benedetti J., Bleiberg H., Catalano P., Lordick F., Michiels S., Morita S., Ohashi Y., Pignon J.P., Rougier P., Sasako M., Sakamoto J., Sargent D., Shitara K., Van Cutsem E., Buyse M., Byrzykowski T., GASTRIC group (2013) Disease-free survival as a surrogate for overall survival in adjuvant trials of gastric cancer: a meta-analysis. J. Natl. Cancer Inst. 105, 1600–1607.
Dicken B.J., Bigam D.L., Cass C., Mackey J.R., Joy A.A., Hamilton S.M. (2005) Gastric adenocarcinoma: review and considerations for future directions. Ann. Surgery. 241, 27–39.
Каприн А.Д., Старинский В.В., Шахзадова А.О. (2020) Злокачественные новообразования в России в 2019 году. Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ “НМИЦ радиологии” Минздрава России.
Lauren P. (1965) The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol. Microbial. Scandinavica. 64, 31–49.
Tan P., Yeoh K.G. (2015) Genetics and molecular pathogenesis of gastric adenocarcinoma. Gastroenterology. 149, 1153–1162.
Bonequi P., Meneses-González F., Correa P., Rabkin C.S., Camargo M.C. (2013) Risk factors for gastric cancer in Latin-America: a meta-analysis. Cancer Causes Control. 24, 217‒231.
Strumylaite L., Zickute J., Dudzevicius J., Dregval L. (2006) Salt-preserved foods and risk of gastric cancer. Medicina (Kaunas, Lithuania), 42, 164–170.
González C.A., Pera G., Agudo A., Palli D., Krogh V., Vineis P., Tumino R., Panico S., Berglund G., Simán H., Nyrén O., Agren A., Martinez C., Dorronsoro M., Barricarte A., Tormo M.J., Quiros J.R., Allen N., Bingham S., Day N., Miller A., Nagel G., Boeing H., Overland K., Tjonneland A., Bueno-De-Mesquita H.B., Boshuizen H.C., Peeters P., Numans M., Clavel-Chapelon F., Helen I., Agapitos E., Lund E., Fahey M., Saracci R., Kaaks R., Riboli E. (2003) Smoking and the risk of gastric cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC). Internat. J. Cancer. 107, 629–634.
Plummer M., Franceschi S., Vignat J., Forman D., De Martel C. (2015) Global burden of gastric cancer attributable to Helicobacter pylori. Internat. J. Cancer. 136, 487–490.
Uozaki H., Fukayama M. (2008) Epstein–Barr virus and gastric carcinoma – viral carcinogenesis through epigenetic mechanisms. Int. J. Clin. Exp. Pathol. 1, 198‒216.
Bae J.M., Kim E.H. (2016) Epstein–Barr Virus and gastric cancer risk: a meta-analysis with meta-regression of case-control studies. J. Prev. Med. Public Health. 49, 97‒107.
Assumpção P., Araújo T., Khayat A., Santos S., Barra W., Ishak G., Santos S., Barra W., Felipe Acioli J., Rossi B. Assumpção P. (2020) Hereditary gastric cancer: three rules to reduce missed diagnoses. World J. Gastroenterol. 26, 1382‒1393.
The Cancer Genome Atlas Research Network (2014) Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 513, 202–209.
Matsusaka K., Kaneda A., Nagae G., Ushiku T., Kikuchi Y., Hino R., Uozaki H., Seto Y., Takada K., Aburatani H., Fukayama M. (2011) Classification of Epstein–Barr virus-positive gastric cancers by definition of DNA methylation epigenotypes. Cancer Res. 71, 7187–7197.
Zhao J., Liang Q., Cheung K.F., Kang W., Lung R.W.M., Tong J.H.M., To K.F., Sung J.J.Y., Yu J. (2013) Genome-wide identification of Epstein–Barr virus-driven promoter methylation profiles of human genes in gastric cancer cells. Cancer. 119, 304–312.
Kandoth C., McLellan M.D., Vandin F., Ye K., Niu B., Lu C., Xie M., Zhang Q., McMichael J.F., Wyczalkowski M.A., Leiserson M.D.M., Miller C.A., Welch J.S., Walter M.J., Wendl M.C., Ley T.J., Wilson R.K., Raphael B.J., Ding L. (2013) Mutational landscape and significance across 12 major cancer types. Nature. 502, 333–339.
Astolfi A., Fiore M., Melchionda F., Indio V., Bertuccio S.N., Pession A. (2019) BCOR involvement in cancer. Epigenomics. 11, 835‒855.
Hoadley K.A., Yau C., Wolf D.M., Cherniack A.D., Tamborero D., Zou L., Ng S., Leiserson M. D. M., Niu B., McLellan M.D., Uzunangelov V., Zhang J., Kandoth C., Akbani R., Shen H., Omberg L., Chu A., Margolin A.A., Veer L.A.J., Lopez-Bigas N., Laird P.W., Raphael B.J., Ding L., Robertson A. G., Lauren A.B., Mills G.B., Weinstein J.N., Waes C.V., Chen Z., Collisson E.A., Cancer Genome Atlas Research Network, Benz C.C., Perou C.M., Stuart J.M. (2014) Multiplatform analysis of 12 cancer types reveals molecular classification within and across tissues of origin. Cell. 158, 929–944.
Böger C., Krüger S., Behrens H.M., Bock S., Haag J., Kalthoff H., Röcken C. (2017) Epstein–Barr virus-associated gastric cancer reveals intratumoral heterogeneity of PIK3CA mutations. Ann. Oncol. 28, 1005–1014.
Dong M., Wang H.Y., Zhao X.X., Chen J.N., Zhang Y.W., Huang Y., Xue L., Li H.G., Du H., Wu X.Y., Shao C.K. (2016) Expression and prognostic roles of PIK3CA, JAK2, PD-L1, and PD-L2 in Epstein–Barr virus-associated gastric carcinoma. Hum. Pathol. 53, 25–34.
Derks S., Liao X., Chiaravalli A.M., Xu X., Camargo M.C., Solcia E., Sessa F., Fleitas T., Freeman G.J., Rodig S.J., Rabkin C.S., Bass A.J. (2016) Abundant PD-L1 expression in Epstein–Barr virus-infected gastric cancers. Oncotarget. 7, 32925–32932.
Camargo M.C., Kim K.M., Matsuo K., Torres J., Liao L.M., Morgan D.R., Michel A., Waterboer T., Zabaleta J., Dominguez R.L., Yatabe Y., Kim S., Rocha-Guevara E.R., Lissowska J., Pawlita M., Rabkin C.S. (2016) Anti-Helicobacter pylori antibody profiles in Epstein–Barr virus (EBV)-positive and EBV-negative gastric cancer. Helicobacter. 21, 153–157.
Yanagi A., Nishikawa J., Shimokuri K., Shuto T., Takagi T., Takagi F., Kobayashi Y., Yamamoto M., Miura O., Yanai H., Suehiro Y., Yamasaki T., Yoshiyama H., Sakaida I. (2019) Clinicopathologic characteristics of Epstein–Barr virus-associated gastric cancer over the past decade in Japan. Microorganisms. 7, 305.
van Beek J., zur Hausen A., Kranenbarg E.K., van de Velde C.J.H., Middeldorp J.M., van den Brule A.J.C., Meijer C.J.L.M., Bloemena E. (2004) EBV-positive gastric adenocarcinomas: a distinct clinicopathologic entity with a low frequency of lymph node involvement. J. Clin. Oncol. : Official J. Am. Soc. Clin. Oncol. 22, 664–670.
Sohn B.H., Hwang J.E., Jang H.J., Lee H.S., Oh S.C., Shim J.J., Lee K.W., Kim E.H., Yim S.Y., Lee S.H., Cheong J.H., Jeong W., Cho J.Y., Kim J., Chae J., Lee J., Kang W.K., Kim S., Noh S.H., Ajani J.A., Lee J.S. (2017) Clinical significance of four molecular subtypes of gastric cancer identified by The Cancer Genome Atlas Project. Clin. Cancer Res. 23, 4441–4449.
Lee H.S., Chang M.S., Yang H.K., Lee B.L., Kim W.H. (2004) Epstein–Barr virus-positive gastric carcinoma has a distinct protein expression profile in comparison with Epstein–Barr virus-negative carcinoma. Clin. Cancer Res. 10, 1698–1705.
Choi Y.Y., Bae J.M., An J.Y., Kwon I.G., Cho I., Shin H.B., Eiji T., Aburahmah M., Kim H. I., Cheong J.H., Hyung W.J., Noh S.H. (2014) Is microsatellite instability a prognostic marker in gastric cancer? A systematic review with meta-analysis. J. Surg. Oncol. 110, 129–135.
Smyth E.C., Wotherspoon A., Peckitt C., Gonzalez D., Hulkki-Wilson S., Eltahir Z., Fassan M., Rugge M., Valeri N., Okines A., Hewish M., Allum W., Stenning S., Nankivell M., Langley R., Cunningham D. (2017) Mismatch repair deficiency, microsatellite instability, and survival: an exploratory analysis of the Medical Research Council Adjuvant Gastric Infusional Chemotherapy (MAGIC) trial. JAMA Oncol. 3, 1197–1203.
Choi Y.Y., Cheong J.H. (2019) Comment on ‘To Treat, or Not to Treat, That is the Question: biomarker-guided adjuvant chemotherapy for stage ii and iii gastric cancer’. Ann. Surgery. 270, e40–e41.
Shin S.J., Kim S.Y., Choi Y.Y., Son T., Cheong J.-H., Hyung W.J., Noh S.H., Park C.-G., Kim H.-I. (2019) Mismatch repair status of gastric cancer and its association with the local and systemic immune response. Oncologist. 24, 835–844.
Zhu L., Li Z., Wang Y., Zhang C., Liu Y., Qu X. (2015) Microsatellite instability and survival in gastric cancer: a systematic review and meta-analysis. Mol. Clin. Oncol. 3, 699–705.
Latham A., Srinivasan P., Kemel Y., Shia J., Bandlamudi C., Mandelker D., Middha S., Hechtman J., Zehir A., Dubard-Gault M., Tran C., Stewart C., Sheehan M., Penson A., DeLair D., Yaeger R., Vijai J., Mukherjee S., Galle J., Dickson M.A., Janjigian Y., O’Reilly E.M., Segal N., Saltz L.B., Reidy-Lagunes D., Varghese A.M., Bajorin D., Carlo M.I., Cadoo K., Walsh M.F., Weiser M., Aguilar J.G., Klimstra D.S., Diaz L.A., Baselga J., Zhang L., Ladanyi M., Hyman D.M., Solit D.B., Robson M.E., Taylor B.S., Offit K., Berger M.F., Stadler Z.K. (2019) Microsatellite instability is associated with the presence of Lynch syndrome pan-cancer. J. Clin. Oncol. 37, 286–295.
Wu M.S., Sheu J.C., Shun C.T., Lee W.J., Wang J.T., Wang T.H., Cheng A.L., Lin J.T. (1997) Infrequent hMSH2 mutations in sporadic gastric adenocarcinoma with microsatellite instability. Cancer Lett. 112, 161–166.
Leite M., Corso G., Sousa S., Milanezi F., Afonso L.P., Henrique R., Soares J.M., Castedo S., Carneiro F., Roviello F., Oliveira C., Seruca R. (2011) MSI phenotype and MMR alterations in familial and sporadic gastric cancer. Internat. J. Cancer. 128, 1606–1613.
Wang K., Kan J., Yuen S.T., Shi S.T., Chu K.M., Law S., Chan T.L., Kan Z., Chan A.S.Y., Tsui W.Y., Lee S.P., Ho S.L., Chan A.K.W., Cheng G.H.W., Roberts P.C., Rejto P.A., Gibson N.W., Pocalyko D.J., Mao M., Xu J., Leung S.Y. (2011) Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer. Nat. Genet. 43, 1219–1223.
Corso G., Velho S., Paredes J., Pedrazzani C., Martins D., Milanezi F., Pascale V., Vindigni C., Pinheiro H., Leite M., Marrelli D., Sousa S., Carneiro F., Oliveira C., Roviello F., Seruca R. (2011) Oncogenic mutations in gastric cancer with microsatellite instability. Eur. J. Cancer. 47, 443–451.
Wang K., Yuen S.T., Xu J., Lee S.P., Yan H.H.N., Shi S.T., Siu H.C., Deng S., Chu K.M., Law S., Chan K.H., Chan A.S.Y., Tsui W.Y., Ho S.L., Chan A.K.W., Man J.L.K., Foglizzo V., Ng M.K., Chan A.S., Ching Y.P., Leung S.Y. (2014) Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer. Nat. Genet. 46, 573–582.
Kim M.S., Oh J.E., Kim Y.R., Park S.W., Kang M.R., Kim S.S., Ahn C.H., Yoo N.J., Lee S.H. (2010) Somatic mutations and losses of expression of microRNA regulation-related genes AGO2 and TNRC6A in gastric and colorectal cancers. J. Pathol. 221, 139–146.
Bernal M., Ruiz-Cabello F., Concha A., Paschen A., Garrido F. (2012) Implication of the β2-microglobulin gene in the generation of tumor escape phenotypes. Cancer Immunol., Immunother. 61, 1359–1371.
Chao J., Fuchs C.S., Shitara K., Tabernero J., Muro K., Van Cutsem E., Bang Y.J., De Vita F., Landers G., Yen C.J., Chau I., Elme A., Lee J., Özgüroǧlu M., Catenacci D., Yoon H.H., Chen E., Adelberg D., Shih C.S., Shah S., Bhagia P., Waingberg Z.A. (2021) Assessment of pembrolizumab therapy for the treatment of microsatellite instability-high gastric or gastroesophageal junction cancer among patients in the KEYNOTE-059, KEYNOTE-061, and KEYNOTE-062 clinical trials. JAMA Oncol. 7, 895–902.
Polom K., Marano L., Marrelli D., De Luca R., Roviello G., Savelli V., Tan P., Roviello F. (2018) Meta-analysis of microsatellite instability in relation to clinicopathological characteristics and overall survival in gastric cancer. Br. J. Surgery. 105, 159–167.
Mathiak M., Warneke V.S., Behrens H.M., Haag J., Böger C., Krüger S., Röcken C. (2017) Clinicopathologic characteristics of microsatellite instable gastric carcinomas revisited: urgent need for standardization. Appl. Immunohistochem. Mol. Morphol. 25, 12–24.
Hause R.J., Pritchard C.C., Shendure J., Salipante S.J. (2016) Classification and characterization of microsatellite instability across 18 cancer types. Nat. Med. 22, 1342–1350.
Lengauer C., Kinzler K.W., Vogelstein B. (1998) Genetic instabilities in human cancers. Nature. 396, 643–649.
Ottini L., Falchetti M., Lupi R., Rizzolo P., Agnese V., Colucci G., Bazan V., Russo A. (2006) Patterns of genomic instability in gastric cancer: clinical implications and perspectives. Ann. Oncol. 17(Suppl. 7), vii97–vii102.
Jung E.J., Jung E.J., Min S.Y., Kim M.A., Kim W.H. (2012) Fibroblast growth factor receptor 2 gene amplification status and its clinicopathologic significance in gastric carcinoma. Hum. Pathol. 43, 1559–1566.
Xie L., Su X., Zhang Lin, Yin X., Tang L., Zhang Xiuhua, Xu Y., Gao Z., Liu K., Zhou M., Gao B., Shen D., Zhang L., Ji A., Gavine P.R., Zhang J., Kilgour E., Zhang X., Ji Q. (2013) FGFR2 gene amplification in gastric cancer predicts sensitivity to the selective FGFR inhibitor AZD4547. Clin. Cancer Res. 19, 2572–2583.
Dulak A.M., Schumacher S.E., Van Lieshout J., Imamura Y., Fox C., Shim B., Ramos A.H., Saksena G., Baca S.C., Baselga J., Tabernero J., Barretina J., Enzinger P.C., Corso G., Roviello F., Lin L., Bandla S., Luketich J.D., Pennathur A., Meyerson M., Ogino S., Shivdasani R.A., Beer D.G., Godfrey T.E., Beroukhim R., Bass A.J. (2012) Gastrointestinal adenocarcinomas of the esophagus, stomach, and colon exhibit distinct patterns of genome instability and oncogenesis. Cancer Res. 72, 4383–4393.
Deng N., Goh L.K., Wang H., Das K., Tao J., Tan I.B., Zhang S., Lee M., Wu J., Lim K.H., Lei Z., Goh G., Lim Q.Y., Tan A.L.K., Poh D.Y.S., Riahi S., Bell S., Shi M.M., Linnartz R., Zhu F., Yeoh K.G., Toh H.C., Yong W.P., Cheong H.C., Rha S.Y., Boussioutas A., Grabsch H., Rozen S., Tan P. (2012) A comprehensive survey of genomic alterations in gastric cancer reveals systematic patterns of molecular exclusivity and co-occurrence among distinct therapeutic targets. Gut. 61, 673–684.
Palanisamy N., Ateeq B., Kalyana-Sundaram S., Pflueger D., Ramnarayanan K., Shankar S., Han B., Cao Q., Cao X., Suleman K., Kumar-Sinha C., Dhanasekaran S.M., Chen Y.B., Esgueva R., Banerjee S., Lafargue C.J., Siddiqui J., Demichelis F., Moeller P., Bismar T.A., Kuefer R., Fullen D.R., Johnson T.M., Greenson J.K., Giordano T.J., Tan P., Tomlins S.A., Varambally S., Rubin M.A., Maher C.A., Chinnaiyan A.M. (2010) Rearrangements of the RAF kinase pathway in prostate cancer, gastric cancer and melanoma. Nat. Med. 16, 793–798.
Yu H., Jove R. (2004) The STATs of cancer – new molecular targets come of age. Nat. Rev. Cancer. 4, 97–105.
The Cancer Genome Atlas Network (2012) Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487, 330–337.
Medina P.P., Nolde M., Slack F.J. (2010) OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma. Nature. 467, 86–90.
Pfeffer S.R., Yang C.H., Pfeffer L.M. (2015) The role of miR-21 in cancer. Drug Dev. Res. 76, 270–277.
Deyhimi P., Kalantari M. (2014) Study of Epstein-Barr virus expression in Burkitt’s lymphoma by polymerase chain reaction and in situ hybridization: a study in Iran. Dental Res. J. 11, 380–385.
Tavakoli A., Monavari S.H., Solaymani Mohammadi F., Kiani S.J., Armat S., Farahmand M. (2020) Association between Epstein–Barr virus infection and gastric cancer: a systematic review and meta-analysis. BMC Cancer. 20, 493.
Suraweera N., Duval A., Reperant M., Vaury C., Furlan D., Leroy K., Seruca R., Iacopetta B., Hamelin R. (2002) Evaluation of tumor microsatellite instability using five quasimonomorphic mononucleotide repeats and pentaplex PCR. Gastroenterology. 123, 1804–1811.
Polom K., Marrelli D., Roviello G., Pascale V., Voglino C., Vindigni C., Generali D., Roviello F. (2018) PIK3CA mutation in gastric cancer and the role of microsatellite instability status in mutations of exons 9 and 20 of the PIK3CA gene. Adv. Clin. Exp. Med. 7, 963–969.
Van Grieken N.C.T., Aoyma T., Chambers P.A., Bottomley D., Ward L.C., Inam I., Buffart T.E., Das K., Lim T., Pang B., Zhang S.L., Tan I.B., Carvalho B., Heideman D.A.M., Miyagi Y., Kameda Y., Arai T., Meijer G.A., Tsuburaya A., Tan P., Yoshikawa T., Grabsch H.I. (2013) KRAS and BRAF mutations are rare and related to DNA mismatch repair deficiency in gastric cancer from the East and the West: results from a large international multicentre study. Br. J. Cancer. 108, 1495–1501.
Barbi S., Cataldo I., De Manzoni G., Bersani S., Lamba S., Mattuzzi S., Bardelli A., Scarpa A. (2010) The analysis of PIK3CA mutations in gastric carcinoma and metanalysis of literature suggest that exon-selectivity is a signature of cancer type. J. Exp. Clin. Cancer Res. 29, 32.
Lu W., Wei H., Li M., Wang H., Liu L., Zhang Q., Liu L., Lu S. (2015) Identification of KRAS and PIK3CA but not BRAF mutations in patients with gastric cancer. Mol. Med. Rep. 1, 1219–1224.
Бесова Н. С., Трякин А. А., Артамонова Е. В., Болотина Л. В., Калинин А. Е., Кононец П. В., Лядов В. К., Малихова О. А., Неред С. Н., Проценко С. А., Рябов А. Б., Стилиди И. С., Тер-Ованесов М. Д., Хомяков В. М. (2020) Практические pекомендации по лекарственному лечению рака желудка. Злокачественные опухоли. 10, 339–354.
Muti H.S., Heij L.R., Keller G., Kohlruss M., Langer R., Dislich B., Cheong J.H., Kim Y.W., Kim H., Kook M.C., Cunningham D., Allum W.H., Langley R.E., Nankivell M.G., Quirke P., Hayden J.D., West N.P., Irvine A.J., Yoshikawa T., Oshima T., Huss R., Grosser M., Roviello F., d’Ignazzio A., Quaas A., Alakus H., Tan X., Pearson A.T., Luedde., Ebbert M.P., Jager D., Trautwein C., Gaisa N.T., Grabsch H.I., Kather J.N. (2021) Development and validation of deep learning classifiers to detect Epstein–Barr virus and microsatellite instability status in gastric cancer: a retrospective multicentre cohort study. Lancet. Digital Health. 3, e654–e664.
Ботезату И.В., Панчук И.О., Строганова А.М., Сендерович А.И., Кондратова В.Н., Шелепов В.П., Лихтенштейн А.В. (2017) Сканирование мутаций KRAS, NRAS, BRAF и PIK3CA методом плавления ДНК c использованием зондов TaqMan. Молекуляр. биология. 51, 50–58.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


