Молекулярная биология, 2023, T. 57, № 1, стр. 10-23
Разнообразие функций хеликазы MLE в регуляции экспрессии генов у высших эукариот
Ю. В. Николенко a, *, С. Г. Георгиева a, Д. В. Копытова a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: julia.v.nikolenko@gmail.com
Поступила в редакцию 20.06.2022
После доработки 08.08.2022
Принята к публикации 11.08.2022
- EDN: AYAXGF
- DOI: 10.31857/S0026898423010123
Аннотация
Белок MLE (Maleless) Drosophila melanogaster – консервативная хеликаза, вовлеченная в широкий спектр процессов регуляции экспрессии генов. У многих высших эукариот, включая человека, обнаружен ортолог MLE, получивший название DHX9. DHX9 участвует в таких процессах, как поддержание стабильности генома, репликация, транскрипция, сплайсинг, редактирование и транспорт клеточных и вирусных РНК, регуляция трансляции. Часть из этих функций изучена довольно подробно, но большая часть остается неохарактеризованной. Изучение функций ортолога MLE у млекопитающих in vivo ограничено тем, что потеря этого белка приводит к эмбриональной летальности. Хеликазу MLE у D. melanogaster первоначально обнаружили и долгое время изучали как участника процесса дозовой компенсации. Однако в последние годы появились данные о том, что в клетках D. melanogaster и в клетках млекопитающих хеликаза MLE участвует в одних и тех же процессах, при этом многие функции этого белка эволюционно консервативны. Кроме того, в экспериментах на D. melanogaster обнаружены такие новые важные функции MLE, как участие в гормонзависимой регуляции транскрипции, взаимодействие с транскрипционным комплексом SAGA и другими кофакторами транскрипции и комплексами ремоделирования хроматина. В отличие от млекопитающих, мутации mle не приводят к гибели D. melanogaster на эмбриональной стадии, что позволяет изучать функции этого белка in vivo на протяжении всего онтогенеза у самок и до стадии куколки у самцов. Ортолог MLE у человека рассматривается как потенциальная мишень для противоопухолевой и противовирусной терапии. Поэтому изучение функций этой хеликазы на модельном организме D. melanogaster представляется важным и перспективным как в фундаментальном, так и в прикладном аспектах. В настоящем обзоре рассмотрено систематическое положение, доменное строение, а также консервативные и специфические функции хеликазы MLE D. melanogaster.
СИСТЕМАТИЧЕСКОЕ ПОЛОЖЕНИЕ MLE
Белок MLE относится к хеликазам, обширному классу ферментов, представленному во всех клеточных формах жизни и у многих вирусов [1–3]. На основании анализа аминокислотной последовательности, структуры и функций выделяют шесть суперсемейств хеликаз (SF1–6), которые, в свою очередь, делятся на семейства [4]. MLE входит в состав семейства хеликаз с DExH-боксом, входящего в суперсемейство SF2. Представители суперсемейства SF2 содержат консервативное каталитическое “ядрo”, состоящее из двух глобулярных RecA-подобных доменов, сходных с доменами бактериальной рекомбиназы А, каждый из которых состоит из пяти β-структур, окруженных пятью α-спиралями. В последовательности RecA-подобных доменов выделяют от 7 до 12 наиболее консервативных аминокислотных мотивов [1]. Еще совсем недавно семейство хеликаз с DExH-боксом объединяли в одну группу с DEAD-бокс-хеликазами и называли их хеликазами с DExD/H-боксом, однако со временем обнаружили принципиальные различия как в аминокислотной последовательности, так и в биохимических свойствах этих белков, что привело к выделению двух отдельных семейств в составе SF2: DEAD-бокс (альтернативное название DExD, или DDX) и DEAH/RHA (DExH, DHX). Свои названия эти два семейства получили по аминокислотной последовательности консервативного мотива II, представленного у этих белков последовательностями Asp-Glu-x-Asp и Asp-Glu-x-His, где x – остаток любой аминокислоты. Мотив II – главный сайт связывания и гидролиза NTP, который взаимодействует с их β- и γ-фосфатными группами, координируя ион Mg2+.
Несмотря на структурное сходство, выявлены и существенные различия в ключевых аминокислотных остатках консервативных мотивов белков семейств DDХ и DHХ. Как следствие, хеликазы DHХ могут гидролизовать любые нуклеотиды, в то время как хеликазы DDХ – только ATP. Это свойство хеликаз связано с дополнительным консервативным Q-мотивом, расположенным непосредственно перед мотивом I в последовательности хеликаз DDХ. Q-мотив образует контакт с остатком аденина, что и обеспечивает специфичность узнавания ATP. У хеликаз DHХ Q-мотив отсутствует. Другое отличие хеликаз DDХ и DHX состоит в том, что хеликазы DDX осуществляют непроцессивное локальное расплетание молекулы нуклеиновой кислоты без транслокации. Хеликазы же семейства DHX с умеренной процессивностью расплетают нуклеиновые кислоты, перемещаясь вдоль молекулы в 3'→5'-направлении (есть исключение), часто этим хеликазам для связывания с субстратом нужен “свободный” одноцепочечный 3'-конец.
СТРОЕНИЕ MLE, БИОХИМИЧЕСКАЯ АКТИВНОСТЬ in vitro
Хеликаза MLE консервативна у высших эукариот и все ее ортологи имеют одинаковое строение. Ортологи MLE найдены у человека и других млекопитающих (Bos taurus, Mus musculus), а также у других высших эукариот: Caenorhabditis elegans, Arabodopsis thaliana [5–7], но не обнаружены у птиц [8, 9]. В настоящее время все эти белки-ортологи имеют общее название DHX9. Далее мы будем использовать название MLE для белка Drosophila melanogaster, а DHX9 – для обозначения его ортологов у других организмов. Обнаружен высокий уровень гомологии DHX9 у разных организмов: гомология между белками разных видов млекопитающих составляет 90% и более. У белков D. melanogaster и человека идентичны 50% аминокислотных остатков, а 85% – подобны. Поликлональные антитела к MLE D. melanogaster распознают DHX9 в экстракте клеток HeLa [5]. Белки DHX9 человека и белки C. elegans и A. thaliana имеют 42 и 27% идентичных аминокислотных остатков соответственно [10]. Все эти белки имеют сходные размеры (1270 аминокислотных остатков у человека и 1293 – у D. melanogaster) и одинаковую доменную структуру [10–13].
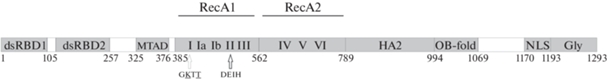
Строение белка MLE представлено на рис. 1. В центральной части молекулы расположено характерное для хеликаз DHX каталитическое ядро, содержащее восемь консервативных мотивов, организованных в два хеликазных RecA-подобных домена. В первом домене располагаются мотивы I–III, а во втором – IV–VI. Связывание NTP и нуклеиновой кислоты происходит в углублении между доменами. Остатки глутаминовой и аспарагиновой кислоты в мотиве II, представленном последовательностью DEIH, как сказано выше, координируют катион Mg2+ и взаимодействуют с β- и γ-фосфатными группами NTP. Также во взаимодействии с NTP и его гидролизе участвуют мотивы I и VI. Мутация mleGET (замена одного аминокислотного остатка К413E в мотиве I) приводит к полной потере АТРазной активности белка. Мотив III отвечает за хеликазную активность, т.е. за связь гидролиза NTP с расплетанием нуклеиновой кислоты, а мотивы Ia, Ib, IV и V – за связывание нуклеиновой кислоты. Сразу за RecA-подобными доменами локализован ассоциированный с хеликазой домен НА2. На N-конце белка находятся два домена связывания дцРНК (dsRB-D1, dsRBD2), а затем небольшой (примерно 50 аминокислотных остатков) домен трансактивации MTAD [11]. За каталитическим ядром располагается район связывания олигосахарида/олигонуклеотида (OB-fold), затем следует сигнал ядерной локализации и глицин-богатая C-концевая область (Gly). Особенностью С-концевой области MLE является 9-кратный несовершенный повтор последовательности GGGYGNN [14], где тирозин занимает каждое седьмое положение в пределах повтора. Такое псевдогептадное расположение тирозина может указывать на формирование амфипатической спирали с гидрофобной поверхностью, которая может участвовать в межмолекулярных взаимодействиях [15]. Домены dsRBD2, НА2 и OB-fold необходимы для хеликазной активности MLE in vitro, в то время как ds-RBD1 и С-концевой глицин-богатый домены для этого не важны. Однако эти домены необходимы для определения специфичности связывания MLE с нуклеиновыми кислотами и белками in vivo. В частности, dsRBD1 определяет связывание MLE с X-хромосомой самцов, а С-концевой домен обеспечивает ядерную локализацию [15].
Рис. 1.
Доменная структура белка MLE. Районы, соответствующие определенным доменам, обозначены серым цветом. Линкерные участки обозначены белым цветом. Представлены два домена связывания дцРНК – dsRBD1 и d-sRBD2, минимальный домен трансактивации MTAD, каталитическое ядро, состоящее из доменов RecA1 и RecA2 и хеликаза-ассоциированного домена HA2, область связывания олигосахарида/олигонуклеотида OB-fold, сигнал ядерной локализации NLS, глицин-богатый С-концевой домен Gly. Консервативные мотивы в составе каталитического ядра обозначены римскими цифрами, мотив DExН представлен последовательностью DEIH. Подчеркнуты консервативные аминокислотные остатки в мотиве I: K413 и T415, замены которых приводят к мутациям, mleGET и mlenapts соответственно.
Белок без dsRBD1 и С-концевого домена был кристаллизован в присутствии аналога ATP и оцРНК [12]. Выявлены многочисленные взаимодействия доменов dsRBD2 и OB-fold с каталитическим ядром, образованным доменами RecA1, RecA2 и HA2. “Оборачиваясь” вокруг каталитического ядра, они формируют вместе с ним кольцевую структуру неправильной формы. Направляемая доменами dsRBD2 и OB-fold оцРНК проходит по каналу внутри кольцевой структуры.
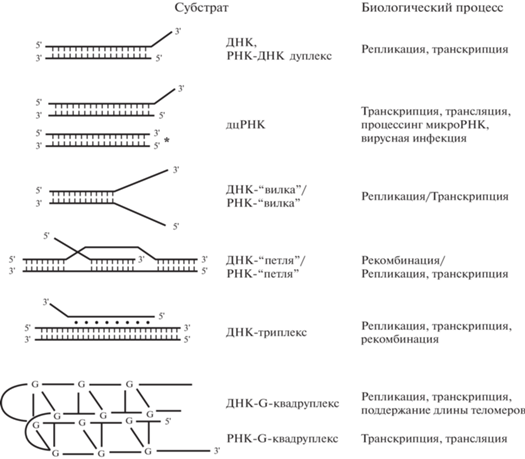
Биохимическая активность MLE D. melanogaster и DHX9 человека подробно изучена in vitro. Показана способность DHX9 расплетать самые разнообразные субстраты (рис. 2), в том числе G-квадруплексы в ДНК и РНК [5, 10, 15, 16]. Экспериментально обнаружены две особенности MLE in vitro, не характерные для других хеликаз DHX, а именно, исключительно высокая аффинность к полиуридиновым последовательностям, а также зависящая от домена dsRBD2 способность расплетать дуплексы РНК с “тупыми” концами (без выступающего одноцепочечного 3'-конца) [12].
Рис. 2.
Схематическое изображение образованных ДНК и РНК структур, которые способны расплетать in vitro MLE и ее ортолог у млекопитающих. Указаны биологические процессы, в которых образуются эти структуры. Звездочкой отмечены дуплексы РНК с “тупыми” концами, способность расплетать которые показана только для MLE D. melanogaster. Схема с модификациями, введенными нами, цитирована по [10, лицензия Creative Commons Attribution License].
Таким образом, хеликаза MLE in vitro способна без участия N-и C-концевых доменов расплетать вторичные структуры в молекулах нуклеиновых кислот, перемещаясь в 3' → 5'-направлении. При этом in vivo домены на N- и C-концах молекулы MLE обеспечивают взаимодействие с разными белковыми факторами и определяют специфичность функций этой хеликазы.
ФУНКЦИИ MLE В ДОЗОВОЙ КОМПЕНСАЦИИ
MLE экспрессируется на всех стадиях развития самцов и самок D. melanogaster и имеет ядерную локализацию. Исторически сложилось так, что в большей части научных исследований хеликазу MLE рассматривали как компонент комплекса дозовой компенсации, специфичного для D. melanogaster. За последние три десятилетия опубликовано множество работ, посвященных дозовой компенсации, и подробное рассмотрение этой темы выходит за рамки данного обзора. Здесь представлены только общие сведения о составе и функциях комплекса дозовой компенсации, более подробно будут рассмотрены другие функции MLE.
Комплекс дозовой компенсации у D. melanogaster (MSL – male specific lethal) – это РНП-комплекс, формирующийся только у самцов и необходимый для их жизнеспособности. Комплекс MSL необходим для выравнивания уровней экспрессии генов в одной Х-хромосоме самцов и двух Х-хромосомах самок. В состав комплекса помимо MLE входят еще четыре белка – MSL1, MSL2, MSL3 и MOF (males absent on the first), и одна из двух длинных некодирующих РНК, roX1 или roX2 (RNA on the X 1 или 2) [17–21]. MSL1, MSL2, MSL3 и MOF связаны белок-белковыми взаимодействиями и формируют гетерооктамер, а MLE входит в состав комплекса через взаимодействие с РНК roX.
Встраивание одной из РНК roX в MSL необходимо для его функционирования [22, 23]. РНК roX1 и roX2 отличаются по размеру и последовательности, но имеют общие консервативные мотивы вблизи 3'-конца: обогащенные уридином последовательности, названные roX-box. Эти последовательности необходимы для формирования вторичных структур стебель–петля. MLE связывается с одноцепочечной последовательностью петли и расплетает РНК-дуплекс спирального стебля, открывая тем самым сайты связывания белка MSL2 [18, 24–27]. Таким образом MLE интегрирует РНК roX в комплекс MSL [28–30].
Из перечисленных компонентов комплекса MSL только MSL2 и roX экспрессируются специфично у самцов и отсутствуют у самок D. melanogaster [31, 32]. У самцов функциональный комплекс MSL собирается на X-хромосоме в так называемых высокоаффинных участках (High Affinity Sites, HAS), а затем распространяется по всей длине Х-хромосомы [2, 33]. В разных исследованиях выявлено от нескольких десятков до полутора сотен высокоаффинных сайтов, самыми сильными из них являются гены roX1 и roX2. Последовательности HAS содержат GA-богатый мотив длиной 21 п.н., названный MRE (MSL Recognition Element). Цистеин-богатый домен белка MSL2 способен связываться с MRE, что частично определяет связывание комплекса MSL c X-хромосомой.
Анализ ряда мутаций MLE позволил установить, что замена K413E (мутация mleGET), нарушающая АТРазную и хеликазную активности белка, приводит к тому, что комплекс MSL, в состав которого входит такой белок, остается связанным с высокоаффинными сайтами и не распространяется по всей длине X-хромосомы. Это нарушает дозовую компенсацию и приводит к летальности самцов на стадии поздней личинки. Для более точного исследования функции MLE в распространении комплекса по X-хромосоме подобраны мутации, избирательно блокирующие хеликазную активность при сохранении АТРазной: аминокислотные замены в мотиве III и делеция мотива V. Комплекс MSL, содержащий такой дефектный белок MLE, сохраняет способность активировать экспрессию гена, расположенного в непосредственной близости к высокоаффинному сайту, но при этом не происходит распространения комплекса на большие расстояния, как и в случае с mleGET. Это означает, что для распространения комплекса MSL по всей длине X-хромосомы необходима хеликазная активность MLE [2, 33, 34].
Итак, хеликаза MLE необходима для включения РНК roX в комплекс MSL и распространения этого комплекса по всей длине X-хромосомы самцов, что, в свою очередь, необходимо для дозовой компенсации.
Классические представления о механизмах дозовой компенсации у D. melanogaster связывают уравнивание экспрессии одной дозы генов Х-хромосомы у самцов и двух доз генов Х-хромосомы у самок с двукратной активацией экспрессии Х-хромосомы у самцов [17–19]. Действительно, MOF является ацетилтрансферазой гистонов, специфично ацетилирующей H4K16. Обогащение Х-хромосомы самцов H4K16ac за счет активности MOF в составе комплекса MSL приводит к деконденсации хроматина и способствует активации транскрипции [35]. Показано, что усиление экспрессии X-сцепленных генов осуществляется как на стадии рекрутирования РНК-полимеразы II (PolII), так и на последующих стадиях инициации транскрипции и выхода РolII из состояния паузы [18, 19]. Однако в изучении феномена дозовой компенсации у D. melanogaster остается много вопросов. Исследователи сходятся на том, что в специфическое распознавание Х-хромосомы самцов и достижение адекватных уровней экспрессии Х-сцепленных и аутосомных генов вовлечено много факторов, взаимодействующих с комплексом MSL или действующих независимо от него. Последнее заключение связано с тем, что у триплоидных по Х-хромосоме самок D. melanogaster (метасамки), несмотря на отсутствие у них функционального комплекса MSL, наблюдается дозовая компенсация, при которой X-сцепленные гены экспрессируются на том же уровне, что и у диплоидных самок, а экспрессия аутосомных генов снижается [36]. Не известно, каким образом обеспечивается точное двукратное усиление экспрессии генов Х‑хромосомы самцов. В ряде исследований показано, что комплекс MSL не обеспечивает полной компенсации, усиливая экспрессию не вдвое, а менее чем в 1.5 раза [17, 19, 37–39]. При этом повышение уровня H4K16ac может привести к активации генов X-хромосомы более чем в 2 раза. Согласно последним данным, в ограничение активации до двукратного уровня вовлечен белок Mtor. который связывается с комплексом MSL [40]. Кроме того, в дозовую компенсацию вовлечены факторы, участвующие в формировании гетерохроматина, ремоделировании хроматина и РНК-интерференции [17].
Существует также альтернативная гипотеза, которая представляет дозовую компенсацию у D. melanogaster как компенсацию глобального анеуплоидного эффекта, вызванного Х-моносомией [36, 41–45]. Моносомия Х-хромосомы может привести к увеличению количества не использованных транскрипционных активаторов у самцов по сравнению с самками, что, в свою очередь, может привести к повышению экспрессии генов других хромосом. Согласно этой гипотезе, усиленное ацетилирование Х-хромосомы комплексом MSL позволяет секвестрировать лишние активаторы хроматина с аутосом, предотвращая тем самым их гиперактивацию. В этом случае результаты анализа экспрессии генов у MSL-мутантов интерпретируются как общее увеличение экспрессии аутосомных генов, а не снижение экспрессии Х-сцепленных генов. Для проверки этой гипотезы необходимы исследования, в которых нормализация глобального транскриптомного анализа будет основана на внешнем эталоне [18].
Дисбаланс в геноме млекопитающих и человека при анеуплоидии имеет сильнейший физиологический эффект, чаще всего приводящий к эмбриональной летальности [46–48], анеуплоидия характерна также для раковых клеток, ее находят более чем в 90% солидных опухолей [49, 50]. Поскольку у млекопитающих DHX9 участвует в эмбриогенезе как самцов, так и самок, изначально предполагалось, что она не имеет отношения к дозовой компенсации. Однако поскольку DHX9 вовлечена в канцерогенез (что будет рассмотрено ниже), ее влияние на регуляцию анеуплоидного эффекта в клетках опухолей представляется вполне возможным. Эти вопросы представляют не только фундаментальный, но и прикладной интерес для медицины.
ВЗАИМОДЕЙСТВИЕ MLE С РНК-ПОЛИМЕРАЗОЙ II
Хеликаза MLE обладает способностью активировать транскрипцию, физически взаимодействуя с PolII [11, 51, 52]. За эту функцию отвечает минимальный домен трансактивации (MTAD) – небольшой консервативный домен (~50 аминокислотных остатков), предшествующий каталитическому ядру хеликазы. Особенно важны для взаимодействия с PolII остатки триптофана в консервативных положениях MTAD (у D. melanogaster это W328, W335 и W338). MLE с делецией участка 326–378, включающей всю последовательность MTAD, равно как и MLE с заменой трех консервативных остатков триптофана на остатки аланина, не взаимодействует с PolII. Эта функция MLE консервативна в эволюции, она показана также для DHX9 человека и нематоды C. elegans [11]. MTAD MLE может взаимодействовать как с гиперфосфорилированной (элонгирующей), так и (преимущественно) с гипофосфорилированной (инициаторной) формами PolII. Исследования in vivo показали, что MLE с делецией MTAD не спасает летальный фенотип самцов с нуль-аллелем mle, что указывает на необходимость MTAD для функционирования MLE в комплексе MSL. Интересно, что MLE с заменами консервативных остатков триптофана, как и MLE дикого типа, имеет ядерную локализацию, а MLE с делецией MTAD находится и в ядре, и в цитоплазме, несмотря на присутствие интактного сигнала ядерной локализации на С-конце белка. Природа этого явления на данный момент не ясна. В экспериментах с репортерными трансгенами показана способность MTAD активировать транскрипцию не только с промотора roX, известной мишени комплекса MSL, но и транскрипцию с промотора гена теплового шока hsp70, на которую MSL не влияет. Показано, что MLE D. melanogaster, как и ее ортолог у млекопитающих, может активировать транскрипцию независимо, а не как компонент комплекса дозовой компенсации [11].
Чтобы получить представление о возможной роли MLE в регуляции транскрипции in vivo, проведено картирование сайтов связывания MLE на политенных хромосомах из слюнных желез личинок D. melanogaster на стадии L3 у обоих полов [53]. Обнаружено, что паттерн распределения MLE в составе комплекса MSL на Х-хромосоме самцов не зависит от стадии развития и, соответственно, от активного или неактивного статуса района связывания. В то же время отмечено, что MSL-независимое распределение MLE на аутосомах идентично у обоих полов, зависит от транскрипционного статуса района и напоминает паттерн распределения элонгирующей формы PolII. MLE связывается практически со всеми “пуффами развития”, экдизоновыми пуффами, типичными для анализируемых стадий, а также со многими “интербэндами”. MLE присутствует в пуффах и на Х-хромосомах самок. После кратковременного теплового шока белок MLE можно обнаружить во многих пуффах, появляющихся при тепловом шоке. В частности, сильный сигнал наблюдался в районах 87C, 93D и 95D, но никогда в районе 87A. Два соседних района 87A и 87C, как известно, развиваются благодаря активности кластера генов hsp70 [54]. Однако в отличие от района 87A, район 87C содержит не только кластер hsp70, но и αγ-элемент, с которого синтезируется некодирующая РНК теплового шока (hshRNA), обладающая неизвестными на данный момент функциями [55]. Поскольку в условиях, не зависящих от теплового шока, MLE у обоих полов не связывается с районом 87C, предполагается, что hshRNA, которая принадлежит к тому же классу некодирующих РНК, что и roX, может быть специфической мишенью MLE.
Таким образом, независимо от других белков комплекса MSL, MLE взаимодействует с наиболее заметными транскрипционно-активными районами хромосом и, вероятно, проявляет повышенную аффинность к транскриптам определенных генов [53].
Показано также, что DHX9 участвует в регуляции транскрипции генов человека, привлекая PolII непосредственно на промотор генов-мишеней. DHX9 специфически связывается с определенными последовательностями ДНК в промоторных областях этих генов [56–58]. Кроме того, DHX9 может активировать транскрипцию, связываясь одновременно с PolII (через MTAD) и с такими факторами транскрипции, как CBP/p300 и BRCA1 (через домены dsRBD) [59, 60]. В ряде случаев DHX9 может репрессировать транскрипцию. Связываясь с активатором транскрипции TonEBP, DHX9 ингибирует его активность посредством неизвестного механизма, привлекая, возможно, в область транскрипции другие белки [61].
ФУНКЦИИ MLE В СПЛАЙСИНГЕ И РЕДАКТИРОВАНИИ пре-мРНК
Первую функцию MLE, не имеющую отношения к дозовой компенсации, выявили еще в 1991 году, но ее механизм долгое время оставался неизвестным [62]. Обнаружено, что мутация mlenapts вызывает “паралитический” фенотип как у самок, так и у самцов при повышенной температуре. Этот фенотип обусловлен снижением экспрессии белка Na+-каналов, что приводит, в свою очередь, к блокаде потенциала действия. Дальнейшее изучение показало, что транскрипт гена para, кодирующего белок Na+-каналов, в норме подвергается редактированию, при котором аденин дезаминируется с образованием инозина (который в дальнейшем при трансляции ведет себя как гуанин) [63, 64]. Для редактирования необходимо образование двухцепочечной структуры в РНК, включающей редактируемый экзон и следующий за ним интрон. На фоне мутации mlenapts, которая приводит к замене T415S в мотиве I, повышение температуры приводит к тому, что более 80% транскриптов para представлены аберрантными мРНК, в которых пропущен редактируемый экзон. В то же время, нуль-мутация mle не имеет паралитического фенотипа. Считается, что в норме MLE дикого типа расплетает двухцепочечную структуру в районе редактируемого экзона. Повышение температуры вызывает изменение конформации мотива I с заменой T415S, что приводит к снижению каталитической активности MLE. При этом мутантный белок остается связанным с дцРНК, которую он не может расплести, а донорный сайт сплайсинга редактируемого экзона остается заблокированным. В этом случае сплайсинг происходит “в обход” заблокированного донорного сайта с пропуском экзона. Поскольку нуль-мутация mle такого эффекта не вызывает, можно предположить, что при полном отсутствии MLE расплетание вторичной структуры пре-мРНК гена para выполняет какая-то другая хеликаза [63].
Регуляция сопряженного с редактированием сплайсинга para – единственный изученный на данный момент пример участия MLE в регуляции сплайсинга пре-мРНК конкретного гена у D. melanogaster. Однако масс-спектрометрический анализ белков, которые MLE соосаждает из экстракта клеток S2 [65], показал, что самая многочисленная функциональная группа (19 белков) представлена белками, участвующими в сплайсинге. Нокдаун MSL не влияет на взаимодействие с 15 из этих белков, указывая на то, что MLE в сплайсинге участвует в форме, свободной от комплекса MSL. Кроме того, большая часть обнаруженных взаимодействий (16 из 19) была РНК-зависимой: при обработке РНКазой взаимодействия между белками исчезали. Эти данные согласуются с представлениями о том, что MLE в процессе сплайсинга осуществляет расплетание и ремоделирование вторичных структур, образующихся в пре-мРНК. Взаимодействие с тремя из обнаруженных белков изучили отдельно и подтвердили с помощью коиммунопреципитации и Вестерн-блот-анализа. Эти три белка, Pep (Protein on ecdysone puffs, CG6143), Hrb87F (heterogeneous nuclear ribonucleoprotein at 87F, CG12749) и Hrb98DE (heterogeneous nuclear ribonucleoprotein at 98DE, CG9983), – гетерогенные ядерные рибонуклеопротеины, участвующие в процессинге РНК и депонировании белка гетерохроматина (HP1a). Они коиммунопреципитируют с MLE РНК-зависимо и независимо от MSL-комплекса. Pep и Hrb87F взаимодействуют с белком HP1a, который участвует в сайленсинге генов и формировании гетерохроматина, а также в регуляции многочисленных генов эухроматина [66]. Белок Hrb98DE является близким гомологом белка Hrb87F (эти белки идентичны на 80%) и оба они гомологичны гяРНП A1 (hnRNP A1). Эти белки участвуют преимущественно в регуляции альтернативного сплайсинга мРНК и, по-видимому, взаимозаменяемы [65, 67, 68]. Показано, что DHX9 человека входит в состав пресплайсосомы [69], связывается как с мРНК, так и с пре-мРНК [70], взаимодействует с белком-регулятором сплайсинга MBNL1 [71], а также с белком SMN, компонентом мяРНП (snRNP) [72]. Кроме того, DHX9, функционируя согласованно с ADAR2, координирует редактирование и сплайсинг пре-мРНК рецептора глутамата [73]. Как и в случае гена para, редактирование и сплайсинг пре-мРНК рецептора глутамата являются конкурирующими процессами: ферменту ADAR2 для осуществления редактирования требуется транскрипт, содержащий вторичную структуру стебель–петля, которая секвестрирует 5'-сайт сплайсинга. Считается, что DHX9 расплетает этот двухцепочечный участок пре-мРНК после редактирования и тем самым делает возможным последующий правильный сплайсинг. Таким образом, участие MLE в регуляции сплайсинга консервативно в эволюции и не имеет отношения к дозовой компенсации.
В упомянутом выше масс-спектрометрическом исследовании [65], помимо взаимодействия MLE с белками сплайсосомы, выявлено еще несколько десятков взаимодействий MLE с белками, участвующими в метаболизме нуклеиновых кислот. В том числе, найдены взаимодействия с несколькими РНК-хеликазами, факторами, регулирующими трансляцию, белками, ремоделирующими хроматин. Дальнейшее изучение функций MLE происходило в следующих направлениях: исследование конкретных функций MLE в РНК-интерференции [74], ремоделировании хроматина и регуляции экспреcсии экдизонзависимых генов [65, 75], о чем пойдет речь далее.
MLE И РНК-ИНТЕРФЕРЕНЦИЯ
В число белков, взаимодействующих с MLE, входят Ago2 и Dicer2 [65]. Обнаружено также, что помимо своих главных мишеней – РНК roX, MLE связывается в клетках S2 D. melanogaster c целым рядом пре-мРНК и мРНК, локализуясь преимущественно в интронах и в 3'-UTR (untranslated regions), образующих вторичные структуры [76]. Возникло предположение, что MLE участвует в раcплетании котранскрипционно генерируемых шпилек РНК [74]. Для проверки этой гипотезы проанализированы линии D. melanogaster, полученные в рамках проекта Transgenic RNAi Project (TRiP) и Венского исследовательского центра дрозофилы (VDRC). Эти линии несут распределенные по всему геному D. melanogaster индуцибельные трансгены, экспрессирующие шпилечные РНК, специфичные для определенных кодирующих генов [77–80]. На политенных хромосомах MLE специфически выявляется в местах транскрипции этих трансгенов, и связывание MLE не зависит от размера шпильки или ее геномного расположения. Параллельный анализ трансгенов Notch и Egfr (epidermal growth factor receptor) показал, что MLE необходима для функциональной интерференции РНК in vivo. Нуль-мутация mle в гомозиготном состоянии резко снижает эффективность интерференции РНК в трансгенных мухах, что приводит к спасению фенотипа индуцированных мутаций. По предположению авторов, связывание MLE со шпильками РНК может быть важным для их переноса в цитоплазму, и MLE может участвовать в формировании комплекса RISC. Альтернативная гипотеза заключается в том, что MLE может устранять неправильное сворачивание только что транскрибированных шпилек РНК, что позволяет им участвовать в интерференции РНК. Возможно, что MLE вмешивается в редактирующую активность фермента ADAR. Дезаминирование аденина до инозина может привести к снижению комплементарности и нестабильности дцРНК, что ограничивает синтез эффективных siРНК. MLE может физически блокировать связывание ADAR со шпильками РНК или же расплетать структуры, участвующие в рекрутировании ADAR. Все рассмотренные гипотезы не являются взаимоисключающими. В то же время, данные об участии DHX9 млекопитающих в интерференции РНК противоречивы [81–83].
ВЗАИМОДЕЙСТВИЕ MLE С КОМПЛЕКСАМИ РЕМОДЕЛИРОВАНИЯ ХРОМАТИНА
Взаимодействие MLE с белками Mi-2, MEP-1 и p66 не зависит от MSL, а обработка иммунопреципитатов РНКазой ослабляет, но не разрушает полностью эти взаимодействия [65]. Таким образом, MLE можно рассматривать как функционального партнера комплексов NuRD и dMEC. NuRD – это комплекс, который увеличивает плотность гистонов/нуклеосом на определенных последовательностях ДНК по всему геному и отвечает за изменения в организации нуклеосом в соседних локусах [84]. Как это часто бывает с комплексами ремоделирования хроматина, NuRD и dMEC могут участвовать как в репрессии, так и в активации генов [85]. У D. melanogaster комплекс NuRD, выделенный из эмбрионов, содержит девять субъединиц. В состав комплекса входят такие белки, как деацетилаза гистонов RPD3, белок с цинковым пальцем MEP-1 и ДНК-связывающая АТРаза CHD4/Mi-2, обладающая хеликазной активностью [85]. MEP-1 и Mi-2 также образуют отдельный комплекс dMEC [86]. Субъединица Mi-2, общая для обоих комплексов, необходима для экспрессии генов теплового шока [87], она играет важную роль в поддержании структуры хромосом, поскольку влияет на функцию когезина [88]. Участки связывания MLE и Mi-2 в геноме существенно перекрываются, при этом большая часть общих сайтов совпадает с энхансерами (54%), промоторами и сайтами стартов транскрипции (TSS) – 37%. Вопрос о функциональной значимости взаимодействий MLE с компонентами комплексов NuRD и dMEC остается открытым [65].
MLE взаимодействует также с субъединицами комплекса SWI/SNF (Brm, PB, Bap170) [75]. Функциональная значимость этого взаимодействия изучена на примере регуляции транскрипции SWI/SNF-зависимого позднего гена экдизонового каскада ftz-f1. Ген ftz-f1 кодирует ядерный рецептор, играющий важную роль в процессе онтогенеза D. melanogaster. Транскрипция этого гена в начале метаморфоза происходит с участием паузированной РolII, ограничена узким периодом времени и подвержена сложной многоступенчатой регуляции. Важную роль в адекватной экспрессии гена ftz-f1 играет физическое сближение промотора и энхансера, расположенного в первом интроне. Привлечение SWI/SNF на промотор и энхансер гена важно для их взаимодействия. При нокдауне субъединицы SWI/SNF, привлекающей комплекс на ген, связь промотора с энхансером ослабевает. При этом в начале метаморфоза ген ftz-f1 начинает экспрессироваться преждевременно, а его транскрипция остается на низком уровне [89–91]. Изучение связывания MLE с геном ftz-f1 в процессе его активации показало, что профиль связывания MLE повторяет профиль связывания комплекса SWI/SNF. MLE сильнее всего связан с промотором и энхансером, и это связывание усиливается в процессе активации транскрипции. Нокдаун MLE в модельной системе в клетках S2 и мутация mle в гомозиготном состоянии in vivo вызывают эффект, сходный с описанным для SWI/SNF: происходит преждевременная, но при этом недостаточная активация гена ftz-f1 [75]. Чтобы исключить возможное влияние комплекса MSL, в эксперименте использовали личинок и предкуколок исключительно женского пола. Итак, MLE совместно с комплексом SWI/SNF связывается c регуляторными элементами гена ftz-f1 и влияет на его транскрипцию. Предположительно, MLE в процессе экспрессии данного гена расплетает сложные аберрантные структуры (РНК-вилки, РНК-петли, РНК-G-квадруплексы и др.), которые образуются в процессе транскрипции с участием паузированной РolII, а также при сближении промотора и энхансера и одновременном прохождении транскрипции.
УЧАСТИЕ MLE В РЕГУЛЯЦИИ ЭКСПРЕССИИ РАННИХ ГЕНОВ ЭКДИЗОНОВОГО КАСКАДА
Поскольку, как описано выше, MLE связывается с экдизоновыми пуффами на политенных хромосомах личинок D. melanogaster, а также взаимодействует с белком Pep, который характеризуется таким же распределением, закономерно возник вопрос об участии MLE в экдизоновом генном каскаде. (Влияние MLE на транскрипцию гена позднего ответа ftz-f1 описано выше [75].) Также изучено влияние MLE на экспрессию трех ранних генов этого каскада: Eip74EF, BR-C и Eip75B [65]. В этих экспериментах, чтобы избежать косвенных эффектов, связанных с функцией MLE в комплексе MSL, анализ проводили на личинках женского пола. У мутантных по mle самок содержание транскриптов генов Eip74EF и BR-C снижалось незначительно, но статистически значимо, тогда как уровень Eip75B оказался несколько повышенным. Этот результат предполагает вклад MLE в регуляцию экдизон-индуцируемой транскрипции. Возможно, в экдизоновых пуффах MLE, как и Pep, связан с комплексом гяРНП [92].
ВЗАИМОДЕЙСТВИЕ MLE С ENY2 – КОМПОНЕНТОМ ТРАНСКРИПЦИОННОГО КОМПЛЕКСА SAGA
В двугибридных скринингах библиотек кДНК D. melanogaster и человека обнаружено, что MLE/DHX9 взаимодействует с консервативным белком ENY2 [93, 94]. ENY2 D. melanogaster входит в состав транскрипционного комплекса SAGA и ряда других белковых комплексов, участвует в организации транскрипционных доменов хроматина, активации и элонгации транскрипции, экспорте мРНК из ядра и регуляции пространственного расположения генов в ядре [95–100]. ENY2 – это небольшой белок с массой ~10 кДа. Белки dENY2 D. melanogaster и hENY2 человека содержат 56.4% идентичных и 37.3% подобных аминокислотных остатков. В обоих случаях во взаимодействии MLE с dENY2 и DHX9 c hENY2 участвует глицин-богатый С-концевой домен, консервативный в хеликазах человека и D. melanogaster (в районах, взаимодействующих с ENY2, идентичны 40% аминокислотных остатков). Обнаруженное у D. melanogaster взаимодействие подтверждено с помощью реакций коиммунопреципитации и генетических экспериментов. Анализ сайтов колокализации MLE и ENY2 на политенных хромосомах D. melanogaster показал, что они не совпадают с сайтами локализации комплекса MSL и обнаруживаются в сайтах активного хроматина на всех хромосомах самцов и самок [93].
Таким образом, показано, что MLE D. melanogaster может участвовать в широком спектре биологических процессов, посредством взаимодействия с ENY2-содержащими комплексами.
ФУНКЦИИ DHX9 У МЛЕКОПИТАЮЩИХ
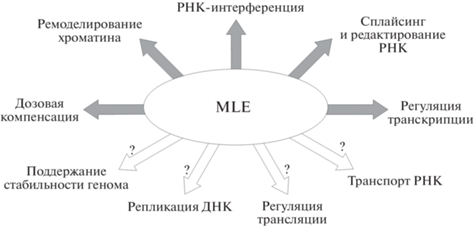
Помимо перечисленных функций, DHX9 млекопитающих участвует также в репликации ДНК и поддержании геномной стабильности [101], в регуляции трансляции [102, 103] и в транспорте РНК [104, 105]. Схематическое изображение участия MLE и ее ортолога у млекопитающих в процессах, ассоциированных с метаболизмом нуклеиновых кислот, представлено на рис. 3.
Рис. 3.
Схема участия MLE и ее ортолога в различных внутриклеточных процессах, связанных с метаболизмом нуклеиновых кислот. Стрелками со знаком вопроса обозначены процессы, участие MLE в которых не изучено, в то время как есть данные об участии DHX9 млекопитающих в этих процессах.
Очень важна связь DHX9 человека и других млекопитающих с канцерогенезом. Уровень экспрессии DHX9 повышается в клетках злокачественных опухолей нескольких типов, что рассматривается как плохой прогностический признак [106, 107]. Нокдаун DHX9 в панели культур раковых клеток человека приводит к гибели большей части из них [108]. В то же время, в других типах клеток DHX9 активирует транскрипцию генов онкосупрессоров, что предполагает двоякую роль этой хеликазы в канцерогенезе [56, 109].
Ряд вирусов, в том числе ВИЧ-1 [110], вирус гепатита С [111], цитомегаловирус [112], аденовирусы [113] и др., используют DHX9 для репликации, транскрипции, трансляции своих РНК. Одновременно с этим, DHX9 участвует в противовирусном иммунном ответе [114, 115].
DHX9 человека вовлечен также в патогенез аутоиммунных заболеваний: этот белок является аутоантигеном у 6–23% пациентов с системной красной волчанкой. Количество больных, в сыворотке которых выявляются аутоантитела к DHX9, существенно варьирует в разных популяциях и на разных стадиях развития заболевания. На ранних стадиях аутоантитела к DHX9 выявляются с более высокой частотой и могут быть использованы в клинической практике в качестве диагностического маркера системной красной волчанки [116, 117].
ЗАКЛЮЧЕНИЕ
Итак, поскольку MLE у D. melanogaster и DHX9 у млекопитающих способны взаимодействовать с различными ядерными и цитоплазматическими белками и связываться с разными формами нуклеиновых кислот, эти хеликазы считаются одними из ключевых регуляторов экспрессии генов. Посредством разных доменов MLE и DHX9 способны взаимодействовать с разными белками и участвовать в работе разных белковых комплексов, что и определяет многообразие функций этих хеликаз. Многие функции MLE и ее ортолога консервативны в эволюции. Некоторые функции избыточны, их важность становится очевидной только в сочетании с потерей функции других хеликаз. Так, отсутствие DHX9 в геномах домашних кур и уток делает их более чувствительными к вирусным инфекциям по сравнению с млекопитающими. При этом особенно это выражено у кур, у которых отсутствует также хеликаза RIG-1 (DDX58) [8, 9].
Несмотря на интенсивные исследования, остается много неясного в том, как функционируют MLE и ее ортологи in vivo, как определяется и изменяется специфичность связывания субстратов, процессивность и т.д. в клетках разных тканей, в процессах онтогенеза, в патологических процессах. Преимущество D. melanogaster в качестве модельного объекта для изучения функций MLE состоит в том, что потеря функции MLE не приводит к эмбриональной летальности у D. melanogaster, что позволяет исследовать функции этого белка на дальнейших стадиях развития, а также установить, какие белки могут компенсировать отсутствие MLE в клетках разных тканей, частично выполняя ее функции.
Поскольку потенциально ортолог MLE представляет собой мишень для противоопухолевой и противовирусной терапии и вовлечен в развитие аутоиммунных заболеваний, дальнейшее изучение функций этого белка может иметь большую практическую ценность для медицины.
Работа поддержана Российским научным фондом (№ 22-14-00270).
В работе не использовали людей и животных в качестве объектов исследования.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Fairman-Williams M.E., Guenther U.-P., Jankowsky E. (2010) SF1 and SF2 helicases: family matters. Curr. Opin. Struct. Biol. 20, 313–324.
Lee C.-G. (1997) The NTPase/helicase activities of Drosophila maleless, an essential factor in dosage compensation. EMBO J. 16, 2671–2681.
Gorbalenya A.E., Koonin E.V. (1993) Helicases: amino acid sequence comparisons and structure-function relationships. Curr. Opin. Struct. Biol. 3, 419–429.
Singleton M.R., Dillingham M.S., Wigley D.B. (2007) Structure and mechanism of helicases and nucleic acid translocases. Annu. Rev. Biochem. 76, 23–50.
Lee C.G., Hurwitz J. (1993) Human RNA helicase A is homologous to the maleless protein of Drosophila. J. Biol. Chem. 268, 16822–16830.
Walstrom K.M., Schmidt D., Bean C.J., Kelly W.G. (2005) RNA helicase A is important for germline transcriptional control, proliferation, and meiosis in C. elegans. Mech. Dev. 122, 707–720.
Wei W., Twell D., Lindsey K. (1997) A novel nucleic acid helicase gene identified by promoter trapping in Arabidopsis. Plant J. 11, 1307–1314.
Sato H., Oshiumi H., Takaki H., Hikono H., Seya T. (2015) Evolution of the DEAD box helicase family in chicken: chickens have no DHX9 ortholog. Microbiol. Immunol. 59, 633–640.
Barber M.R.W., Aldridge J.R., Webster R.G., Magor K.E. (2010) Association of RIG-I with innate immunity of ducks to influenza. Proc. Natl. Acad. Sci. USA. 107, 5913–5918.
Lee T., Pelletier J. (2016) The biology of DHX9 and its potential as a therapeutic target. Oncotarget. 7, 42716–42739.
Aratani S., Kageyama Y., Nakamura A., Fujita H., Fujii R., Nishioka K., Nakajima T. (2008) MLE activates transcription via the minimal transactivation domain in Drosophila. Int. J. Mol. Med. 21, 469–476.
Prabu J.R., Müller M., Thomae A.W., Schüssler S., Bonneau F., Becker P.B., Conti E. (2015) Structure of the RNA helicase MLE reveals the molecular mechanisms for uridine specificity and RNA–ATP coupling. Mol. Cell. 60, 487–499.
Xing L., Zhao X., Niu M., Kleiman L. (2014) Helicase associated 2 domain is essential for helicase activity of RNA helicase A. Biochim. Biophys. Acta (BBA) – Proteins Proteomics. 1844, 1757–1764.
Kuroda M.I., Kernan M.J., Kreber R., Ganetzky B., Baker B.S. (1991) The maleless protein associates with the X chromosome to regulate dosage compensation in Drosophila. Cell. 66, 935–947.
Izzo A., Regnard C., Morales V., Kremmer E., Becker P.B. (2008) Structure-function analysis of the RNA helicase maleless. Nucl. Acids Res. 36, 950–962.
Robinson J., Raguseo F., Nuccio S.P., Liano D., Di Antonio M. (2021) DNA G-quadruplex structures: more than simple roadblocks to transcription? Nucl. Acids Res. 49, 8419–8431.
Makki R., Meller V.H. (2021) When down is up: heterochromatin, nuclear organization and X upregulation. Cells. 10, 3416.
Samata M., Akhtar A. (2018) Dosage compensation of the X chromosome: a complex epigenetic assignment involving chromatin regulators and long noncoding RNAs. Annu. Rev. Biochem. 87, 323–350.
Kuroda M.I., Hilfiker A., Lucchesi J.C. (2016) Dosage compensation in Drosophila – a model for the coordinate regulation of transcription. Genetics. 204, 435–450.
Keller C.I., Akhtar A. (2015) The MSL complex: juggling RNA–protein interactions for dosage compensation and beyond. Curr. Opin. Genet. Develop. 31, 1–11.
Georgiev P., Chlamydas S., Akhtar A. (2011) Drosophila dosage compensation. Fly (Austin). 5, 147–154.
Franke A., Baker B.S. (1999) The Rox1 and Rox2 RNAs are essential components of the compensasome, which mediates dosage compensation in Drosophila. Mol. Cell. 4, 117–122.
Meller V.H. (2002) The RoX genes encode redundant male-specific lethal transcripts required for targeting of the MSL complex. EMBO J. 21, 1084–1091.
Park S.-W., Kuroda M.I., Park Y. (2008) Regulation of histone H4 Lys16 acetylation by predicted alternative secondary structures in RoX noncoding RNAs. Mol. Cell. Biol. 28, 4952–4962.
Park S.-W., Kang Y.I., Sypula J.G., Choi J., Oh H., Park Y. (2007) An evolutionarily conserved domain of RoX2 RNA is sufficient for induction of H4-Lys16 acetylation on the Drosophila X chromosome. Genetics. 177, 1429–1437.
Stuckenholz C., Meller V.H., Kuroda M.I. (2003) Functional redundancy within roX1, a noncoding RNA involved in dosage compensation in Drosophila melanogaster. Genetics. 164, 1003–1014.
Kelley R.L., Lee O.-K., Shim Y.-K. (2008) Transcription rate of noncoding roX1 RNA controls local spreading of the Drosophila MSL chromatin remodeling complex. Mech. Devel. 125, 1009–1019.
Ilik I.A., Quinn J., Georgiev P., Tavares-Cadete F., Maticzka D., Toscano S., Wan Y., Spitale R., Luscombe N., Backofen R., Chang H., Akhtar A. (2013) Tandem stem-loops in roX RNAs act together to mediate X chromosome dosage compensation in Drosophila. Mol. Cell. 51, 156–173.
Militti C., Maenner S., Becker P.B., Gebauer F. (2014) UNR facilitates the interaction of MLE with the lncRNA roX2 during Drosophila dosage compensation. Nat. Commun. 5, 4762.
Maenner S., Müller M., Fröhlich J., Langer D., Becker P.B. (2013) ATP-dependent roX RNA remodeling by the helicase maleless enables specific association of MSL proteins. Mol. Cell. 51, 174–184.
Bashaw G.J., Baker B.S. (1997) The regulation of the Drosophila msl-2 gene reveals a function for sex-lethal in translational control. Cell. 89, 789–798.
Kelley R.L., Wang J., Bell L., Kuroda M.I. (1997) Sex lethal controls dosage compensation in Drosophila by a non-splicing mechanism. Nature. 387, 195–199.
Morra R., Smith E.R., Yokoyama R., Lucchesi J.C. (2008) The MLE subunit of the Drosophila MSL complex uses its ATPase activity for dosage compensation and its helicase activity for targeting. Mol. Cell. Biol. 28, 958–966.
Morra R., Yokoyama R., Ling H., Lucchesi J.C. (2011) Role of the ATPase/helicase maleless (MLE) in the assembly, targeting, spreading and function of the male-specific lethal (MSL) complex of Drosophila. Epigenet. Chromatin. 4, 6.
Akhtar A., Becker P.B. (2000) Activation of transcription through histone H4 acetylation by MOF, an acetyltransferase essential for dosage compensation in Drosophila. Mol. Cell. 5, 367–375.
Sun L., Johnson A.F., Donohue R.C., Li J., Cheng J., Birchler J.A. (2013) Dosage compensation and inverse effects in triple X metafemales of Drosophila. Proc. Natl. Acad. Sci. USA. 110, 7383–7388.
Deng X., Meller V.H. (2006) roX RNAs are required for increased expression of X-linked genes in Drosophila melanogaster males. Genetics. 174, 1859–1866.
Straub T., Gilfillan G.D., Maier V.K., Becker P.B. (2005) The Drosophila MSL complex activates the transcription of target genes. Genes Dev. 19, 2284–2288.
Hamada F.N., Park P.J., Gordadze P.R., Kuroda M.I. (2005) Global regulation of X chromosomal genes by the MSL complex in Drosophila melanogaster. Genes Dev. 19, 2289–2294.
Aleman J.R., Kuhn T.M., Pascual-Garcia P., Gospocic J., Lan Y., Bonasio R., Little S.C., Capelson M. (2021) Correct dosage of X chromosome transcription is controlled by a nuclear pore component. Cell Rep. 35, 109236.
Bhadra U., Gandhi S.G., Palaparthi R., Balyan M.K., Pal-Bhadra M. (2016) Drosophila maleless gene counteracts X global aneuploid effects in males. FEBS J. 283, 3457–3470.
Sun L., Fernandez H.R., Donohue R.C., Li J., Cheng J., Birchler J.A. (2013) Male-specific lethal complex in Drosophila counteracts histone acetylation and does not mediate dosage compensation. Proc. Natl. Acad. Sci. USA. 110, E808–E817.
Sun L., Johnson A.F., Li J., Lambdin A.S., Cheng J., Birchler J.A. (2013) Differential effect of aneuploidy on the X chromosome and genes with sex-biased expression in Drosophila. Proc. Natl. Acad. Sci. USA. 110, 16514–16519.
Zhang S., Qi H., Huang C., Yuan L., Zhang L., Wang R., Tian Y., Sun L. (2021) Interaction of male specific lethal complex and genomic imbalance on global gene expression in Drosophila. Sci. Rep. 11, 19679.
Birchler J.A. (2016) Parallel universes for models of X chromosome dosage compensation in Drosophila: a review. Cytogenet. Genome Res. 148, 52–67.
Nawata H., Kashino G., Tano K., Daino K., Shimada Y., Kugoh H., Oshimura M., Watanabe M. (2011) Dysregulation of gene expression in the artificial human trisomy cells of chromosome 8 associated with transformed cell phenotypes. PLoS One. 6, e25319.
Torres E.M., Williams B.R., Amon A. (2008) Aneuploidy: cells losing their balance. Genetics. 179, 737–746.
Jallepalli P.V., Pellman D. (2007) Aneuploidy in the balance. Science. 317, 904–905.
Williams B.R., Amon A. (2009) Aneuploidy: cancer’s fatal flaw? Cancer Res. 69, 5289–5291.
Taylor A.M., Shih J., Ha G., Gao G.F., Zhang X., Berger A.C., Schumacher S.E., Wang C., Hu H., Liu J., Lazar A.J., Cancer Genome Atlas Research Network; Cherniack A.D., Beroukhim R., Meyerson M. (2018) Genomic and functional approaches to understanding cancer aneuploidy. Cancer Cell. 33, 676–689,e3.
Aratani S., Fujii R., Fujita H., Fukamizu A., Nakajima T. (2003) Aromatic residues are required for RNA helicase A mediated transactivation. Int. J. Mol. Med. 12, 175–180.
Aratani S., Fujii R., Oishi T., Fujita H., Amano T., Ohshima T., Hagiwara M., Fukamizu A., Nakajima T. (2001) Dual roles of RNA helicase A in CREB-dependent transcription. Mol. Cell. Biol. 21, 4460–4469.
Kotlikova I.V., Demakova O.V., Semeshin V.F., Shloma V.V., Boldyreva L.V., Kuroda M.I., Zhimulev I.F. (2006) The Drosophila dosage compensation complex binds to polytene chromosomes independently of developmental changes in transcription. Genetics. 172, 963–974.
Ish-Horowicz D., Pinchin S.M., Gausz J., Gyurkovics H., Bencze G., Goldschmidt-Clermont M., Holden J.J. (1979) Deletion mapping of two D. melanogaster loci that code for the 70,000 dalton heat-induced protein. Cell. 17, 565–571.
Sharma A., Lakhotia S.C. (1995) In situ quantification of hsp70 and alpha-beta transcripts at 87A and 87C loci in relation tohsr-omega gene activity in polytene cells of Drosophila melanogaster. Chromosome Res. 3, 386–393.
Myöhänen S., Baylin S.B. (2001) Sequence-specific DNA binding activity of RNA helicase A to the p16 promoter. J. Biol. Chem. 276, 1634–1642.
Zhong X., Safa A.R. (2004) RNA helicase A in the MEF1 transcription factor complex up-regulates the MDR1 gene in multidrug-resistant cancer cells. J. Biol. Chem. 279, 17134–17141.
Huo L., Wang Y.-N., Xia W., Hsu S.-C., Lai C.-C., Li L.-Y., Chang W.-C., Wang Y., Hsu M.-C., Yu Y.-L., Huang T.-H., Ding Q., Chen C.-H., Tsai C.-H., Hung M.-C. (2010) RNA helicase A is a DNA-binding partner for EGFR-mediated transcriptional activation in the nucleus. Proc. Natl. Acad. Sci. USA. 107, 16125–16130.
Nakajima T., Uchida C., Anderson S.F., Lee C.-G., Hurwitz J., Parvin J.D., Montminy M. (1997) RNA helicase A mediates association of CBP with RNA polymerase II. Cell. 90, 1107–1112.
Anderson S.F., Schlegel B.P., Nakajima T., Wolpin E.S., Parvin J.D. (1998) BRCA1 protein is linked to the RNA polymerase II holoenzyme complex via RNA helicase A. Nat. Genet. 19, 254–256.
Colla E., Lee S.D., Sheen M.R., Woo S.K., Kwon H.M. (2006) TonEBP is inhibited by RNA helicase A via interaction involving the E′F loop. Biochem. J. 393, 411–419.
Kernan M.J., Kuroda M.I., Kreber R., Baker B.S., Ganetzky B. (1991) napts, a mutation affecting sodium channel activity in Drosophila, is an allele of mle a regulator of X chromosome transcription. Cell. 66, 949–959.
Reenan R.A., Hanrahan C.J., Ganetzky B. (2000) The mle(napts) RNA helicase mutation in Drosophila results in a splicing catastrophe of the para Na+ channel transcript in a region of RNA editing. Neuron. 25, 139–149.
Hanrahan C.J., Palladino M.J., Ganetzky B., Reenan R.A. (2000) RNA editing of the Drosophila para Na+ channel transcript: evolutionary conservation and developmental regulation. Genetics. 155, 1149–1160.
Cugusi S., Kallappagoudar S., Ling H., Lucchesi J.C. (2015) The Drosophila helicase maleless (MLE) is implicated in functions distinct from its role in dosage compensation. Mol. Cell. Proteomics. 14, 1478–1488.
Piacentini L., Fanti L., Negri R., del Vescovo V., Fatica A., Altieri F., Pimpinelli S. (2009) Heterochromatin protein 1 (HP1a) positively regulates euchromatic gene expression through RNA transcript association and interaction with hnRNPs in Drosophila. PLoS Genet. 5, e1000670.
Herold N., Will C.L., Wolf E., Kastner B., Urlaub H., Lührmann R. (2009) Conservation of the protein composition and electron microscopy structure of Drosophila melanogaster and human spliceosomal complexes. Mol. Cell. Biol. 29, 281–301.
Borah S., Wong A.C., Steitz J.A. (2009) Drosophila hnRNP A1 homologs Hrp36/Hrp38 enhance U2-type versus U12-type splicing to regulate alternative splicing of the prospero twintron. Proc. Natl. Acad. Sci. USA. 106, 2577–2582.
Hartmuth K., Urlaub H., Vornlocher H.-P., Will C.L., Gentzel M., Wilm M., Lührmann R. (2002) Protein composition of human prespliceosomes isolated by a tobramycin affinity-selection method. Proc. Natl. Acad. Sci. USA. 99, 16719–16724.
Zhang S., Herrmann C., Grosse F. (1999) Pre-mRNA and mRNA binding of human nuclear DNA helicase II (RNA helicase A). J. Cell Sci. 112, 1055–1064.
Paul S., Dansithong W., Jog S.P., Holt I., Mittal S., Brook J.D., Morris G.E., Comai L., Reddy S. (2011) Expanded CUG repeats dysregulate RNA splicing by altering the stoichiometry of the muscleblind 1 complex. J. Biol. Chem. 286, 38427–38438.
Terns M.P., Terns R.M. (2001) Macromolecular complexes: SMN – the master assembler. Curr. Biol. 11, R862–R864.
Bratt E., Öhman M. (2003) Coordination of editing and splicing of glutamate receptor pre-mRNA. RNA. 9, 309–318.
Cugusi S., Li Y., Jin P., Lucchesi J.C. (2016) The Drosophila helicase MLE targets hairpin structures in genomic transcripts. PLoS Genet. 12, e1005761.
Николенко Ю.В., Куршакова М.М., Краснов А.Н., Георгиева С.Г. (2021) Хеликаза MLE – новый участник регуляции транскрипции гена ftz-f1, кодирующего ядерный рецептор у высших эукариот. Докл. Акад. Наук. Науки о жизни. 496, 48–51.
Ilik I.A., Maticzka D., Georgiev P., Gutierrez N.M., Backofen R., Akhtar A. (2017) A mutually exclusive stem–loop arrangement in roX2 RNA is essential for X-chromosome regulation in Drosophila. Genes Dev. 31, 1973–1987.
Ni J.Q., Markstein M., Binari R., Pfeiffer B., Liu L.-P., Villalta C., Booker M., Perkins L., Perrimon N. (2008) Vector and parameters for targeted transgenic RNA interference in Drosophila melanogaster. Nat. Meth. 5, 49–51.
Ni J.Q., Liu L.P., Binari R., Hardy R., Shim H.S., Cavallaro A., Booker M., Pfeiffer B.D., Markstein M., Wang H., Villalta C., Laverty T., Perkins L., Perrimon N. (2009) A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182, 1089–1100.
Ni J.Q., Zhou R., Czech B., Liu L.P., Holderbaum L., Yang-Zhou D., Shim H.S., Tao R., Handler D., Karpowicz P., Binari R., Booker M., Brennecke J., Perkins L., Hannon G., Perrimon N. (2011) A genome-scale shRN-A resource for transgenic RNAi in Drosophila. Nat. Meth. 8, 405–407.
Dietzl G., Chen D., Schnorrer F., Su K., Barinova Y., Fellner M., Gasser B., Kinsey K., Oppel S., Scheiblauer S., Couto A., Marra V., Keleman K., Dickson B. (2007) A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151–156.
Fu Q., Yuan Y.A. (2013) Structural insights into RISC assembly facilitated by dsRNA-binding domains of human RNA helicase A (DHX9). Nucl. Acids Res. 41, 12–23.
Robb G.B., Rana T.M. (2007) RNA helicase a interacts with RISC in human cells and functions in RISC loading. Mol. Cell. 26, 523–537.
Liang X., Crooke S.T. (2013) RNA helicase A is not required for RISC activity. Biochim. Biophys. Acta (BBA) – Gene Regul. Mech. 1829, 1092–1101.
Moshkin Y.M., Chalkley G., Kan T., Reddy B., Ozgur Z., van ljcken W., Dekkers D., Demmers J., Travers A., Verrijzer C.P. (2012) Remodelers organize cellular chromatin by counteracting intrinsic histone-DNA sequence preferences in a class-specific manner. Mol. Cell. Biol. 32, 675–688.
Reddy B.A., Bajpe P.K., Bassett A., Moshkin Y.M., Kozhevnikova E., Bezstarosti K., Demmers J.A.A., Travers A.A., Verrijzer C.P. (2010) Drosophila transcription factor Tramtrack69 binds MEP1 to recruit the chromatin remodeler NuRD. Mol. Cell. Biol. 30, 5234–5244.
Kunert N., Wagner E., Murawska M., Klinker H., Kremmer E., Brehm A. (2009) dMec: a novel Mi-2 chromatin remodelling complex involved in transcriptional repression. EMBO J. 28, 533–544.
Murawska M., Hassler M., Renkawitz-Pohl R., Ladurner A., Brehm A. (2011) Stress-induced PARP activation mediates recruitment of Drosophila Mi-2 to promote heat shock gene expression. PLoS Genet. 7, e1002206.
Fasulo B., Deuring R., Murawska M., Gause M., Dorighi K.M., Schaaf C.A., Dorsett D., Brehm A., Tamkun J.W. (2012) The Drosophila Mi-2 chromatin-remodeling factor regulates higher-order chromatin structure and cohesin dynamics in vivo. PLoS Genet. 8, e1002878.
Николенко Ю.В., Краснов А.Н., Воробьева Н.Е. Ремоделирующий хроматин комплекс SWI/SNF влияет на пространственную организацию локуса гена ftz-f1. (2019) Генетика. 55, 156–164.
Николенко Ю.В., Краснов А.Н., Мазина М.Ю., Георгиева С.Г., Воробьева Н.Е. (2017) Изучение свойств нового экдизонзависимого энхансера. Докл. Акад. Наук. 474, 756–759.
Vorobyeva N.E., Nikolenko J.V., Nabirochkina E.N., Krasnov A.N., Shidlovskii Y.V., Georgieva S.G. (2012) SAYP and Brahma are important for ‘repressive’ and ‘transient’ Pol II pausing. Nucl. Acids Res. 40, 7319–7331.
Amero S.A., Matunis M.J., Matunis E.L., Hockensmith J.W., Raychaudhuri G., Beyer A.L. (1993) A unique ribonucleoprotein complex assembles preferentially on ecdysone-responsive sites in Drosophila melanogaster. Mol. Cell. Biol. 13, 5323–5330.
Николенко Ю.В., Куршакова М.М., Краснов А.Н. (2019) Мультифункциональный белок ENY2 взаимодействует с РНК-хеликазой MLE. Докл. Акад. Наук. 489, 637–640.
Georgieva S., Nabirochkina E., Dilworth F.J., Eickhoff H., Becker P., Tora L., Georgiev P., Soldatov A. (2001) The novel transcription factor e(y)2 interacts with TAFII 40 and potentiates transcription activation on chromatin templates. Mol. Cell. Biol. 21, 5223–5231.
Gurskiy D., Orlova A., Vorobyeva N., Nabirochkina E., Krasnov A., Shidlovskii Y., Georgieva S., Kopytova D. (2012) The DUBm subunit Sgf11 is required for mRNA export and interacts with Cbp80 in Drosophila. Nucl. Acids Res. 40, 10689–10700.
Николенко Ю.В., Вдовинa Ю.А., Фефеловa Е.И., Глуховa А.А., Набирочкина Е.Н., Копытова Д.В. (2021) Деубиквитинирующий (DUB) модуль SAG-A участвует в Pol III-зависимой транскрипции. Молекуляр. биология. 55, 500–509.
Kopytova D.V., Krasnov A.N., Orlova A.V., Gurskiy D.Ya., Nabirochkina E.N., Georgieva S.G., Shidlovskii Y.V. (2010) ENY2: Couple, triple … more? Cell Cycle. 9, 479–481.
Popova V.V., Orlova A.V., Kurshakova M.M., Nikolenko J.V., Nabirochkina E.N., Georgieva S.G., Kopytova D.V. (2018) The role of SAGA coactivator complex in snRNA transcription. Cell Cycle. 17, 1859–1870.
Kopytova D.V., Orlova A.V., Krasnov A.N., Gurskiy D.Ya., Nikolenko J.V., Nabirochkina E.N., Shidlovskii Y.V., Georgieva S.G. (2010) Multifunctional factor ENY2 is associated with the THO complex and promotes its recruitment onto nascent mRNA. Genes Dev. 24, 86–96.
Фурсова Н.А., Николенко Ю.В., Сошникова Н.В., Мазина М.Ю., Воробьева Н.Е., Краснов А.Н. (2018) Белок CG9890 с доменами цинковых пальцев – новый компонент ENY2-содержащих комплексов дрозофилы. Acta Naturae. 10. 110–114.
Zhou K. (2003) RNA helicase A interacts with dsDNA and topoisomerase II alpha. Nucl. Acids Res. 31, 2253–2260.
Hartman T.R., Qian S., Bolinger C., Fernandez S., Schoenberg D.R., Boris-Lawrie K. (2006) RNA helicase A is necessary for translation of selected messenger RNAs. Nat. Struct. Mol. Biol. 13, 509–516.
Ranji A., Shkriabai N., Kvaratskhelia M., Musier-Forsyth K., Boris-Lawrie K. (2011) Features of double-stranded RNA-binding domains of RNA helicase A are necessary for selective recognition and translation of complex mRNAs. J. Biol. Chem. 286, 5328–5337.
Zhang S., Buder K., Burkhardt C., Schlott B., Görlach M., Grosse F. (2002) Nuclear DNA helicase II/RNA helicase A binds to filamentous actin. J. Biol. Chem. 277, 843–853.
Tang H., Wong-Staal F. (2000) Specific interaction between RNA helicase A and tap, two cellular proteins that bind to the constitutive transport element of type D retrovirus. J. Biol. Chem. 275, 32694–32700.
Wei X., Pacyna-Gengelbach M., Schlüns K., An Q., Gao Y., Cheng S., Petersen I. (2004) Analysis of the RNA helicase A gene in human lung cancer. Oncol. Rep. 11, 253–258.
Sun Z., Wang L., Eckloff B., Deng B., Wang Y., Wampfler J., Jang J., Wieben E., Jen J., You M., Yang P. (2014) Conserved recurrent gene mutations correlate with pathway deregulation and clinical outcomes of lung adenocarcinoma in never-smokers. BMC Med. Genomics. 7, 486.
Lee T., Paquet M., Larsson O., Pelletier J. (2016) Tumor cell survival dependence on the DHX9 DExH-box helicase. Oncogene. 35, 5093–5105.
Chen Z.X., Wallis K., Fell S., Sobrado V., Hemmer M., Ramsköld D., Hellman U., Sandberg R., Kenchappa R., Martinson T., Johnsen J., Kogner P., Schlisio S. (2014) RNA helicase A is a downstream mediator of KIF1Bβ tumor-suppressor function in neuroblastoma. Cancer Discovery. 4, 434–451.
Xing L., Niu M., Zhao X., Kleiman L. (2013) Roles of the linker region of RNA helicase A in HIV-1 RNA metabolism. PLoS One. 8, e78596.
He Q.S., Tang H., Zhang J., Truong K., Wong-Staal F., Zhou D. (2008) Comparisons of RNAi approaches for validation of human RNA helicase A as an essential factor in hepatitis C virus replication. J. Virol. Meth. 154, 216–219.
Lenarcic E.M., Ziehr B.J., Moorman N.J. (2015) An unbiased proteomics approach to identify human cytomegalovirus RNA-associated proteins. Virology. 481, 13–23.
Liao H.-J., Kobayashi R., Mathews M.B. (1998) Activities of adenovirus virus-associated RNAs: purification and characterization of RNA binding proteins. Proc. Natl. Acad. Sci. USA. 95, 8514–8519.
Fuchsová B., Novák P., Kafková J., Hozák P. (2002) Nuclear DNA helicase II is recruited to IFN-α–activated transcription sites at PML nuclear bodies. J. Cell Biol. 158, 463–473.
Sadler A.J., Latchoumanin O., Hawkes D., Mak J., Williams B.R.G. (2009) An antiviral response directed by PKR phosphorylation of the RNA helicase A. PLoS Pathogens. 5, e1000311.
Yamasaki Y., Narain S., Yoshida H., Hernandez L., Barker T., Hahn P., Sobel E., Segal M., Richards H., Chan E., Reeves W., Satoh M. (2007) Autoantibodies to RNA helicase A: a new serologic marker of early lupus. Arthritis Rheumatism. 56, 596–604.
Vazquez-Del Mercado M., Palafox-Sanchez C., Munoz-Valle J., Orozco-Barocio G., Oregon-Romero E., Navarro-Hernandez R., Salazar-Paramo M., Armendariz-Borunda J., Gamez-Nava J., Gonzalez-Lopez L., Chan J., Chan E., Satoh M. (2010) High prevalence of autoantibodies to RNA helicase A in Mexican patients with systemic lupus erythematosus. Arthritis Res. Therapy. 12, R6
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


