Молекулярная биология, 2023, T. 57, № 2, стр. 232-242
Об иммунологических исследованиях в научно-технологическом университете “Сириус”
И. В. Астраханцева a, В. Г. Круть a, С. А. Чувпило a, Д. В. Шевырев a, А. Н. Шумеев a, С. А. Рыбцов a, С. А. Недоспасов a, b, *
a АНО ВО Научно-технологический университет “Сириус”
354340 Федеральная территория Сириус, Краснодарский край, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: sergei.nedospasov@gmail.com
Поступила в редакцию 10.08.2022
После доработки 21.09.2022
Принята к публикации 22.09.2022
- EDN: EFWNVA
- DOI: 10.31857/S0026898423020039
Аннотация
Эта небольшая статья суммирует результаты недавних иммунологических исследований, проведенных в новом Научно-технологическом университете “Сириус”. Основное направление работ связано с изучением особенностей иммунного ответа на вакцинацию и ревакцинацию против SARS-CoV-2, а также с поиском потенциальных агентов для предотвращения заражения этим вирусом.
C момента образования Научно-технологического университета “Сириус” в состав Центра генетики и наук о жизни вошло отдельное научное направление: “Иммунобиология и биомедицина”, задача которого состояла в развитии как фундаментальных исследований, так и технологии в области иммунологии. Пандемия COVID-19 оказала “мгновенное действие”, скорректировав научные планы направления и частично “переключив” исследования на инфекционную иммунологию. Отметим, что к этому моменту находящийся в стадии становления НТУ “Сириус” уже приобрел высокотехнологичное оборудование, которое было развернуто во временных помещениях. Эта статья обобщает результаты иммунологических исследований, в первую очередь связанных с пандемией COVID-19, которые были проведены в тесной кооперации с несколькими ключевыми партнерами. Кроме того, была оценена возможность создания пептидного аналога клеточного рецептора коронавируса ‒ ангиотензинконвертирующего фермента-2 (ACE2), ‒ как потенциального ингибитора проникновения вируса в клетку, тем самым предотвращающего ее заражение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Участники исследования и образцы. У добровольцев-участников брали периферическую кровь через 1 и 6 мес после прохождения полного курса вакцинации для оценки гуморального и клеточного иммунитета. Были сформированы следующие группы сравнения:
1. Переболевшие COVID-19, n = 7.
2. Вакцинированные Гам-Ковид-Вак (Sputnik V), n = 7.
3. Вакцинированные ЭпиВакКорона, n = 7.
4. Вакцинированные КовиВак (CoviVac), n = 7.
5. Вакцинированные мРНК-вакцинами: BNT162b2 (Pfizer/BioNTech) или mRNA-1273 (Moderna), ‒ n = 8.
6. Вакцинированные Гам-Ковид-Вак через 6 мес или более после перенесенного заболевания COVID-19, n = 7.
7. Вакцинированные КовиВак через 6 мес или более после перенесенного заболевания COVID-19, n = 5.
Периферическую кровь собирали в две 9-миллилитровые пробирки IMPROVacutainer с натрий гепарином (“IMPROVE”, Китай). Кровь разделяли на клеточные фракции центрифугированием в градиенте плотности фиколла. Мононуклеары периферической крови (РВМС) замораживали в жидком азоте в количестве 1 × 106 клеток в 1 мл среды RPMI-1640 (“ПанЭко”, Россия) c 10% диметилсульфоксида (DMSO; “Sigma”, США), 5% фетальной сыворотки крупного рогатого скота (FBS; “Capricorn Scientific”, Германия). Для выделения сыворотки периферическую кровь собирали в пробирки IMPROVacutainer с активатором свертывания объемом 5 мл (“IMPROVE”). Полученную сыворотку разделяли на аликвоты и хранили при ‒80°С.
Иммуноферментный анализ. Уровни антител к рецепторсвязывающему домену (RBD) белка шипа (S) SARS-CoV-2 оценивали с использованием иммуноферментной тест-системы SARS-CoV-2-IgG-ИФА (любезно предоставлена ФГБУ “Национальный медицинский исследовательский центр гематологии” Минздрава России, Москва).
Мультиплексный анализ антител. Наличие антител против различных эпитопов в составе белков S (S1, S2, RBD) и нуклеопротеина (N) SARS-CoV-2 оценивали с помощью набора MILLIPLEX® SARS-CoV-2 Antigen Panel 1 IgG (“Merсk”, Германия) на приборе MagPix (“Merсk”).
Получение псевдовирусных частиц (PVPs) c S-белком SARS-CoV-2. Для получения PVP клетки HEK-293Т (6 × 106 клеток) высаживали на 10-сантиметровую чашку Петри и культивировали в 7 мл полной среды DMEM/F12, содержащей 2% FBS (“Capricon”, США), 2 мМ L-глутамин и пенициллин/стрептомицин в концентрации 50 ед/мл и 50 мкг/мл соответственно (”ПанЭко”), в течение ночи. Среду заменяли на DMEM/F12 без FBS (6.5 мл). Для трансфекции к 650 мкл культуральной среды OptiMEM (“Capricon”) добавляли 30 мкл водного раствора полиэтиленимина (PEI, 1 мг/мл) и раствор плазмид pCMVdelta8.2R, pUCHR-IR-GFP, pCG1-SARS-2S-deltaF-deltaC19 [1], содержащий суммарно 15 мкг ДНК (соотношение ДНК : PEI = 1 : 2), и проводили трансфекцию по стандартному протоколу [2]. Через 48 ч клеточную среду собирали и концентрировали центрифугированием (23 000 × g, 4°С, 2.5 ч). Содержащий PVPs осадок ресуспендировали в 1/20 исходного объема, разделяли на аликвоты и хранили при ‒80°С.
Нейтрализация трансдукции PVPs. Эту процедуру проводили, как описано ранее [1], c небольшими модификациями. Предварительно для опыта по нейтрализации клетки линии НЕК-293Т/АСЕ2, экспрессирующие на поверхности ACE2, высевали в лунки 96-луночного планшета TC-treated (“Eppendorf”, Германия) в расчете 2 × 105 клеток/лунка. В качестве отрицательного контроля использовали сыворотку человека, не содержащую антител против SARS-CoV-2, а для положительного контроля ‒ сыворотку с высоким титром антител, полученную от реконвалесцента COVID-19. В опытных образцах PVPs инкубировали с пептидами, взятыми в диапазоне концентраций от 0.9 до 200 мкM, в полной среде DMEM/F12 (“ПанЭко”) в течение 60 мин при комнатной температуре, после чего их вносили в культуру клеток НЕК-293Т/АСЕ2 и культивировали в течение 48 ч при 37°С и 5% СО2. Анализ трансдукции проводили с помощью проточной цитометрии на анализаторе BD LSRFortessaTM (“BD Biosciences”, США).
FACS-анализ специфических Т-клеток. После разморозки PBMC культивировали в полной среде RPMI-1640 в 96-луночных планшетах TC-treated (“Eppendorf”) по 0.5 × 106 клеток на лунку. После размораживания жизнеспособность PBMC составляла 90‒95% при оценке по включению в них пропидия йодида (PI). Стимуляцию проводили пептидами SARS-CoV-2 PepTivator Peptide Pools (“Miltenyi Biotec”, Германия). В качестве отрицательного контроля использовали нестимулированные клетки, для положительного контроля клетки активировали форбол-12-миристат-13-ацетатом (PMA) в концентрации 25 нг/мл (“Sigma”). Для подавления секреции цитокинов через 2 ч после стимуляции к клеткам добавляли брефельдин A (“BioLegend”, США) и культивировали их в течение ночи при 37°C и 5% CO2. После отмывки клетки окрашивали антителами к поверхностным маркерам: anti-CD3-AF700 (56-0037-42, “Thermo Fisher Scientific”, США), anti-CD8-APC (17-0088-42, “Thermo Fisher Scientific”), anti-CD4-PE/Cy5.5 (35-0047-42, “Thermo Fisher Scientific”). Клетки фиксировали и пермеабилизировали по протоколу BD Cytofix/Cytoperm kit (“BD Biosciences”), после чего окрашивали антителами против интерферона-γ (IFNγ) ‒ anti-IFNγ-BV421 (562988, “BD Biosciences”). Цитофлуориметрический анализ проводили на приборе BD LSRFortessa (“BD Biosciences”). Полученные результаты обрабатывали с использованием программы FlowJo v.10.8.1.
Синтетические пептиды. C использованием данных о контактах между RBD S-белка SARS-CoV-2 и клеточным рецептором вируса ‒ ACE2 [3] выбран и синтезирован пептид, соответствующий аминокислотной последовательности 19‒50 а.о. N-концевого участка АСЕ2 (P1, табл. 1), а также контрольный пептид, в котором ключевые позиции были мутированы (Pm, табл. 1). Эти же варианты пептидов (Р1 и Pm) были синтезированы с флуоресцентной меткой 5(6)-карбоксифлуоресцеином (FAM). Кроме того, был синтезирован пептид P1’st длиной 30 а.о., модифицированный ковалентными сшивками на основе (S)-2-(4-пентенил)аланина (табл. 1).
Иммунофлуоресцентный анализ. Способность синтетических пептидов связываться с S-белком SARS-CoV-2 оценивали в иммунофлуоресцентном тесте с использованием пептидов, меченных FAM. Пептиды инкубировали в 96-луночном планшете (“Greiner Bio-One”, Австрия), который предварительно сенсибилизировали рекомбинантным полноразмерным S-белком (1 мкг/мл бикарбонатного буфера, рН 9.5). Эффективность связывания оценивали по интенсивности флуоресценции на микропланшетном ридере CLARIOstar® Plus (“BMG Labtech”, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение иммунного ответа на вакцины против COVID-19
Начиная с 2020 г., во всем мире развернулась настоящая гонка по скорейшей разработке профилактических вакцин от COVID-19 [7].
Отметим, что уже более 225 лет прошло со времен работ Э. Дженнера, а классический подход к профилактической вакцинации по-прежнему заключается в использовании ослабленного (аттенуированного) патогена, который, инфицируя клетки и ткани организма, размножается в них, не вызывая при этом серьезного заболевания. В связи с патогенезом COVID-19, высокой контагиозностью и смертностью разработка вакцинных препаратов на основе этиологического агента: уханьского варианта SARS-CoV-2 или его эволюционных вариантов ‒ пока невозможна. Как альтернатива, вирус может быть инактивирован химическим или физическим воздействием. В этом случае он не способен реплицироваться, но при условии сохранения структуры вириона может оставаться высокоиммуногенным и вызывать хороший иммунный ответ. На этой платформе разработаны полновирионные инактивированные вакцины BBIBP-CorV компании “Sinopharm” (Китай) и CoronaVac компании “Sinovac Biotech” (Китай), а также отечественная вакцина КовиВак (CoviVac) Федерального научного центра исследований и разработки иммунобиологических препаратов им. М.П. Чумакова Российской академии наук (ФГБНУ “ФНЦИРИП им. М.П. Чумакова” РАН) [8–10].
Кроме того, широкое применение получили высокотехнологичные вакцины на основе рекомбинантных аденовирусов: Sputnik V (Гам-Ковид-Вак) Национального исследовательского центра эпидемиологии и микробиологии им. Н.Ф. Гамалеи (ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи” Минздрава России, Россия), AZD1222 от Oxford/”AstraZeneca” (Великобритания), Ad26.COV2.S компании “Johnson & Johnson” (США) [11–13] и Ad5-nCoV (Convidicea) компании “CanSino Biologics Inc.” (Китай) [14] – и так называемые мРНК-вакцины BNT162b2 компаний “Pfizer”/”BioNTech” (США/Германия) и mRNA-1273 компании “Moderna” (США) [15]. Все они, как векторные, так и мРНК-вакцины, экспрессируют только S-белок в той или иной модификации.
К середине 2022 года 5.3 млрд человек в мире (более 65%) получило хотя бы одну дозу вакцины (а с учетом числа вакцинаций было сделано около 12.39 млрд прививок) [16]. Вакцинация населения России началась в начале 2021 года на фоне очень высокой нагрузки на медицинские службы в период второй волны пандемии COVID-19. Первая зарегистрированная отечественная вакцина ‒ Sputnik V (Гам-Ковид-Вак) ‒ была разработана учеными ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи” Минздрава России [11, 16], второй стала пептидная вакцина ЭпиВакКорона Государственного научного центра вирусологии и биотехнологии “Вектор” Роспотребнадзора (ФБУН “ГНЦ ВБ “Вектор” Роспотребнадзора”) [17, 18] и третьей ‒ полновирионная инактивированная вакцина КовиВа-к (CoviVac) ФГБНУ “ФНЦИРИП им. М.П. Чумакова” РАН [10]. Кампанию по вакцинации в России сопровождало общее недоверие к вакцинам, подогреваемое безответственными публикациями в средствах массовой информации. К настоящему времени в стране производится достаточное число доз вакцин (в основном Sputnik V и Sputnik-light), но появление новых вариантов вируса SARS-CoV-2, таких как Omicron, поставило новые вопросы относительно эффективности уже существующих вакцин [19]. Даже без учета этого обстоятельства на начало августа 2022 года только 57% населения Российской Федерации получили хотя бы одну дозу вакцины, что ниже среднемирового уровня [16]. Кроме того, для всех широко используемых вакцин было установлено снижение уровня защитных антител к вновь появляющимся вариантам SARS-CoV-2. В связи с этим во всем мире для уже вакцинированных рекомендована дополнительная ревакцинация, однако вопрос об оптимальной комбинации вакцин до конца не изучен [20].
В наших исследованиях мы прежде всего задались целью сравнить между собой несколько известных вакцин (3 отечественных, 2‒3 зарубежных ‒ в первую очередь инновационные мРНК-вакцины) по способности вызывать антительный ответ на несколько вирусных эпитопов с последующим определением уровня нейтрализующих антител. Для этого у выбранных групп добровольцев исследовали изменения титров антител в динамике. У некоторых участников определяли и Т-клеточный ответ на конкретные эпитопы вирусных белков. Кроме того, нам удалось сравнить гуморальный ответ после нескольких вариантов ревакцинации. Следует отметить, что в ходе исследования часть добровольцев (в том числе вакцинированных) не избежала заражения SARS-CoV-2 (о чем можно было объективно судить по паттерну антительного ответа), поэтому по ходу работы число испытуемых в экспериментальных группах снижалось.
Из рис. 1 следует, что как Sputnik V, так и особенно мРНК-вакцины вызывают сильный антительный ответ на RBD S-белка SARS-CoV-2, сравнимый с ответом у переболевших. Однако через 6 месяцев уровень ответа для всех исследованных вакцин значительно снижался, тогда как у переболевших он сохранялся на практически прежнем уровне. Антитела к RBD S-белка у вакцинированных полновирионной инактивированной вакциной CoviVac вырабатывались на очень низком уровне, хотя на основании эпидемиологических данных защитные свойства этой вакцины сомнения не вызывают [10].
Рис. 1.
Уровень антител к RBD S-белка через 1 (a) и 6 (б) месяцев после полного курса вакцинации или инфекции SARS-CoV-2. Иммуноферментный анализ проведен в тест-системе SARS-CoV-2-IgG-ИФА; оптическую плотность регистрировали при длине волны 450 нм (А450) По оси Y ‒ отношение оптической плотности образца (Aex) к оптической плотности критического значения (Ac). Образцы, где отношение Aex/Ac было больше 1, считались положительными. Здесь и далее: mRNA – группа участников, вакцинированных BNT162b2 (“Pfizer”/”BioNTech”) или mRNA-1273 (“Moderna”); COVID-19 ‒ переболевшие COVID-19. У группы участников, вакцинированных ЭпиВакКорона, антительный ответ на S-белок вируса в данной тест-системе был ниже критического значения оптической плотности.

Для дальнейших, более углубленных исследований применяли мультиплексную технологию Luminex, которая позволяет одновременно детектировать антитела к трем разным доменам S-белка: S1, S2 и RBD, а также к N-белку (рис. 2). Как и ожидалось, в этой системе только у переболевших и у вакцинированных полновирионной вакциной детектировали антитела к внутреннему N-белку вириона. Отметим, что появление антител к N-белку у вакцинированных Sputnik V или мРНК-вакцинами мы интерпретировали как “перенесенное заболевание COVID-19” и этих испытуемых исключали из дальнейших исследований.
Рис. 2.
Уровень антител против белков S2 (а) и N (б) SARS-CoV-2 через 1 и 6 месяцев после перенесенной инфекции или вакцинации. Анализ проведен в тест-системе MILLIPLEX® SARS-CoV-2 Antigen Panel 1 IgG. По оси Y ‒ отношение медианы интенсивности флуоресценции (MFI) образца (MFIex) к медиане интенсивности флуоресценции критического значения (MFIc). Образцы, где отношение MFIex/MFIc было больше 1, считались положительными.
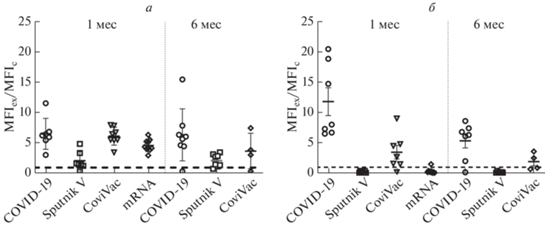
Интересно, что у вакцинированных CoviVac уровни антител к субъединице S2 были сравнимы с таковыми у переболевших, в то время как у вакцинированных Sputnik V этот ответ был достоверно слабее. Роль иммунного ответа на белок S2 (напомним, что RBD не входит в состав этой субъединицы) до сих пор не выяснена. Недавно на мышиной модели показано, что иммунизация белком S2 вызывает у животных продукцию вируснейтрализующих антител [21, 22]. Эти результаты, безусловно, требуют осмысления и подтверждения.
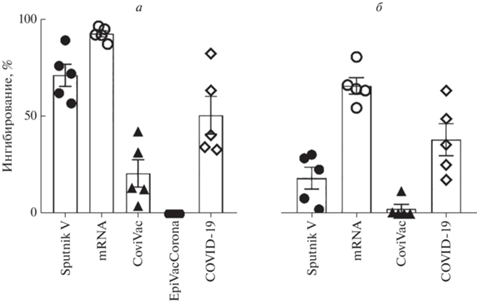
Кроме того, с помощью псевдовирусной системы в динамике была исследована нейтрализующая активность антител к S-белку у испытуемых разных групп. К преимуществам этой системы относится возможность быстрой наработки PVPs и смены их “покрытия” тем или иным целевым белком, например разными структурными компонентами S-белка SARS-CoV-2, причем от разных вариантов вируса.
Нами обнаружено, что у вакцинированных Sputnik V вируснейтрализующая активность антител против S-белка варианта Wuhan-Hu-1 SARS-CoV-2 сильно снижается через полгода после вакцинации. В группе реципиентов вакцин на платформе мРНК детектировали самый высокий уровень нейтрализацующих антител, который даже через полгода был выше, чем в группе переболевших. Вакцинация полновирионной инактивированной вакциной CoviVac не вызывала высокого антительного ответа против RBD, что соответствовало низкой эффективности нейтрализации в тесте с PVPs (рис. 3).
Рис. 3.
Оценка вируснейтрализующей активности антител против S-белка SARS-CoV-2 (вариант Wuhan-Hu-1) у испытуемых через 1 (а) и 6 (б) месяцев после вакцинации или перенесенной инфекции COVID-19.
Дополнительно мы оценили нейтрализующую активность антител против S-белка SARS-CoV-2 варианта Delta (B.1.617.2.). В этом случае у вакцинированных Sputnik V уже через месяц после вакцинации титры вируснейтрализующих антител заметно снижались и оставались почти на том же уровне и через полгода. В группе реципиентов мРНК-вакцин через полгода также отмечалось резкое падение вируснейтрализующей активности (рис. 4). Стоит обратить внимание на специфичность и различия в нейтрализации варианта Delta SARS-CoV-2 у испытуемых, которые перенесли COVID-19 в разные периоды времени. Вируснейтрализующая активность сывороток тех, кто перенес заболевание в весенне-летний период 2021 г., была выше по отношению к варианту Delta, чем у переболевших в 2020 году в период циркуляции варианта Wuhan-Hu-1.
Рис. 4.
Оценка вируснейтрализующей активности антител против S-белка SARS-CoV-2 (вариант B.1.617.2 ‒ Delta) у испытуемых через 1 (а) и 6 (б) месяцев после вакцинации/перенесенной инфекции COVID-19.

Далее мы приступили к анализу эффективности различных схем ревакцинации. К середине 2021 года началась масштабная вакцинация в России, в том числе и тех, кто в прошлом перенес инфекцию SARS-CoV-2. На рис. 5а приведены данные по ревакцинации переболевших двумя отечественными вакцинами.
Рис. 5.
Уровни антител к RBD S-белка SARS-CoV-2 после вакцинации ранее переболевших (а) и ревакцинации не болевших COVID-19 (б). Показаны уровни антител через 6 месяцев после заражения или первичной вакцинации и через 1 месяц после вакцинации переболевших или ревакцинации не болевших COVID-19.
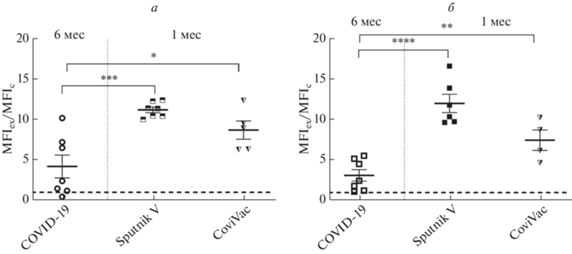
Эффективный иммунный ответ восстанавливался и при ревакцинации ранее вакцинированных групп (рис. 5б), при этом уровень антител через месяц после ревакцинации был существенно выше, чем до нее. Предполагается, что гетерологичная вакцинация, сочетающая вакцины разных типов, позволяет расширить репертуар эпитопов, против которых нацелены антитела, включая ненейтрализующие. По последним данным, такие антитела, как и нейтрализующие, могут играть протективную роль [20, 21].
Наряду с антительным ответом у некоторых добровольцев из разных групп анализировали и Т-клеточный ответ с использованием проточной цитометрии и технологии ELISPOT. Нами обнаружено, что через полгода после заражения SARS-CoV-2, а также после вакцинации как векторной (Sputnik V), так и полновирионной (CoviVac) вакцинами у части добровольцев сохраняется специфический Т-клеточный иммунитет (рис. 6), хотя количество вирусспецифических Т-клеток у переболевших в среднем сохранялось на более высоком уровне.
Рис. 6.
Содержание IFNγ-продуцирующих Т-клеток в ответ на стимуляцию пулом пептиваторов SARS-CoV-2 (пептиды, представляющие собой участки Т-клеточных эпитопов S- и N-белков). а – Визуализация IFNγ-продуцирующих Т-клеток до и после стимуляции как пятнообразующих единиц (SFU); форбол-12-миристат-13-ацетат (PMA) использовали для неспецифической стимуляции Т-клеток. б – Число SFU на 1 × 106 клеток периферической крови, продуцирующих IFNγ, через 6 месяцев после перенесенного заболевания или вакцинации.

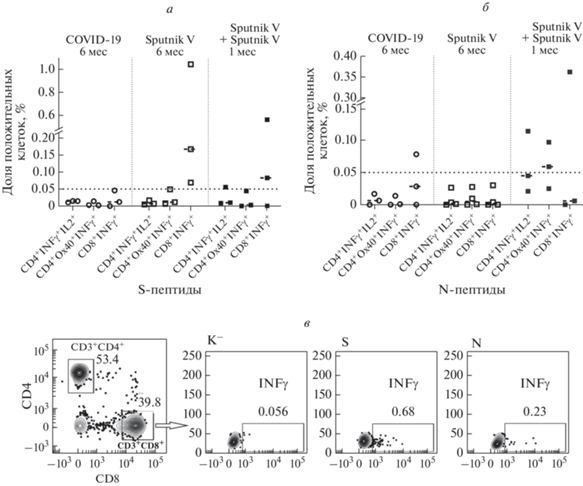
Хотя цитометрический анализ менее чувствителен и более сложен, чем ELISPOT, его использование позволило определить, какие популяции Т-клеток активируются при инфекции и вакцинации. У всех исследованных групп детектировали в основном специфические CD8+-клетки; при этом у вакцинированных Sputnik V эти клетки были нацелены против Т-клеточных эпитопов S-белка SARS-CoV-2 (рис. 7а, б), в то время как у переболевших детектировали и CD8+-клетки, нацеленные против N-белка (рис. 7б). Важно отметить, что через месяц после ревакцинации существенно повышалась доля как CD4+, так и S-специфических CD8+ Т-клеток.
Рис. 7.
Количество цитокинпродуцирующих Т-клеток у переболевших и вакцинированных в ответ на стимуляцию пулом пептидов, происходящих из белков S (а) или N (б) SARS-CoV-2 (PepTivators, Miltenyi Biotec). в ‒ Популяция IFNγ-продуцирующих CD3+CD8+ клеток человека, вакцинированного Sputnik V, после стимуляции различными пулами S- или N-пептидов. К‒ ‒ клетки до стимуляции. Анализ выполнен на приборе BD LSRFortessa.
Поиск пептидов, блокирующих проникновение SARS-CoV-2 в клетку
Во многих лабораториях проводят работы по поиску ингибиторов SARS-CoV-2 на стадии проникновения в клетку. Для этой цели рассматриваются молекулы на основе пептидов или небольших белков, представляющих собой домены молекулы АСЕ2, которые и контактируют с RBD S-белка вируса. Ранее было показано, что внеклеточная часть АСЕ2, экспрессированная в гетерологичной системе, может быть таким блокатором [23], однако минимальный размер такого фрагмента ACE2, достаточный для предотвращения взаимодействия с ним RBD, не был установлен. В основе нашего исследования лежала гипотеза о том, что одна или две хорошо структурированные α-спирали из N-концевого домена АСЕ2, включающие ключевые аминокислоты для контактов с RBD S-белка, могут быть активными блокаторами [4]. Для этого нами детально изучены свойства синтетического пептида Р1, содержащего α1-спираль, и рекомбинантного полипептида Р2, содержащего α1- и α2-спирали. Эти пептиды хорошо связывались с S-белком in vitro (рис. 8а), но ни в PVP-системе, ни в экспериментах с живым вирусом SARS-CoV-2 они не блокировали проникновение вируса в клетку (рис. 8в).
Рис. 8.
Анализ взаимодействия S-белка SARS-CoV-2 с ACE2-пептидами. Показаны результаты иммунофлуоресцентного анализа связывания S-белка SARS-CoV-2 с АСЕ2-пептидами Р1 и Р1m, меченными флуорофором FAM (а), и конкурентного ингибирования связывания S-белка с P1-FAM, который предварительно инкубировали с аналогичным по первичной структуре пептидом, модифицированным химическими сшивками (Stapled) (б). Нейтрализация трансдукции псевдовирусных частиц под действием пептидов P1 и P1m (в) и под действием модифицированного пептида Stapled и его немодифицированного аналога Р1 (г). (Данные по связыванию Р2-пептида и данные по нейтрализации в системе с живым вирусом не приведены.)
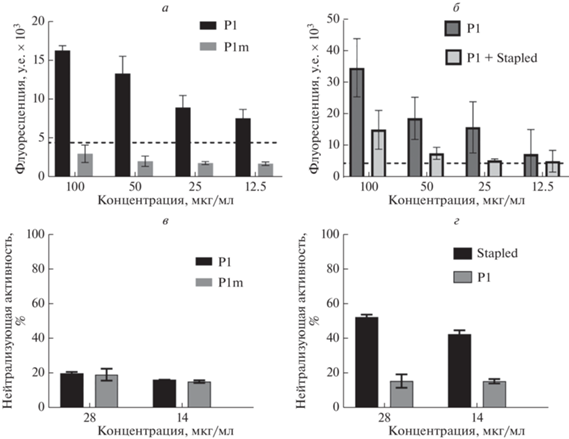
В ряде других лабораторий, практически в одно и тоже время, проверяли ту же гипотезу о возможности блокировки входа вируса SARS-CoV-2 в клетку с помощью пептида ‒ аналога ключевого для взаимодействия с RBD участка ACE2, ‒ используя различные синтетические пептиды [24–26] Так R. Larue и соавт. [27] обнаружили, что очень короткие пептиды (всего 6‒16 а. о.), содержащие часть α1-спирали и относящиеся к самособирающимся пептидам (self-assembling peptides, SAР), ингибировали связывание S-белоксодержащих PVPs c АСЕ2, хотя по меньшей мере один из этих пептидов вообще не связывался с S-белком in vitro. Мы считаем, что SAP препятствуют проникновению вируса в клетку по какому-то иному механизму. Кроме того, идея использования “сшитых” пептидов как аналогов SAP для исследования взаимодействия SARS-CoV-2 с его рецептором АСЕ2 была реализована в работе F. Curreli и др. [6]. Нам удалось воспроизвести не только эти результаты по связыванию сшитого пептида с S-белком SARS-CoV-2, но и продемонстрировать его ингибирующую активность при внедрении в клетку как псевдовируса (рис. 8б, г), так и SARS-CoV-2 (данные не приведены). Заметим, что классические синтетические пептиды уже получили широкое применение как в качестве лекарственных средств, так и компонентов вакцин. Что касается “сшитых” пептидов, то их синтез представляет собой трудную технологическую задачу, реализация которой на современном этапе нерентабельна [5].
Таким образом, за 2021‒2022 гг. в НТУ “Сириус” удалось создать высокотехнологичную платформу для иммунологических исследований. Так, с участием сотрудников направления “Иммунобиология и биомедицина” и ресурсного центра “Клеточные технологии и иммунология” проведено три исследования, которые имеют отношение к иммунологическим аспектам пандемии COVID-19. Кроме того, выполнена работа, связанная с изучением метаболических особенностей различных типов миелоидных клеток. Продолжается работа по созданию собственной коллекции иммунологических реагентов, что позволит проводить исследования в условиях санкций. Наконец, в ожидании запуска вивария НТУ “Сириус” в сотрудничестве с Федеральным исследовательским центром “Институт цитологии и генетики” Сибирского отделения Российской академии наук (ИЦиГ СО РАН) и Федеральным государственным бюджетным учреждением науки “Институт биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова” Российской академии наук (ИБХ РАН) создаются новые мышиные модели для иммунологических исследований.
Авторы благодарят Н.А. Круглову, Г.А. Ефимова, А.А. Круглова, М.С. Друцкую, Л.И. Козловскую, А.В. Кривцова, М.А. Лагарькову, С.В. Кулемзина, Д.В. Мазурова, В.П. Терещенко, В.С. Лактюшкина, А.А. Сухих, Д.М. Якшина и Р.А. Абагяна, а также коллектив медицинского центра Парка науки и Искусства (Сириус) за советы, помощь в сборе материала, отработке методов и прочее содействие.
Исследования были поддержаны НТУ “Сириус” (проект ИМБ-2103.), грантом РФФИ 20-04-60338 и Министерством науки и высшего образования (дополнительное соглашение № 075-03-2021-448/3, тема № 121122300151-5). Работы были выполнены на базе ресурсного центра “Клеточных технологий и иммунологии” НТУ “Сириус”; очистка пептида P2 была проведена на базе ресурсного центра “Биотехнологических продуктов” НТУ “Сириус”.
Исследование было разрешено Комитетом по Биоэтике АНО ВО “Университет Сириус” (протокол от 5.02.2021). Все участники исследования подписали информированное согласие на участие в исследовании до начала сбора биоматериала.
Конфликт интересов отсутствует.
Список литературы
Kruglova N., Siniavin A., Gushchin V., Mazurov D. (2021) Different neutralization sensitivity of SARS-CoV-2 cell-to-cell and cell-free modes of infection to convalescent sera. Viruses. 13, 1133.
Fliedl L., Kaisermayer C. (2011) Transient gene expression in HEK293 and Vero cells immobilised on microcarriers. J. Biotechnol. 153, 15–21.
Joyce M.G., Wheatley A.K., Modjarrad K. (2020) Need for speed: from human SARS-CoV-2 samples to protective and efficacious antibodies in weeks. Cell. 182, 7–9.
Круть В.Г., Астраханцева И.В., Чувпило С.А., Ефимов Г.А., Амбарян С.Г., Друцкая М.С., Недоспасов С.А. (2022) Антитела к N-концевому домену ангиотензин-конвертирующего фермента (АСЕ2) блокируют его взаимодействие с S белком вируса SARS-CoV-2. Доклады Российской академии наук. Науки о жизни. 502, 5–9.
Круть В.Г., Чувпило С.А., Астраханцева И.В., Козловская Л.И., Ефимов Г.А., Круглов А.А., Друцкая М.С., Недоспасов С.А. (2022) Помогут ли пептиды остановить COVID-19? Биохимия. 87, 707–726.
Curreli F., Victor S.M.B., Ahmed S., Drelich A., Tong X., Tseng C.K., Hillyer C.D., Debnath A.K. (2020) Stapled peptides based on human angiotensin-converting enzyme 2 (ACE2) potently inhibit SARS-CoV-2 infection in vitro. mBio. 11, e02451-20.
Chen W.-H., Strych U., Hotez P.J., Bottazzi M.E. (2020) The SARS-CoV-2 vaccine pipeline: an overview. Curr. Trop. Med. Rep. 7, 61–64.
Xia S., Zhang Y., Wang Y., Wang H., Yang Y., Gao G.F., Tan W., Wu G., Xu M., Lou Z., Huang W., Xu W., Huang B., Wang H., Wang W., Zhang W., Li N., Xie Z., Ding L., You W., Zhao Y., Yang X., Liu Y., Wang Q., Huang L., Yang Y., Xu G., Luo B., Wang W., Liu P., Guo W., Yang X. (2021) Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. Lancet Infec. Dis. 21, 39–51.
Wu Z., Hu Y., Xu M., Chen Z., Yang W., Jiang Z., Li M., Jin H., Cui G., Chen P., Wang L., Zhao G., Ding Y., Zhao Y., Yin W. (2021) Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infec. Dis. 21, 803–812.
Kozlovskaya L.I., Piniaeva A.N., Ignatyev G.M., Gordeychuk I.V., Volok V.P., Rogova Y.V., Shishova A.A., Kovpak A.A., Ivin Y.Yu., Antonova L.P., Mefyod K.M., Prokosheva L.S., Sibirkina A.S., Tarasova Y.Yu., Bayurova E.O., Gancharova O.S., Illarionova V.V., Glukhov G.S., Sokolova O.S., Shaitan K.V., Moysenovich A.M., Gulyaev S.A., Gulyaeva T.V., Moroz A.V., Gmyl L.V., Ipatova E.G., Kirpichnikov M.P., Egorov A.M., Siniugina A.A., Ishmukhametov A.A. (2021) Long-term humoral immunogenicity, safety and protective efficacy of inactivated vaccine against COVID-19 (C-oviVac) in preclinical studies. Emerg. Microbes Infect. 10, 1790–1806.
Logunov D.Y., Dolzhikova I.V., Shcheblyakov D.V., Tukhvatulin A.I., Zubkova O.V., Dzharullaeva A.S., Kovyrshina A.V., Lubenets N.L., Grousova D.M., Erokhova A.S., Botikov A.G., Izhaeva F.M., Popova O., Ozharovskaya T.A., Esmagambetov I.B., Favorskaya I.A., Zrelkin D.I., Voronina D.V., Shcherbinin D.N., Semikhin A.S., Simakova Y.V., Tokarskaya E.A., Egorova D.A., Shmarov M.M., Nikitenko N.A., Gushchin V.A., Smolyarchuk E.A., Zyryanov S.K., Borisevich S.V., Naroditsky B.S., Gintsburg AL.; Gam-COVID-Vac Vaccine Trial Group. (2021) Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 397(10275), 671–681.
Knoll M.D., Wonodi C. (2021) Oxford–AstraZeneca COVID-19 vaccine efficacy. Lancet. 397, 72–74.
Stephenson K.E., Le Gars M., Sadoff J., de Groot A.M., Heerwegh D., Truyers C., Atyeo C., Loos C., Chandrashekar A., McMahan K., Tostanoski L.H., Yu J., Gebre M.S., Jacob-Dolan C., Li Z., Patel S., Peter L., Liu J., Borducchi E.N., Nkolola J.P., Souza M., Tan C.S., Zash R., Julg B., Nathavitharana R.R., Shapiro R.L., Azim A.A., Alonso C.D., Jaegle K., Ansel J.L., Kanjilal D.G., Guiney C.J., Bradshaw C., Tyler A., Makoni T., Yanosick K.E., Seaman M.S., Lauffenburger D.A., Alter G., Struyf F., Douoguih M., Van Hoof J., Schuitemaker H., Barouch D.H. (2021) Immunogenicity of the Ad26.COV2.S vaccine for COVID-19. JAMA. 325(15), 1535‒15445.
Zhu F.C., Li Y.H., Guan X.H., Hou L.H., Wang W.J., Li J.X., Wu S.P., Wang B.S., Wang Z., Wang L., Jia S.Y., Jiang H.D., Wang L., Jiang T., Hu Y., Gou J.B., Xu S.B., Xu J.J., Wang X.W., Wang W., Chen W. (2020) Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet. 395(10240), 1845‒1854.
Wang Z., Schmidt F., Weisblum Y., Muecksch F., Barnes C.O., Finkin S., Schaefer-Babajew D., Cipolla M., Gaebler C., Lieberman J.A., Oliveira T.Y., Yang Z., Abernathy M.E., Huey-Tubman K.E., Hurley A., Turroja M., West K.A., Gordon K., Millard K.G., Ramos V., Da Silva J., Xu J., Colbert R.A., Patel R., Dizon J., Unson-O’Brien C., Shimeliovich I., Gazumyan A., Caskey M., Bjorkman P.J., Casellas R., Hatziioannou T., Bieniasz P.D., Nussenzweig M.C. (2021) mRNA vaccine-elicited antibodies to SARS-CoV-2 and circulating variants. Nature. 592, 616–622.
Coronavirus (COVID-19) Vaccinations. https://ourworldindata.org/covid-vaccinations
Ryzhikov A.B., Ryzhikov E.A., Bogryantseva M.P., Danilenko E.D., Imatdinov I.R., Nechaeva E.A., Pyankov O.V., Pyankova O.G., Susloparov I.M., Taranov O.S., Gudymo A.S, Danilchenko N.V., Sleptsova E.S., Bodnev S.A., Onkhonova G.S., Petrov V.N., Moiseeva A.A., Torzhkova P.Yu., Pyankov S.A., Tregubchak T.V., Antonets D.V., Gavrilova E.V., Maksyutov R.A. (2021) Immunogenicity and protectivity of the peptide vaccine against SARS-CoV-2. Annals RAMS. 76, 5–19.
Ryzhikov A.B., Ryzhikov E.A., Bogryantseva M.P., Usova S.V., Danilenko E.D., Nechaeva E.A., Pyankov O.V., Pyankova O.G., Gudymo A.S., Bodnev S.A., Onkhonova G.S., Sleptsova E.S., Kuzubov V.I., Ryndyuk N.N., Ginko Z.I., Petrov V.N., Moiseeva A.A., Torzhkova P.Yu., Pyankov S.A., Tregubchak T.V., Antonec D.V., Gavrilova E.V., Maksyutov R.A. (2021) A single blind, placebo-controlled randomized study of the safety, reactogenicity and immunogenicity of the “EpiVacCorona” vaccine for the prevention of COVID-19, in volunteers aged 18–60 years (phase I–II). Russ. J. Inf. Immun. 11, 283–296.
Kudriavtsev A.V., Vakhrusheva A.V., Novoseletsky V.N., Bozdaganyan M.E., Shaitan K.V., Kirpichnikov M.P., Sokolova O.S. (2022) Immune escape associated with RBD Omicron mutations and SARS-CoV-2 evolution dynamics. Viruses. 14, 1603.
Rashedi R., Samieefar N., Masoumi N., Mohseni S., Rezaei N. (2022) COVID-19 vaccines mix-and-match: the concept, the efficacy and the doubts. J. Med. Virol. 94, 1294–1299.
Ng K.W., Faulkner N., Finsterbusch K., Wu M., Harvey R., Hussain S., Greco M., Liu Y., Kjaer S., Swanton C., Gandhi S., Beale R., Gamblin S.J., Cherepanov P., McCauley J., Daniels R., Howell M., Arase H., Wack A., Bauer D.L.V., Kassiotis G. (2022) SARS-CoV-2 S2-targeted vaccination elicits broadly neutralizing antibodies. Sci. Transl. Med. 14, eabn3715.
Claireaux M., Caniels T.G., de Gast M., Han J., Guerra D., Kerster G., van Schaik B.D.C., Jongejan A., Schriek A.I., Grobben M., Brouwer P.J.M., van der Straten K., Aldon Y., Capella-Pujol J., Snitselaar J.L., Olijhoek W., Aartse A., Brinkkemper M., Bontjer I, Burger J.A., Poniman M., Bijl T.P.L., Torres J.L., Copps J., Martin I.C., de Taeye S.W., de Bree G.J., Ward A.B., Sliepen K., van Kampen A.H.C., Moerland P.D., Sanders R.W., van Gils M.J. (2022) A public antibody class recognizes an S2 epitope exposed on open conformations of SARS-CoV-2 spike. Nat. Commun. 13, 4539.
Zoufaly A., Poglitsch M., Aberle J.H., Hoepler W., Seitz T., Traugott M., Grieb A., Pawelka E., Laferl H., Wenisch C., Neuhold S., Haider D., Stiasny K., Bergthaler A., Puchhammer-Stoeckl E., Mirazimi A., Montserrat N., Zhang H., Slutsky A.S., Penninger J.M. (2020) Human recombinant soluble ACE2 in severe COVID-19. Lancet Respir. Med. 8, 1154–1158.
Bibilashvili R.Sh., Sidorova M.V., Dudkina U.S., Palkeeva M.E., Molokoedov A.S., Kozlovskaya L.I., Egorov A.M., Ishmukhametov A.A., Parfyonova Y.V. (2021) Peptide inhibitors of the interaction of the SARS-CoV-2 receptor-binding domain with the ACE2 cell receptor. Biomed. Khim. 67, 244–250 (in Russ.)
Zhang G., Pomplun S., Loftis A.R., Tan X., Loas A. Pentelute B.L. (2020) Investigation of ACE2 N-terminal fragments binding to SARS-CoV-2 spike RBD. bioRxiv. 2020.03.19.999318. https://doi.org/10.1101/2020.03.19.999318
Karoyan P., Vieillard V., Gómez-Morales L., Odile E., Guihot A., Luyt C.E., Denis A., Grondin P., Lequin O. (2021) Human ACE2 peptide-mimics block SARS-CoV-2 pulmonary cells infection. Commun. Biol. 4, 197.
Larue R.C., Xing E., Kenney A.D., Zhang Y., Tuazon J.A., Li J., Yount J.S., Li P.K., Sharma A. (2021) Rationally designed ACE2-derived peptides inhibit SARS-CoV-2. Bioconjug. Chem. 32, 215–223.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


