Молекулярная биология, 2023, T. 57, № 2, стр. 243-253
Аномальная активность сигнального пути mTOR в расстройствах аутистического спектра: возможности механизмобоснованной терапии
Е. А. Трифонова a, *, А. А. Котлярова b, А. В. Кочетов a, c
a Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Институт клинической и экспериментальной лимфологии – филиал Института цитологии и генетики
Сибирского отделения Российской академии наук
630117 Новосибирск, Россия
c Новосибирский государственный университет
630090 Новосибирск, Россия
* E-mail: trifonova.k@rambler.ru
Поступила в редакцию 27.07.2022
После доработки 05.09.2022
Принята к публикации 21.09.2022
- EDN: EFQXLY
- DOI: 10.31857/S0026898423020222
Аннотация
Расстройства аутистического спектра (РАС) ‒ это патология развития, характеризующаяся ранним возникновением проблем в коммуникации, обучении и поведении. Синдромная форма РАС обусловлена моногенными мутациями. В том случае, когда не удается найти генетических или других известных механизмов для объяснения причин расстройства, используют термин “идиопатический аутизм”. Значительная часть случаев как синдромного, так и идиопатического аутизма связана с дерегуляцией трансляции, зависящей от механистической мишени рапамицина ‒ mTOR. В этом обзоре мы представляем как биоинформатические, так и экспериментальные данные, которые связывают сигнальный путь mTOR с аутизмом, спровоцированным материнскими аутоантителами, и детскими аутоиммунными нейропсихиатрическими расстройствами, такими как хорея Сиденгама и детское аутоиммунное нейропсихиатрическое расстройство, ассоциированное со стрептококковой инфекцией (PANDAS). Также мы обсуждаем необходимость субтипирования РАС и возможности механизмобоснованной терапии ингибиторами сигнального пути mTOR.
ВВЕДЕНИЕ
Расстройства аутистического спектра (РАС) относятся к гетерогенным расстройствам нейропсихического развития со сложными генетическими, экологическими и эпигенетическими компонентами и характеризуются ранним дебютом проблем с коммуникацией, в том числе и речевой, социализацией, стереотипным поведением и ограниченными интересами, часто сопровождаются сенсорной гиперчувствительностью. Согласно данным Центра по контролю и профилактике заболеваний (CDC, США), РАС поражает примерно одного из 44 (2.27%) детей в США (https://www.cdc.gov/ncbddd/autism/data.html).
Синдромная форма РАС включает вызываемые моногенными мутациями синдромы, которые значительно повышают риск развития аутизма, но каждый из них имеет дополнительные особенности, не связанные с РАС. В настоящее время принято считать, что генетическими причинами можно объяснить до 25% случаев РАС. В том случае, когда не удается найти генетических или других известных механизмов для объяснения причин расстройства, используют термин “идиопатический аутизм” [1]. С помощью модельных животных с мутациями, приводящими к разным типам синдромного аутизма, было продемонстрировано, что нарушения в структуре, функциях или формировании межнейронных связей – синапсов – часто встречаются при РАС. Оказалось, что некоторые гены предрасположенности к аутизму кодируют структурные белки синапса, такие как SHANK3 или нейролигины, другие кодируют белки-регуляторы трансляции. С нарушениями регуляции локальной (происходящей непосредственно в синапсе) трансляции связан синдром ломкой Х-хромосомы, туберозный склероз, а также ряд синдромов под названием RASопатии (включает нейрофиброматоз типа 1 и другие мутации в генах пути RAS/MAPK с очень похожими проявлениями), PTEN-синдром множественных гамартом и другие менее известные [2]. Один из генов, вызывающих такой малоизвестный синдром, ‒ механистическая мишень рапамицина (mTOR). Это серин/треониновая протеинкиназа, центральный компонент двух мультибелковых комплексов: mTORC1 и mTORC2, ‒ которые различаются по белковому составу и субстратам. Показано, что дерегуляция сигнального пути mTOR играет определяющую роль в патогенезе множества неврологических расстройств, таких как эпилепсия, аутизм, умственная отсталость, болезнь Альцгеймера, опухоли головного мозга [3], а проведенный нами биоинформатический анализ генов предрасположенности к аутизму, представленных в базе данных SFARI Gene (https://gene.sfari.org), выявил, что 606 из 1 053 генов (58%) прямо или косвенно связаны с активностью mTOR [4].
Учитывая сходство нейропсихических проявлений синдромной и идиопатической форм аутизма, H. Zoghbi и M. Bear [5] высказали предположение, что дерегуляция mTORC1 ‒ общий патологический механизм этого расстройства. Действительно, более высокая активность киназ mTOR, ERK и p70S6 и более низкая активность GSK3 и туберина (TSC2) зарегистрированы у детей с несиндромальным аутизмом, что предполагает повышение активности пути Akt/mTOR при идиопатическом РАС [6]. Также сообщалось о снижение продукции интерферона, эпидермального и тромбоцитарного факторов роста с одновременной активацией сигнальных путей PI3K/Akt/mTOR и RAS/MAPK и mTOR-зависимой трансляции при РАС [7]. Следовательно, значительная часть как синдромных, так и идиопатических случаев аутизма может быть отнесена к расстройствам, вызванным гиперактивацией mTOR-зависимой трансляции.
Одна из особенностей аутизма, как и большинства нейропсихических расстройств, заключается в их исключительно поведенческой диагностике, которая не предоставляет практической возможности определения патогенетических подтипов расстройства, а генетический скрининг разбивает спектр аутизма на очень мелкие категории (обычно менее 1%, максимально до 7% ‒ в случае синдрома ломкой Х-хромосомы). В этом обзоре мы проанализируем как генетические, так и напрямую не связанные с генетикой причины аутизмподобного поведения, выявленные в исследованиях последних лет, а также разберем варианты механизмобоснованной терапии РАС.
МАТЕРИНСКАЯ ИММУННАЯ АКТИВАЦИЯ (МИА)
Принимая во внимание известный тератогенный эффект инфицирования матери в процессе беременности вирусом краснухи, цитомегаловирусом и Toxoplasma gondii, H.-Y. Jiang и соавт. [8] проанализировали исследования, подтвердившие связь пренатальных инфекций с последующей диагностикой РАС у детей. Судя по результатам этого мета-анализа, случившиеся во время беременности инфекции в среднем на 12% повышали риск развития аутизма у ребенка, особенно в случае тяжелого течения заболевания, приведшего к госпитализации. Также на уровень риска развития РАС у ребенка влияли: а) тип инфекционного агента; б) триместр беременности, в котором инфекция имела место; в) сайт локализации инфекции. Хотя авторы обнаружили лишь небольшую в процентном отношении связь между МИА и РАС, популяционное влияние этой ассоциации должно быть существенным, потому что инфекции в процессе беременности достаточно частое явление [8]. Более того, показано, что для РАС, сопровождающихся сниженным интеллектом, корреляция с МИА выше, чем для РАС с сохранным интеллектом, что позволяет предположить особенно сильное воздействие материнской инфекции в более тяжелых вариантах расстройства [9].
Гипотеза о том, что МИА нарушает регуляцию транскриптома мозга плода, приводя к тем же изменениям, которые наблюдаются у детей и взрослых с РАС, была проверена на нескольких линиях модельных животных. М. Lombardo и соавт. [10] показали, что идентичный набор генов дерегулирован в транскриптомах мозга плода при МИА и в кортексе детей и взрослых с РАС. Оказалось, что MИA понижает экспрессию ассоциированных с РАС генов, причем в наибольшей степени в генах с редкими высокопенетрантными мутациями. При МИА также понижена экспрессия многих генов, которые постоянно экспрессируются на низком уровне в коре головного мозга пациентов с РАС и важны в развитии синапсов в позднепренатальном периоде [11].
Транскрипционные и трансляционные программы, связанные с высокопенетрантными генами FMR1 и CHD8, ассоциированными с РАС, сильно изменяются под воздействием МИА. МИА значительно повышает экспрессию многих генов, участвующих в инициации трансляции, клеточном цикле, репарации повреждений ДНК и процессах протеолиза, которые влияют на несколько важных этапов развития центральной нервной системы (ЦНС). Один из ключевых генов инициации трансляции ‒ EIF4E ‒ относится к наиболее сильно МИА-дерегулрованным из всех РАС-ассоциированных генов, причем анализ генных сетей выявил значительную МИА-индуцированную транскрипционную дерегуляцию сигнального пути mTOR/EIF4E [10].
Еще один хорошо исследованный ген предрасположенности к аутизму ‒ TSC2 (tuberous sclerosis 2) ‒ ключевой регулятор сигнального пути mTOR, вызывает туберозный склероз. У 40‒50% детей, пораженных туберозным склерозом, развивается РАС, и одно из возможных объяснений этой частичной пенетрантности заключается во взаимодействии между мутациями гена TSC2 и факторами риска окружающей среды. Так, показано, что МИА снижает выживаемость плода и ухудшает социальное поведение взрослых мышей на одной из самых изученных мышиных моделей синдромного аутизма ‒ Tsc2+/−. В экспериментах по имитации сезонных вирусных инфекций D. Ehninger и соавт. [11] использовали модельных мышей Tsc2+/−/Poly(I:C). А проведенный авторами статистический анализ туберозного склероза в человеческой популяции выявил связь между высокой сезонной активностью гриппа в поздние сроки беременности и появлением у ребенка аутизма [11].
Наличие у матери антител, направленных против нейронов мозга плода (аутоантител), было предложено в качестве одного из возможных механизмов того, как МИА провоцирует развитие фенотипа РАС. Недавно А. Ramirez-Celis и соавт. [12] сообщили о разработке серологического анализа для выявления специфичных для РАС материнских аутоантител к 8 ранее идентифицированным белкам: CRMP1, CRMP2, GDA, NSE, LDHA, LDHB, STIP1 и YBOX, ‒ которые высоко экспрессируются в развивающемся мозге [12]. Эта иммуноферментная тест-система, включающая антигены каждого из вышеуказанных белков, позволяет определять паттерны аутоантител, имеющие значимую связь с РАС. Выделено три основных паттерна: CRMP1 + GDA (РАС (%) = 4.2 против контроль (%) = 0, OR = 31.04, p ≤ 0.0001), CRMP1 + CRMP2 (РАС (%) = 3.6 против контроль (%) = 0, OR = 26.08, p = 0.0005) и NSE + + STIP1 (РАС (%) = 3.1 против контроль (%) = 0, OR = 22.82, p = 0.0001). Также обнаружено, что реактивность материнских аутоантител к CRMP1 значительно увеличивает вероятность того, что у ребенка будет более глубокий аутизм. Авторы утверждают, что выявили МИА-специфичные паттерны РАС у 18% участников этого исследования [12].
Мы проанализировали взаимодействия между сигнальным путем mTOR и генами, кодирующими специфические для РАС белки-мишени материнских аутоантител. Обнаружено, что шесть (CRMP1, CRMP2, LDHA, LDHB, STIP1 и YBOX) из восьми МИА-ассоциированных генов тесно переплетены с путем mTOR и три (LDHA, LDHB и STIP1) из восьми непосредственно модулируются mTOR. Более того, по меньшей мере один mTOR-связанный ген представлен в каждом из трех основных паттернов аутоантител (CRMP1 + GDA, CRMP1 + CRMP2 и NSE + STIP1) [12], а именно CRMP1, CRMP2 и STIP1 [13].
Таким образом, влияние материнских аутоантител, по-видимому, следует рассматривать как определяющий фактор развития некоторой части аутистического спектра [14].
ПОСТИНФЕКЦИОННЫЕ АУТОИММУННЫЕ РАССТРОЙСТВА, ВЛИЯЮЩИЕ НА ПОВЕДЕНИЕ (ХОРЕЯ СИДЕНГАМА, PANS/PANDAS)
Инфекции и индуцируемый ими иммунный ответ в последнее время получают все большее признание в качестве механизмов патогенеза психоневрологических расстройств. Хорея Сиденгама (ХС), известное постстрептококковое аутоиммунное заболевание, служит традиционной моделью для изучения патогенеза подобных расстройств. Считается, что при ХС дерегулированный иммунный ответ на стрептококковую инфекцию приводит к воспалению нейронных сетей, особенно ядер базальных ганглиев. Дисфункция в ядрах базальных ганглиев приводит к совокупности неконтролируемых движений и психиатрических симптомов, которые, как показали исследования, поддаются иммуномодулирующей терапии. PANDAS (детское аутоиммунное нейропсихическое расстройство, ассоциированное со стрептококковой инфекцией) считается вариантом ХС; предполагается, что они имеют общий патогенез, несмотря на уникальный профиль преимущественно психиатрических симптомов PANDAS [15]. Стрептококки не уникальны в своей способности вызывать аутоиммунные психоневрологические осложнения, среди альтернативных индукторов ‒ вирусы гриппа и вирус варицелла-зостер (ветряная оспа), микоплазмы. Обобщенно весь спектр подобных синдромов называют PANS (детский нейропсихический синдром с острым началом) [15].
Исторически РАС во всем мире диагностируют исключительно путем наблюдения за поведением. Золотым стандартом диагностики аутизма считается шкала ADOS (Autism Diagnostic Observation Schedule ‒ план диагностического обследования при аутизме), представляющий собой структурированный и удобный в использовании инструмент оценки социального взаимодействия, коммуникации и особенностей поведения. Таким образом, в настоящее время речь может идти только о диагностике аутизмподобного поведения. Часто после диагностики по ADOS проводят генетические тесты, но практически никогда не проверяют на наличие антинейрональных аутоантител. “PANS/PANDAS иногда ошибочно диагностируют как обсессивно-компульсивное расстройство (ОКР), синдром Туретта, РАС, синдром дефицита внимания и гиперактивности, анорексию и другие психические расстройства. Наличие навязчивых ритуалов и интересов, стереотипия и нарушение зрительного контакта могут быть ошибочно отнесены к РАС у маленьких детей”, ‒ отмечает доктор Касоли Рирдон [16]. И действительно, РАС и PANS/PANDAS на практике специалисты дискриминируют только по выраженности и скорости регресса (рис. 1), но в три года, а именно с этого возраста диагностируют PANDAS, регресс более заметен, так как ребенок обладает большим объемом знаний и навыков. Регресс в течение первого года жизни ребенка трудно заметить даже родителям, а от специалистов он совершенно ускользает.
Рис. 1.
Сравнительная диаграмма симптоматики расстройств аутистического спектра (РАС) и детского аутоиммунного психоневрологического расстройства, ассоциированного со стрептококковой инфекцией (PANDAS).
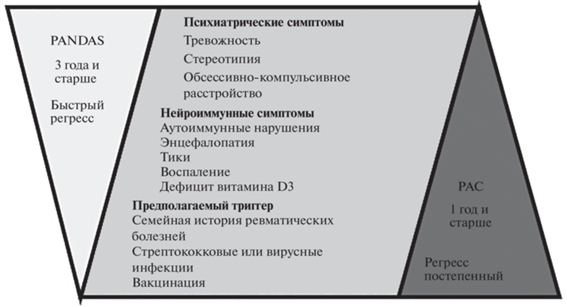
Диагностические критерии PANS/PANDAS определяют как резкое начало ОКР или анорексии при наличии по крайней мере двух из следующих семи категорий: (1) беспокойство; (2) эмоциональная лабильность и/или депрессия; (3) раздражительность, агрессия и/или резко оппозиционное поведение; (4) поведенческий регресс; (5) ухудшение успеваемости в школе (связанное с симптомами, подобными синдрому дефицита внимания и гиперактивности, дефицитом памяти, когнитивными изменениями); (6) сенсорные или моторные нарушения (тики); (7) соматические признаки и симптомы, включая нарушения сна, энурез или повышенную частоту мочеиспускания [17].
Объективная, не связанная с поведением, диагностика ХС и PANS/PANDAS осложняется тем, что коммерчески доступные анализы на стрептококковую инфекцию: антитела к антигену (стрептолизину) (АСЛ-О) и/или антитела против ДНКазы В β-гемолитического стрептококка группы А (GAS) ‒ вполне подходят для измерения активности GAS, но совершенно не связаны с аутоиммунной реактивностью GAS и ЦНС [18]. В процессе исследования нейропсихических аутоиммунных осложнений GAS-инфекций было выявлено несколько общих для ХС и PANDAS мишеней, которые использовали для разработки панели Каннингем [19, 20]. Эта диагностическая платформа включает пять анализов сыворотки крови человека. В четырех из них, используя иммуноферментную тест-систему, измеряют уровень антител IgG, направленных против дофаминового рецептора D1 (D1R), дофаминового рецептора D2 (D2R), ганглиозида GM1 и тубулина. В пятом анализе оценивают способность IgG сыворотки стимулировать активность кальций/кальмодулинзависимой протеинкиназы II (CaMKII) в нейрональных клетках человека [18].
В исследовании, проведенном С. Shimasaki и соавт. [18] с использованием панели Каннингем, выявлена прямая связь между нейропсихическими симптомами и изменениями уровней антинейрональных антител и активацией CaMKII. На основании полученных результатов авторы высказали предположение, что мониторинг уровней аутоантител против этих четырех нейрональных антигенных мишеней и активность CaMKII имеют клиническую значимость в диагностике и лечении аутоиммунных нейропсихических расстройств [18].
В то же время повышенная активность CaMKII напрямую связана с активацией пути mTOR. Известно, что избыток циркулирующих аминокислот играет определяющую роль в таких патологиях человека, как ожирение и диабет II типа, причем эта связь частично опосредована активацией mTORC1 под действием аминокислот [21]. Показано, что аминокислоты, особенно разветвленные, повышают внутриклеточную концентрацию ионов Ca2+ [21], которые затем активирует CaMKII. Протеинкиназа CaMKII фосфорилирует Akt [22] и тем самым активирует сигнальный путь Akt/mTOR [23]. Таким образом, клиническую значимость повышенного уровня CaMKII можно считать дополнительным подтверждением клинической значимости повышенной активности mTOR при аутоиммунных нейропсихических расстройствах.
Стрептококк группы А, GAS, относится к наиболее распространенным патогенам и индукторам ХС и PANDAS. GAS использует интернализацию в клетки в качестве основной стратегии иммунного уклонения. mTOR-зависимая аутофагия ‒ важный компонент иммунной защиты от внутриклеточных бактерий, поэтому размножение GAS напрямую связано с активностью сигнального пути mTOR [24, 25]. Более того, во время взаимодействия с хозяином GAS регулирует множество путей аутофагии, включая mTOR, используя различные специфические регуляторы, такие как стрептолизин O и NAD-гликогидролазу (Nga), для выживания в клетках-хозяевах [26].
ИНГИБИТОРЫ СИГНАЛЬНОГО ПУТИ mTOR И ИНДУКТОРЫ АУТОФАГИИ: ВОЗМОЖНОСТИ МЕХАНИЗМОБОСНОВАННОЙ ТЕРАПИИ РАС, ХС И PANS/PANDAS
На сегодняшний день нет патогенетической терапии РАС из-за отсутствия точного механизма развития заболевания. Нейровоспаление и иммунные нарушения часто становятся мишенями при разработке лекарственных средств для патогенетической терапии РАС [27].
Хотя РАС не относят к классическим иммунноопосредованным заболеваниям, интерес к исследованию роли иммунной системы и хронического воспаления в патогенезе РАС постоянно растет. Микроглия, будучи резидентными макрофагами ЦНС, первой реагирует на различные ее повреждения и отвечает за поддержание гомеостаза [28]. Действительно, микроглия выполняет в ЦНС множество функций: 1) участвует в образовании и развитии новых нейронов за счет высвобождения нейротрофического фактора BDNF [29]; 2) запускает процесс нейровоспаления путем высвобождения провоспалительных цитокинов TNF-α, интерлейкина-1 (IL-1), IL-6, IL-12, интерферона-γ [30]; 3) участвует в фагоцитозе дебриса и апоптотических клеток [31]. Нейровоспаление и избыточная активация микроглии обнаружены в аутопсийных препаратах мозга молодых и пожилых людей с аутизмом [32]. В настоящее время все больше внимания уделяют “невоспалительной” роли микроглии ‒ синаптическому прунингу [31]. Синаптический прунинг – это нормальный процесс снижения числа синапсов, происходящий на протяжении всей жизни. Но при патологичских состояниях этот процесс может нарушаться [33, 34]. Так, в исследованиях постмортальных образцов обнаружено, что у детей и взрослых с РАС синаптическая плотность пирамидных нейронов в височной доле повышена (см. обзор [35]).
Нейровоспаление, иммунная и митохондриальная дисфункция и дерегулированный сигнальный путь mTOR часто становятся мишенями для механизмобоснованной терапии РАС [27]. Однако на самом деле мутации генов и/или нарушение регуляции mTOR могут быть ответственны как за нарушения иммунитета, так и за митохондриальную дисфункцию. В некоторых исследованиях подтверждено [36, 37], что активация сигнального пути mTOR служит положительным регулятором дифференцировки CD4+ эффекторных Т-клеток и отрицательным регулятором дифференцировки регуляторных Т-клеток (Treg), а гиперактивация mTOR ассоциирована с патогенезом ряда аутоиммунных заболеваний. В то же время митохондриальную дисфункцию все чаще рассматривают как одну из причин нарушений развития нервной системы у детей, в том числе и при РАС [38]. В ходе исследований на модельных животных с туберозным склерозом, одним из вариантов синдромного аутизма, показано, что регуляция жизненного цикла митохондрий посредством аутофагии, или митофагии, критически нарушена как в аксоне, так и во всем организме. Обработка Tsc2-дефицитных нейронов и модельных животных ингибитором mTOR рапамицином восстанавливала митохондриальный фенотип, включая массу, транспорт и митофагию [39]. Снижение активности сигнального пути mTOR стало основным фармакологическим способом активации аутофагии [40]. Возможно, эта стратегия может также стать наиболее удачной механизмобоснованной терапией той части аутистического спектра, которая связана с гиперактивацией mTOR.
Основным инструментом в изучении активности сигнального пути mTOR изначально был его фармакологический ингибитор рапамицин, иначе называемый сиролимус (Rapamycin/Sirolimus). Еще в 2008 году было впервые показано, что взрослые мыши Tsc2+/−, одна из самых распространенных моделей синдромного аутизма, после краткого курса рапамицина практически преодолевали как поведенческий дефицит, так и проблемы с обучением на фоне нормализации синаптической пластичности [41]. К сожалению, двойные слепые плацебо-контролируемые исследования оказались не такими обнадеживающими: рапалог (аналог рапамицина) эверолимус только слабо снижал судорожную активность и немного улучшал коморбидные симптомы РАС в первом исследовании [42] и не давал статистически значимого положительного эффекта во втором [43]. Вместе с тем встречаются отдельные публикации о значительном улучшении поведения и обучаемости детей как с идиопатическим [44], так и с синдромным, связанным с мутациями TSC, аутизмом [45] после терапии рапамицином или рапалогами.
Проанализируем с точки зрения связи с активностью mTOR актуальный протокол, используемый для лечения ХС и PANDAS [46] (рис. 2). Авторы протокола, S. Dean и H. Singer, не считают его механизмобоснованным, так как все симптоматическое лечение ХС основано на off-label использовании лекарств. Первым и обязательным пунктом в нем стоят антибиотики пенициллинового ряда, наиболее эффективные против GAS. Следующим по порядку пунктом протокола следуют применяемые off-label противоэпилептические препараты карбамазепин и вальпроат. Авторы отмечают, что препараты практически не вызывают побочных эффектов у пациентов с ХС, эффект достигается в первую же неделю применения и продолжительность курса составляет около 12 недель до полного исчезновения симптомов при средней тяжести заболевания. Однако вальпроат и карбамазепин известны как индукторы аутофагии [40] и, по крайней мере для вальпроата, показана реализация этой активности через ингибирование сигнального пути Akt/mTOR [47].
Рис. 2.
Актуальный протокол лечения хореи Сиденгама и PANDAS, согласно S. Dean и H. Singer ([46], лицензия Creative Commons Attribution–Noncommerical–No Derivatives License). На схеме приведены суточные дозы лекарственных средств.
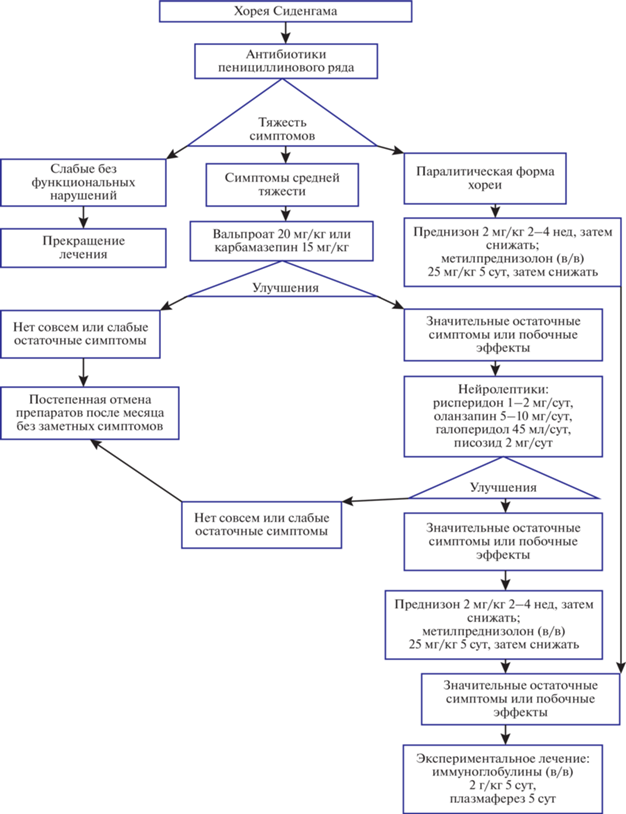
При более тяжелых вариантах ХС, например паралитическом, или в случае хронических и повторяющихся эпизодов, что скорее характерно для PANDAS, препаратами выбора чаще всего становятся глюкокортикоиды. Несмотря на множество описанных побочных эффектов для этого класса препаратов, в случае ХС и PANDAS большинства из них можно избежать за счет достаточно коротких курсов приема. Для этого типа препаратов также показано ингибирование сигнального пути mTOR [48, 49].
Авторы протокола с осторожностью предлагают использовать нейролептики (галоперидол, рисперидон и оланзапин) для симптоматической терапии ХС из-за противоречивых литературных и клинических данных [46]. Возможно, это связано с тяжелыми моторными и каталептическими побочными эффектами галоперидола (в случае атипичных нейролептиков эти побочные эффекты проявляются в меньшей степени), которые, как показано, в некоторой степени объясняются активацией mTOR [50], что может приводить к непредсказуемым результатам терапии нейролептиками у пациентов с аномально активным mTOR.
Внутривенные иммуноглобулины и плазмаферез в анализируемом протоколе представлены последним пунктом, что объясняется как высокой стоимостью процедур, так и возможными побочными эффектами. В случае с иммуноглобулином индукция аутофагии и связанное с этим ингибирование mTOR, видимо, также вносят вклад в позитивный терапевтический эффект процедуры [51].
Еще одним интересным примером работающей для большого процента детей с аутизмом методики можно считать популярный в интернете протокол Немечека (https://www.nemechekconsultativemedicine.com/nemechek-protocol). Основные средства, используемые в этом протоколе, следующие: омега-3-полиненасыщенные жирные кислоты (из рыбьего жира), высокофенольное оливковое масло первого отжима, пребиотик инулин и антибиотик широкого спектра действия рифаксимин для детей старшего возраста. Соглашаясь со всеми оговорками об отсутствии плацебо-контролируемых исследований и рецензируемых публикаций данного протокола, но принимая также во внимание его безопасность и эффективность, замеченную “независимыми наблюдателями” ‒ родителями, можно предположить, что действенность протокола Немечека связана с ингибированием mTOR. Так, при изучении влияния высокофенольного оливкового масла первого отжима на старение выявлена его способность нормализовать гиперактивированный mTOR [52]. В исследованиях влияния омега-3-жирных кислот на предотвращение и замедление онкогенеза показано, что и они служат ингибиторами mTOR и индукторами аутофагии и апоптоза [53, 54]. Как можно заметить, отличительная черта “работающих” протоколов (как протокола против ХС, так и протокола Немечека) ‒ использование, помимо mTOR-ингибиторов, антимикробных и/или микробиомориентированных препаратов. Антимикробных препаратов определенно не требовалось модельным животным, выращенным в стерильных условиях. Возможно, более персонифицированное введение антимикробных лекарственных средств и/или про- и пребиотиков совместно с рапалогами сделало бы терапию этими препаратами более эффективной.
Ацетилцистеин (АЦЦ) в последнее время все чаще рекомендуют не только в качестве муколитического средства при кашле, но и как модулятор поведения. Продемонстрирована эффективность АЦЦ для снижения симптомов ОКР, часто сопровождающего РАС [55], а двойное слепое плацебо-контролируемое исследование подтвердило снижение раздражительности у детей с РАС при применении АЦЦ совместно с рисперидоном [56]. Также в двойном слепом плацебо-контролируемом исследовании продемонстрирована эффективность курса АЦЦ при системной красной волчанке ‒ заболевании, имеющем доказанную аутоиммунную этиологию; причем авторы обосновали механизм действия АЦЦ через ингибирование сигнального пути mTOR [57].
ЗАКЛЮЧЕНИЕ
Исторически психические заболевания в целом и расстройства аутистического спектра в частности диагностировали и классифицировали на основе поведенческих критериев. Биоинформатические и молекулярно-биологические исследования последних лет обосновали необходимость выделения подтипов РАС и других психических расстройств на основе патогенетических механизмов. Один из наиболее важных путей, вовлеченных в патогенез как психоневрологических, так и аутоиммунных заболеваний, ‒ сигнальный путь mTOR. Дальнейшие попытки модулировать этот многостадийный разветвленный сигналинг на разных этапах с помощью природных и фармакологических ингибиторов нацелены на разработку перспективных лекарственных препаратов для механизмобоснованной терапии расстройств аутистического спектра.
Работа поддержана в рамках государственного задания FWNR-2022-0032.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Yoo H. (2015) Genetics of autism spectrum disorder: current status and possible clinical applications. Exp. Neurobiol. 24, 257–272. https://doi.org/10.5607/en.2015.24.4.257
Winden K.D., Ebrahimi-Fakhari D., Sahin M. (2018) Abnormal mTOR activation in autism. Annu. Rev. Neurosci. 41, 1–23. https://doi.org/10.1146/annurev-neuro-080317-061747
Bockaert J., Marin P. (2015) mTOR in brain physiology and pathologies. Physiol. Rev. 95, 1157–1187. https://doi.org/10.1152/physrev.00038.2014
Trifonova E.A, Klimenko A.I., Mustafin Z.S., Lashin S.A., Kochetov A.V. (2019) The mTOR signaling pathway activity and vitamin D availability control the expression of most autism predisposition genes. Int. J. Mol. Sci. 20, E6332. https://doi.org/10.3390/ijms20246332
Zoghbi H.Y., Bear M.F. (2012) Synaptic dysfunction in neurodevelopmental disorders associated with autism and intellectual disabilities. Cold Spring Harb. Perspect. Biol. 4, a009886. https://doi.org/10.1101/cshperspect.a009886
Onore C., Yang H., Van de Water J., Ashwood P. (2017) Dynamic Akt/mTOR signaling in children with autism spectrum disorder. Front. Pediatr. 5, 43. https://doi.org/10.3389/fped.2017.00043
Tylee D.S., Hess J.L., Quinn T.P., Barve R., Huang H., Zhang-James Y., Chang J., Stamova B.S., Sharp F.R., Hertz-Picciotto I., Faraone S.V., Kong S.W., Glatt S.J. (2017) Blood transcriptomic comparison of individuals with and without autism spectrum disorder: a combined-samples mega-analysis. Am. J. Med. Genet. B. Neuropsychiatr. Genet. 174, 181–201. https://doi.org/10.1002/ajmg.b.32511
Jiang H.-Y., Xu L.-L., Shao L., Xia R.M., Yu Z.H., Ling Z.X., Yang F., Deng M., Ruan B. (2016) Maternal infection during pregnancy and risk of autism spectrum disorders: a systematic review and meta-analysis. Brain Behav. Immun. 58, 165–172. https://doi.org/10.1016/j.bbi.2016.06.005
Lee B.K., Magnusson C., Gardner R.M., Blomström Å., Newschaffer C.J., Burstyn I., Karlsson H., Dalman C. (2015) Maternal hospitalization with infection during pregnancy and risk of autism spectrum disorders. Brain Behav. Immun. 44, 100–105. https://doi.org/10.1016/j.bbi.2014.09.001
Lombardo M.V., Moon H.M., Su J., Palmer T.D., Courchesne E., Pramparo T. (2018) Maternal immune activation dysregulation of the fetal brain transcriptome and relevance to the pathophysiology of autism spectrum disorder. Mol. Psychiatry. 23, 1001–1013. https://doi.org/10.1038/mp.2017.15
Ehninger D., Sano Y., de Vries P.J., Dies K., Franz D., Geschwind D.H., Kaur M., Lee Y.S., Li W., Lowe J.K., Nakagawa J.A., Sahin M., Smith K., Whittemore V., Silva A.J. (2012) Gestational immune activation and Tsc2 haploinsufficiency cooperate to disrupt fetal survival and may perturb social behavior in adult mice. Mol. Psychiatry. 17, 62–70. https://doi.org/10.1038/mp.2010.115
Ramirez-Celis A., Becker M., Nuño M., Schauer J., Aghaeepour N., Van de Water J. (2021) Risk assessment analysis for maternal autoantibody-related autism (MAR-ASD): a subtype of autism. Mol. Psychiatry. 26, 1551–1560. https://doi.org/10.1038/s41380-020-00998-8
Trifonova E.A., Mustafin Z.S., Lashin S.A., Kochetov A.V. (2022) Abnormal mTOR activity in pediatric autoimmune neuropsychiatric and MIA-associated autism spectrum disorders. Int. J. Mol. Sci. 23, 967. https://doi.org/10.3390/ijms23020967
Meltzer A., Van de Water J. (2017) The role of the immune system in autism spectrum disorder. Neuropsychopharmacology. 42, 284–298. https://doi.org/10.1038/npp.2016.158
Williams K.A., Swedo S.E. (2015) Post-infectious autoimmune disorders: Sydenham’s chorea, PANDAS and beyond. Brain Res. 1617, 144–154. https://doi.org/10.1016/j.brainres.2014.09.071
True G. (2019) November Clinical Conversation: understanding PANS and PANDAS. In: Aspire. https://aspire.care/news/november-clinical-conversation-understanding-pans-and-pandas/
Swedo S.E., Leonard H.L., Mittleman B.B., Allen A.J., Rapoport J.L., Dow S.P., Kanter M.E., Chapman F., Zabriskie J. (1997) Identification of children with pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections by a marker associated with rheumatic fever. Am. J. Psychiatry. 154, 110–112. https://doi.org/10.1176/ajp.154.1.110
Shimasaki C., Frye R.E., Trifiletti R., Cooperstock M., Kaplan G., Melamed I., Greenberg R., Katz A., Fier E., Kem D., Traver D., Dempsey T., Latimer M.E., Cross A., Dunn J.P., Bentley R., Alvarez K., Reim S., Appleman J. (2020) Evaluation of the Cunningham PanelTM in pediatric autoimmune neuropsychiatric disorder associated with streptococcal infection (PANDAS) and pediatric acute-onset neuropsychiatric syndrome (PANS): changes in antineuronal antibody titers parallel changes in patient symptoms. J. Neuroimmunol. 339, 577138. https://doi.org/10.1016/j.jneuroim.2019.577138
Cunningham M.W. (2012) Streptococcus and rheumatic fever. Curr. Opin. Rheumatol. 24, 408–416. https://doi.org/10.1097/BOR.0b013e32835461d3
Cunningham M.W. (2014) Rheumatic fever, autoimmunity, and molecular mimicry: the streptococcal connection. Int. Rev. Immunol. 33, 314–329. https://doi.org/10.3109/08830185.2014.917411
Gulati P., Gaspers L.D., Dann S.G., Joaquin M., Nobukuni T., Natt F., Kozma S.C., Thomas A.P., Thomas G. (2008) Amino acids activate mTOR complex 1 via Ca2+/CaM signaling to hVps34. Cell Metab. 7, 456–465. https://doi.org/10.1016/j.cmet.2008.03.002
Jing Z., Sui X., Yao J., Xie J., Jiang L., Zhou Y., Pan H., Han W. (2016) SKF-96365 activates cytoprotective autophagy to delay apoptosis in colorectal cancer cells through inhibition of the calcium/CaMKIIγ/AKT-mediated pathway. Cancer Lett. 372, 226–238. https://doi.org/10.1016/j.canlet.2016.01.006
Fan X., Zhou J., Yan X., Bi X., Liang J., Lu S., Luo L., Zhou D., Yin Z. (2021) Citrate activates autophagic death of prostate cancer cells via downregulation CaMKII/AKT/mTOR pathway. Life Sci. 275, 119355. https://doi.org/10.1016/j.lfs.2021.119355
Cheng Y.-L., Kuo C.-F., Lu S.-L., Omori H., Wu Y.N., Hsieh C.L., Noda T., Wu S.R., Anderson R., Lin C.F., Chen C.L., Wu J.J., Lin Y.S. (2019) Group A Streptococcus induces LAPosomes via SLO/β1 integrin/NOX2/ROS pathway in endothelial cells that are ineffective in bacterial killing and suppress xenophagy. mBio. 10, e02148-19. https://doi.org/10.1128/mBio.02148-19
Wang J., Meng M., Li M., Guan X., Liu J., Gao X., Sun Q., Li J., Ma C., Wei L. (2020) Integrin α5β1, as a receptor of fibronectin, binds the FbaA protein of group A Streptococcus to initiate autophagy during infection. mBio. 11, e00771-20. https://doi.org/10.1128/mBio.00771-20
Toh H., Nozawa T., Minowa-Nozawa A., Hikichi M., Nakajima S., Aikawa C., Nakagawa I. (2020) Group A Streptococcus modulates RAB1- and PIK3C3 complex-dependent autophagy. Autophagy. 16, 334–346. https://doi.org/10.1080/15548627.2019.1628539
Shuid A.N., Jayusman P.A., Shuid N., Ismail J., Nor N.K., Mohamed I.N. (2020) Update on atypicalities of central nervous system in autism spectrum disorder. Brain Sci. 10, E309. https://doi.org/10.3390/brainsci10050309
Salter M.W., Stevens B. (2017) Microglia emerge as central players in brain disease. Nat. Med. 23, 1018–1027. https://doi.org/10.1038/nm.4397
Colonna M., Butovsky O. (2017) Microglia function in the central nervous system during health and neurodegeneration. Annu. Rev. Immunol. 35, 441–468. https://doi.org/10.1146/annurev-immunol-051116-052358
Block M.L., Zecca L., Hong J.-S. (2007) Microglia-mediated neurotoxicity: uncovering the molecular mechanisms. Nat. Rev. Neurosci. 8, 57–69. https://doi.org/10.1038/nrn2038
Dong H., Zhang X., Qian Y. (2014) Mast cells and neuroinflammation. Med. Sci. Monit. Basic Res. 20, 200–206. https://doi.org/10.12659/MSMBR.893093
Pardo C.A., Vargas D.L., Zimmerman A.W. (2005) Immunity, neuroglia and neuroinflammation in autism. Int. Rev. Psychiatry. 17, 485–495. https://doi.org/10.1080/02646830500381930
Жмуров В.А., Кручинин Е.В., Жмуров Д.В., Лебедев И.А., Пышнов А.С., Ахметьянов М.А., Кузнецов В.В., Козлов М.В., Мокин Е.А., Алекберов Р.И., Тяпкин А.В., Сметанин Е.И., Сейпилов А.А., Тарасов М.Ю. (2020) Молекулярные механизмы развития синаптического прунинга. Уральский медицинский журнал. 1(184), 58‒63. https://doi.org/10.25694/URMJ.2020.01.11.
Sakai J. (2020) How synaptic pruning shapes neural wiring during development and, possibly, in disease. Proc. Natl. Acad. Sci. USA. 117, 16096–16099. https://doi.org/10.1073/pnas.2010281117
Eltokhi A., Janmaat I.E., Genedi M., Haarman B.C.M., Sommer I.E.C. (2020) Dysregulation of synaptic pruning as a possible link between intestinal microbiota dysbiosis and neuropsychiatric disorders. J. Neurosci. Res. 98, 1335–1369. https://doi.org/10.1002/jnr.24616
Liu Y., Zhang D., Liu X. (2015) mTOR signaling in T cell immunity and autoimmunity. Int. Rev. Immunol. 34, 50–66. https://doi.org/10.3109/08830185.2014.933957
Delgoffe G.M., Pollizzi K.N., Waickman A.T., Heikamp E., Meyers D.J., Horton M.R., Xiao B., Worley P.F., Powell J.D. (2011) The kinase mTOR regulates the differentiation of helper T cells through the selective activation of signaling by mTORC1 and mTORC2. Nat. Immunol. 12, 295–303. https://doi.org/10.1038/ni.2005
Ortiz-González X.R. (2021) Mitochondrial dysfunction: a common denominator in neurodevelopmental disorders? Dev. Neurosci. 43, 222–229. https://doi.org/10.1159/000517870
Lenzi P., Ferese R., Biagioni F., Fulceri F., Busceti C.L., Falleni A., Gambardella S., Frati A., Fornai F. (2021) Rapamycin ameliorates defects in mitochondrial fission and mitophagy in glioblastoma cells. Int. J. Mol. Sci. 22, 5379. https://doi.org/10.3390/ijms22105379
Thellung S., Corsaro A., Nizzari M., Barbieri F., Florio T. (2019) Autophagy activator drugs: a new opportunity in neuroprotection from misfolded protein toxicity. Int. J. Mol. Sci. 20, E901. https://doi.org/10.3390/ijms20040901
Ehninger D., Han S., Shilyansky C., Zhou Y., Li W., Kwiatkowski D.J., Ramesh V., Silva A.J. (2008) Reversal of learning deficits in a Tsc2+/‒ mouse model of tuberous sclerosis. Nat. Med. 14, 843–848. https://doi.org/10.1038/nm1788
Mizuguchi M., Ikeda H., Kagitani-Shimono K., Yoshinaga H., Suzuki Y., Aoki M., Endo M., Yonemura M., Kubota M. (2019) Everolimus for epilepsy and autism spectrum disorder in tuberous sclerosis complex: EXIST-3 substudy in Japan. Brain Dev. 41, 1–10. https://doi.org/10.1016/j.braindev.2018.07.003
Overwater I.E., Rietman A.B., Mous S.E., Bindels-de Heus K., Rizopoulos D., Ten Hoopen L.W., van der Vaart T., Jansen F.E., Elgersma Y., Moll H.A., de Wit M.Y. (2019) A randomized controlled trial with everolimus for IQ and autism in tuberous sclerosis complex. Neurology. 93, e200–e209. https://doi.org/10.1212/WNL.0000000000007749
Hu L.-Y., Shi X.-Y., Yang X.-F., Liu M.J., Zou L.P. (2021) Rapamycin/Sirolimus improves the behavior of an 8-year-old boy with nonsyndromic autism spectrum disorder. Am. J. Ther. 28, e608. https://doi.org/10.1097/MJT.0000000000001131
Hwang S.-K., Lee J.-H., Yang J.-E., Lim C.S., Lee J.A., Lee Y.S., Lee K., Kaang B.K. (2016) Everolimus improves neuropsychiatric symptoms in a patient with tuberous sclerosis carrying a novel TSC2 mutation. Mol. Brain. 9, 56. https://doi.org/10.1186/s13041-016-0222-6
Dean S.L., Singer H.S. (2017) Treatment of Sydenham’s chorea: a review of the current evidence. Tremor Other Hyperkinet. Mov. (N.Y.). 7, 456. https://doi.org/10.7916/D8W95GJ2
Han W., Yu F., Cao J., Dong B., Guan W., Shi J. (2020) Valproic acid enhanced apoptosis by promoting autophagy via Akt/mTOR signaling in glioma. Cell Transplant. 29, 963689720981878. https://doi.org/10.1177/0963689720981878
Weichhart T., Haidinger M., Katholnig K., Kopecky C., Poglitsch M., Lassnig C., Rosner M., Zlabinger G.J., Hengstschläger M., Müller M., Hörl W.H., Säemann M.D. (2011) Inhibition of mTOR blocks the anti-inflammatory effects of glucocorticoids in myeloid immune cells. Blood. 117, 4273–4283. https://doi.org/10.1182/blood-2010-09-310888
Fu L., Wu W., Sun X., Zhang P. (2020) Glucocorticoids enhanced osteoclast autophagy through the PI3K/Akt/mTOR signaling pathway. Calcif. Tissue Int. 107, 60–71. https://doi.org/10.1007/s00223-020-00687-2
Ramírez-Jarquín U.N., Shahani N., Pryor W., Usiello A., Subramaniam S. (2020) The mammalian target of rapamycin (mTOR) kinase mediates haloperidol-induced cataleptic behavior. Transl. Psychiatry. 10, 336. https://doi.org/10.1038/s41398-020-01014-x
Das M., Karnam A., Stephen-Victor E., Gilardin L., Bhatt B., Kumar Sharma V., Rambabu N., Patil V., Lecerf M., Käsermann F., Bruneval P., Narayanaswamy Balaji K., Benveniste O., Kaveri S.V., Bayry J. (2020) Intravenous immunoglobulin mediates anti-inflammatory effects in peripheral blood mononuclear cells by inducing autophagy. Cell Death Dis. 11, 50. https://doi.org/10.1038/s41419-020-2249-y
Menendez J.A., Joven J., Aragonès G., Barrajón-Catalán E., Beltrán-Debón R., Borrás-Linares I., Camps J., Corominas-Faja B., Cufí S., Fernández-Arroyo S, Garcia-Heredia A., Hernández-Aguilera A., Herranz-López M., Jiménez-Sánchez C., López-Bonet E., Lozano-Sánchez J., Luciano-Mateo F., Martin-Castillo B., Martin-Paredero V., Pérez-Sánchez A., Oliveras-Ferraros C., Riera-Borrull M., Rodríguez-Gallego E., Quirantes-Piné R., Rull A., Tomás-Menor L., Vazquez-Martin A., Alonso-Villaverde C., Micol V., Segura-Carretero A. (2013) Xenohormetic and anti-aging activity of secoiridoid polyphenols present in extra virgin olive oil. Cell Cycle. 12, 555–578. https://doi.org/10.4161/cc.23756
Chen Z., Zhang Y., Jia C., Wang Y., Lai P., Zhou X., Wang Y., Song Q., Lin J., Ren Z., Gao Q., Zhao Z., Zheng H., Wan Z., Gao T., Zhao A., Dai Y., Bai X. (2014) mTORC1/2 targeted by n-3 polyunsaturated fatty acids in the prevention of mammary tumorigenesis and tumor progression. Oncogene. 33, 4548–4557. https://doi.org/10.1038/onc.2013.402
Liu J., Xu M., Zhao Y., Ao C., Wu Y., Chen Z., Wang B., Bai X., Li M., Hu W. (2016) n-3 polyunsaturated fatty acids abrogate mTORC1/2 signaling and inhibit adrenocortical carcinoma growth in vitro and in vivo. Oncol. Rep. 35, 3514–3522. https://doi.org/10.3892/or.2016.4720
di Michele F., Siracusano A., Talamo A., Niolu C. (2018) N-acetyl cysteine and vitamin D supplementation in treatment resistant obsessive-compulsive disorder patients: a general review. Curr. Pharm. Des. 24, 1832–1838. https://doi.org/10.2174/1381612824666180417124919
Nikoo M., Radnia H., Farokhnia M., Mohammadi M.R., Akhondzadeh S. (2015) N-acetylcysteine as an adjunctive therapy to risperidone for treatment of irritability in autism: a randomized, double-blind, placebo-controlled clinical trial of efficacy and safety. Clin. Neuropharmacol. 38, 11–17. https://doi.org/10.1097/WNF.0000000000000063
Lai Z.-W., Hanczko R., Bonilla E., Caza T.N., Clair B., Bartos A., Miklossy G., Jimah J., Doherty E., Tily H., Francis L., Garcia R., Dawood M., Yu J., Ramos I., Coman I., Faraone S.V., Phillips P.E., Perl A. (2012) N-acetylcysteine reduces disease activity by blocking mammalian target of rapamycin in T cells from systemic lupus erythematosus patients: a randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 64, 2937–2946. https://doi.org/10.1002/art.34502
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


