Молекулярная биология, 2023, T. 57, № 2, стр. 220-231
Влияние производного усниновой кислоты (ингибитора тирозил-ДНК-фосфодиэстеразы 1) на трансплантированные опухоли in vivo в качестве монотерапии и в сочетании с олапарибом
Т. Е. Корниенко a, А. Л. Захаренко a, Е. С. Ильина a, d, А. А. Чепанова a, О. Д. Захарова a, Н. С. Дырхеева a, Н. А. Попова b, d, В. П. Николин b, А. С. Филимонов c, О. А. Лузина c, Н. Ф. Салахутдинов c, d, О. И. Лаврик c, d, *
a Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
c Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
d Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, Россия
* E-mail: lavrik@niboch.nsc.ru
Поступила в редакцию 29.07.2022
После доработки 25.08.2022
Принята к публикации 25.08.2022
- EDN: EFXISX
- DOI: 10.31857/S0026898423020143
Аннотация
Тирозил-ДНК-фосфодиэстераза 1 (Tdp1) удаляет различные аддукты с 3'-конца ДНК, которые образуются под действием ферментов (например, топоизомеразы 1), вносящих в процессе катализа одноцепочечные разрывы в ДНК, а также ряда противоопухолевых препаратов с различным механизмом действия. Поли(ADP-рибоза)полимераза 1 (PARP1) катализирует посттрансляционную модификацию различных мишеней (PARилирование) и с помощью этих модификаций управляет множеством процессов в клетке, включая репарацию ДНК. Мишенью PARP1 является в том числе Tdp1, PARилирование которой привлекает Tdp1 к месту повреждения. PARилированию и тем самым репарации ДНК препятствует олапариб – ингибитор PARP1, используемый в терапии опухолей с дефицитом гомологичной рекомбинации. В настоящей работе нами изучена возможность повышения противоопухолевого эффекта олапариба при использовании его в комбинации с ингибитором Tdp1 OL7-43. Обнаружено повышение цитотоксичности олапариба в присутствии OL7-43 in vitro, при этом не выявлен сенсибилизирующий эффект OL7-43 в моделях карциномы Льюис и карциномы Кребс-2, но показан собственный противоопухолевый и антиметастатический эффект OL7-43.
ВВЕДЕНИЕ
Онкологические заболевания считаются одной из основных причин смертности. По данным ВОЗ ежегодно в мире регистрируется не менее 12 млн новых случаев опухолевых заболеваний. Разработаны различные методы терапии опухолей, такие как радиационная, химическая, таргетная, корригирующая генная, циторедуктивная генная, иммунная терапия [1], однако существуют и многочисленные проблемы, которые еще не имеют оптимального решения, например, метастазирование, тяжелые побочные эффекты и приобретение опухолевыми клетками резистентности к терапии. На сегодняшний день основными методами остаются радиационная терапия и химиотерапия, направленные на повреждение ДНК злокачественных клеток. Результат таких воздействий зависит, в том числе, от эффективности работы систем репарации ДНК, которые зачастую успешно удаляют повреждения, что препятствует действию применяемых препаратов и методов лечения, и считаются одним из ключевых механизмов лекарственной резистентности опухоли. В связи с этим ферменты – участники и регуляторы систем репарации ДНК – становятся многообещающими мишенями в терапии онкологических заболеваний. К таким мишеням, в частности, относятся регулятор системы репарации ДНК поли(ADP-рибоза)полимераза 1 (PARP1), а также тирозил-ДНК-фосфодиэстераза 1 (Tdp1) [2, 3].
Tdp1 – один из ключевых ферментов репарации ДНК – играет важную роль в устранении повреждений ДНК, вызванных эндогенными (возникают в ходе нормального или патологического жизненного цикла клетки) и экзогенными (вызванными, например, противоопухолевыми препаратами, такими как топотекан, иринотекан и др.) факторами [4, 5]. Tdp1 участвует в восстановлении стабилизированных ковалентных комплексов Top1-ДНК (Top1cc, Top1 cleavage complex), гидролизуя фосфодиэфирную связь между остатком каталитического тирозина топоизомеразы 1 (Top1) и 3′-фосфатом ДНК в одноцепочечном разрыве, генерируемом Top1. Tdp1 также катализирует расщепление фосфодиэфирных связей в других аддуктах ДНК-белок и устраняет ряд различных повреждений на 3'-конце ДНК [6]. Следовательно, активность Tdp1 можно рассматривать как возможную причину резистентности опухолей к широко используемым в клинике препаратам.
PARP1 – фермент, участвующий в регуляции различных процессов, включая поддержание стабильности генома, регуляцию клеточного цикла, апоптоз. PARP1 действует как первичный сенсор разрывов в ДНК, который обеспечивает выбор пути репарации, катализируя синтез поли(ADP-рибозы) (PAR) и присоединение этого полимера к белку или к ДНК (PARилирование, или парилирование) [7, 8]. Олапариб – это препарат, разрешенный к применению при различных видах рака с мутацией BRCA1/2. Механизм действия олапариба основан на ингибировании синтеза PAR и, соответственно, на блокировании ответа на повреждение ДНК [9]: он подавляет опухолевый рост при применении в качестве монотерапии и в сочетании с традиционными химиотерапевтическими препаратами.
Известно, что парилирование усиливает рекрутирование Tdp1 в места повреждения ДНК, не влияя на каталитическую активность [10]. PARP1 стимулирует ферментативную активность Tdp1 на AP-сайтах [11]. По некоторым данным, парилирование комплекса Top1cc необходимо для протеолитической деградации белковой глобулы Тор1 в составе этого комплекса непротеасомной протеазой SPRTN и обеспечения доступа Tdp1 к месту повреждения [12]. По другим данным, парилирование Top1cc мешает протеолизу этого комплекса протеазой 26S [13], следовательно, подавление активности PARP1 должно способствовать более быстрому и/или более эффективному расщеплению Top1cc. Таким образом, комбинированное применение ингибиторов PARP1 и Tdp1 может быть многообещающей терапевтической стратегией при различных видах рака.
Ранее мы обнаружили эффективный ингибитор Tdp1, синтезированный на основе вторичного метаболита лишайников – (+)-усниновой кислоты (УК) (рис. 1, слева), с химическими модификациями колец А и С, OL7-43 (лабораторный шифр, рис. 1, справа) [14]. Сама (+)-усниновая кислота довольно токсична для перевиваемых клеточных линий (полутоксическая концентрация 17–45 мкМ) [15]. Модификации ее структуры, разработанные нашей командой, обеспечивают снижение токсичности и эффективное связывание с активным центром Tdp1 [14]. Введение цианогрупп, присоединенных через длинные алифатические линкеры, предположительно обеспечивает связывание с ферментом, а введение пиразольного цикла снижает токсичность соединения в отношении клеток линии MCF-7 (рак молочной железы) по сравнению с исходной (+)-усниновой кислотой (токсичность соединения OL7-43 отсутствует во всем диапазоне изученных концентраций до 100 мкм).
Рис. 1.
Структура (+)-усниновой кислоты (слева) и ее производного OL7-43 (справа). Буквами А и С обозначены бензольные кольца, подвергнутые модификации.
Результаты скрининга ингибирующей активности этого соединения в отношении очищенного рекомбинантного Tdp1 позволяют отметить, что оно обладает высокой ингибирующей активностью (IC50 = 2.9 ± 0.8 мкм) [14].
Ранее мы обнаружили сенсибилизирующий эффект производных усниновой кислоты другой структуры в комбинации с топотеканом на карциномах Льюис и/или Кребс-2 [16–19]. В настоящей работе изучен противоопухолевый и другие эффекты производного (+)-усниновой кислоты OL7-43, олапариба и их комбинации на этих же экспериментальных моделях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Препараты и реагенты. Эксперименты проводили с использованием следующих реагентов: олапариба (“Santa Cruz Biotechnology”, США); диметилсульфоксида (ДМСО) (“Sigma”, США); Tween-80 (“Panreac”, Испания); 0.9%-ого физиологического раствора Буфус (Производственная фармацевтическая компания “Обновление”, Новосибирск, Россия); 3%-ной лимонной кислоты (“ХИММЕД”, Россия); 10%-ого формалина (“БиоВитрум”, Россия). Производное усниновой кислоты OL7-43 (ингибитор Tdp1) синтезирован по методике, описанной в работе [14].
Исследование цитотоксичности соединений в отношении перевиваемых клеточных линий. Цитотоксичность олапариба, соединения OL7-43 и их комбинации изучали с использованием клеток линий MCF-7 (рак молочной железы), HeLa (рак шейки матки) и T98G (глиобластома) с помощью колориметрического теста EZ4U (“Biomedica”, Австрия). Клетки приобретены в Центре коллективного пользования “Коллекция культур клеток позвоночных” (Санкт-Петербург, Россия). Клетки выращивали в среде DMEM/F12 (“Gibco”, “Thermo Fisher Scientific”, США) в присутствии ×1 GlutaMAX (“Gibco”, “Thermo Fisher Scientific”), 50 ед./мл пенициллина, 50 мкг/мл стрептомицина (“MP Biomedicals”, США), 10% эмбриональной бычьей сыворотки (“Биолот”, Россия) в атмосфере 5% СО2. После формирования 30–50% монослоя в среду добавляли исследуемые соединения или 1% ДМСО (растворитель) и проводили тест EZ4U через 72 ч согласно протоколу производителя с использованием флуориметра CLARIOstar (“BMG LABTECH”, GmbH, Германия). Данные обрабатывали с помощью встроенного программного обеспечения MARS Data Analysis 2.0 (“BMG LABTECH”). Графики зависимости выживаемости клеток от концентрации соединений строили в программе OriginPro 8.6.0 (“OriginLab”, США).
Лабораторные животные и модели опухолей. В исследованиях мы использовали самок мышей линии C57BL массой ~19–21 г. Животных содержали в пластиковых клетках на подстилках из опилок со свободным доступом к воде и корму. Содержание и обращение с мышами соответствовало международным правилам проведения экспериментов на животных (Директива Европейского сообщества (86/609 EEC)).
В качестве экспериментальных моделей опухолей использовали карциному легких Льюис (LLC) и асцитную форму карциномы Кребс-2. Эти перевиваемые опухоли, полученные из хранилища клеток ИЦиГ СО РАН (Новосибирск, Россия), поддерживаются у мышей в виде трансплантированных опухолей. Мышиная модель LLC является наиболее широко используемой моделью рака легкого, которая поддерживает высокую туморогенность и метастазирование в легкие мышей C57BL. Перед трансплантацией опухолевую ткань измельчали и ресуспендировали в 0.9%-ном растворе NaCl. Опухолевые клетки прививали внутримышечно в правое бедро (объем 0.1 мл, 800 000 опухолевых клеток на мышь); в месте введения формировался первичный опухолевый узел.
Линейно-неспецифическую опухоль Кребс-2 в асцитной форме трансплантировали мышам линии C57BL. Перед трансплантацией опухолевые клетки суспендировали в 0.9%-ном растворе NaCl и вводили внутрибрюшинно (0.2 мл, 2 млн опухолевых клеток на мышь). При внутрибрюшинной прививке образуется асцитная форма опухоли, слабо иммуногенная и не дающая метастазов.
Противоопухолевое действие соединения OL7-43 в монорежиме и в сочетании с олапарибом на модели асцитной карциномы Кребс-2. После прививки опухоли животных разделяли произвольным образом на пять групп по шесть особей в каждой. Все препараты вводили на четвертый день после трансплантации опухоли (внутрибрюшинно однократно в объеме 0.2 мл, этот способ введения обеспечивает препаратам доступ непосредственно к опухолевым клеткам, что позволяет оценить их собственный противоопухолевый эффект). Каждая группа мышей, кроме контрольной, получала по две инъекции (в одной олапариб или растворитель, в другой ингибитор Tdp1 или растворитель):
• группа 1 – интактный контроль – мышам этой группы привили опухоль, но лекарства не вводили;
• группа 2 – мышам ввели 4% ДМСО + 10% Tween-80 (растворитель для олапариба) и 15% ДМСО + 10% Tween-80 (растворитель для OL7-43);
• группа 3– мышам вводили олапариб в разовой дозе 25 мг/кг в виде суспензии в 4% ДМСО + + 10% Tween-80 и 15% ДМСО + 10% Tween-80;
• группа 4 – мышам ввели олапариб в разовой дозе 25 мг/кг и OL7-43 в разовой дозе 50 мг/кг в виде суспензии в 15% ДМСО + 10% Tween-80;
• группа 5 – мышам вводили OL7-43 в разовой дозе 50 мг/кг и 4% ДМСО + 10% Tween-80.
Действие препаратов оценивали в конце эксперимента по массе асцитной опухоли, по концентрации опухолевых клеток в асцитической жидкости (клетки подсчитывали в камере Горяева), индексам массы печени и селезенки.
Приготовление образца для подсчета опухолевых клеток в камере Горяева: к 10 мкл асцита добавляли 400 мкл физиологического раствора 0.9% (разведение в 40 раз). Подсчет осуществляли при малом увеличении в пяти больших квадратах, разделенных на 16 малых (общее количество 80).
Противоопухолевое антиметастатическое действие соединения OL7-43 в монорежиме и в сочетании с олапарибом на модели карциномы легкого Льюис, а также влияние препаратов на формулу крови. Предварительно животных разделили случайным образом на пять групп по семь особей в каждой, группы были сформированы таким же образом, как в эксперименте с моделью опухоли Кребс-2. Препараты вводили однократно внутрибрюшинно в объеме 0.2 мл на 13-й день после трансплантации опухоли.
Оценка токсического действия препаратов основывалась на изменении массы тела мышей в ходе эксперимента (взвешивания проводили на 13, 15, 18, 20, 22 и 25 день после трансплантации) и в конце эксперимента по индексам массы печени и селезенки. Противоопухолевое действие оценивали по росту первичных опухолевых узлов (измерения проводили одновременно с взвешиванием) и по количеству метастазов в легких всех животных после фиксации в 10%-ном формалине (подсчет осуществляли под микроскопом MBI-3 (“ЛОМО”, СССР) при трехкратном увеличении. Также дополнительно подсчитывали количество лейкоцитов и эритроцитов крови в камере Горяева. Кроме того, выполняли микроскопический анализ мазка крови и подсчет лейкоцитарной формулы с помощью биологического исследовательского микроскопа БИОСКОП-1 (“ЛОМО-МА”, Санкт-Петербург, Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сенсибилизация цитотоксического действия олапариба соединением OL7-43 in vitro
Как уже упоминалось, соединение OL7-43 нетоксично для клеток MCF-7 во всем исследованном диапазоне концентраций (до 100 мкМ, соединение III в работе [14]). Мы также изучили цитотоксичность этого соединения для клеток HeLa (карцинома шейки матки) и T98G (глиобластома) и обнаружили, что в концентрации до 50 мкМ оно не влияет на выживаемость клеток (рис. S1 , см. Дополнительные материалы на сайте http:// www.molecbio.ru/downloads/2023/2/supp_Kornienko_ rus.pdf). Далее мы изучили влияние этого соединения на цитотоксичность олапариба в отношении перевиваемых клеток и обнаружили, что соединение OL7-43 в нетоксичной концентрации 20 мкМ усиливает цитотоксический эффект олапариба на всех трех клеточных линиях (рис. 2). Следует отметить, что усиление цитотоксического эффекта топотекана было заметным на клетках линии HeLa и незначительным на клетках MCF-7 и T98G.
Противоопухолевое действие OL7-43 в монорежиме и в сочетании с олапарибом на модели асцитной карциномы Кребс-2
Введение только олапариба привело к незначительному снижению массы опухоли Кребс-2 (рис. 3) и концентрации опухолевых клеток в асците (рис. 4) по сравнению с контрольной группой (без введения препаратов) и с группой, которой вводили ДМСО. Сочетанное применение олапариба и ингибитора Tdp1 незначительно снизило массу опухоли (рис. 3) и концентрацию опухолевых клеток в асците (рис. 4) по сравнению с контрольной группой (без лечения), группой, которой вводили ДМСО, и группой, получившей олапариб в качестве монотерапии, но различия были статистически недостоверными. Масса асцитной опухоли в данной группе по сравнению с группой, которой вводили только OL7-43, снизилась аддитивно.
Рис. 3.
Средняя масса асцитной опухоли Кребс-2 (разница в массе мыши с опухолью в брюшной полости и после удаления опухоли) после терапии олапарибом (Ola, 25 мг/кг), OL7-43 (50 мг/кг) и их комбинацией.
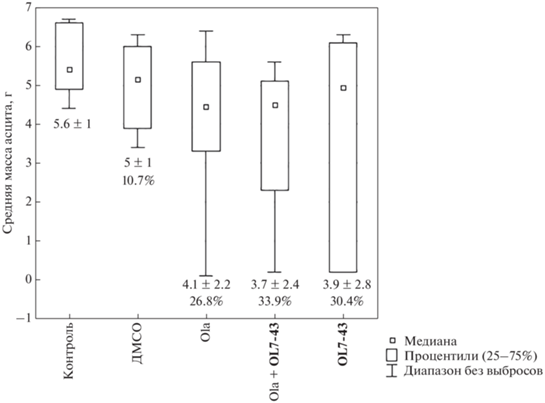
Рис. 4.
Концентрация опухолевых клеток в асцитической жидкости после терапии олапарибом (Ola, 25 мг/кг), OL7-43 (50 мг/кг) и их комбинацией.

Для проверки общей токсичности исследуемых соединений и их комбинации по окончании эксперимента извлекали и взвешивали печень. На основе полученных данных рассчитывали индекс этих органов. Органные индексы рассчитывали как отношение массы органа к массе тела мыши (с опухолью). Изменение относительного веса печени (как в сторону увеличения, так и в сторону уменьшения) может свидетельствовать о токсическом влиянии соединений. Масса печени незначительно изменялась, однако в группах, получавших ингибитор Tdp1 – OL7-43, отмечено недостоверное увеличение печени (табл. S1 , см. Дополнительные материалы на сайте http:// www.molecbio.ru/downloads/2023/2/supp_Kornienko_ rus.pdf). Индекс печени также не менялся (табл. S1 ), что указывает на отсутствие острого токсического действия олапариба, соединения OL7-43 и их комбинации на организм животных.
При лечении ингибитором Tdp1 наблюдалось недостоверное снижение массы асцита (рис. 3) и концентрации опухолевых клеток в асцитической жидкости (рис. 4) по сравнению со всеми группами.
Таким образом, соединение OL7-43 нетоксично для экспериментальных животных и обладает собственной противоопухолевой активностью в отношении асцитной карциномы Кребс-2, на что указывает снижение концентрации опухолевых клеток в асците. Синергический эффект этого соединения, показанный нами in vitro на клеточных линиях, в эксперименте in vivo не выявлен.
Противоопухолевое и антиметастатическое действие OL7-43 в монорежиме и в сочетании с олапарибом на модели карциномы легкого Льюис
Введение одного олапариба не привело к снижению массы первичного опухолевого узла (рис. 5) и не уменьшило число метастазов в легких мышей (рис. 6) по сравнению с контрольной группой (без введения препаратов) и с группой, которой вводили ДМСО. Применение соединения OL7-43 в комбинации с олапарибом незначительно снижало массу опухоли, но не оказывало влияния на процесс метастазирования.
Рис. 5.
Средняя масса первичного опухолевого узла. Цифры под ящичками обозначают среднее значение ± стандартное отклонение (верхняя строчка) и значения коэффициента торможения роста опухоли (ТРО, %) (нижняя строчка).

Рис. 6.
Среднее число метастазов в легких мышей. Звездочкой отмечено статистически значимое различие между группами (р < 0.05). Цифры над ящичками обозначают среднее значение ± стандартное отклонение.
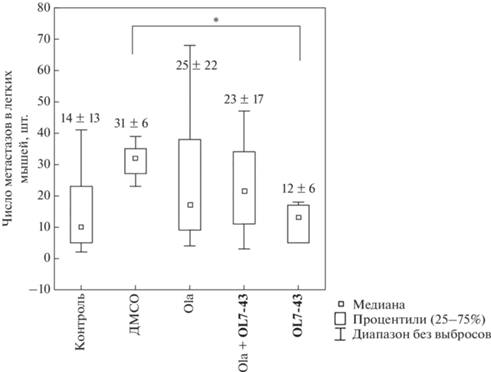
Соединение OL7-43 в монорежиме более эффективно снижало как среднюю массу первичного опухолевого узла, так и число метастазов в легких мышей (количество метастазов под действием OL7-43 снизилось статистически значимо по сравнению с группой мышей, которым ввели ДМСО) (рис. 5, 6). Также для всех групп рассчитывали коэффициент торможения роста опухоли (ТРО, %), данные представлены на рис. 5.
Слабый эффект терапии изучаемыми соединениями (олапариб, OL7-43 и их комбинация), возможно, связан с выбором режима дозирования, лекарственной формы и/или моделью опухоли.
Токсичность олапариба, соединения OL7-43 и их комбинации
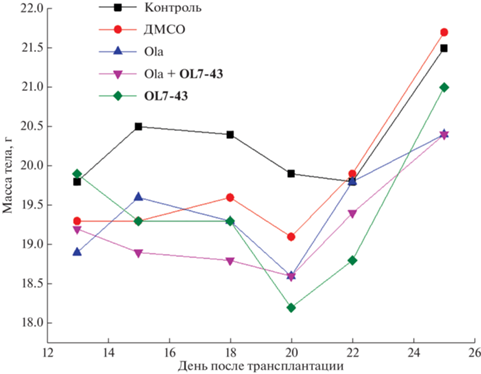
Токсичность препаратов и их комбинации мы оценивали по изменению массы тела мышей с 13‑ого по 25-й день после трансплантации опухоли (т.е. со дня лечения). Выявлена тенденция к увеличению массы животных, что говорит об отсутствии острой токсичности исследуемых соединений (рис. 7).
Рис. 7.
Динамика изменений массы тела мышей под действием соединения OL7-43 и его комбинации с олапарибом (Ola).
Кроме того, по окончании эксперимента мы извлекали и взвешивали печень и селезенку, рассчитывали индексы печени и селезенки. Значимых изменений массы печени и селезенки не наблюдали (табл. S2 , см. Дополнительные материалы на сайте http://www.molecbio.ru/downloads/ 2023/2/supp_Kornienko_rus.pdf). Отмечено, что терапия олапарибом, OL7-43 и их комбинацией в указанных дозах не вызывала острого токсического эффекта.
Таким образом, соединение OL7-43 не оказывает острого токсического действия на внутренние органы мышей и обладает собственной противоопухолевой активностью в отношении карциномы легких Льюис, на что указывает снижение числа метастазов в легких и массы первичного опухолевого узла. Синергический эффект в отношении олапариба у данного соединения не выявлен.
Влияние изучаемых препаратов на периферическую кровь мышей с карциномой легких Льюис
У мышей с карциномой легких Льюис число эритроцитов в периферической крови значительно снижается [20], а количество лейкоцитов увеличивается [21]. Увеличение числа лейкоцитов в периферической крови связано с воспалительным процессом, вызванным некрозом, который возникает в процессе формирования и роста опухолевого узла.
Применение олапариба в монорежиме увеличивает концентрацию эритроцитов в крови на 14% по сравнению с контрольной группой без лечения и на 10% по сравнению с группой, которой вводили ДМСО (табл. 1, рис. 8).
Таблица 1.
Влияние OL7-43 и его комбинации с олапарибом на лейкоцитарную формулу крови мышей
| Показатель | Норма | Контроль – опухоль без лечения | Опухоль + ДМСО | Опухоль + олапариб |
Опухоль + олапариб + OL7-43 |
Опухоль + OL7-43 |
|---|---|---|---|---|---|---|
| Эритроциты, млн/мл | 8.0–9.0 | 6.5 ± 0.6 | 6.7 ± 0.8 | 7.4 ± 0.5 | 7.9 ± 0.5 | 8.1 ± 0.3 |
| Лейкоциты, т./мл | 5.4–10.0 | 13 ± 1 | 11 ± 1 | 11 ± 1 | 9 ± 1 | 8 ± 1 |
| Лимфоциты, % | 55.0–63.0 | 44 ± 5 | 44 ± 5 | 50 ± 3 | 53 ± 3* | 56 ± 4* |
| Моноциты, % | 0.5–2.0 | 3 ± 1 | 1.1 ± 0.8 | 1.4 ± 1* | 2 ± 1* | 1.0 ± 0.6 |
| Базофилы, % | 0.0–0.5 | 0.2 ± 0.4 | 0 | 0.1 ± 0.2 | 0.1 ± 0.2 | 0 |
| Эозинофилы, % | 0.0–1.0 | 2 ± 1 | 1 ± 1 | 1 ± 1 | 1 ± 1 | 1 ± 1 |
| Нейтрофилы п/я, % | 1.0–5.0 | 5 ± 3 | 4 ± 2 | 3 ± 1 | 3 ± 1 | 3 ± 1 |
| Нейтрофилы с/я, % | 34.0–39.0 | 45 ± 7 | 50 ± 7 | 45 ± 4 | 41 ± 4 | 39 ± 5 |
Рис. 8.
Влияние соединения олапариба (Ola) в разовой дозе 25 мг/кг, OL7-43 в разовой дозе 50 мг/кг и их комбинации на концентрацию эритроцитов.

Сочетанное применение олапариба и OL7-43 привело к увеличению концентрации эритроцитов по сравнению с группами, которым вводили ДМСО (на 18%) и олапариб (незначительно). Применение только соединения OL7-43 привело к увеличению числа эритроцитов на 25% по сравнению с контролем без лечения и на 21% по сравнению с контролем с ДМСО, возвращая число эритроцитов к норме (здоровые мыши без лечения).
Введение олапариба снизило на 18% концентрацию лейкоцитов по сравнению с контролем без лечения и не изменило ее по сравнению с контролем с ДМСО. Комбинированная терапия снизила число лейкоцитов на 44% по сравнению с отсутствием лечения и на 22% по сравнению с применением растворителя и олапариба по отдельности. Соединение OL7-43 более эффективно снижало концентрацию лейкоцитов, чем остальные препараты или их комбинации (рис. 9, табл. 1), также приводя число лейкоцитов к нормальным значениям.
Рис. 9.
Влияние соединения олапариба (Ola) в разовой дозе 25 мг/кг, OL7-43 в разовой дозе 50 мг/кг и их комбинации на концентрацию лейкоцитов.
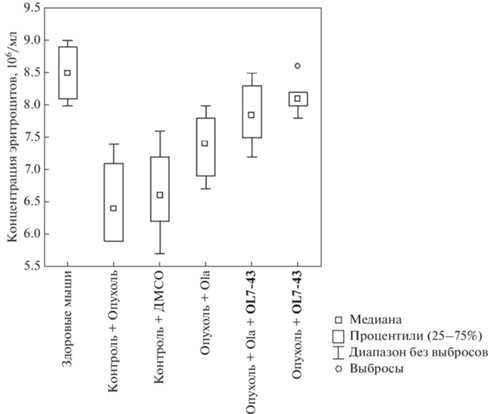
Введение олапариба, OL7-43 и их комбинации приводит к восстановлению показателей белой и красной крови, т.е. к нормализации гемопоэза (рис. 8, 9). За норму приняли показатели крови здоровых мышей без опухоли, не получавших никаких препаратов. Результаты подсчета лейкоцитарных формул периферической крови мышей представлены в табл. 1.
Применение олапариба в монорежиме увеличило число лимфоцитов по сравнению с контрольной группой (без лечения) и особями, которым вводили ДМСО.
Сочетанное применение олапариба и OL7-43 привело к статистически значимому увеличению числа лимфоцитов по сравнению с контрольной группой (опухоли без лечения) и особями, которым вводили ДМСО. Введение только OL7-43 приводило к еще большему увеличению числа лимфоцитов по сравнению с комбинацией препаратов и, как и в случае эритроцитов, возвращало этот показатель к норме (табл. 1).
Содержание моноцитов, эозинофилов и нейтрофилов при терапии только олапарибом было статистически значимо ниже, чем в контроле без лечения и незначительно повышено по сравнению с группами, которым вводили комбинацию олапариба с OL7-43 и собственно OL7-43 в монорежиме (табл. 1).
Терапия олапарибом, OL7-43 и их комбинацией в указанных дозах не привела к развитию гематологических осложнений.
Таким образом, в экспериментах in vitro на клеточных линиях MCF-7, HeLa и T98G производное усниновой кислоты OL7-43 – ингибитор Tdp1 – в дозе 50 мкM не оказывал токсического действия на клетки, однако даже в меньшей дозе (20 мкM) OL7-43 усиливал цитотоксический эффект олапариба при совместном с ним воздействии.
Исследование в системе in vivo, проведенное на мышах с асцитной опухолью Кребс-2 и карциномой легких Льюис, показало, что на клетках этих опухолей проявилось непосредственное цитотоксическое действие OL7-43, но при этом не наблюдалось статистически значимой способности сенсибилизировать опухоль in vivo к действию олапариба.
Олапариб слабо влияет на показатели белой и красной крови. Введение OL7-43 или его комбинации с олапарибом нормализует гемопоэз (по окончании эксперимента процентное соотношение различных видов лейкоцитов, определенное путем подсчета в окрашенном мазке крови, соответствовало норме либо было максимально близким к ней).
Учитывая противоопухолевую активность OL7-43, обнаруженную на двух перевиваемых линиях опухолей мышей, при отсутствии общетоксического действия на организм животных и нормализации гемопоэза, можно заключить, что соединение OL7-43, может представлять интерес для дальнейшего исследования на других типах опухолей и при других схемах его применения.
Авторы выражают благодарность Можной Александре Григорьевне за консультации по работе с лабораторными животными.
Работа поддержана грантом Российского научного фонда (№ 21-14-00105, Т.Е. Корниенко, Н.Д. Дырхеева, А.Л. Захаренко, А.С. Филимонов, А.А. Чепанова, Н.А. Попова, В.П. Николин) и проектом Государственного задания ИХБФМ СО РАН (№ 121031300041-4, Е.С. Ильина, О.Д. Захарова, О.И. Лаврик).
Все процедуры с мышами соответствовали международным правилам проведения экспериментов на животных (Директива Европейского сообщества (86/609 EEC)).
Авторы заявляют об отсутствии конфликта интересов.
Дополнительные материалы включают данные по цитотоксичности олапариба и по острой токсичности препаратов на моделях опухолей мышей и размещены на сайтах http://link.springer.com, http://molecbio.ru.
Список литературы
Безбородова О.А., Немцова Е.Р., Кармакова Т.А., Венедиктова Ю.Б., Панкратов А.А, Алексеенко И.В., Плешкан В.В., Зиновьева М.В., Монастырская Г.С., Свердлов Е.Д., Каприн А.А. (2019) Современные тенденции развития противоопухолевой генной и клеточной терапии. Материалы Первого Международного Форума онкологии и радиологии, 23–27 сентября 2019 г. Москва, 65–66.
Curtin N.J., Szabo C. (2020) Poly (ADP-ribose) polymerase inhibition: past, present and future. Nat. Rev. Drug Discov. 19, 711–736.
Zakharenko A., Dyrkheeva N., Lavrik O. (2019) Dual DNA topoisomerase 1 and tyrosyl-DNA phosphodiesterase 1 inhibition for improved anticancer activity. Med. Res. Rev. 39, 1427–1441.
Alagoz M., Gilbert D.C., El-Khamisy S., Chalmers A.J. (2012) DNA repair and resistance to topoisomerase I inhibitors: mechanisms, biomarkers and therapeutic targets. Curr. Med. Chem. 19, 3874–3885.
Pommier Y., Huang S.N., Gao R., Das B.B., Murai J., Marchand C. (2014) Tyrosyl-DNA-phosphodiesterases (tdp1 and tdp2). DNA Repair. 19, 114–129.
Comeaux E.Q., van Waardenburg R.C. (2014) Tyrosyl-DNA phosphodiesterase I resolves both naturally and chemically induced DNA adducts and its potential as a therapeutic target. Drug Metabolism Rev. 46, 494–507.
Virág L., Szabó C. (2002) The therapeutic potential of poly (ADP-ribose) polymerase inhibitors. Pharmacol. Rev. 54, 375–429.
Groslambert J., Prokhorova E., Ahel I. (2021) ADP-ribosylation of DNA RNA. DNA Repair. 105, 103144.
Lord C.J., Tutt A.N.J., Ashworth A. (2015) Synthetic lethality and cancer therapy: lessons learned from the development of PARP inhibitors. Annu. Rev. Med. 66, 455–470.
Das B.B., Huang S.N., Murai J., Rehman I., Amé J.-C., Sengupta S., Das S.K., Majumdar P., Zhang H., Biard D., Majumder H.K., Schreiber V., Pommier Y. (2014) PARP1–TDP1 coupling for the repair of topoisomerase I-induced DNA damage. Nucl. Acids Res. 42, 4435–4449.
Lebedeva N.A., Anarbaev R.O., Sukhanova M., Vasil’eva I.A., Rechkunova N.I., Lavrik O.I. (2015) Poly(ADP-ribose) polymerase 1 stimulates the AP-site cleavage activity of tyrosyl-DNA phosphodiesterase 1. Biosci. Rep. 35–44.
Lopez-Mosqueda J., Hurley K., Simonson Q., Kloet M.S., Liu Q., Filippov D.V., van der Heden van Noort G.J. (2022) Poly-ADP-ribosylation modifies DNA-protein crosslinks to signal for SPRTN-dependent degradation. Int. Conference the PARP Family & ADP-ribosylation, Cold Spring Harbor Lab., USA. Abstract book. P. 42.
Sun Y., Chen J., Huang S.N., Su Y.P., Wang W., Agama K., Saha S., Jenkins L.M., Pascal J.M., Pommier Y. (2021) PARylation prevents the proteasomal degradation of topoisomerase I DNA-protein crosslinks and induces their deubiquitylation. Nat. Commun. 12, 1–16.
Захаренко А.Л., Лузина О.А., Соколов Д.Н., Захарова О.Д., Рахманова М.Е., Чепанова А.А., Дырхеева Н.С., Лаврик О.И., Салахутдинов Н.Ф. (2017) Производные усниновой кислоты как эффективные ингибиторы тирозил-ДНК-фосфодиэстеразы 1. Биоорган. химия. 43, 97–104.
Лузина О.А., Салахутдинов Н.Ф. (2016) Биологическая активность усниновой кислоты и ее производных. Часть 2. Действие усниновой кислоты и ее производных на высшие организмы, молекулярные и физико-химические аспекты биологической активности (обзорная статья). Биоорган. химия. 42, 276–276.
Zakharenko A.L. Zakharenko A.L., Luzina O.A., Sokolov D.N., Kaledin V.I., Nikolin V.P., Popova N.A., Patel J., Zakharova O.D., Chepanova A.A., Zafar A., Reynisson J., Leung E., Leung I.K.H., Volcho K.P., Salakhutdinov N.F., Lavrik O.I. (2019) Novel tyrosyl-DNA phosphodiesterase 1 inhibitors enhance the therapeutic impact of topotecan on in vivo tumor models. Eur. J. Med. Chem. 161, 581–593.
Nikolin V.P., Popova N.A., Kaledin V.I., Luzina O.A., Zakharenko A.L., Salakhutdinov N.F., Lavrik O.I. (2021) The influence of an enamine usnic acid derivative (a tyrosyl-DNA phosphodiesterase 1 inhibitor) on the therapeutic effect of topotecan against transplanted tumors in vivo. Clin. Exp. Metastasis. 38, 431–440.
Колдышева Е.В., Меньщикова А.П., Лушникова Е.Л., Попова Н А., Каледин В.И., Николин В.П., Захаренко А.Л., Лузина О.А., Салахутдинов Н.Ф., Лаврик О.И. (2018) Антиметастатическая активность комбинации топотекана и ингибитора тирозил-ДНК-фосфодиэстеразы 1 на модели карциномы легкого Льюис. Бюлл. Эксп. биологии медицины. 166, 609–615.
Дырхеева Н.С., Захаренко А.Л., Новоселова Е.С., Чепанова А.А., Николин В.П., Лузина О.А., Салахутдинов Н.Ф., Рябчикова Е.И., Лаврик О.И. (2021) Противоопухолевая активность комбинации топотекана и ингибитора тирозил-ДНК-фосфодиэстеразы 1 на модели асцитной карциномы Кребс-2 мыши. Молекуляр. биология. 55, 312–317.
Моисеев С.В. (2012) Анемия при онкологических заболеваниях. Онкол. Журн. им. П.А. Герцена. 1, 77–82.
Плотникова Н.А., Пятаев Н.А., Канаев П.М., Кокорев А.В., Кемайкин С.П., Харитонов С.В., Громова С.В. (2014) Особенности морфологии карциномы легкого Льюис на фоне коррекции опухолевого роста мелатонином и 3-гидроксипиридином. Фунд. исслед. 10, 549–552.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Рис. 1. Влияние соединения OL7-43 на выживаемость клеток HeLa и T98G по данным EZ4U-теста
Таблица 1. Влияние ингибитора Tdp1-OL7-43 и его комбинации с олапарибом на вес и индекс печени у мышей с асцитной карциномой Кребс-2
Таблица 2. Влияние ингибитора Tdp1-OL7-43 и его комбинации с олапарибом на вес и индекс печени и селезёнки у мышей с карциномой легких Льюис
Инструменты
Молекулярная биология



