Молекулярная биология, 2023, T. 57, № 2, стр. 166-177
Первичная и вторичная микроРНК-модуляция внешнего пути апоптоза при гепатоцеллюлярной карциноме
Т. М. Хлебодарова a, b, П. С. Деменков a, b, Т. В. Иванисенко a, b, Е. А. Антропова a, И. Н. Лаврик c, В. А. Иванисенко a, b, *
a Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Курчатовский геномный центр, Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
c Translational Inflammation Research, Medical Faculty, Otto von Guericke University Magdeburg
39106 Magdeburg, Germany
* E-mail: salix@bionet.nsc.ru
Поступила в редакцию 27.08.2022
После доработки 09.09.2022
Принята к публикации 09.09.2022
- EDN: EGEKQP
- DOI: 10.31857/S0026898423020118
Аннотация
Гепатоцеллюлярная карцинома – распространенное злокачественное заболевание печени, имеющее высокий уровень рецидивов и низкую пятилетнюю выживаемость. Диагностику гепатоцеллюлярной карциномы, а также прогнозирование течения и ответа на лечение существенно затрудняет структурная и межиндивидуальная неоднородность опухоли, поэтому важным становится пациент-ориентированный подход, определяющим при котором может быть применение миметиков и ингибиторов микроРНК (миРНК), вовлеченных в патогенез заболевания. С этой точки зрения интерес представляют миРНК, аберрантная экспрессия которых ассоциируется с плохим прогнозом и связана с прогрессией опухоли из-за нарушения механизмов регуляции процесса программируемой клеточной гибели (апоптоза). Однако влияние миРНК на развитие опухоли зависит не только от ее прямого воздействия на первичные мишени, но и на вторичные мишени, опосредованные регуляторными путями. И если первичные мишени активно изучаются, то роль вторичных мишеней этих миРНК в модуляции апоптоза до сих пор не ясна. В настоящей работе суммированы данные о миРНК, первичными мишенями которых являются ключевые гены внешнего пути апоптоза. Их аберрантная экспрессия ассоциирована с ранним рецидивом заболевания и его неблагоприятным исходом. С помощью программного комплекса ANDSystem реконструированы пути регуляции экспрессии вторичных мишеней этих миРНК, проведен анализ их влияния на активность внешнего пути апоптоза. Показано, что потенциальный эффект миРНК, опосредованный действием на вторичные мишени, отрицательно коррелирует с числом их первичных мишеней. При поиске маркеров гепатоцеллюлярной карциномы приоритет отдается hsa-miR-373, hsa-miR-106b и hsa-miR-96, действие которых на вторичные мишени усиливает их антиапоптотический эффект.
ВВЕДЕНИЕ
МикроРНК (миРНК) – это класс малых эндогенных одноцепочечных некодирующих РНК длиной ~18–25 нуклеотидов, которые регулируют экспрессию своих генов-мишеней с использованием различных механизмов, включая деградацию мРНК и ингибирование трансляции посредством как прямого связывания с комплементарной последовательностью в 3′-нетранслируемой области (3′UTR) мРНК [1–5], так и регуляции экспрессии генов, опосредованной регуляторными путями. МикроРНК участвуют в регуляции многих процессов, включая развитие, дифференцировку, выживание клеток, функционирование иммунной системы [6–8]. В базе данных hsa-miRTarBase (https://miRTarBase.cuhk.edu.cn/) представлены экспериментальные данные об участии более 4000 различных миРНК в регуляции активности более 27 тысяч генов-мишеней у 37 видов организмов [9]. У человека нарушения экспрессии миРНК связаны с различными заболеваниями – аллергическими, сердечно-сосудистыми, респираторными, в том числе с сахарным диабетом, бронхиальной астмой [10–14], и онкологическими [15–17].
Гепатоцеллюлярная карцинома (ГЦК) – наиболее распространенный вид первичного рака печени. Ежегодно во всем мире от ГЦК умирает около 750 тыс. человек [18]. ГЦК, имеющая высокий уровень рецидивов и низкую пятилетнюю выживаемость, отличается значительной структурной и межиндивидуальной неоднородностью, что затрудняет диагностику, прогноз и ответ на лечение. В этой связи важным становится индивидуальный, пациент-ориентированный подход. Определяющим при таком подходе может быть использование миметиков и ингибиторов миРНК, играющих существенную роль в регуляции экспрессии генов-мишеней, вовлеченных в патогенез ГЦК [19–22]. С этой точки зрения наибольший интерес представляют миРНК, высокая или низкая экспрессия которых связана с пролиферацией опухоли. Необходимо отметить, что в контексте развития и прогрессирования злокачественных опухолей миРНК, нацеленные на опухолевые гены-супрессоры, функционируют как онкогены. Если аберрантная экспрессия таких онко-миРНК ассоциирована с ранним рецидивом ГЦК и плохим исходом для пациента, то эти миРНК представляют интерес для использования в качестве биомаркеров и терапевтических мишеней.
В качестве перспективной мишени для разработки новых противоопухолевых средств интерес представляет внешний путь апоптоза, индуцируемый через клеточные рецепторы смерти – отдельной подгруппе семейства рецепторов фактора некроза опухолей (TNF, tumor necrosis factor) (см. обзор [23]). Наиболее хорошо изучен рецептор CD95 (Fas/APO-1). Активацию этого пути связывают, в том числе, с повреждениями ДНК и репликативным стрессом, ведущими к нарушению регуляции клеточного деления и развитию ГЦК. Реализуется этот путь через взаимодействие белков FADD (Fas-associated DD-protein), сFLIP (cellular FLICE inhibitory protein) и прокаспазы-8, ведущему к формированию макромолекулярного комплекса DISC (Death Inducing Signaling Complex), обеспечивающего активацию внешнего сигнального пути апоптоза через образование активной формы каспазы-8 [23–26] и дальнейшей активации каспазного каскада с участием каспаз-3 и -7. Данные о миРНК, аберрантная экспрессия которых при ГЦК напрямую связана с нарушением активности внешнего пути апоптоза и с плохим прогнозом, суммированы в настоящей работе. Однако эффект миРНК на развитие опухоли зависит не только от их прямого влияния на первичные мишени – экспрессию генов внешнего пути апоптоза, но и на вторичные мишени, опосредованные регуляторными путями. Механизмы модуляции внешнего пути апоптоза при ГЦК посредством действия миРНК на первичные мишени активно изучаются, тогда как о роли вторичных мишеней известно не слишком много. Для решения этого вопроса мы использовали разработанную нами ранее программно-информационную систему ANDSystem, предназначенную для реконструкции генных сетей на основе информации, извлеченной из фактографических баз данных, или полученной путем автоматического анализа текстов научных публикаций [27–30]. ANDSystem широко применяется для реконструкции и анализа генных сетей. В частности, с использованием ANDSystem осуществлена реконструкция ассоциома преэклампсии [31], идентифицированы новые гены, связанные с восприимчивостью к туберкулезу [32], реконструирован и проанализирован интерактом вируса гепатита С [33], проведен поиск новых генов-кандидатов, потенциально ассоциированных с коморбидностью астмы и гипертонии [34], проанализирована программируемая клеточная гибель при заражении SARS-CoV-2 [35].
В настоящей работе с помощью ANDSystem проведена реконструкция и анализ регуляторных путей, описывающих действие онко-миРНК на активность ключевых генов внешнего пути апоптоза, которые являются одновременно и первичными мишенями одних, и вторичными мишенями других миРНК. Оказалось, что ожидаемый модулирующий антиапоптотический эффект данных миРНК на первичные мишени может быть как усилен, так и ослаблен их действием на вторичные мишени согласно реконструированным регуляторным путям. Показано, что ожидаемый потенциальный эффект непрямой модуляции внешнего пути апоптоза за счет регуляции экспрессии вторичных мишеней, отрицательно коррелирует с числом первичных мишеней миРНК – чем больше первичных мишеней у миРНК, тем слабее суммарный антиапоптотический эффект от действия на вторичные мишени.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реконструкция молекулярно-генетических путей. Молекулярно-генетические пути для описания влияния миРНК на экспрессию генов-вторичных мишеней реконструировали с помощью программно-информационной системы ANDSystem [26–29]. ANDSystem содержит глобальную генную сеть, описывающую взаимодействия между объектами онтологии ANDSystem, для формирования которой проведен массовый анализ текстов абстрактов PubMed и полнотекстовых статей PubMed Central. Всего в ANDSystem представлено 13 типов разных объектов (белки, гены, метаболиты, заболевания, миРНК и т.д.) и 24 типа различных взаимодействий (физические взаимодействия, регуляция экспрессии, регуляция активности, регуляция стабильности и т.д.). Программный модуль ANDVisio обеспечивает графический интерфейс для пользовательского доступа к базе знаний, который позволяет реконструировать целевые генные сети, а также с помощью шаблонов проводить поиск регуляторных путей в глобальной генной сети. Шаблоны представляют собой линейную цепочку объектов и связей между ними. Объекты могут быть заданы списком конкретных имен/идентификаторов, либо только типом объекта. В первом случае при поиске путей будут рассматриваться только эти конкретные объекты, а во втором, все объекты заданного типа.
Программа осуществляет поиск в глобальной сети путей, которые удовлетворяют требованиям шаблона. В данной работе использован шаблон, включающий четыре участника: (1) миРНК; (2) белок, являющийся первичной мишенью миРНК; (3) ген – вторичная мишень миРНК, экспрессия которого может регулироваться белком – первичной мишенью 2; и (4) белок – продукт экспрессии гена 3. Участники 1 и 4 задавались списком соответствующих идентификаторов из баз данных miRbase (https://www.miRbase.org/) [36] и Swiss-Prot (https://www.expasy.org/resources/uniprotkb-swiss-prot) [37]. Участники 2 и 3 задавались только типом объекта, “gene” и “protein” соотв. Разрешенные типы взаимодействий в цепочке пути заданы следующими: между участниками 1 и 2 – “microRNA regulation”; между участниками 2 и 3 – “expression regulation”, “expression upregulation”, “expression downregulation”, “interaction” (при работе программы между указанными типами взаимодействий применяется логическое ИЛИ); между участниками 3 и 4 – “expression” (экспрессия гена).
Потенциальный антиапоптотический эффект миРНК. Потенциальный антиапоптотический эффект миРНК при их действии на экспрессию генов-вторичных мишеней оценивали по следующей формуле:
(1)
$Ea = \delta \left( {\mathop \sum \limits_{g \in AAP} Eg - \mathop \sum \limits_{g \in PAP} Eg} \right),$Согласно уравнению (1), суммарный антиапоптотический эффект (Еа) миРНК на активность процесса оценивали с помощью разности суммарных вкладов ($Eg$) генов-регуляторов в экспрессию анти- и проапоптотических генов, являющихся вторичными мишенями миРНК. При такой оценке эффекта положительные значения Еа характеризуют повышенную супрессию апоптоза (онкогенная активность), а отрицательные значения – повышенную индукцию апоптоза (онкосупрессорная активность).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Регуляция внешнего пути активации программируемой гибели клеток при гепатоцеллюлярной карциноме, опосредованная действием миРНК на первичные мишени
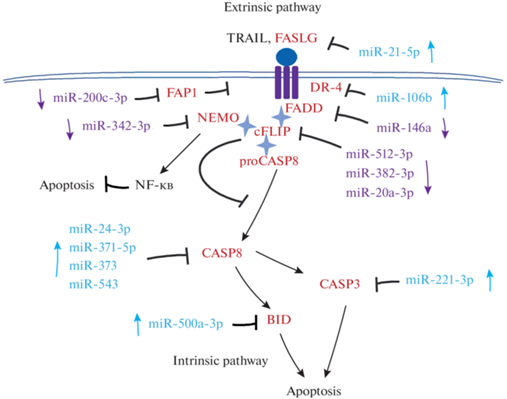
На рис. 1 приведена схема процесса программируемой клеточной гибели, который реализуется через рецепторы смерти (CD95, DR4/5; внешний путь апоптоза). Компонентами этого пути являются белки FADD, сFLIP и прокаспаза-8, взаимодействие которых ведет к формированию макромолекулярного комплекса DISC, обеспечивающего процесс активации внешнего пути апоптоза через образование активной формы каспазы-8 [23–26]. Одновременно активируется и внутренний (митохондриальный) путь апоптоза, медиатором которого является белок BID (BH3 interacting domain death agonist). Активация BID связана с его расщеплением каспазой-8 c последующей ассоциацией с внешней митохондриальной мембраной, что приводит к образованию митохондриальных пор и индукции апоптоза [38–40]. Указаны миРНК, участвующие в регуляции ключевых генов этого пути через прямое (физическое) взаимодействие с их мРНК, экспрессия которых нарушена при ГЦК.
Рис. 1.
Схема компонентов внешнего пути апоптоза и миРНК, участвующих в его регуляции при
ГЦК. Обозначения: BID (Bcl-2 homolog (BH)3-only protein, BH3 interacting domain death
agonist), CD95/Fas/APO-1 (Death receptor), CASP-3, -8 (caspase-3, -8), сFLIP / CFLAR
(cellular FADD-like interleukin-1b-converting enzyme (FLICE)-inhibitory protein/CASP8
and FADD like apoptosis regulator), DR-4 (death receptor 4), FADD (Fas associated
via death domain), FAP1 (Fas-associated phosphatase-1), FASLG (FAS ligand), NF-κB
(Nuclear factor kappa-B), NEMO (NF-kB essential modulator/IκB kinase γ), TRAIL (TNF-related
apoptosis-inducing ligand). Apoptosis – апоптоз, Extrinsic pathway – внешний путь
апоптоза, Intrinsic pathway – внутренний путь апоптоза. Черные стрелки – активация
функции соответствующего белка или экспрессии его гена, стрелки с тупым концом – блокирование.
Красным отмечены белки, экспрессия генов которых контролируется миРНК, голубым выделены
онко-миРНК, фиолетовым – супрессоры. Цветные стрелки, направленные вверх, указывают
на повышенный уровень экспрессии соответствующих миРНК при ГЦК, направленные вниз
– на пониженный. Значок  указывает на взаимодействие между отмеченными белками.
указывает на взаимодействие между отмеченными белками.
Данные о миРНК, аберрантная экспрессия которых при ГЦК связана с нарушением активности внешнего пути апоптоза и ассоциирована с плохим прогнозом, получены из результатов анализа пациент-специфических данных по дифференциальной экспрессии миРНК в ГЦК, представленных в научной литературе. Эти данные суммированы на рис. 1 и в табл. 1.
Таблица 1.
Список миРНК, участвующих в регуляции внешнего пути апоптоза, экспрессия которых нарушена при гепатоцеллюлярной карциноме
| миРНК | Нуклеотидная последовательность* | Изменение экспрессии | Мишень | Ссылка |
|---|---|---|---|---|
| miR-21-5p | 5'-UUGUAACCCAUUGUUAUUCGAU | ↑ | FASLG | [42] |
| miR-106b | 3'-UAGACGUGACAGUCGUGAAAU-5' | ↑ | DR-4 | [41] |
| miR-200c | 3'- AGGUAGUAAUGGGCCGUCAUAAU-5′ | ↓ | Fap-1 | [45, 46] |
| miR-146a | 3'-UAGUCAGACUAUUCGAU-5′ | То же | FADD | [49, 50] |
| miR-20a-3p | 3'-GAAAUUCACGАGAUUACGUCA-5′ | “–” | c-FLIP | [60] |
| miR-512-3p | 3'-CUGGAGUCGAUACUGUCGUGAA-5′ | “–” | c-FLIP | [61] |
| miR-382-3p | 3'-UUCACAACAGGCACUUACUAA -5′ | “–” | c-FLIP | [62] |
| miR-342-3p | 3'-UGCCCACGCUAAAGACACACUCU-5’ | “–” | NEMO (IKKγ) | [59] |
| miR-24-3p | 3'-GACAAGGACGACUUGACUCGGU-5' | ↑ | Каспаза-8 | [43] |
| miR-543 | 3'-UUCUUCACGUGGCGCUUACAAA-5' | То же | То же | [44] |
| miR-371-5p | 3'-UCACGGGGGUGUCAAACUCA-5' | “–” | “–” | |
| miR-373 | 3'-UGUGGGGUUUUAGCUUCGUGAAG-5' | “–” | “–” | |
| miR-96-5p | 3'-UCGUUUUUACACGAUCACGGUUU-5' | “–” | Каспаза-9 | [63] |
| miR-221-3р | 3'-CUUUGGGUCGUCUGUUACAUCGA-5' | “–” | Каспаза-3 | [43] |
Анализ этих данных показал, что с ранним рецидивом ГЦК и плохим исходом заболевания коррелирует высокий уровень экспрессии hsa-miR-21-5p и hsa-miR-106b [41, 42], действие которых направлено на гены лиганда Fas рецептора смерти FASLG и рецептора смерти DR-4, соответственно, а также целого набора миРНК, блокирующих экспрессию генов каспаз-8 и -3 (рис. 1) [43, 44].
В то же время, при ГЦК снижен уровень миРНК hsa-miR-200c [45], регулирующей экспрессию гена Fap-1 Fas-ассоциированной фосфатазы [46] – ингибитора CD95 рецептора [47, 48], hsa-miR-146а, контролирующей экспрессию гена белка FADD [49, 50], участвующего в формировании макромолекулярного комплекса DISC [25, 26, 51], а также hsa-miR-512-3p, hsa-miR-382-3p и hsa-miR-20a-3p, блокирующих экспрессию гена белка cFLIP, негативно влияющего на активацию прокаспазы-8 [52, 53] (рис. 1). Известно, что изменение количественного соотношения FADD и FLIP и прокаспазы-8 определяет баланс между апоптотической гибелью и выживанием клеток [54, 55].
Белок c-FLIP в составе комплекса DISC также вовлечен в активацию антиапоптотического сигнального пути NF-κB. Особую роль в этом процессе играет белок-белковое взаимодействие c-FLIP с белком NEMO (NF-kB essential modulator, известный как IKKγ, IκB kinase γ) – ключевым активатором сигнального пути NF-κB [56–58]. Одним из механизмов повышения пролиферации опухолевых клеток при ГЦК может быть активация сигнального пути NF-κB через взаимодействие белков c-FLIP/NEMO. Такая возможность подтверждается снижением уровня миРНК hsa-miR-342-3p [59], ведущим к активации экспрессии гена белка NEMO и увеличением его количества в клетках гепатомы.
Таким образом, при ГЦК миРНК часто блокируют первые этапы сигнального пути, связанные с активацией рецепторов смерти на мембране клетки, и сам каспазный каскад через ингибирование экспрессии гена инициирующей каспазы-8 и эффекторной каспазы-3. При этом изменение уровня всех описанных миРНК, контролирующих активность компонентов внешнего пути апоптоза, логично связаны с его блокированием в клетках гепатомы.
С другой стороны, необходимо отметить, что в гетерогенных опухолях, таких как ГЦК, эффект каждой миРНК может быть связан и с другими ее мишенями, способными не только модулировать активность апоптоза, но и влиять на прогрессию опухоли, используя другие механизмы. В качестве примера можно рассмотреть вторичные мишени hsa-miR-24, hsa-miR-21, hsa-miR-200с и hsa-miR-373. Оказалось, что мишенью hsa-miR-24, помимо гена каспазы-8 (инициирующей каспазы внешнего пути апоптоза), является ген белка p53 – ключевого регулятора митохондриального пути апоптоза [64]. Таким образом, повышение уровня этой миРНК при ГЦК приводит к блокированию обоих путей апоптоза и способствует усилению прогрессии опухоли.
В число мишеней hsa-miR-21, помимо гена Fas лиганда, активатора внешнего пути апоптоза, входят ген PDCD4 (programmed cell death factor 4), кодирующий негативный регулятор антиапоптотических белков внутреннего пути апоптоза Bcl-xL и XIAP [65], и ген фосфатазы PTEN – негативного регулятора сигнального пути PI3K/AKT [66–68]. В рассмотренном примере повышенный уровень этой миРНК при ГЦК способствует не только блокированию внешнего и внутреннего путей апоптоза, но также пролиферации клеток опухоли через активацию сигнального пути PI3K/AKT и его эффекторов [69, 70]. В обоих случаях миРНК действуют как онкогены.
миРНК hsa-miR-200с в целом действует как онкосупрессор и низкий уровень ее экспрессии при ГЦК ассоциирован с неблагоприятным прогнозом заболевания. Ее мишенями, помимо гена Fas-ассоциированной фосфатазы 1 – ингибитора рецептора CD95 внешнего пути апоптоза, служат гены циклина Е2, киназы RIP2 (Receptor-interacting protein 2) и проапоптотического белка Noxa [46, 71–73]. Таким образом, низкий уровень этой миРНК при ГЦК способствует активации Noxa и внутреннего пути апоптоза, при этом он, однако, ассоциирован с плохим исходом заболевания [45], что, по-видимому, связано с действием этой миРНК на другие гены-мишени, активация которых способствует пролиферации клеток опухоли, развитию воспалительного процесса в печени и блокированию внешнего пути апоптоза [74–77]. Не исключено, что существуют и другие причины плохого прогноза при ГЦК, связанные с низким уровнем миРНК hsa-miR-200c.
Исключением из этого ряда выглядит hsa-miR-373, которая в одних исследованиях позиционируется как онко-миРНК, уровень которой повышен в злокачественных опухолях, включая ГЦК [44, 78], а в других – как супрессор опухоли с пониженным уровнем в клетках ГЦК [79]. В первом случае hsa-miR-373 влияет на активность генов каспазы-8 [44] и CD44, маркера опухолевых стволовых клеток [78], тогда как во втором – действие этой миРНК направлено на фактор транскрипции TFAP4 (transcription factor activating enhancer binding protein 4), активация экспрессии которого при ГЦК способствует пролиферации клеток опухоли и блокированию апоптоза через сигнальный путь PI3K/AKT [79]. Таким образом, нарушение экспрессии hsa-miR-373 в злокачественных опухолях не зависит от того, действует она, как онкоген или как опухолевый супрессор, а конкретное проявление ее эффекта зависит от набора генов-мишеней, участвующих в этом ответе [80].
В целом, это означает, что при выборе маркера, связанного с неблагоприятным прогнозом развития ГЦК, необходим дополнительный анализ всего спектра мишеней интересующей миРНК. Такого рода анализ проведен для миРНК, аберрантная экспрессия которых при ГЦК блокирует ключевые гены внешнего пути апоптоза и ассоциирована с плохим прогнозом заболевания (см. табл. 1).
Регуляция внешнего пути активации программируемой гибели клеток при гепатоцеллюлярной карциноме, опосредованная действием миРНК на вторичные мишени
На этом этапе исследования проведен поиск вторичных мишеней миРНК, представленных в табл. 1, аберрантная экспрессия которых при ГЦК негативно влияет на активность внешнего пути апоптоза. Оценено потенциальное влияние миРНК на внешний путь апоптоза через данные мишени. Пространство поиска вторичных мишеней было ограничено первичными мишенями. Мы предположили, что первичная мишень одной миРНК может оказаться вторичной мишенью другой миРНК. Очевидно, что такое сетевое взаимодействие разных миРНК может приводить к усилению или ослаблению их действия на свои мишени и, как результат, к модуляции внешнего пути апоптоза.
С помощью системы ANDSystem для каждой миРНК по заданному шаблону реконструированы регуляторные пути, посредством которых миРНК потенциально может влиять на экспрессию генов из набора первичных мишеней других миРНК (рис. 2).
Рис. 2.
Регуляторные пути экспрессии генов вторичных мишеней миРНК, построенные с использованием ANDSystem. Обозначения: BCL2 (B-cell lymphoma 2), CCL2 (C-C Motif Chemokine Ligand 2), CD (Crohn’s disease, receptor), CD40L (CD40 ligand), CFLAR (CASP8 and FADD like apoptosis regulator), DDIT3 (DNA damage induced transcript 3), FASLG (FAS ligand), FETA (α-fetoprotein), FOXO1 (Forkhead box O protein 1), IL1B/8 (Interleukin 1B/8), ITCH (Itchy E3 ubiquitin-protein ligase), JUN (proto-oncogene, AP-1 transcription factor subunit), M3K1 (Mitogen-activated protein kinase kinase kinase 1), MK14 (Mitogen-activated protein kinase 14), hsa-miR (microRNA Homo sapiens ), NF1 (Nuclear factor 1), NFKB1 (Nuclear factor kappa-B 1), PTPN13/PTN13 (Tyrosine-protein phosphatase nonreceptor type 13), SP1 (Specificity protein 1, transcription factor), STAT3 (Signal transducer and activator of transcription 3), TGFB1 (Transforming growth factor beta 1), TET1 (Ten-eleven translocation 1), TNFRSF10A/TR10A (Tumor necrosis factor receptor superfamily 10A), UCRI (Ubiquinol-cytochrome C reductase iron-sulfur subunits), VEGFA (Vascular endothelial growth factor receptor), ‘canonical’ nf-kappab pathway – Канонический путь NF-ⱪВ.
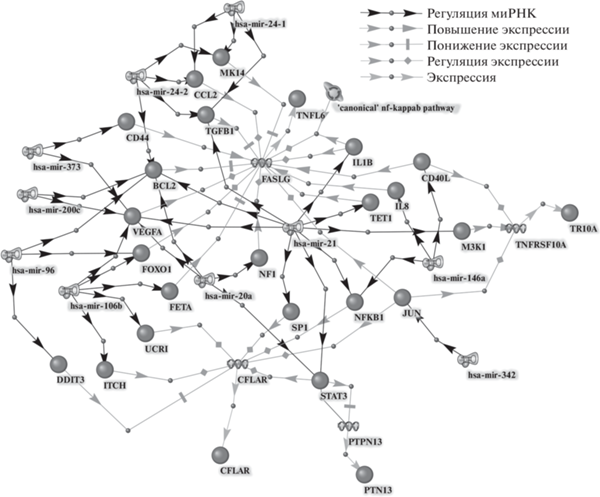
Как мы и ожидали, многие миРНК используют в качестве вторичных мишеней несколько первичных мишеней других миРНК (табл. 2). Однако не все миРНК способны регулировать экспрессию первичных мишеней других миРНК. Оказалось, что регуляторные пути найдены только для 10 из 14 онко-миРНК (табл. 2). В этих регуляторных путях представлены только четыре из семи генов-первичных мишеней. В их числе оказались два проапоптотических гена – FASLG (FAS-лиганд) и TNFRSF10A (рецептор DR-4), а также два антиапоптотических гена – PTPN13 (Fas-ассоциированная фосфатаза 1) и CFLAR (негативный регулятор каспазы-8 – белок c-FLIP).
Таблица 2.
Регуляция экспрессии миРНК генов-мишеней внешнего пути апоптоза при гепатоцеллюлярной карциноме посредством регуляторных путей
| миРНК | Экспрессия | Первичные мишени, общее число | Вторичные мишени | Регуляторные пути, число | Eg | Ea | |
|---|---|---|---|---|---|---|---|
| N1 | N2 | ||||||
| hsa-miR-373 | ↑ | 60 | FASLG | 0 | 2 | –2 | 2 |
| hsa-miR-106b | То же | 203 | FASLG | 1 | 2 | –1 | 1 |
| CFLAR (c-FLIP) | 1 | 1 | 0 | ||||
| hsa-miR-96 | “–” | 74 | FASLG CFLAR (c-FLIP) |
1 1 |
1 0 |
0 1 |
1 |
| hsa-miR-24-1 (miR-24-3p) |
“–” | 249 | FASLG | 2 | 1 | 1 | –1 |
| hsa-miR-24-2 (miR-24-3p) |
“–” | 249 | FASLG | 3 | 1 | 2 | –2 |
| hsa-miR-21-5p | “–” | 398 | FASLG | 3 | 2 | 1 | –2 |
| CFLAR (c-FLIP) | 0 | 3 | –3 | ||||
| PTN13 (Fap-1) | 1 | 0 | 1 | ||||
| TNFRSF10A (DR4) | 0 | 1 | –1 | ||||
| hsa-miR-200c | ↓ | 44 | FASLG | 1 | 1 | 0 | 0 |
| hsa-miR-342 | То же | 91 | FASLG | 0 | 1 | –1 | –1 |
| CFLAR (c-FLIP) | 0 | 1 | –1 | ||||
| TNFRSF10A (DR4) | 0 | 1 | –1 | ||||
| hsa-miR-20a | “–” | 155 | CFLAR (c-FLIP) | 0 | 1 | –1 | –1 |
| PTN13 (Fap-1) | 1 | 0 | 1 | ||||
| FASLG | 1 | 2 | –1 | ||||
| hsa-miR-146a | “–” | 52 | FASLG | 0 | 2 | –2 | –2 |
| CFLAR (c-FLIP) | 0 | 1 | –1 | ||||
| TNFRSF10A (DR4) | 0 | 1 | –1 | ||||
N1 – число регуляторных путей с положительной регуляцией экспрессии; N2 – число регуляторных путей с отрицательной регуляцией экспрессии; Eg – влияние миРНК на экспрессию гена-вторичной мишени; Ea – суммарный антиапоптотический эффект миРНК при действии на экспрессию всех генов-вторичных мишеней; ↓ – экспрессия снижена, ↑ –экспрессия повышена.
Модулирующий эффект миРНК на внешний путь апоптоза вторичных мишеней оценивали, суммируя потенциальные вклады каждой вторичной мишени согласно уравнению (1). Показано, что действие миРНК на вторичные мишени потенциально может вести как к усилению, так и к ослаблению антиапоптотического эффекта.
Например, показатель антиапоптотического эффекта (Ea = 2), опосредованного действием вторичных мишеней, был наибольшим у миРНК hsa-miR-373 (табл. 2). Первичной мишенью этой миРНК, непосредственно связанной с внешним путем апоптоза, является каспаза-8 (табл. 1). Согласно данным ANDSystem, эта миРНК имеет еще 59 других первичных мишеней. Как видно из рис. 2, две из этих мишеней (белки VEGFA и CD44) могут осуществлять положительную регуляцию экспрессии гена FASLG, что ведет к активации апоптоза [81, 82]. Таким образом, подавляя экспрессию белков VEGFA и CD44, hsa-miR-373 может снижать экспрессию своей вторичной мишени – гена FASLG, что, в свою очередь, дает эффект отрицательной модуляции внешнего пути апоптоза или повышенного антиапоптотического эффекта. Однако следует особо отметить, что все реконструированные регуляторные пути представляют собой описание потенциальных молекулярно-генетических событий в клетке и требуют дальнейшего экспериментального подтверждения.
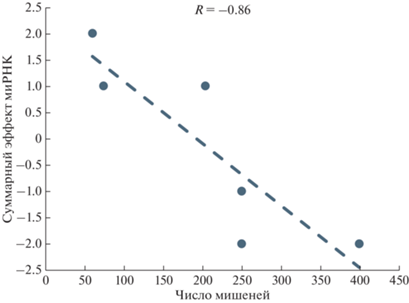
Величина антиапоптотического эффекта миРНК, экспрессия которых увеличена при ГЦК (табл. 2), отрицательно коррелировала с общим числом их первичных мишеней (рис. 3). Эта зависимость хорошо согласуется с наблюдениями, согласно которым высокая полифункциональность генов или белков может приводить к интерференции регуляторных путей [83]. Интересно, что миРНК, экспрессия которых подавлена при ГЦК, не показали ни положительной, ни отрицательной корреляции. Этот результат может быть связан с тем, что отсутствие активного действия миРНК с подавленной экспрессией на первичные и вторичные мишени можно рассматривать как некий пассивный сигнал. Можно предположить, что закономерности распространения таких пассивных сигналов по регуляторным путям имеют свои особенности. Однако использование нами очень ограниченной выборки миРНК не позволяет сделать каких-либо уверенных выводов. Для проведения такого анализа следует использовать большие наборы данных.
ЗАКЛЮЧЕНИЕ
Приведенный нами анализ пациент/тканеспецифической экспрессии миРНК, дифференциально экспрессирующихся в клетках ГЦК, показал, что практически все компоненты рецептор-опосредованного (внешнего) пути программируемой клеточной гибели подвержены регуляции со стороны миРНК, причем изменение уровня их экспрессии при ГЦК логично связано с блокированием активности апоптоза. Все выявленные миРНК тесно связаны с неблагоприятным прогнозом и активно обсуждаются как маркеры ГЦК.
Анализ эффектов вторичных мишеней рассмотренных миРНК показал, что потенциальный эффект модулирования внешнего пути апоптоза через вторичные мишени миРНК отрицательно коррелирует с числом их первичных мишеней – антиапоптотический эффект снижается с увеличением числа мишеней. Эта закономерность хорошо объясняется тем, что с увеличением числа мишеней неизбежно увеличивается число связанных с ними регуляторных путей в глобальной генной сети, что, в свою очередь, увеличивает вероятность их интерференции. Проблема потенциальных конфликтов между отдельными функциями полифункциональных макромолекул носит широкий характер.
Таким образом, спектр первичных и вторичных мишеней некоторых миРНК при ГЦК может быть связан с регуляцией процессов, вносящих как однонаправленный, так и разнонаправленный вклад в прогрессию заболевания.
Полученные результаты могут помочь при выборе мишеней для снижения агрессивности опухоли, а анализ вторичных мишеней позволяет рассматривать как приоритетные hsa-miR-373, hsa-miR-106b и hsa-miR-96, действие которых на вторичные мишени усиливает их антиапоптотический эффект.
Работа выполнена в рамках проекта ERA-NET “Target identification and drug development in liver cancer (TAIGA)” (соглашение с Минобрнаукой России No 075-15-2021-944).
В работе не использовали людей и животных в качестве объектов исследования.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Fabian M.R., Sonenberg N., Filipowicz W. (2010) Regulation of mRNA translation and stability by microRNAs. Annu. Rev. Biochem. 79, 351–379.
Vasudevan S. (2012) Posttranscriptional upregulation by microRNAs. Wiley. Interdiscip. Rev. RNA. 3, 311–330.
Saliminejad K., Khorram Khorshid H.R., Soleymani Fard S., Ghaffari S.H. (2019) An overview of microRNAs: biology, functions, therapeutics, and analysis methods. J. Cell. Physiol. 234, 5451–5465.
Hill M., Tran N. hsa-miRNA interplay: mechanisms and consequences in cancer. (2021) Dis. Model. Mech. 14, dmm047662.
Leitão A.L., Enguita F.J. (2022) A structural view of hsa-miRNA biogenesis and function. Noncoding RNA. 8, 10.
Shivdasani R.A. (2006) MicroRNAs: regulators of gene expression and cell differentiation. Blood. 108, 3646–3653.
Gracias D.T., Katsikis P.D. (2011) MicroRNAs: key components of immune regulation. Adv. Exp. Med. Biol. 780, 15–26.
Mens M.M.J., Ghanbari M. (2018). Cell cycle regulation of stem cells by microRNAs. Stem. Cell. Rev. Rep. 14, 309–322.
Huang H.Y., Lin YC., Cui S., Huang Y., Tang Y., Xu J., Bao J., Li Y., Wen J., Zuo H., Wang W., Li J., Ni J., Ruan Y., Li L., Chen Y., Xie Y., Zhu Z., Cai X., Chen X., Yao L., Chen Y., Luo Y., LuXu S., Luo M., Chiu C.M., Ma K., Zhu L., Cheng G.J., Bai C., Chiang Y.C., Wang L., Wei F., Lee T.Y., Huang H.D. (2022) hsa-miRTarBase update 2022: an informative resource for experimentally validated hsa-miRNA-target interactions. Nucl. Acids Res. 50, D222–D230.
Nazari-Jahantigh M., Egea V., Schober A., Weber C. (2015) MicroRNA-specific regulatory mechanisms in atherosclerosis. J. Mol. Cell. Cardiol. 89, 35–41.
Aghabozorgi A.S., Ahangari N., Eftekhaari T.E., Torbati P.N., Bahiraee A., Ebrahimi R., Pasdar A. (2019) Circulating exosomal hsa-miRNAs in cardiovascular disease pathogenesis: New emerging hopes. J. Cell. Physiol. 234, 21796–21809.
He X., Kuang G., Wu Y., Ou C. (2021) Emerging roles of exosomal hsa-miRNAs in diabetes mellitus. Clin. Transl. Med. 11, e468.
Weidner J., Bartel S., Kılıç A., Zissler U.M., Renz H., Schwarze J., Schmidt-Weber C.B., Maes T., Rebane A., Krauss-Etschmann S., Rådinger M. (2021) Spotlight on microRNAs in allergy and asthma. Allergy. 76, 1661–1678.
Zhang L., Zhang J., Qin Z., Liu N., Zhang Z., Lu Y., Xu Y., Zhang J., Tang J. (2022) Diagnostic and predictive values of circulating extracellular vesicle-carried microRNAs in ischemic heart disease patients with type 2 diabetes mellitus. Front. Cardiovasc. Med. 9, 813310.
Xie Y., Dang W., Zhang S., Yue W., Yang L., Zhai X., Yan Q., Lu J. (2019) The role of exosomal noncoding RNAs in cancer. Mol. Cancer. 18, 37.
Ali Syeda Z., Langden S.S.S., Munkhzul C., Lee M., Song S.J. (2020) Regulatory mechanism of microRNA expression in cancer. Int. J. Mol. Sci. 21, 1723.
Humphries B., Wang Z., Yang C. (2021) MicroRNA regulation of breast cancer stemness. Int. J. Mol. Sci. 22, 3756.
Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre LA., Jemal A. (2018) Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 68, 394–424.
Tsoulfas G. (2014) Role of microRNA in the diagnosis and therapy of hepatocellular carcinoma: a new frontier. Microrna. 3, 137–143.
Morishita A., Masaki T. hsa-miRNA in hepatocellular carcinoma. (2015) Hepatol. Res. 45, 128–141.
Morishita A., Oura K., Tadokoro T., Fujita K., Tani J., Masaki T. (2021) MicroRNAs in the pathogenesis of hepatocellular carcinoma: a review. Cancers (Basel). 13, 514.
Oura K., Morishita A., Masaki T. (2020) Molecular and functional roles of microRNAs in the progression of hepatocellular carcinoma – a review. Int. J. Mol. Sci. 21, 8362.
Ivanisenko N.V., Seyrek K., Hillert-Richter L.K., König C., Espe J., Bose K., Lavrik I.N. (2022) Regulation of extrinsic apoptotic signaling by c-FLIP: towards targeting cancer networks. Trends Cancer. 8, 190–209.
Schleich K., Buchbinder J.H., Pietkiewicz S., Kähne T., Warnken U., Öztürk S., Schnölzer M., Naumann M., Krammer P.H., Lavrik I.N. (2016) Molecular architecture of the DED chains at the DISC: regulation of procaspase-8 activation by short DED proteins c-FLIP and procaspase-8 prodomain. Cell. Death. Differ. 23, 681–694.
Иванисенко Н.В., Лаврик И.Н. (2019) Механизмы активации прокаспазы-8 при инициации внешнего пути программируемой клеточной гибели. Молекуляр. биология. 53, 830–837.
Seyrek K., Ivanisenko N.V., Richter M., Hillert L.K., König C., Lavrik I.N. (2020) Controlling cell death through post-translational modifications of DED proteins. Trends Cell Biol. 30, 354–369.
Demenkov P.S., Ivanisenko T.V., Kolchanov N.A., Ivanisenko V.A. (2012) ANDVisio: a new tool for graphic visualization and analysis of literature mined associative gene networks in the ANDSystem. In Silico Biol. 11, 149–161.
Ivanisenko T.V., Saik O.V., Demenkov P.S., Ivanisenko N.V., Savostianov A.N., Ivanisenko V.A. (2020) ANDDigest: a new web-based module of ANDSystem for the search of knowledge in the scientific literature. BMC Bioinformatics. 21, 228.
Ivanisenko V.A., Saik O.V., Ivanisenko N.V., Tiys E.S., Ivanisenko T.V., Demenkov P.S., Kolchanov N.A. (2015) ANDSystem: an Associative Network Discovery System for automated literature mining in the field of biology. BMC Syst. Biol. 9, S2.
Ivanisenko V.A., Demenkov P.S., Ivanisenko T.V., Mishchenko E.L., Saik O.V. (2019) A new version of the ANDSystem tool for automatic extraction of knowledge from scientific publications with expanded functionality for reconstruction of associative gene networks by considering tissue-specific gene expression. BMC Bioinformatics. 20, 34.
Glotov A.S., Tiys E.S., Vashukova E.S., Pakin V.S., Demenkov P.S., Saik O.V., Ivanisenko T.V., Arzhanova O.N., Mozgovaya E.V., Zainulina M.S., Kolchanov N.A., Baranov V.S., Ivanisenko V.A. (2015) Molecular association of pathogenetic contributors to pre-eclampsia (pre-eclampsia associome). BMC Syst. Biol. 9, S4.
Bragina E.Yu., Tiys E.S., Rudko A.A., Ivanisenko V.A., Freidin M.B. (2016) Novel tuberculosis susceptibility candidate genes revealed by the reconstruction and analysis of associative networks. Infection, Genet. Evol. 46, 118–123.
Saik O.V., Ivanisenko T.V., Demenkov P.S., Ivanisenko V.A. (2016) Interactome of the hepatitis C virus: literature mining with ANDSystem. Virus Res. 218, 40–48.
Saik O.V., Demenkov P.S., Ivanisenko T.V., Bragina E.Y., Freidin M.B., Goncharova I.A., Dosenko V.E., Zolotareva O.I., Hofestaedt R., Lavrik I.N., Rogaev E.I., Ivanisenko V.A. (2018) Novel candidate genes important for asthma and hypertension comorbidity revealed from associative gene networks. BMC Med. Genomics. 11, 15.
Ivanisenko N.V., Seyrek K., Kolchanov N.A., Ivanisenko V.A., Lavrik, I.N. (2020) The role of death domain proteins in host response upon SARS-CoV-2 infection: modulation of programmed cell death and translational applications. Cell. Death. Discov. 6, 101.
Kozomara A., Birgaoanu M., Griffiths-Jones S. (2019) hsa-miRBase: from microRNA sequences to function. Nucl. Acids Res. 47, D155–D162.
Boutet E., Lieberherr D., Tognolli M., Schneider M., Bairoch A. (2007) UniProtKB/Swiss-Prot. Methods Mol. Biol. 406, 89–112.
Kantari C., Walczak H. (2011) Caspase-8 and bid: caught in the act between death receptors and mitochondria. Biochim. Biophys. Acta. 1813, 558–563.
Schug Z.T., Gonzalvez F., Houtkooper R.H., Vaz FM., Gottlieb E. (2011) BID is cleaved by caspase-8 within a native complex on the mitochondrial membrane. Cell. Death. Differ. 18, 538–548.
Huang K., Zhang J., O’Neill K.L., Gurumurthy C.B., Quadros R.M., Tu Y., Luo X. (2016) Cleavage by caspase 8 and mitochondrial membrane association activate the BH3-only protein Bid during TRAIL-induced apoptosis. J. Biol. Chem. 291, 11843–11851.
Xu C., Shi L., Chen W., Fang P., Li J., Jin L., Pan Z., Pan C. (2017) hsa-miR-106b inhibitors sensitize TRAIL-induced apoptosis in hepatocellular carcinoma through increase of death receptor 4. Oncotarget. 8, 41921–41931.
Chen S., Yang C., Sun C., Sun Y., Yang Z., Cheng S., Zhuge B. (2019) hsa-miR-21-5p suppressed the sensitivity of hepatocellular carcinoma cells to cisplatin by targeting FASLG. DNA Cell. Biol. 38, 865–873.
Jin X., Cai L., Wang C., Deng X., Yi S., Lei Z., Xiao Q., Xu H., Luo H., Sun J. (2018) CASC2/miR-24/miR-221 modulates the TRAIL resistance of hepatocellular carcinoma cell through caspase-8/caspase-3. Cell. Death. Dis. 9, 318.
Visalli M., Bartolotta M., Polito F., Oteri R., Barbera A., Arrigo R., Di Giorgio R.M., Navarra G., Aguennouz M. (2018) hsa-miRNA expression profiling regulates necroptotic cell death in hepatocellular carcinoma. Int. J. Oncol. 53, 771–780.
Luo C., Pu J., Liu F., Long X., Wang C., Wei H., Tang Q. (2019) MicroRNA-200c expression is decreased in hepatocellular carcinoma and associated with poor prognosis. Clin. Res. Hepatol. Gastroenterol. 43, 715–721.
Schickel R., Park S.M., Murmann A.E., Peter M.E. (2010) hsa-miR-200c regulates induction of apoptosis through CD95 by targeting FAP-1. Mol. Cell. 38, 908–915.
Lee S.H., Shin M.S., Lee J.Y., Park W.S., Kim S.Y., Jang J.J., Dong S.M., Na E.Y., Kim C.S., Kim S.H., Yoo N.J. (1999) In vivo expression of soluble Fas and FAP-1: possible mechanisms of Fas resistance in human hepatoblastomas. J. Pathol. 188, 207–212.
Nicolini V., Cassinelli G., Cuccuru G., Bongarzone I., Petrangolini G., Tortoreto M., Mondellini P., Casalini P., Favini E., Zaffaroni N., Zunino F., Lanzi C. (2011) Interplay between Ret and Fap-1 regulates CD95-mediated apoptosis in medullary thyroid cancer cells. Biochem. Pharmacol. 82, 778–788.
Barnaba V., Macino G. (2010) An emerging player in the adaptive immune response: microRNA-146a is a modulator of IL-2 expression and activation-induced cell death in T lymphocytes. Blood. 115, 265–273.
Rong M., He R., Dang Y., Chen G. (2014) Expression and clinicopathological significance of hsa-miR-146a in hepatocellular carcinoma tissues. Ups. J. Med. Sci. 119, 19–24.
Hillert L.K., Ivanisenko N.V., Espe J., König C., Ivanisenko V.A., Kähne T., Lavrik I.N. (2020) Long and short isoforms of c-FLIP act as control checkpoints of DED filament assembly. Oncogene. 39, 1756–1772.
Krueger A., Schmitz I., Baumann S., Krammer PH., Kirchhoff S. (2001) Cellular FLICE-inhibitory protein splice variants inhibit different steps of caspase-8 activation at the CD95 death-inducing signaling complex. J. Biol. Chem. 276, 20633–20640.
Okano H., Shiraki K., Inoue H., Kawakita T., Yamanaka T., Deguchi M., Sugimoto K., Sakai T., Ohmori S., Fujikawa K., Murata K., Nakano T. (2003) Cellular FLICE/caspase-8-inhibitory protein as a principal regulator of cell death and survival in human hepatocellular carcinoma. Lab. Invest. 83, 1033–1043.
Dickens L.S., Boyd R.S., Jukes-Jones R., Hughes M.A., Robinson G.L., Fairall L., Schwabe J.W., Cain K., Macfarlane M. (2012) A death effector domain chain DISC model reveals a crucial role for caspase-8 chain assembly in mediating apoptotic cell death. Mol. Cell. 47, 291–305.
Schleich K., Krammer P.H., Lavrik I.N. (2013) The chains of death: a new view on caspase-8 activation at the DISC. Cell Cycle. 12, 193–194.
Bagnoli M., Canevari S., Mezzanzanica D. (2010) Cellular FLICE-inhibitory protein (c-FLIP) signalling: a key regulator of receptor-mediated apoptosis in physiologic context and in cancer. Int. J. Biochem. Cell. Biol. 42, 210–213.
Baratchian M., Davis CA., Shimizu A., Escors D., Bagnéris C., Barrett T., Collins M.K. (2016) Distinct activation mechanisms of NF-κB regulator inhibitor of NF-κB kinase (IKK) by isoforms of the cell death regulator cellular FLICE-like inhibitory protein (cFLIP). J. Biol. Chem. 291, 7608–7620.
Ivanisenko N.V., Buchbinder J.H., Espe J., Richter M., Bollmann M., Hillert L.K., Ivanisenko V.A., Lavrik I.N. (2019) Delineating the role of c-FLIP/NEMO interaction in the CD95 network via rational design of molecular probes. BMC Genomics. 20, 293.
Zhao L., Zhang Y. (2015) hsa-miR-342-3p affects hepatocellular carcinoma cell proliferation via regulating NF-κB pathway. Biochem. Biophys. Res. Commun. 457, 370–377.
Deng L., Wang C., He C., Chen L. (2021) Bone mesenchymal stem cells derived extracellular vesicles promote TRAIL-related apoptosis of hepatocellular carcinoma cells via the delivery of microRNA-20a-3p. Cancer. Biomark. 30, 223–235.
Chen F., Zhu H.H., Zhou L.F., Wu S.S., Wang J., Chen Z. (2010) Inhibition of c-FLIP expression by hsa-miR-512-3p contributes to taxol-induced apoptosis in hepatocellular carcinoma cells. Oncol. Rep. 23, 1457–1462.
Chen Z., Zheng Z., Feng L., Huo Z., Huang L., Fu M., Chen Q., Ke Y., Yang J., Hou B. 2020. Overexpression of hsa-miR-382 sensitizes hepatocellular carcinoma cells to γδ T cells by inhibiting the expression of c-FLIP. Mol. Ther. Oncolytics. 18, 467–475.
Iwai N., Yasui K., Tomie A., Gen Y., Terasaki K., Kitaichi T., Soda T., Yamada N., Dohi O., Seko Y., Umemura A., Nishikawa T., Yamaguchi K., Moriguchi M., Konishi H., Naito Y., Itoh Y. (2018) Oncogenic hsa-miR-96-5p inhibits apoptosis by targeting the caspase-9 gene in hepatocellular carcinoma. Int. J. Oncol. 53, 237–245.
Chen L., Luo L., Chen W., Xu HX., Chen F., Chen L.Z., Zeng W.T., Chen J.S., Huang X.H. (2016) MicroRNA-24 increases hepatocellular carcinoma cell metastasis and invasion by targeting p53: hsa-miR-24 targeted p53. Biomed. Pharmacother. 84, 1113–1118.
Zhu Q., Wang Z., Hu Y., Li J., Li X., Zhou L., Huang Y. (2012) hsa-miR-21 promotes migration and invasion by the hsa-miR-21-PDCD4-AP-1 feedback loop in human hepatocellular carcinoma. Oncol. Rep. 27, 1660–1668.
Meng F., Henson R., Wehbe-Janek H., Ghoshal K., Jacob S.T., Patel T. (2007) MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer. Gastroenterology. 133, 647–658.
Xia C., Zeng H., Zheng Y. (2020) Low‑intensity ultrasound enhances the antitumor effects of doxorubicin on hepatocellular carcinoma cells through the ROS‑miR‑21‑PTEN axis. Mol. Med. Rep. 21, 989–998.
He C., Dong X., Zhai B., Jiang X., Dong D., Li B., Jiang H., Xu S., Sun X. (2015) hsa-miR-21 mediates sorafenib resistance of hepatocellular carcinoma cells by inhibiting autophagy via the PTEN/AKT pathway. Oncotarget. 6, 28867–28881.
Dituri F., Mazzocca A., Lupo L., Edling C.E., Azzariti A., Antonaci S., Falasca M., Giannelli G. (2012) PI3K class IB controls the cell cycle checkpoint promoting cell proliferation in hepatocellular carcinoma. Int. J. Cancer. 130, 2505–2513.
Kunter I., Erdal E., Nart D., Yilmaz F., KarademiR S., Sagol O., Atabey N. (2014) Active form of AKT controls cell proliferation and response to apoptosis in hepatocellular carcinoma. Oncol. Rep. 31, 573–580.
Lerner M., Haneklaus M., Harada M., Grandér D. (2012) hsa-miR-200c regulates Noxa expression and sensitivity to proteasomal inhibitors. PLoS One. 7, e36490.
Cao J., Sun L., An J., Zhang H., He X., Shen H. (2020) [MicroRNA-200c-3p inhibits proliferation of nephroblastoma cells by targeting CCNE2]. Nan. Fang. Yi. Ke. Da. Xue. Xue. Bao. 40, 1246–1252.
Zhao L., Liu X., Yang J., Wang X., Liu X., Wu J., Li C., Xu D., Hu Y. (2022) hsa-miR-200c-3p inhibits LPS-induced M1 polarization of BV2 cells by targeting RIP2. Genes. Genomics. 44, 477–486.
McCarthy J.V., Ni J., Dixit V.M. (1998) RIP2 is a novel NF-kappaB-activating and cell death-inducing kinase. J. Biol. Chem. 273, 16968–16975.
Geng Y., Michowski W., Chick J.M., Wang Y.E., Jecrois M.E., Sweeney K.E., Liu L., Han R.C., Ke N., Zagozdzon A., Sicinska E., Bronson R.T., Gygi S.P., Sicinski P. (2018) Kinase-independent function of E-type cyclins in liver cancer. Proc. Natl. Acad. Sci. USA. 115, 1015–1020.
Hofmann S.R., Girschick L., Stein R., Schulze F. (2021) Immune modulating effects of receptor interacting protein 2 (RIP2) in autoinflammation and immunity. Clin. Immunol. 223, 108648.
Zhou Y., Hu L., Tang W., Li D., Ma L., Liu H., Zhang S., Zhang X., Dong L., Shen X., Chen S., Xue R., Zhang S. (2021) Hepatic NOD2 promotes hepatocarcinogenesis via a RIP2-mediated proinflammatory response and a novel nuclear autophagy-mediated DNA damage mechanism. J. Hematol. Oncol. 14, 9.
Huang Q., GumiReddy K., Schrier M., le Sage C., Nagel R., Nair S., Egan D.A., Li A., Huang G., Klein-Szanto A.J., Gimotty P.A., Katsaros D., Coukos G., Zhang L., Puré E., Agami R. (2008) The microRNAs hsa-miR-373 and hsa-miR-520c promote tumour invasion and metastasis. Nat. Cell. Biol. 10, 202–210.
Li H., Wang N., Xu Y., Chang X., Ke J., Yin J. (2022) Upregulating microRNA-373-3p promotes apoptosis and inhibits metastasis of hepatocellular carcinoma cells. Bioengineered. 13, 1304–1319.
Wei F., Cao C., Xu X., Wang J. (2015) Diverse functions of hsa-miR-373 in cancer. J. Transl. Med. 13, 162.
Nakano K., Saito K., Mine S., Matsushita S., Tanaka Y. (2007) Engagement of CD44 up-regulates Fas ligand expression on T cells leading to activation-induced cell death. Apoptosis. 12, 45–54.
Motz G.T., Santoro. SP., Wang L.P., Garrabrant T., Lastra R.R., Hagemann I.S., Lal P., Feldman M.D., Benencia F., Coukos G. (2014) Tumor endothelium FasL establishes a selective immune barrier promoting tolerance in tumors. Nat. Med. 20, 607–615.
Snaebjornsson M.T., Schulze A. (2018) Non-canonical functions of enzymes facilitate cross-talk between cell metabolic and regulatory pathways. Exp. Mol. Med. 50, 1–16.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология