Молекулярная биология, 2023, T. 57, № 2, стр. 340-349
Новые цвиттер-ионные олигонуклеотиды: получение и комплементарное связывание
Д. Э. Патрушев a, b, Е. А. Буракова a, b, С. Н. Бизяев a, b, c, А. А. Фокина a, b, Д. А. Стеценко a, b, *
a Физический факультет Новосибирского государственного университета
630090 Новосибирск, Россия
b Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
c Институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: stetsenkoda@bionet.nsc.ru
Поступила в редакцию 31.07.2022
После доработки 05.09.2022
Принята к публикации 05.09.2022
- EDN: EEIRJW
- DOI: 10.31857/S0026898423020180
Аннотация
Описаны новые цвиттер-ионные производные олигонуклеотидов, содержащие 1,2,3,4-тетрагидроизохинолин-7-сульфонилфосфорамидную группу. Автоматизированный синтез этих соединений осуществлен по β-цианэтильной амидофосфитной схеме с использованием реакции Штаудингера между 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилазидом и фосфиттриэфиром в составе олигонуклеотида, привитого к полимерному носителю. 1,2,3,4-Тетрагидроизохинолин-7-сульфонилфосфорамидная группа (THIQ) оказалась устойчивой в условиях стандартного синтеза олигонуклеотидов, включая удаление защитных групп с отщеплением олигонуклеотида от полимерного носителя обработкой смесью концентрированных водных растворов аммиака и метиламина (1:1) при нагревании. Получены олигонуклеотиды, модифицированные от одной до пяти THIQ-групп в различных положениях. Цвиттер-ионный характер полученных производных отражался в различной подвижности в условиях денатурирующего электрофореза в ПААГ. Термическая устойчивость дуплексов олигодезоксинуклеотидов, содержащих THIQ-группы, с комплементарными ДНК и РНК слабо отличалась от устойчивости природных дуплексов ДНК:ДНК и ДНК:РНК. Полученные результаты позволяют предположить возможность использования олигонуклеотидов, модифицированных цвиттер-ионными THIQ-группами, в качестве антисмысловых терапевтических агентов.
ВВЕДЕНИЕ
Интерес к производным олигонуклеотидов как к терапевтическим агентам повышается с каждым годом [1–3]. Для этого есть несколько причин, а именно, олигонуклеотиды способны комплементарно связываться с нуклеиновыми кислотами, прежде всего с РНК живых клеток, и воздействовать на экспрессию генов, что, как правило, не могут лекарственные средства на основе малых молекул [4]. К настоящему времени получено множество производных олигонуклеотидов, применяемых в так называемой антисмысловой терапии [5, 6], которые, исходя из различий в механизме действия, можно разделить на две основные группы, а именно, на пространственные блокаторы функции РНК [7], в частности, корректоры сплайсинга [8], и на активаторы клеточных нуклеаз, в основном РНКазы Н [9]. Из числа последних наиболее широко используются олигонуклеотиды с модифицированной фосфатной группой, прежде всего тиофосфатные производные [10]. Популярность этих производных вызвана, с одной стороны, относительной простотой получения и повышенной устойчивостью к ферментативному расщеплению, а с другой – свойствами тиофосфатной группы (облегченное проникновение в клетки за счет связывания со специфическими рецепторами и эффективная транслокация в ядра клеток), а также улучшенной фармакокинетикой и фармакодинамикой тиофосфатных производных по сравнению с другими аналогами ДНК и РНК [11]. Эти благоприятные свойства обусловлены повышенной аффинностью тиофосфатных олигонуклеотидов к белкам [12]. Обратной стороной высокого сродства к белкам является повышенная токсичность данных производных [13]. Для снижения неспецифической токсичности и повышения селективности антисмыслового действия актуальной остается разработка новых аналогов фосфодиэфирной связи, лишенных недостатков тиофосфатной группы, но не потерявших ее достоинств. Примером может служить предложенная недавно мезилфосфорамидная группа [14, 15]. Взаимодействие тиофосфатных олигонуклеотидов с белками, как считается, обусловлено нековалентными ван-дер-ваальсовыми (гидрофобными) взаимодействиями [12, 16], хотя недавно была выдвинута оригинальная гипотеза о ведущей роли в улучшенном проникновении в клетки динамического образования несимметричных дисульфидных мостиков между тиофосфатными группами олигонуклеотида и остатками цистина в белках [17]. Особый интерес вызывают аналоги фосфатной группы, способные к взаимодействию с аминокислотными остатками в белках за счет как ионных (электростатических), так и гидрофобных взаимодействий. К их числу можно отнести цвиттер-ионные группировки, несущие как отрицательный, так и положительный заряд. Известно большое число катионных модификаций межнуклеотидной группы и гетероциклических оснований или углеводного остатка в олигонуклеотидах [18, 19]. В ряде производных природные фосфодиэфиры сочетаются с модифицированными фосфатами, несущими положительно заряженные группы [20]. Показано возрастание устойчивости некоторых цвиттер-ионных олигонуклеотидов к ферментативному гидролизу [21], повышение сродства к ДНК [22] и улучшение проникновения в клетки [20]. Можно предположить, что аналоги олигонуклеотидов, сочетающие цвиттер-ион с гидрофобной группой, будут способны взаимодействовать с более широким спектром аминокислотных остатков в составе белков: не только катионных (Lys, Arg, His), но и анионных (Asp и Glu) и неполярных (Trp, Phe, Leu, Ile, Val).
Этим условиям отвечает 1,2,3,4-тетрагидроизохинолин-7-сульфонилфосфорамидная группа (THIQ), сочетающая вторичную алифатическую аминогруппу с рКа около 10 в насыщенном цикле с бензольным кольцом при сульфонилфосфорамидной связи, отрицательно заряженной при физиологических значениях рН [14, 23].
Известно, что химическая модификация часто снижает способность олигонуклеотида к комплементарному связыванию [24]. Поэтому представляет интерес замещение по крайней мере части фосфодиэфирных связей в олигонуклеотиде цвиттер-ионными группами с целью повышения прочности образующегося комплементарного комплекса за счет компенсации электростатического отталкивания между цепями [22]. Ранее мы предложили использовать для стабилизации G-квадруплексов путем уменьшения электростатического отталкивания незаряженные фосфорилгуанидиновые группы [25] и цвиттер-ионные алифатические сульфонилфосфорамидные группы, содержащие в боковой цепи остаток четвертичного аммония [26]. В дальнейшем Su и соавт. показали, что эта цвиттер-ионная группировка повышает устойчивость комплементарного дуплекса с ДНК и РНК, и триплекса с ДНК [27]. В то же время выявлено преимущество ароматической тозилфосфорамидной группы [23] в реальном биологическом приложении [28].
В данной работе мы синтезировали новые олигодезоксинуклеотиды, содержащие в одном или нескольких межнуклеотидных положениях цвиттер-ионные THIQ-группы и провели эксперименты по термической денатурации дуплексов олигонуклеотидов, модифицированных THIQ, с комплементарными ДНК и РНК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез олигонуклеотидов проводили с помощью автоматического синтезатора ДНК/РНК ASM-800 производства ООО “Биоссет” (Новосибирск, Россия) согласно доработанному протоколу твердофазного амидофосфитного синтеза в стандартных реакторах объемом 12–50 мкл в масштабе 0.1–0.4 мкмоль из соответствующих дезоксирибонуклеозид-3'-β-цианэтил-N,N-диизопропиламидофосфитов и полимерных носителей на основе пористого стекла с размером пор 500 Å с привитыми дезоксирибонуклеозидами от компании “Sigma Aldrich” (США). В качестве защитных групп для экзоциклических аминогрупп азотистых оснований использовали: А – бензоил, С – ацетил, и G – изобутирил. 4,4'-Диметокситритильную (DMTr) группу с 5′-конца нуклеозида, иммобилизованного на полимере, удаляли обработкой 3%-ной дихлоруксусной кислотой в хлористом метилене. Конденсацию амидофосфитов проводили в присутствии активатора 5-этилтио-1H-тетразола (0.25 М раствор в ацетонитриле). Для кепирования непрореагировавших 5'-гидроксильных групп использовали стандартные растворы Cap А и Cap B. Для введения 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфамидной группы по межнуклеотидному фосфату вместо окисления иодом использовали реакцию Штаудингера с 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилазидом (0.2 М раствор в ацетонитриле) в течение 30 мин [17, 21]. Соответствующий сульфонилазид получен из коммерческого сульфонилхлорида компании “Alfa Aesar” (США) и азида натрия в ацетонитриле.
Олигонуклеотиды синтезировали в режиме без сохранения 5'-DMTr-группы и отщепляли от полимера обработкой реагентом АМА (смесь (1 : 1) 28% водного аммиака и 40% водного метиламина) при 55°С в течение 15 мин. Также одновременно удаляли трифторацетильную группу с атома азота тетрагидроизохинолинового кольца, β-цианэтильные защитные группы с фосфатов и ацильные защитные группы с азотистых оснований А, С и G. При этом избегали побочной реакции, связанной с присоединением акрилонитрила к вторичной аминогруппе изохинолинового кольца, которая имеет место при использовании только аммиака. После удаления летучих компонентов с помощью вакуум-концентратора Concentrator Plus (“Eppendorf”, Германия) олигонуклеотиды растворяли в 50%-ном ацетонитриле и осаждали, добавляя 10-кратный объем 30%‑го перхлората лития в ацетоне с выдерживанием при –20°С в течение 15 мин. Осадок отделяли центрифугированием, промывали 2 раза ацетоном и высушивали в течение 10 мин на воздухе при комнатной температуре. Далее олигонуклеотиды растворяли в 50%-ном ацетонитриле и определяли концентрацию по оптической плотности раствора при λ = 260 нм с помощью УФ-спектрофотометра NanoPhotometer N80Touch (“Implen”, Германия).
Аналитическую обращенно-фазовую (ОФ) ВЭЖХ проводили на приборе Милихром А-02 ООО “Эконова” (Новосибирск, Россия) на колонке Prontosil C18 5 мкм 2 × 75 мм в градиенте элюента Б (ацетонитрил : вода = 1 :1) в 20 мМ ацетате триэтиламмония, рН 7.0 (элюент А) от 0 до 50% за 30 мин, скорость потока 0.1 мл/мин.
Аналитический электрофорез проводили в 20%‑ном ПААГ толщиной 0.4 мм в следующих условиях: акриламид – N,N'-метилен-бисакриламид (30 :1), 8 М мочевина, 90 мМ Трис-борат, pH 8.3, 2 мМ Na2EDTA. Олигонуклеотиды наносили в растворе, содержащем 8 М мочевину, 0.05%-ный ксиленцианол FF и 0.05%-ный бромфеноловый синий. Полосы визуализировали, окрашивая гель раствором 500 мг/л красителя Stains-All (“Sigma Aldrich”) в формамиде с последующей отмывкой дистиллированной водой. Гели фотографировали на приборе ChemiDoc MP (“Bio-Rad”, США).
Олигонуклеотиды выделяли с помощью электрофореза в 20%-ном денатурирующем ПААГ толщиной 1.2 мм в аналогичных условиях с последующей элюцией 0.3 М перхлоратом натрия и обессоливанием путем гель-фильтрации на колонке NAP-25 с сорбентом Sephadex G-25 (“GE Healthcare”, Великобритания) в виде натриевой соли и лиофилизировали на лиофильной сушилке “Labconco” (США).
Молекулярные массы олигонуклеотидов определяли с помощью масс-спектрометрии MALD-I-TOF на приборе Ultraflex III TOF/TOF (“Bruker Daltonics”, Германия). Масс-спектры олигонуклеотидов получали в линейном режиме отрицательных ионов прибора и в диапазоне m/z от 500 до 16 000 Да при частоте импульсов 25 Гц, ускоряющем напряжении 25.0 кВ и времени задержки экстракции ионов 120 нс. Образцы олигонуклеотидов растворяли до концентрации 0.1 мМ в водном буфере, содержащем 20 мM ТЕАА и 60% ацетонитрила. Объем анализируемого образца составлял 10 мкл. Отобранную пробу (0.7 мкл) смешивали на подложке (Ground Steel или AnchorChip) с 0.7 мкл раствора матрицы, приготовленного согласно базовому протоколу производителя. Матрицей для ионизации служил 2,6-дигидроксиацетофенон (2,6-DHAP) с добавлением дигидроцитрата аммония. Итоговый масс-спектр получали суммированием 8–20 одиночных спектров по 100 импульсов лазера на точку. Калибровку прибора проводили с использованием калибровочных стандартов компании “Bruker”, а также набора олигонуклеотидов с известными массами. Молекулярные массы олигонуклеотидов рассчитывали, используя наборы экспериментальных значений m/z, определенные для каждого анализируемого образца.
1H и 13C ЯМР-спектры 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилазида записывали в Институте органической химии им. Н.Н. Ворожцова СО РАН на приборах AV-400 и DRX-500 (“Bruker”).
Температуры плавления дуплексов олигонуклеотидов, содержащих THIQ-группы, с комплементарными ДНК и РНК измеряли на спектрофотометре UV-1900i (“Shimadzu”, Япония) в буфере следующего состава: 10 мМ какодилат натрия, 100 мМ NaCl, 5 мМ MgCl2, pH 7. Концентрация олигонуклеотида и матрицы – по 5 мкМ.
Синтез 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилазида. К 0.975 г (4.5 ммоль) 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилхлорида (“Alfa Aesar”) и 0.27 г азида натрия в стеклянной колбе (50 мл) добавляли 12 мл сухого ацетонитрила и оставляли при перемешивании на магнитной мешалке на 24 ч. Осадок хлорида натрия отфильтровывали, растворитель удаляли в вакууме и кристаллизовали продукт из бензола. Выход азида в виде бесцветных кристаллов 0.9 г (90%). 1Н ЯМР, 300 МГц (δ, м.д., СD3CN): 1.92 (p, J = 2.4 Гц, CHD2CN), 3.05 (t, 2H, J = 5.9 Гц, H4), 3.84 (t, 2H, J = 5.9 Гц, H3), 4.83 (s, 2H, H1), 7.48 (dd, 1H, J1,2 = 8.1; 2.6 Гц, H6), 7.79 (m, 1H, H5), 7.86 (s, 1H, W1/2 = 5 Гц, H8).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использование амидофосфитной схемы твердофазного синтеза обеспечивает, как правило, эффективное получение олигонуклеотидов с модифицированными фосфатными группами [29]. Для модификации фосфата требуется замена обычного окисления P(III) в P(V) иной реакцией, например, реакцией тионирования (сульфуризации) для получения тиофосфатной группы [30]. Мы показали, что реакция Штаудингера между остатком β-цианэтилфосфита в составе олигонуклеотида, привитого к полимерному носителю, и различными органическими азидами, в том числе сульфонилазидами, является удобным способом введения различных аналогов фосфатной группы по межнуклеотидному положению [31–35]. Использование сульфонилазидов, которые легко получаются из азида натрия и соответствующих сульфонилхлоридов (более 250 из которых коммерчески доступны), позволяет получить широкий спектр сульфонилфосфорамидных производных олигонуклеотидов [14, 23, 27, 34, 35]. Впервые олигодезоксинуклеотиды с ароматической сульфонилфосфорамидной группой, а именно, 4-ацетиламинобензолсульфонилфосфорамидной, были получены Dieter Heindl и соавт. в середине 2000-х [36, 37]; тогда же кратко, без приведения каких-нибудь деталей, отмечено незначительное влияние данной группы на устойчивость комплементарного дуплекса с ДНК. В наших работах приведены новые примеры олигонуклеотидов с сульфонилфосфорамидными группами: тозилфосфорамидной [23], мезилфосфорамидной [14] и другими [26, 34, 35], и показано, что введение данных групп относительно слабо отражается на устойчивости комплементарного комплекса с ДНК и, в меньшей степени, с РНК, что в дальнейшем подтверждено другими группами [27, 38]. Также показан анионный характер сульфонилфосфорамидной группы при физиологическом значении рН около 7, что делает данную группу близким аналогом фосфата. Наиболее изученными из полученных производных оказались мезилфосфорамидные олигонуклеотиды (μ), которые показали себя эффективными антисмысловыми [15, 39–42] и иммуномодулирующими агентами [43]. В то же время олигонуклеотиды, полностью замещенные по всем межнуклеотидным положениям мезилфосфорамидными группами, подобно малым интерферирующим РНК, для наиболее полного проявления своего терапевтического потенциала, по-видимому, нуждаются в дополнительных трансфекционных агентах, таких как катионные липосомы [39, 41]. Это свидетельствует в пользу того, что мезилфосфорамидная группа слабее взаимодействует с белками, чем тиофосфатная. Поэтому поиск новых сульфонилфосфорамидных производных, способных преодолеть это ограничение, сохраняет свою актуальность [34, 35, 40].
В данной работе мы впервые синтезировали олигонуклеотиды, содержащие 1,2,3,4-тетрагидроизохинолин-7-сульфонилфосфорамидную группу (THIQ, или θ), цвиттер-ионный характер которой обусловлен присутствием вторичной аминогруппы в насыщенном кольце, которая имеет рКа около 10 и поэтому должна быть протонирована при физиологических значениях рН (рис. 1), и исследовали влияние данной группы на устойчивость комплементарных комплексов, формируемых модифицированными олигонуклеотидами.
Рис. 1.
Синтез олигонуклеотидов с 1,2,3,4-тетрагидроизохинолин-7-сульфонилфосфорамидной группой (THIQ) по реакции Штаудингера. Обозначения: i – завершение синтеза ДНК; ii – конц. водн. (~28%) NH3 – конц. водн. (~40%) MeNH2 (1:1), 55°С, 15 мин. Вp/B – защищенные (р) или незащищенные азотистые основания А(бензоил), C(ацетил) или G(изобутирил); Tfa – трифторацетил.
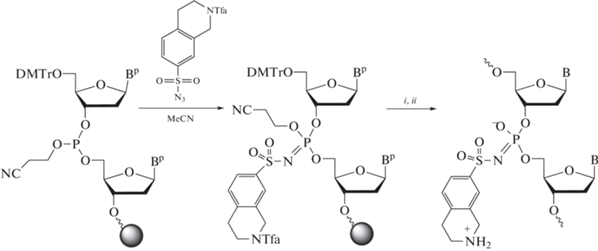
Необходимый сульфонилазид, легко получаемый реакцией 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилхлорида с азидом натрия, представляет собой кристаллическое вещество, хорошо растворимое в ацетонитриле. Полученный раствор стабилен при хранении при комнатной температуре в автоматическом синтезаторе ДНК и активно вступает в реакцию Штаудингера в процессе олигонуклеотидного синтеза (рис. 1). Отработка условий синтеза олигонуклеотидов на гексатимидилатной модели выявила побочную реакцию при отщеплении от полимера и деблокировании олигонуклеотида при помощи аммиака. В случае монозамещения с 3'-конца на хроматограмме присутствовал пик побочного продукта с бόльшим временем удерживания в виде пары диастереомеров, аналогично основному продукту (рис. 2а). Примеси была приписана формула β-цианэтильного аддукта, образующегося в результате присоединения по Михаэлю акрилонитрила, полученного при β-элиминировании защитной 2-цианэтильной группы с фосфата, к вторичной аминогруппе кольца. Побочная реакция минимизирована заменой аммиака на реагент АМА: смесь концентрированного водного аммиака и концентрированного (40%) водного метиламина (1 : 1). По-видимому, повышенной нуклеофильности метиламина по сравнению с аммиаком вполне достаточно, чтобы эффективно улавливать акрилонитрил, образующийся при деблокировании, не затрагивая вторичную аминогруппу. Получив удовлетворительный результат с одной модификацией (рис. 2б), мы перешли к синтезу мультизамещенных олигонуклеотидов.
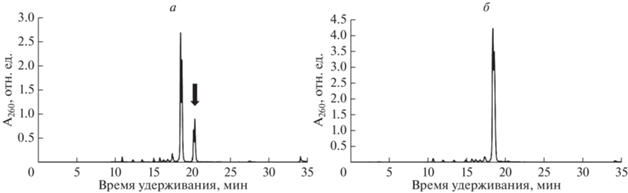
Рис. 2.
Профили элюции оф-ВЭЖХ олигонуклеотида 5′-d(TTTTTθT) в зависимости от способа деблокирования. а ‒ При обработке конц. водн. (~28%) аммиаком, 55оС, 1 ч. б – При обработке смесью конц. водн. (~28%) аммиака и конц. водн. (~40%) метиламина (1:1 об.). Стрелкой указан побочный продукт присоединения акрилонитрила по вторичной аминогруппе кольца.
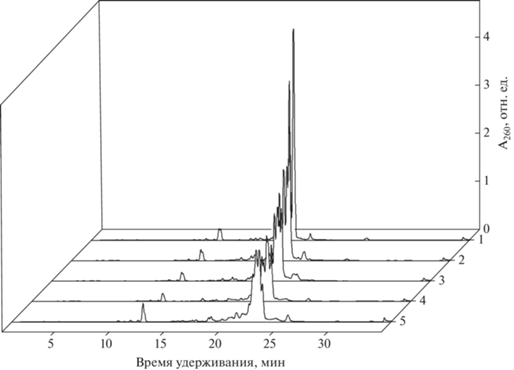
Показано (рис. 3), что THIQ-группа имеет достаточно гидрофобный характер, чтобы служить “якорем” для обращенно-фазовой хроматографии. Времена удерживания олигонуклеотидов, содержащих 1, 2, 3, 4 и 5 THIQ-групп, существенно различаются. Также различаются времена удерживания соответствующих диастереомеров (2n, где n – число модификаций фосфатной группы): одна THIQ-группа – два пика диастереомеров (профиль 1), две THIQ-группы – четыре пика диастереомеров (профиль 2) и т.д. (рис. 3).
Рис. 3.
Профили элюции оф-ВЭЖХ олиготимидилатов, полизамещенных THIQ-группами: (1) 5'-ТθТТ ТТТ; (2) 5'-ТθТθТ ТТТ; (3) 5'-ТθТθТθ ТТТ; (4) 5'-ТθТθТθ ТθТТ; и (5) 5'-ТθТθТθ ТθТθТ; θ – 1,2,3,4-тетрагидроизохинолин-7-сульфонильная группа (THIQ).
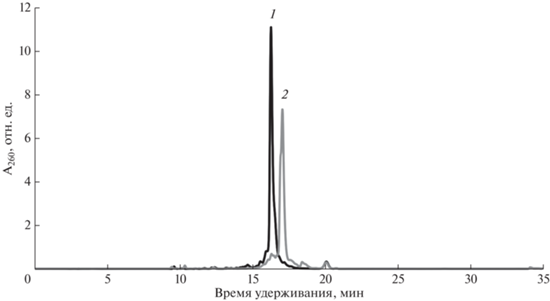
Далее были синтезирован набор из шести модифицированных олигонуклеотидов на основе единой последовательности 5′-d(CTC CCA GGC TCA AAT) с THIQ-группами в различных положениях. Аналитическая оф-ВЭЖХ в случае протяженных олигонуклеотидов, как правило, выявляет один основной пик (рис. 4) без выраженного разделения диастереомеров, как у коротких последовательностей (рис. 3).
Рис. 4.
Профиль элюции оф-ВЭЖХ модифицированных 15-звенных олигонуклеотидов: (1) 5′-d(CTC CCA GGθC TCA AAT); и (2) 5′-d(CθTC CCA GGC TCA AAθT).
Аналитический электрофорез в ПААГ в денатурирующих условиях показал удовлетворительную чистоту полученных олигонуклеотидов, сравнимую с чистотой контрольных олигонуклеотидов (рис. 5), что говорит о достаточно высокой конверсии реакции Штаудингера. Присутствие возрастающего числа THIQ-групп инкрементально снижает подвижность олигонуклеотидов в геле ввиду цвиттер-ионной природы данной модификации из-за компенсации заряда от одного до, в пределе, пяти (рис. 5а, дорожки 6–10), тогда как подвижность монозамещенных олигонуклеотидов слабо зависит от положения цвиттер-ионной группы (дорожки 5 и 6). Это свидетельствует в пользу того, что вторичная аминогруппа в кольце остается протонированной в Трис-боратном буфере с рН 8.3, что компенсирует отрицательный заряд сульфонилфосфорамидной группы (рис. 1). В то же время, даже олигонуклеотид с THIQ-группами во всех межнуклеотидных положениях сохраняет мобильность в геле, что говорит о ненулевом суммарном заряде (рис. 5а, дорожка 10). При этом, в отличие от электронейтральной фосфорилгуанидиновой модификации [44], олигонуклеотиды даже с несколькими THIQ-группами способны эффективно окрашиваться красителем Stains-All. Следует указать на размывание полос в геле с накоплением THIQ-групп в последовательности, связанное, возможно, с присутствием нескольких ионных форм с различным суммарным зарядом.
Рис. 5.
Аналитический электрофорез в денатурирующем ПААГ THIQ-модифицированных олигонуклеотидов. а ‒ Олиготимидилаты с 1–5 модификациями: контроль dT5 (1); контроль dT6 (2); контрольные олигонуклеотиды другой структуры с одной цвиттер-ионной группой различной основности (3 и 4); 5'-d(TTTTTθT), формальный заряд –5 (5); 5'‑d(TθTT TTT), формальный заряд –4 (6); 5'-d(TθTθT TTT), формальный заряд –3 (7); 5'-d(TθTθTθ TTT), формальный заряд –2 (8); 5'-d(TθTθTθ TθTT), формальный заряд –1 (9); 5'-d(TθTθTθ TθTθT), формальный заряд 0 (10). б ‒ 15-звенные олигонуклеотиды: 5'-d(CTC CCA GGC TCA AAT) (немодифицированный контроль) (1); 5'-d(CTC CCA GGC TCA AAθT) (0.05 о.е.) (2); 5'-d(CTC CCA GGC TCA AAθT) (0.1 о.е.) (3); 5'-d(CTC CCA GGθC TCA AAT) (4); 5'-d(CTC CCA GGC TCA AθAθT) (5); 5'-d(CθTC CCA GGC TCA AAθT) (6); 5'-d(CTC CCA GGθC TCA AAθT) (7); 5'-d(CTC CCA GGC TCAθ AθAθT) (8). θ – THIQ-группа; BP – бромфеноловый синий. Окрашивание Stains-All.
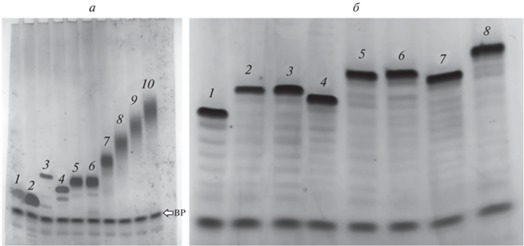
Вклад THIQ-групп в подвижность 15-звенных олигонуклеотидов с 1–3 цвиттер-ионнами пропорционально менее выражен, чем у гексатимидилатов, но также инкрементален (рис. 5б, дорожки 2–8) и зависит от положения модификаций в последовательности (см. например, дорожки 3–4 и 5–7). Кроме того, большая длина олигонуклеотидов и, соответственно, больший суммарный отрицательный заряд балансируют “размывающий” эффект THIQ-групп, что позволяет полосам в геле оставаться четкими. Поэтому именно гель-электрофорез использовали для выделения гомогенных θ-олигонуклеотидов, включающих все четыре природных азотистых основания A, C, G и Т.
Влияние числа и положения THIQ-групп на термическую стабильность дуплексов, образуемых модифицированными олигонуклеотидами с комплементарными ДНК и РНК, определяли, используя последовательности на основе 15-звенного олигонуклеотида 5′-d(CTC CCA GGC TCA AAT) (табл. 1 ). Обнаружен в целом незначительный эффект цвиттер-ионных модификаций на температуру плавления дуплексов: слабо положительный в случае ДНК и незначительно дестабилизирующий в случае РНК. Можно заключить, что негативное влияние объемной и относительно “жесткой” бициклической модификации THIQ-группы может быть отчасти компенсировано позитивным вкладом цвиттер-иона, что приводит к значениям ТМ, близким к полученным в случае наименее стерически объемной мезилфосфорамидной группы, имеющей чисто анионный характер [14].
Tаблица 1. Термическая стабильность дуплексов олигонуклеотидов, модифицированных 1,2,3,4-тетрагидроизохинолин-7-сульфонилфосфорамидными группами (THIQ) с комплементарными ДНК и РНК
| Последовательность олигонуклеотида, 5′→3′ | TМ, °C | ΔTМ, °C | ΔTМ мод.–1, °C |
|---|---|---|---|
| d(CTC CCA GGC TCA AAT) | 60.0 | – | – |
| d(CTC CCA GGC TCA AAθT) | 60.0 | – | – |
| d(CTC CCA GGθC TCA AAT) | 60.1 | +0.1 | +0.1 |
| d(CTC CCA GGθC TCA AAθT) | 60.6 | +0.6 | +0.3 |
| d(CTC CCA GGC TCA AAT) | 64.4 | – | – |
| d(CTC CCA GGC TCA AAθT) | 63.7 | –0.7 | –0.7 |
| d(CTC CCA GGθC TCA AAT) | 63.8 | –0.6 | –0.6 |
| d(CTC CCA GGθC TCA AAθT) | 64.2 | –0.2 | –0.1 |
В заключение, при помощи разработанной ранее методики автоматизированного твердофазного синтеза по β-цианэтильной амидофосфитной схеме с использованием реакции Штаудингера с 2-трифторацетил-1,2,3,4-тетрагидроизохинолин-7-сульфонилазидом были получены и охарактеризованы новые производные олигонуклеотидов, содержащие цвиттер-ионную THIQ, или θ, группу, и выявлено незначительное влияние данной группы на термическую устойчивость дуплексов, образуемых модифицированными олигонуклеотидами с комплементарными ДНК и РНК, что позволяет рассматривать данные производные в качестве перспективных кандидатов для дальнейшего изучения как потенциальных антисмысловых терапевтических агентов.
Работа поддержана Российским научным фондом (грант № 22-13-00212) и Министерством науки и высшего образования Российской Федерации (проект Новосибирского государственного университета FSUS-2020-0035).
Опыты с участием животных или человека не проводились.
Конфликт интересов отсутствует.
Список литературы
Curreri A., Sankholkar D., Mitragotri S., Zhao Z. (2022) RNA therapeutics in the clinic. Bioeng. Transl. Med. e10374.
Halloy F., Biscans A., Bujold K.E., Debacker A., Hill A.C., Lacroix A., Luige O., Strömberg R., Sundstrom L., Vogel J., Ghidini A. (2021) Innovative developments and emerging technologies in RNA therapeutics. RNA Biol. 19, 313–332.
Zhou L.Y., Qin Z., Zhu Y.H., He Z.Y., Xu T. (2019) Current RNA-based therapeutics in clinical trials. Curr. Gene Ther. 19, 172–196.
Quemener A.M., Centomo M.L., Sax S.L., Panella R. (2022) Small drugs, huge impact: the extraordinary impact of antisense oligonucleotides in research and drug development. Molecules. 27, 536.
Crooke S.T., Liang X.H., Baker B.F., Crooke R.M. (2021) Antisense technology: a review. J. Biol. Chem. 296, 100416.
Crooke S.T., Baker B.F., Crooke R.M., Liang X.H. (2021) Antisense technology: an overview and prospectus. Nat. Rev. Drug Discov. 20, 427–453.
Arzumanov A., Walsh A.P., Rajwanshi V.K., Kumar R., Wengel J., Gait M.J. (2001) Inhibition of HIV-1 Tat-dependent trans activation by steric block chimeric 2'-O-methyl/LNA oligoribonucleotides. Biochemistry. 40, 14645–14654.
Arechavala-Gomeza V., Khoo B., Aartsma-Rus A. (2014) Splicing modulation therapy in the treatment of genetic diseases. Appl. Clin. Genet. 7, 245–252.
Crooke S.T. (2017) Molecular mechanisms of antisense oligonucleotides. Nucl. Acid Ther. 27, 70–77.
Eckstein F. (2014) Phosphorothioates, essential components of therapeutic oligonucleotides. Nucl. Acid Ther. 24, 374–387.
Shen W., De Hoyos C.L., Migawa M.T., Vickers T.A., Sun H., Low A., Bell T.A. 3rd, Rahdar M., Mukhopadhyay S., Hart C.E., Bell M., Riney S., Murray S.F., Greenlee S., Crooke R.M., Liang X.H., Seth P.P., Crooke S.T. (2019) Chemical modification of PS-ASO therapeutics reduces cellular protein-binding and improves the therapeutic index. Nat. Biotechnol. 37, 640–650.
Crooke S.T., Vickers T.A., Liang X.H. (2020) Phosphorothioate modified oligonucleotide-protein interactions. Nucl. Acids Res. 48, 5235–5253.
Shen W., De Hoyos C.L., Sun H., Vickers T.A., Liang X.H., Crooke S.T. (2018) Acute hepatotoxicity of 2' fluoro-modified 5-10-5 gapmer phosphorothioate oligonucleotides in mice correlates with intracellular protein binding and the loss of DBHS proteins. Nucl. Acids Res. 46, 2204–2217.
Челобанов Б.П., Буракова Е.А., Прохорова Д.В., Фокина А.А., Стеценко Д.А. (2017) Новые производные олигодезоксинуклеотидов, содержащие межнуклеотидную N-(метансульфонил)-фосфорамидную (мезилфосфорамидную) группу. Биоорган. химия. 43, 644–649.
Miroshnichenko S.K., Patutina O.A., Burakova E.A., Chelobanov B.P., Fokina A.A., Vlassov V.V., Altman S., Zenkova M.A., Stetsenko D.A. (2019) Mesyl phosphoramidate antisense oligonucleotides as an alternative to phosphorothioates: improved biochemical and biological properties. Proc. Natl. Acad. Sci. USA. 116, 1229–1234.
Liang X.H., Shen W., Sun H., Kinberger G.A., Prakash T.P., Nichols J.G., Crooke S.T. (2016) Hsp90 protein interacts with phosphorothioate oligonucleotides containing hydrophobic 2'-modifications and enhances antisense activity. Nucl. Acids Res. 44, 3892–3907.
Laurent Q., Martinent R., Moreau D., Winssinger N., Sakai N., Matile S. (2021) Oligonucleotide phosphorothioates enter cells by thiol-mediated uptake. Angew. Chem. Int. Ed. Engl. 60, 19102–19106.
Meng M., Ducho C. (2018) Oligonucleotide analogues with cationic backbone linkages. Beilstein J. Org. Chem. 14, 1293–1308.
Danielsen M.B., Wengel J. (2021) Cationic oligonucleotide derivatives and conjugates: a favorable approach for enhanced DNA and RNA targeting oligonucleotides. Beilstein J. Org. Chem. 17, 1828–1848.
Yanachkov I., Zavizion B., Metelev V., Stevens L.J., Tabatadze Y., Yanachkova M., Wright G., Krichevsky A.M., Tabatadze D.R. (2017) Self-neutralizing oligonucleotides with enhanced cellular uptake. Org. Biomol. Chem. 15, 1363–1380.
Meng M., Schmidtgall B., Ducho C. (2018) Enhanced stability of DNA oligonucleotides with partially zwitterionic backbone structures in biological media. Molecules. 23, 2941.
Schmidtgall B., Kuepper A., Meng M., Grossmann T.N., Ducho C. (2018) Oligonucleotides with cationic backbone and their hybridization with DNA: interplay of base pairing and electrostatic attraction. Chem. Eur. J. 24, 1544–1553.
Прохорова Д.В., Челобанов Б.П., Буракова Е.А., Фокина А.А., Стеценко Д.А. (2017) Новые производные олигодезоксирибонуклеотидов, содержащие межнуклеотидную N-тозилфосфорамидную группу: синтез и взаимодействие с комплементарными последовательностями ДНК и РНК. Биоорган. химия. 43, 45–50.
Freier S.M., Altmann K.H. (1997) The ups and downs of nucleic acid duplex stability: structure-stability studies on chemically-modified DNA:RNA duplexes. Nucl. Acids Res. 25, 4429–4443.
Su Y., Fujii H., Burakova E.A., Chelobanov B.P., Fujii M., Stetsenko D.A., Filichev V.V. (2019) Neutral and negatively charged phosphate modifications altering thermal stability, kinetics of formation and monovalent ion dependence of DNA G-quadruplexes. Chem. Asian J. 14, 1212–1220.
Su Y., Edwards P.J.B., Stetsenko D.A., Filichev V.V. (2020) The importance of phosphates for DNA G-quadruplex formation: evaluation of zwitterionic G-rich oligodeoxynucleotides. ChemBioChem. 21, 2455–2466.
Su Y., Bayarjargal M., Hale T.K., Filichev V.V. (2021) DNA with zwitterionic and negatively charged phosphate modifications: formation of DNA triplexes, duplexes and cell uptake studies. Beilstein J. Org. Chem. 17, 749–761.
Su Y., Raguraman P., Veedu R.N., Filichev V.V. (2022) Phosphorothioate modification improves exon-skipping of antisense oligonucleotides based on sulfonyl phosphoramidates in mdx mouse myotubes. Org. Biomol. Chem. 20, 3790–3797.
Beaucage S.L., Caruthers M.H. (1981) Deoxynucleoside phosphoramidites – a new class of key intermediates for deoxypolynucleotide synthesis. Tetrahedron Lett. 22, 1859–1862.
Stec W.J., Zon G., Egan W., Stec B. (1984) Automated solid-phase synthesis, separation, and stereochemistry of phosphorothioate analogs of oligodeoxyribonucleotides. J. Am. Chem. Soc. 106, 6077–6079.
Купрюшкин М.С., Апухтина В.С., Васильева С.В., Пышный Д.В., Стеценко Д.А. (2015) Новый простой и удобный метод получения олигонуклеотидов, содержащих остатки пирена или холестерина. Изв. Акад. Наук. Сер. Хим. 64, 1678–1681.
Левина А.С., Репкова М.Н., Челобанов Б.П., Бессуднова Е.В., Мазуркова М.А., Стеценко Д.А., Зарытова В.Ф. (2017) Влияние способа доставки на противовирусную активность фосфодиэфирных, тиофосфатных и фосфорилгуанидиновых олигонуклеотидов в клетках MDCK, инфицированных вирусом птичьего гриппа А (H5N1). Молекуляр. биология. 51, 717–723.
Lomzov A.A., Kupryushkin M.S., Shernyukov A.V., Nekrasov M.D., Dovydenko I.S., Stetsenko D.A., Pyshnyi D.V. (2019) Diastereomers of a mono-substituted phosphoryl guanidine trideoxyribonucleotide: isolation and properties. Biochem. Biophys. Res. Commun. 513, 807–811.
Буракова Е.А., Держалова А.Ш., Челобанов Б.П., Фокина А.А., Стеценко Д.А (2019) Новые производные олигонуклеотидов, содержащие N-(сульфонил)-фосфорамидные группы. Биоорган. химия. 45, 662–668.
Derzhalova A., Markov O., Fokina A., Shiohama Y., Zatsepin T., Fujii M., Zenkova M., Stetsenko D. (2021) Novel lipid-oligonucleotide conjugates containing long-chain sulfonyl phosphoramidate groups: synthesis and biological properties. Appl. Sci. 11, 1174.
Heindl D. Polynucleotide containing a phosphate mimetic. Canadian Patent 2627208, September 12, 2006.
Heindl D., Kessler D., Schube A., Thuer W., Giraut A. (2008) Easy method for the synthesis of labeled oligonucleotides. Nucl. Acids Symp. Ser. 52, 405–406.
Santorelli A., Gothelf K.V. (2022) Conjugation of chemical handles and functional moieties to DNA during solid phase synthesis with sulfonyl azides. Nucl. Acids Res. 50, 7235–7246.
Patutina O.A., Gaponova (Miroshnichenko) S.K., Sen’kova A.V., Savin I.A., Gladkikh D.V., Burakova E.A., Fokina A.A., Maslov M.A., Shmendel’ E.V., Wood M.J.A., Vlassov V.V., Altman S., Stetsenko D.A., Zenkova M.A. (2020) Mesyl phosphoramidate backbone modified antisense oligonucleotides targeting miR-21 with enhanced in vivo therapeutic potency. Proc. Natl. Acad. Sci. USA. 117, 32370–32379.
Hammond S.M., Sergeeva O.V., Melnikov P.A., Zatsepin T.S., Stetsenko D.A., Wood M.J.A. (2021) Mesyl phosphoramidate oligonucleotides as potential splice switching agents: impact of backbone structure on activity and intracellular localization. Nucl. Acid Ther. 31, 190–200.
Anderson B.A., Freestone G.C., Low A., De-Hoyos C.L., Iii W.J.D., Østergaard M.E., Migawa M.T., Fazio M., Wan W.B., Berdeja A., Scandalis E., Burel S.A., Vickers T.A., Crooke S.T., Swayze E.E., Liang X., Seth P.P. (2021) Towards next generation antisense oligonucleotides: mesylphosphoramidate modification improves therapeutic index and duration of effect of gapmer antisense oligonucleotides. Nucl. Acids Res. 49, 9026–9041.
Zhang L., Liang X.H., De Hoyos CL., Migawa M., Nichols J.G., Freestone G., Tian J., Seth P.P., Crooke S.T. (2022) The combination of mesyl-phosphoramidate inter-nucleotide linkages and 2'-O-methyl in selected positions in the antisense oligonucleotide enhances the performance of RNaseH1 active PS-ASOs. Nucl. Acid Ther. 32, 5. https://doi.org/10.1089/nat.2022.0005
Останин А.А., Леплина О.Ю., Буракова Е.A., Тыринова Т.В., Фокина А.A., Проскурина А.С., Богачев С.С., Стеценко Д.А., Черных Е.Р. (2020) CpG олигонуклеотиды с модифицированными фосфатными группами индуцируют созревание миелоидных дендритных клеток человека in vitro. Вавиловский журн. генетики и селекции. 24, 653–660.
Fokina A., Wang M., Ilyina A., Klabenkova K., Burakova E., Chelobanov B., Stetsenko D. (2018) Analysis of new charge-neutral DNA/RNA analogues phosphoryl guanidine oligonucleotides (PGO) by gel electrophoresis. Anal. Biochem. 555, 9–11.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


