Молекулярная биология, 2023, T. 57, № 2, стр. 330-339
Факторы, влияющие на стабильность тримерной формы 2'-дезоксиуридин-5'-трифосфатнуклеотидгидролазы Escherichia coli
А. В. Юдкина a, b, Е. А. Коваленко c, А. В. Ендуткин a, Е. П. Панфёрова a, А. А. Кириленко c, А. А. Коханенко c, Д. О. Жарков a, b, *
a Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Новосибирский государственный университет
630090 Новосибирск, Россия
c Томский государственный университет
634050 Томск, Россия
* E-mail: dzharkov@niboch.nsc.ru
Поступила в редакцию 29.07.2022
После доработки 16.08.2022
Принята к публикации 16.08.2022
- EDN: EEJRNT
- DOI: 10.31857/S0026898423020246
Аннотация
Фермент 2'-дезоксиуридин-5′-трифосфатнуклеотидгидролаза (Dut), гидролизующий dUTP до dUMP и пирофосфата, предотвращает ошибочное включение dUMP в ДНК из метаболического пула dUTP и рассматривается как перспективная фармакологическая мишень для антиметаболитной терапии. Активный фермент Dut представляет собой тример, связывающий субстрат в межсубъединичной области. С использованием высокоскоростной наномасштабной дифференциальной сканирующей флуориметрии (nanoDSF) нами изучено влияние различных физико-химических факторов на стабильность тримера Dut Escherichia coli. В отличие от мономерных белков температурная денатурация Dut происходит в два этапа, первый из которых соответствует распаду тримера до мономерных субъединиц. Показано, что основной вклад в стабилизацию тримера вносят гидрофобные взаимодействия и водородные связи на интерфейсах взаимодействия между субъединицами. Тример Dut частично стабилизируется при связывании нуклеотидных лигандов. В целом метод nanoDSF удобен для скрининга низкомолекулярных соединений, способных дестабилизировать активный тример Dut.
В процессе жизнедеятельности организма ДНК постоянно подвергается спонтанной химической модификации даже при нормальных физиологических условиях [1]. Для предотвращения неблагоприятных последствий повреждения ДНК в клетке существуют системы репарации, которые узнают и удаляют поврежденные звенья ДНК, сохраняя генетическую информацию [2]. Кроме того, неканонические нуклеотиды в геномной ДНК могут появляться в результате включения ДНК-полимеразами из пула мононуклеотидов, где они возникают при повреждении или присутствуют как метаболиты. Последнее особенно характерно для dUMP – основания Ura в норме в геномной ДНК отсутствуют, но могут появляться либо за счет дезаминирования оснований Cyt, либо (с гораздо более высокой частотой) при включении dUMP из пула dUTP – метаболического предшественника dTTP [3, 4].
Для предотвращения ошибочного включения dUMP в ДНК клеточный пул dUTP строго контролируется 2'-дезоксиуридин-5'-трифосфатнуклеотидгидролазой (Dut; [КФ 3.6.1.23]), которая катализирует реакцию гидролиза dUTP до dUMP и пирофосфата [5, 6]. Отсутствие активности Dut приводит к дисбалансу внутриклеточного пула dUTP/dTTP, в результате чего в геномной ДНК накапливается dUMP. Удаление dUMP системами репарации приводит к образованию большого числа однонуклеотидных брешей и, во многих случаях, двухцепочечных разрывов, что приводит к гибели активно делящихся клеток [3, 4]. Штаммы Escherichia coli с дефицитом гена dut нежизнеспособны в отсутствие рекомбинации [7–9], а мыши с нокаутом dut (dut–/–) погибают на ранней стадии эмбрионального развития [10]. В связи с этим белок Dut в настоящее время рассматривается как перспективная фармакологическая мишень для антиметаболитной терапии инфекций и злокачественных новообразований.
Анализ последовательностей и пространственных структур белков Dut показывает, что их можно разделить на два класса – гомотримерные, обнаруживаемые в большинстве живых организмов, и реже встречающиеся гомодимерные [5, 6]. Хорошо изученные ферменты Dut E. coli и человека относятся к белкам первого класса. Получение кристаллических структур Dut высокого разрешения, в том числе в комплексе с субстратом [11–18], позволило установить многие аспекты каталитического механизма этого фермента. Гидролиз субстрата инициируется нуклеофильной атакой по атому Pα dUTP молекулой воды, активированной консервативным остатком Asp активного центра фермента. Связывание субстрата в каталитически компетентной конформации достигается за счет взаимодействия трифосфатного фрагмента субстрата с ионом Mg2+, выступающим в роли кофермента, и микроокружением активного центра [15, 19, 20]. Формирование симметричного гомотримера критически важно для каталитической активности Dut, поскольку связывание субстрата происходит в межсубъединичной области, и каждый активный центр сформирован консервативными аминокислотными остатками всех трех субъединиц [21]. В последнее время разработка соединений, направленных на дестабилизацию белковых комплексов, представляет собой активно развивающуюся область фармакологической химии [22, 23], и малые молекулы, дестабилизирующие тример Dut, могли бы послужить основой для конструирования новых лекарственных средств.
Несмотря на то что механизм действия тримера Dut хорошо охарактеризован, само образование активного тримера изучено гораздо хуже. В настоящей работе с использованием метода высокоскоростной наномасштабной дифференциальной сканирующей флуориметрии (nanoDSF [24–26]) исследовано влияние различных физико-химических факторов на стабильность тримера Dut E. coli.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использовали штаммы E. coli BL21(DE3) Star (F–ompT hsdSB (rB–mB–) gal dcm lon rne131 λDE3) (“ThermoFisher Scientific”, США) и DH5α (F–endA1 glnV44 thi-1 recA1 relA1 gyrA96 deoR nupG purB20 φ80dlacZΔM15 Δ(lacZYA-argF)U169, hsdR17(rK–mK+), λ–) (“New England Biolabs”, США), плазмиды pBlueScript II SK(–) (“Agilent Technologies”, США) и pET-23с(+) (“Merck”, Германия), рестриктазы BamHI, EcoRV, FauNDI, ДНК-лигазу бактериофага T4 (все “Сибэнзим”, Россия), dUTP, dUMP, dAMP, dCMP, dGMP и dTMP (“Биосан”, Россия).
Клонирование гена dut E. coli. Последовательность гена dut E. coli была амплифицирована с одиночной колонии штамма DH5α с использованием праймеров 5'-TTTTTTGATATCATATGAAAAAAATCGACGTTAAGATTC-3' и 5'-TTTTTTGATATCGGATCCTGACGACCAGAGTGACCAAAG-3' и клонирована в вектор pBlueScript II SK(–) по сайту EcoRV. После подтверждения последовательности секвенированием по Сэнгеру фрагмент размером 456 п.н., содержащий ген dut, переклонировали в вектор pET-23с(+) по фланкирующим целевой ген сайтам NdeI (FauNDI) и BamHI. Полученная плазмида pET-23c-Dut кодирует белок Dut, несущий на C-конце пептид His6, под промотором РНК-полимеразы бактериофага T7.
Выделение белка Dut. Клетки E. coli BL21(DE3) Star, трансформированные плазмидой pET-23c-Dut, выращивали при 37°C на среде LB в присутствии соответствующего антибиотика до оптической плотности OD600 = 0.8. Экспрессию индуцировали добавлением изопропил-β-D-1-тиогалактопиранозида до концентрации 1 мМ. Клетки культивировали в течение 3 ч при 37°C, затем осаждали центрифугированием при 6000 g в течение 20 мин при 10°C. Дальнейшие процедуры проводили на льду или при 4°C. Биомассу ресуспендировали в 50 мМ Трис-HCl-буфере (pH 7.5), содержащем 500 мM NaCl (буфер A). Клетки разрушали ультразвуком, суспензию центрифугировали при 14 000 g в течение 30 мин при 4°C. Супернатант пропускали через фильтр с размером пор 0.45 мкм и наносили на сорбент IMAC SepFast (“BioToolomics”, Великобритания), насыщенный ионами Ni2+. Сорбент промывали буфером A и проводили элюцию градиентом 50–500 мМ имидазола в буфере A. Фракции, содержащие целевой белок, разбавляли 4 объемами буфера B (50 мМ Трис-HCl pH 7.5, 1 мМ дитиотреитол и 1 мМ EDTА) и наносили на сорбент Q-сефарозу (“Danaher”, США), уравновешенную буфером B с добавлением 100 мМ NaCl. Сорбент промывали буфером B и вели элюцию градиентом 100–1000 мМ NaCl в буфере B. Наиболее гомогенные фракции, содержащие целевой белок, объединяли, диализовали против буфера, содержащего 50 мM Tрис-HCl (pH 7.5), 100 мM NaCl, 50%-ный глицерин, хранили при –20°C. Концентрацию белка определяли спектрофотометрически на приборе NanoDrop One (“ThermoFisher Scientific”). Выход целевого белка составил 17.4 мг с 1 л культуры.
Кинетика гидролиза dUTP. Реакционная смесь содержала 0.5 нМ Dut (по мономерной форме), 50 мM Трис-HCl (pH 7.5), 5 мM MgCl2 и 100 мM NaCl, концентрацию dUTP варьировали в диапазоне 0.5–100 мкМ. Реакцию вели при 37°С в течение 5 мин и останавливали прогреванием в течение 2 мин при 95°С. Продукты реакции анализировали методом высокоэффективной обращеннофазовой жидкостной хроматографии с использованием хроматографа Милихром А-02, оборудованного колонкой ProntoSIL-120-5-C18 (“Эконова”, Россия). Буфер для нанесения пробы содержал 50 мМ ацетат триэтиламмония, для элюции использовали 0–50%-ный градиент ацетонитрила при скорости подачи 150 мкл/мин и температуре 35°С. Поглощение измеряли на длине волны 260 нм. Хроматограммы анализировали в программе МультиХром-СПЕКТР путем измерения площади под пиками dUMP и dUTP. Скорости образования продукта описывали уравнением Михаэлиса–Ментен, параметры уравнения определяли из данных пяти независимых экспериментов нелинейной регрессией гиперболической функции в программе SigmaPlot v11.0 (SPSS, США).
Измерения методом высокоскоростной nanoDSF. Зависимость собственной флуоресценции белка от температуры измеряли при возбуждении на длине волны 280 нм и испускании на длинах волн 330 и 350 нм на установке Tycho (“Nanotemper Technologies”, Германия) в буфере, содержащем 25 мМ Na-фосфатный буфер (pH 7.5) и 1 или 5 мкМ Dut (по тримерной форме). Измерения производили в капилляре объемом 10 мкл при скорости нагрева 0.5°C/c. В качестве основного измеряемого параметра использовали соотношение флуоресценции на длинах волн 350 и 330 нм (F350/F330), которое не зависит от концентрации белка и чувствительно к окружению остатков Trp [27]. Влияние концентрации NaCl изучали в том же буфере, но с равномерно возрастающей концентрацией NaCl от 0 до 1 М с шагом 100 мМ и концентрацией Dut 5 мкМ. Влияние гидрофобных взаимодействий исследовали в том же буфере, дополнительно содержащем 100 мМ NaCl и этанол в концентрации 0–20%. Влияние молекулярного краудинга изучали аналогичным способом, при этом массовую долю полиэтиленгликоля со средней молекулярной массой 4000 Да (ПЭГ 4000) варьировали от 0 до 30%. Значение pH, оптимальное для тримеризации, подбирали, используя Na-фосфатный буфер с диапазоном pH 4.0–8.8 в присутствии 100 мМ NaCl. При изучении связывания dNMP с тримером Dut в смеси присутствовали 100 мМ NaCl и, при необходимости, 5 мМ MgCl2; лиганды добавляли в концентрации 0–30 мМ (dUMP) или 10 мМ (прочие dNMP). Все данные получены по результатам двух–четырех независимых экспериментов. Параметры плавления рассчитывали с использованием программы MoltenProt [26] и собственного программного обеспечения прибора Tycho.
Структурный анализ. Межмолекулярные взаимодействия в тримере Dut анализировали с использованием программ PISA [28] и GETAREA [29]. Для визуализации структур использовали программу PyMol (“Schrödinger”, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клонирование гена dut и выделение рекомбинантного белка Dut E. coli
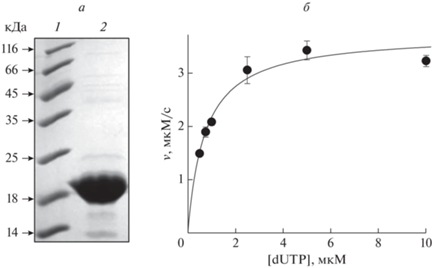
Ген dut амплифицировали из геномной ДНК E. coli и клонировали в вектор pET-23c для последующей продукции белка с C-концевым гексагистидиновым пептидом. Анализ структур тримера Dut в свободном виде и в комплексе с dUTP и его аналогами [11, 12, 14, 15, 17, 18] показывает, что пептид His6 на C-конце мономера не будет мешать ассоциации субъединиц в тример и проявлению ферментативной активности. Индуцированный синтез Dut в клетках E. coli штамма BL21(DE3) Star при 37°С проходил эффективно с высоким содержанием белка в растворимой фракции. После металлхелатной аффинной хроматографии и анионообменной хроматографии целевой белок молекулярной массой ~18 кДа (расчетная молекулярная масса мономера Dut 17.7 кДа) был более чем на 95% гомогенен (рис. 1а). Значения кинетических параметров реакции гидролиза dUTP, измеренных в условиях стационарной кинетики методом высокоэффективной обращеннофазовой жидкостной хроматографии (рис. 1б) составили 7.2 ± 0.2 с–1 для kcat и 0.63 ± 0.08 мкМ для KM, что близко к опубликованным данным [15, 19, 20] и свидетельствует об эффективной сборке Dut в каталитически активный тример.
Рис. 1.
Выделение и ферментативная активность Dut. а – Фотография геля, окрашенного кумасси голубым, после анализа препарата Dut (дорожка 2) электрофорезом в системе Лэммли. 1 – Набор маркеров молекулярной массы. б – Зависимость скорости реакции гидролиза dUTP ферментом Dut от концентрации субстрата. Приведены средние значения и стандартная ошибка, вычисленные по пяти независимым экспериментам, кривая соответствует зависимости Михаэлиса–Ментен v = kcat[E]0[S]/(KM+[S]).
Характеристика температурной денатурации белка Dut методом nanoDSF
Факторы, влияющие на стабильность тримера Dut, изучали с использованием метода nanoDSF, основанного на переходах интенсивности флуоресценции белка при повышении температуры [24–26]. Формально денатурация белка в режиме, характерном для высокоскоростной nanoDSF (>10°C/мин), не является равновесной, но из-за очень малых объемов анализируемого образца процесс приближается к равновесному, что позволяет использовать температуру перехода между состояниями с разной флуоресценцией как величину, характеризующую плавление белковой глобулы. Флуоресценция белков обусловлена в основном флуоресценцией боковых радикалов остатков Trp, а ее изменение при плавлении – изменением окружения (в основном, полярности окружения) этих остатков [30]. Известные структуры тримера Dut демонстрируют уникальное расположение триптофанов: каждый мономер Dut содержит всего один остаток Trp, которые при сборке белка в тример располагаются в межсубъединичной полости, контактируя друг с другом (рис. 2а). Доступная растворителю поверхность каждого остатка составляет 12.9 Å2 (5.4% относительно усредненной доступности в трипептиде Gly-Trp-Gly), что позволяет классифицировать Trp в тримере Dut как внутренний. Таким образом, можно ожидать, что с повышением температуры интенсивность флуоресценции Trp будет меняться при распаде тримера Dut, а затем при денатурации мономера.
Рис. 2.
а – Расположение остатков Trp в структуре Dut (номер в базе данных Protein Data Bank 6HDE [18]). б – График зависимости интенсивности флуоресценции Dut от температуры при концентрациях белка по тримеру 1 мкМ (темно-серые точки) и 5 мкМ (светло-серые точки) в отсутствие NaCl. Точками обозначены результаты отдельных измерений, линиями – сглаженный профиль зависимости. На врезке изображен аналогичный график денатурации бычьего сывороточного альбумина в тех же условиях.
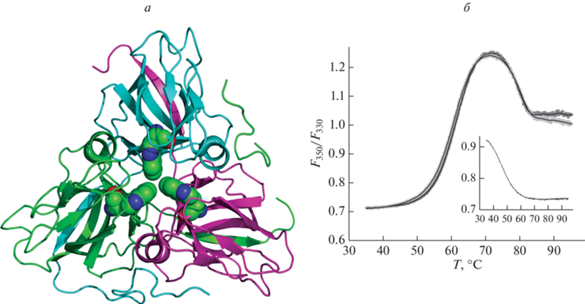
На рис. 2б показаны кривые изменения флуоресценции белка Dut при плавлении. В отличие от мономерного белка – бычьего сывороточного альбумина (БСА; рис. 2б, врезка), у которого наблюдался единственный температурный переход при 62.1 C, на кривых плавления Dut присутствовали два перехода, первый из которых сопровождался повышением, а второй – снижением флуоресценции. Ввиду того, что мономер Dut содержит единственный остаток Trp, весьма вероятно, что первый переход (и соответствующая ему температура плавления Т1) представляет собой диссоциацию субъединиц тримера Dut, в то время как второй переход (Т2) представляет собой плавление мономерных субъединиц. Альтернативные объяснения первого температурного перехода (например, общее изменение структуры внутренней части тримера без распада всего комплекса) маловероятны ввиду большого изменения флуоресценции, которое почти в 2 раза превосходит изменение при втором переходе или при плавлении БСА. Температуры T1 и T2, определенные в соответствии с равновесной моделью трех состояний и не предполагающей равновесия эмпирической моделью трех состояний [26], отличались незначительно (T1 = 62.5 C, T2 = 76.7 C для равновесной модели, T1 = 61.2 C, T2 = 78.8 C для эмпирической модели для кривой на рис. 2б). Далее использовали эмпирическую модель, поскольку она давала меньшее отклонение от экспериментальных данных. При использовании двух концентраций белка (1 и 5 мкМ) профили флуоресценции совпадали (рис. 2б), что указывает на стабильность тримера в этом концентрационном диапазоне в начальных условиях. Помимо точек температурных переходов, при анализе кривых плавления принимали во внимание значение максимума флуоресценции, который зависит от концентрации и удельной интенсивности флуоресценции промежуточного состояния (мономера Dut).
Тример Dut преимущественно стабилизируется гидрофобными взаимодействиями и водородными связями
Для изучения факторов, влияющих на стабильность тримера Dut, сначала определили зависимость вида кривых плавления от ионной силы раствора (рис. 3). Рост концентрации NaCl (0–±1000 мМ) сопровождался заметным повышением значения T1 c (61.2 до 75.8 C). Наблюдалось также изменение T2, однако оно имело меньший масштаб (повышение с 79.7 до 84.4 C). Значения максимума флуоресценции при этом снижались практически симметрично с повышением T1 (рис. 3б). Такая картина характерна для ситуации, при которой с ростом ионной силы относительная концентрация промежуточного состояния снижается из-за сближения T1 и T2 при незначительном изменении удельной интенсивности флуоресценции промежуточного состояния. Таким образом, возрастание ионной силы раствора ведет к стабилизации тримера Dut.
Рис. 3.
Факторы, влияющие на стабильность тримера Dut. а – Кривые плавления Dut при различных концентрациях NaCl (0–1000 мМ, шаг 100 мМ). б–д – Графики зависимости температуры диссоциации тримера Dut (T1, черные кружки) и максимума флуоресценции (белые кружки) от концентрации NaCl (б), концентрации этанола (в), pH (г) и концентрации ПЭГ 4000 (д). Для удобства сравнения оси T1 и F350/F330 на графиках б–д имеют одинаковый масштаб. Приведены средние значения и стандартная ошибка, вычисленные по двум–четырем независимым экспериментам.

Совершенно иная картина наблюдалась при повышении гидрофобности раствора за счет увеличения концентрации в нем этанола. Влияние этанола на стабильность тримера Dut исследовали в диапазоне концентраций 0–20% (v/v), где отсутствует явное влияние на структуру и растворимость глобулярных белков [31]. При концентрации этанола 30% и выше в растворе Dut наблюдалось выпадение осадка. При повышении концентрации этанола наблюдалось выраженное снижение температуры диссоциации тримера – с 65.4 до 48.2°C (рис. 3в). При этом снижалось также значение максимума флуоресценции, что, очевидно, объясняется повышением гидрофобности окружения остатков Trp в водно-органическом растворителе. На начальных участках кривых плавления (T ≤ 40°C) флуоресценция образцов с разным содержанием этанола не отличалась, что подтверждает низкую доступность остатков Trp в составе тримера для растворителя. Эти данные свидетельствуют о значительном снижении стабильности тримерной формы Dut при повышении концентрации этанола. В совокупности с повышением стабильности тримера при возрастании ионной силы это говорит о критической роли гидрофобных взаимодействий для ассоциации субъединиц Dut.
Вклад в стабилизацию тримера могут вносить также водородные связи, однако из-за того, что при сольватации поверхности они замещаются на связи с водой, в среднем каждая водородная связь на интерфейсах в белок-белковых комплексах вносит лишь около –0.5 ккал/моль [28]. Водородные связи, необходимые для межсубъединичного взаимодействия, могут появляться или исчезать при изменении состояния ионизации боковых радикалов аминокислотных остатков. Для установления pH-оптимума существования Dut в тримерном состоянии измеряли профили температурной диссоциации тримера Dut в диапазоне pH 4.0–8.8 (рис. 3г). Значения T1 увеличивались с повышением pH и достигали стабильности при pH ≥ 6.4. Дестабилизация тримера при снижении pH была сходной с дестабилизацией при увеличении гидрофобности среды. Как и в случае NaCl, значения максимальной флуоресценции изменялись практически симметрично с изменением T1, однако это изменение имело меньшую амплитуду. Таким образом, максимальная стабильность тримера Dut наблюдается при околофизиологических значениях pH. Наблюдаемое значение pH для перехода между менее стабильной и более стабильной формой тримера составляет около 5.7, что ближе всего к значению pKa бокового радикала His (~6.0). В структуре Dut остатки His76 и His94 образуют межсубъединичные водородные связи с остатками Ser100 и Asp137/Thr139, соответственно. Возможно, изменение состояния их ионизации влияет на стабильность тримера.
Расчеты на основе опубликованных структур подтверждают важную роль гидрофобных взаимодействий и водородных связей в стабилизации тримера Dut (табл. 1). Образование тримера сопровождается значительным выигрышем в предсказанной энергии сольватации/десольватации поверхности (–25.7 ± 3.0 ккал/моль на каждый из трех интерфейсов взаимодействия). Также на интерфейсах наблюдается значительное число водородных связей, энергетический вклад которых в стабилизацию тримера несколько уступает гидрофобным взаимодействиям (–17.5 ± 3.6 ккал/моль из расчета –0.5 ккал/моль/связь [28]). Число солевых мостиков на интерфейсах взаимодействия в тримере Dut невелико и с учетом того, что каждый из них в среднем вносит –0.3 ккал/моль, они лишь незначительно стабилизируют комплекс. Интересно, что гибкие “хвосты” каждой субъединицы в кристаллической структуре тримера демонстрируют определенную гетерогенность взаимодействия с соседними субъединицами, что проявляется в кажущейся неэквивалентности интерфейсов (табл. 1) и теоретически может вызывать вариабельность микроскопических констант взаимодействия каждого из трех активных центров с субстратом.
Таблица 1.
Теоретически рассчитанные характеристики интерфейсов взаимодействия между субъединицами тримера Duta
| Субъединицы, образующие интерфейс | Площадь, Å2 | ΔG° образования, ккал/мольб | Число водородных связей | Число солевых мостиков |
|---|---|---|---|---|
| A + B | 2326.3 | –27.8 | 37 | 6 |
| B + C | 2085.0 | –22.3 | 41 | 5 |
| A + C | 1847.4 | –27.0 | 27 | 3 |
Живые клетки содержат высокие концентрации различных макромолекул, что зачастую приводит к усилению межмолекулярных взаимодействий за счет снижения объема, доступного молекулам белка (эффект молекулярного краудинга). Для анализа этого эффекта в молекулярно-биологических системах часто используют инертные неструктурированные высокомолекулярные соединения, например, полиэтиленгликоль. Добавление ПЭГ 4000 практически не влияло на стабильность тримера Dut, однако вызывало снижение максимума флуоресценции, сравнимое с эффектом этанола (рис. 3д). Возможно, это связано с меньшей доступностью воды для остатков Trp в мономере Dut в условиях молекулярного краудинга.
Стабильность тримера Dut в присутствии нуклеотидных лигандов
Сродство Dut к продукту реакции – dUMP, и к ряду других несубстратных нуклеотидных лигандов составляет порядка 0.2–10 мМ [17, 19]. Для определения влияния лигандов в нуклеотидсвязывающем центре на стабильность тримера Dut оценили температурную денатурацию Dut в присутствии 0.1–30 мМ dUMP (рис. 4а). В возрастающих концентрациях dUMP умеренно стабилизировал тример (T1 повышалась с 66.2°C в отсутствие dUMP до 72.8 C в присутствии 30 мМ dUMP). Параллельно с этим снижался максимальный уровень флуоресценции. Поскольку в структуре Dut в нуклеотидсвязывающем центре находится также каталитический ион Mg2+, сравнили плавление Dut в присутствии и в отсутствие MgCl2, однако профили денатурации оказались практически идентичными (данные не приведены).
Рис. 4.
Стабильность тримера Dut в присутствии нуклеотидных лигандов. а – Графики зависимости температуры диссоциации тримера Dut (T1, черные кружки) и максимума флуоресценции (белые кружки) от концентрации dUMP. б, в – Температура диссоциации тримера Dut (б) и максимум флуоресценции (в) в присутствии разных dNMP (10 мМ). Оси T1 и F350/F330 имеют тот же масштаб, что и на рис. 3. Приведены средние значения и стандартная ошибка, определенные по трем–четырем независимым экспериментам.

Сравнение влияния разных dNMP на стабильность тримера Dut при фиксированной концентрации (10 мМ) показало, что степень стабилизации убывает в порядке dUMP > dAMP > dTMP ~ ~ dGMP ~ dCMP. При этом наибольшее влияние на максимальную флуоресценцию оказывали dTMP и dCMP, слабо стабилизирующие тример. Возможное взаимодействие лигандов нуклеотидной и другой природы с мономером Dut требует отдельного исследования. Общая флуоресценция образцов в присутствии лигандов снижалась в 4–5 раз, что, очевидно, связано с поглощением растворами нуклеотидов на длине волны 280 нм, использованной для возбуждения флуоресценции Dut.
Таким образом, нами показано, что метод высокоскоростной наномасштабной дифференциальной сканирующей флуориметрии можно успешно применять для анализа стабильности каталитически активной тримерной формы белка Dut – жизненно важного фермента бактерий и эукариот. Основной вклад в стабилизацию тримера вносят гидрофобные взаимодействия и водородные связи. В настоящее время существует большой интерес к поиску низкомолекулярных соединений, разрушающих или стабилизирующих интерфейсы белок-белковых взаимодействий, как возможных фармакологических средств [22, 23]. Метод nanoDSF дает удобный инструмент для скрининга соединений на способность нарушать стабильность тримера Dut с целью поиска новых антиметаболитов для борьбы с бактериальными инфекциями.
Исследование поддержано Программой развития Томского государственного университета (Приоритет-2030). Структурный анализ выполнен при поддержке Министерства науки и высшего образования РФ (соглашение 075-15-2022-263). Секвенирование ДНК выполнено сотрудниками ЦКП “Геномика” СО РАН.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lindahl T. (1993) Instability and decay of the primary structure of DNA. Nature. 362, 709–715.
Friedberg E.C., Walker G.C., Siede W., Wood R.D., Schultz R.A., Ellenberger T. (2006) DNA repair and mutagenesis.Washington, D.C.: ASM Press, 1118 pp.
Berger S.H., Pittman D.L., Wyatt M.D. (2008) Uracil in DNA: consequences for carcinogenesis and chemotherapy. Biochem. Pharmacol. 76, 697–706.
Kavli B., Slupphaug G., Krokan H.E. (2021) Genomic uracil in biology, immunity and cancer. In: DNA Damage, DNA Repair and Disease. Eds Dizdaroglu M., Lloyd R.S. London: Royal Soc. Chem., p. 220–248.
Persson R., Cedergren-Zeppezauer E.S., Wilson K.S. (2001) Homotrimeric dUTPases: structural solutions for specific recognition and hydrolysis of dUTP. Curr. Protein Pept. Sci. 2, 287–300.
Vértessy B.G., Tóth J. (2009) Keeping uracil out of DNA: physiological role, structure and catalytic mechanism of dUTPases. Acc. Chem. Res. 42, 97–106.
Kouzminova E.A., Kuzminov A. (2004) Chromosomal fragmentation in dUTPase-deficient mutants of Escherichia coli and its recombinational repair. Mol. Microbiol. 51, 1279–1295.
Kouzminova E.A., Kuzminov A. (2006) Fragmentation of replicating chromosomes triggered by uracil in DNA. J. Mol. Biol. 355, 20–33.
Ting H., Kouzminova E.A., Kuzminov A. (2008) Synthetic lethality with the dut defect in Escherichia coli reveals layers of DNA damage of increasing complexity due to uracil incorporation. J. Bacteriol. 190, 5841–5854.
Pálinkás H.L., Rácz G.A., Gál Z., Hoffmann O.I., Tihanyi G., Róna G., Gócza E., Hiripi L., Vértessy B.G. (2019) CRISPR/Cas9-mediated knock-out of dUTPase in mice leads to early embryonic lethality. Biomolecules. 9, 136.
Cedergren-Zeppezauer E.S., Larsson G., Nyman P.O., Dauter Z., Wilson K.S. (1992) Crystal structure of a dUTPase. Nature. 355, 740–743.
Larsson G., Svensson L.A., Nyman P.O. (1996) Crystal structure of the Escherichia coli dUTPase in complex with a substrate analogue (dUDP). Nat. Struct. Biol. 3, 532–538.
Mol C.D., Harris J.M., McIntosh E.M., Tainer J.A. (1996) Human dUTP pyrophosphatase: uracil recognition by a β hairpin and active sites formed by three separate subunits. Structure. 4, 1077–1092.
González A., Larsson G., Persson R., Cedergren-Zeppezauer E. (2001) Atomic resolution structure of Escherichia coli dUTPase determined ab initio. Acta Crystallogr. D Biol. Crystallogr. 57, 767–774.
Barabás O., Pongrácz V., Kovári J., Wilmanns M., Vértessy B.G. (2004) Structural insights into the catalytic mechanism of phosphate ester hydrolysis by dUTPase. J. Biol. Chem. 279, 42907–42915.
Varga B., Barabás O., Kovári J., Tóth J., Hunyadi-Gulyás É., Klement É., Medzihradszky K.F., Tölgyesi F., Fidy J., Vértessy B.G. (2007) Active site closure facilitates juxtaposition of reactant atoms for initiation of catalysis by human dUTPase. FEBS Lett. 581, 4783–4788.
Kovári J., Barabás O., Varga B., Békési A., Tölgyesi F., Fidy J., Nagy J., Vértessy B.G. (2008) Methylene substitution at the α–β bridging position within the phosphate chain of dUDP profoundly perturbs ligand accommodation into the dUTPase active site. Proteins. 71, 308–319.
Benedek A., Temesváry-Kis F., Khatanbaatar T., Leveles I., Surányi É.V., Szabó J.E., Wunderlich L., Vértessy B.G. (2019) The role of a key amino acid position in species-specific proteinaceous dUTPase inhibition. Biomolecules. 9, 221.
Larsson G., Nyman P.O., Kvassman J.-O. (1996) Kinetic characterization of dUTPase from Escherichia coli. J. Biol. Chem. 271, 24010–24016.
Mustafi D., Bekesi A., Vertessy B.G., Makinen M.W. (2003) Catalytic and structural role of the metal ion in dUTP pyrophosphatase. Proc. Natl Acad. Sci. USA. 100, 5670–5675.
Fiser A., Vértessy B.G. (2000) Altered subunit communication in subfamilies of trimeric dUTPases. Biochem. Biophys. Res. Commun. 279, 534–542.
Arkin M.R., Wells J.A. (2004) Small-molecule inhibitors of protein–protein interactions: Progressing towards the dream. Nat. Rev. Drug Discov. 3, 301–317.
Petta I., Lievens S., Libert C., Tavernier J., De Bosscher K. (2016) Modulation of protein–protein interactions for the development of novel therapeutics. Mol. Ther. 24, 707–718.
Senisterra G., Chau I., Vedadi M. (2012) Thermal denaturation assays in chemical biology. Assay Drug Dev. Technol. 10, 128–136.
Magnusson A.O., Szekrenyi A., Joosten H.-J., Finnigan J., Charnock S., Fessner W.-D. (2019) nanoDSF as screening tool for enzyme libraries and biotechnology development. FEBS J. 286, 184–204.
Kotov V., Mlynek G., Vesper O., Pletzer M., Wald J., Teixeira-Duarte C.M., Celia H., Garcia-Alai M., Nussberger S., Buchanan S.K., Morais-Cabral J.H., Loew C., Djinovic-Carugo K., Marlovits T.C. (2021) In-depth interrogation of protein thermal unfolding data with MoltenProt. Protein Sci. 30, 201–217.
Eftink M.R. (1994) The use of fluorescence methods to monitor unfolding transitions in proteins. Biophys. J. 66, 482–501.
Krissinel E., Henrick K. (2007) Inference of macromolecular assemblies from crystalline state. J. Mol. Biol. 372, 774–797.
Fraczkiewicz R., Braun W. (1998) Exact and efficient analytical calculation of the accessible surface areas and their gradients for macromolecules. J. Comput. Chem. 19, 319–333.
Vivian J.T., Callis P.R. (2001) Mechanisms of tryptophan fluorescence shifts in proteins. Biophys. J. 80, 2093–2109.
Yoshikawa H., Hirano A., Arakawa T., Shiraki K. (2012) Effects of alcohol on the solubility and structure of native and disulfide-modified bovine serum albumin. Int. J. Biol. Macromol. 50, 1286–1291.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


