Молекулярная биология, 2023, T. 57, № 3, стр. 492-500
Профилирование экспрессии микроРНК в В-крупноклеточной лимфоме
Ю. А. Веряскина a, b, *, С. Е. Титов a, c, И. Б. Ковынев d, С. С. Фёдорова d, Я. Ю. Шебуняева d, О. В. Антоненко a, Т. И. Поспелова d, И. Ф. Жимулёв a
a Институт молекулярной и клеточной биологии Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
b Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
c АО “Вектор-Бест”
630117 Новосибирск, Россия
d Новосибирский государственный медицинский университет Министерства здравоохранения Российской Федерации,
630091 Новосибирск, Россия
* E-mail: microrna@inbox.ru
Поступила в редакцию 10.11.2022
После доработки 05.12.2022
Принята к публикации 13.12.2022
- EDN: CHWPDX
- DOI: 10.31857/S0026898423030175
Аннотация
Неходжкинские лимфомы (НХЛ) представляют собой гетерогенную группу онкологических заболеваний, различающихся по патогенезу и прогнозу. К основным методам лечения НХЛ относятся химиотерапия, иммунохимиотерапия и лучевая терапия. Однако значительная часть этих опухолей отличается химиорезистентностью или быстрым рецидивированием после непродолжительной ремиссии, индуцированной химиотерапией. В связи с этим актуален поиск альтернативных терапевтических циторедуктивных методов. Аберрантная экспрессия микроРНК (miРНК) ‒ один из механизмов возникновения и опухолевой прогрессии злокачественных лимфоидных неоплазий. Мы проанализировали профиль экспрессии miРНК в биопсийном материале лимфоузлов, пораженных диффузной B-крупноклеточной лимфомой (DLBCL). Ключевым материалом исследования стали гистологические препараты лимфатических узлов, полученные в результате эксцизионной диагностической биопсии и обработанные с использованием классических гистоморфологических методов фиксации в формалине. Группу исследования составили пациенты с DLBCL (n = 52), а контрольную – пациенты с реактивной лимфоаденопатией (RL) (n = 40). Показано, что в DLBCL уровень экспрессии miR-150 снижен более чем в 12 раз (p = 3.6 × 10‒15) в сравнении с RL. Биоинформационный анализ выявил участие miR-150 в регуляции гемопоэза и лимфопоэза. Полученные данные позволяют рассматривать miR-150 в качестве перспективной терапевтической мишени, обладающей большим потенциалом в клинической практике.
Согласно классификации гематолимфоидных опухолей WHO-HAEM5, опубликованной Всемирной организации здравоохранения в 2022 году, лимфомы представляют собой гетерогенную группу онкологических заболеваний, различающихся по прогнозу и патогенезу. Неходжкинские лимфомы (НХЛ) делят на В- и Т-клеточные. К основным подтипам НХЛ относятся следующие: диффузная В-крупноклеточная лимфома (DLBCL), фолликулярная лимфома, лимфома Беркитта, хронический лимфолейкоз, ассоциированные со слизистыми оболочками опухоли лимфоидной ткани, лимфома из клеток мантийной зоны и лимфома маргинальной зоны. Классификация лимфом основана на комбинации данных морфологии, иммунофенотипа, специфических генетических аномалий и клинических признаков заболевания. У пациентов с диагностированным заболеванием клиническое течение крайне вариабельно: от индолентного до агрессивного. Так что стратегии их лечения и ответа на терапию тоже сильно различаются, как и клинические результаты. Основными методами лечения НХЛ считаются химиотерапия, иммунохимиотерапия и лучевая терапия, однако значительная часть этого типа опухолей химиорезистентна или рецидивирует после лечения [1]. В связи с этим поиск новых терапевтических подходов сохраняет актуальность.
Успехи в изучении молекулярных механизмов, лежащих в основе лимфомагенеза, привели к разработке таргетных препаратов [2]. В последние годы в качестве таких лекарственных средств рассматривают микроРНК (miРНК) [3]. Аберрантная экспрессия miРНК описана для большинства видов злокачественных опухолей, включая лимфомы [4]. В экспериментах in vitro показано, что использование длинной интерферирующей РНК для одновременного ингибирования 13 онко-miРНК значительно снижало клеточную пролиферацию, индуцировало остановку клеточного цикла и апоптоз в клеточных линиях DLBCL в основном за счет повышения экспрессии белков PTEN, p27Kip1, TIMP3, RECK и подавления p38/MAPK, Survivin, CDK4, c-Myc [5]. H. Due и соавт. [6] сообщали, что повышение уровня miR-155 в клеточных линиях DLBCL индуцировало изменения в чувствительности этих клеток к винкристину. Кроме того, трансфекция миметиков miR-197 и miR-187 в клеточные линии DLBCL повышала их чувствительность к доксорубицину, усиливая апоптоз [7, 8]. Повышение экспрессии miR-10а и miR-26а ингибировало пролиферацию и индуцировало апоптоз клеток DLBCL [9, 10]. Повышение экспрессии miR-223-3p снижало пролиферацию и ускоряло апоптоз клеток в мантийноклеточной лимфоме in vitro и in vivo через модулирование сигнального пути CHUK/NF-κB2 [11]. miR-373 значительно замедляла рост клеток Т-клеточной лимфомы [12]. M. Morales-Martinez и соавт. [13] отмечали, что miR-7 регулирует химиочувствительность НХЛ посредством негативной регуляции генов YY1 и KLF4 [13]. Показано, что miR-150 можно рассматривать в качестве потенциального терапевтического сенсибилизатора, который регулирует путь PI3K/AKT/mTOR при лечении NK/T-клеточной лимфомы [14]. K. Musilova и соавт. [15] показали, что трансфекция miR-150 в клетки фолликулярной лимфомы приводила к значительному снижению доли клеток в S-фазе, что коррелировало со снижением пролиферации опухолевых клеток.
Возможность доставки синтетических миметиков или ингибиторов miРНК открыла новые терапевтические перспективы. MRX34 (миметик miR-34), mesomiR-1 (миметик miR-16) и кобомарсен (анти-miR-155) проявляли противоопухолевую активность в клинических испытаниях фазы I. Эти исследования не были специально разработаны для НХЛ, но в них участвовали пациенты с B-клеточными НХЛ [3, 16, 17].
Эти данные подтверждают терапевтический потенциал miРНК. Персонализированная комбинированная терапия может напрямую воздействовать на главную проблему при лечении опухолей различной локализации – лекарственную устойчивость.
Целью работы было определение профиля экспрессии miРНК в материале лимфоузлов DLBCL и поиск miРНК, которые в перспективе могут быть использованы в качестве таргетных препаратов, позволяющих максимально персонализировать проводимую терапию.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемые группы. В экспериментальную группу вошли пациенты с DLBCL (n = 52). Контрольную группу составили пациенты с реактивной лимфоаденопатией (RL) (n = 40). От каждого пациента было получено письменное информированное согласие, все данные обезличены. Исследование было одобрено Этическим комитетом Новосибирского государственного медицинского университета.
Исследование проведено на гистологических препаратах биоптатов опухолевых лимфатических узлов, которые были обработаны с использованием классических методов фиксации в формалине, обезвоживания в изопропиловом спирте, обезжиривания ксилолом и пропитаны парафином.
Экстракция РНК. Для выделения нуклеиновых кислот из фиксированных в формалине парафинированных образцов проводили их депарафинизацию. Для этого в пробирку, содержащую 3 парафиновых среза ткани лимфатического узла толщиной 15 мкм, добавляли 1 мл минерального масла и тщательно перемешивали в течение 10 с на вортексе (“BioSan”, Латвия), затем пробирку переносили в термошейкер и инкубировали при 65°С и частоте перемешивания 1300 об/мин в течение 2 мин. Полученную суспензию центрифугировали при 13 000‒15 000 g в течение 4 мин и удаляли надосадочную жидкость. В осадок вносили 1 мл 96%-ного этанола, перемешивали в течение 10 с на вортексе и центрифугировали при 13 000‒15 000 g в течение 4 мин. Надосадочную жидкость удаляли, а в осадок вносили 1 мл 70%-ного этанола, центрифугировали при той же скорости в течение 2 мин. Полученный осадок использовали для выделения нуклеиновых кислот.
Выделение нуклеиновых кислот из образцов проводили с использованием набора реагентов РеалБест экстракция 100 (АО “Вектор-Бест”, Россия).
Выбор miРНК. На основании анализа данных E. Sebestyén и соавт. [18] для исследования были выбраны miРНК, число копий которых в образце превышало 100 единиц, и они были представлены, как минимум, в 80% исследованных авторами образцов. Этим критериям удовлетворяло 29 miРНК: miR-124-3p, -144-5p, -15а-5р, -16-5p, -196b-5p, -221-3p, -29b-3p, -148b-3p, -150-5p, -18a-5p, -183-5p, -185-5p, -205-5p, -20a-5p, -23a-3p, -23b-3p, -26b-5p, -30b-5p, -34a-5p, -451a, -9-5p, -128-3p, -141-3p, -200b-3p, -574-3p, -96-5p, let-7a-5p, let-7c-5p и let-7f-5p. Для нормализации использовали среднее геометрическое значений CT трех miРНК: miR-378-3p, -191-5p и -103a-3p, ‒ которые тоже были выбраны на основе литературных данных [19‒21]. Все олигонуклеотиды были синтезированы в АО “Вектор-Бест”. В зависимости от системы значение Е (эффективность реакции) варьировало от 92.5 до 99.7%.
Обратная транскрипция (ОТ). Синтез кДНК проводили в реакционной смеси объемом 30 мкл, содержащей 3 мкл выделенной РНК, 16.2 мкл 40%-ного раствора трегалозы, 3 мкл 10× буфера для ОТ (500 мM Трис-НCl, рН 8.3 (при 25°C), 500 мM KCl, 40 мМ MgCl2), 3 мкл 4 мМ раствора дезоксинуклеозидтрифосфатов, 3 мкл 10%-ного раствора BSA, 0.32 мкл обратной транскриптазы (АО “Вектор-Бест”), 1.5 мкл 10 мкМ раствора соответствующего праймера для ОТ. Смесь инкубировали в течение 15 мин при 16°С и 15 мин при 42°С с последующей инактивацией в течение 2 мин при 95°С.
ПЦР в реальном времени. Уровни экспрессии miРНК оценивали методом ПЦР в реальном времени на амплификаторе CFX96 (“Bio-Rad Laboratories”, США). Реакционная смесь объемом 30 мкл содержала 3 мкл образца кДНК, ПЦР-буфер (АО “Вектор-Бест”), 0.5 мкМ каждого праймера и 0.25 мкМ зонд. Условия реакции: 2 мин при 50°С, 2 мин при 94°С и 50 циклов денатурации (10 с при 94°С), отжига и элонгации цепи (20 с при 60°С).
Статистический анализ. Статистический анализ выполнен с использованием программы Statistica v13.1 и U-критерия Манна‒Уитни. Значения р < 0.05 считали статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ экспрессии исследуемых miРНК в клинических образцах
Методом ОТ-ПЦР в реальном времени проанализированы уровни экспрессии 29 miРНК: miR-124, -144, -15а, -16, -196b, -221, -29b, -148b, -150, -18a, -183, -185, -205, -20a, -23a, -23b, -26b, -30b, -34a, -451a, -9, -128, -141, -200b, -574, -96, let-7a, let-7c и let-7f ‒ в 52 образцах DLBCL и 40 образцах RL. В образцах DLBCL по сравнению с RL выявлено статистически значимое изменение экспрессии для 21 miРНК: снижение для miR-26b, -30b, -150, -451a, -574, -144, -15a, -16, -196b, -221, -29b, -23a, -23b, -148, -128, let-7a, let-7c, let-7f и повышение для miR-124, -9 и -96 (p < 0.05) (табл. 1).
Таблица 1.
Сравнительный анализ уровней miРНК, дифференциально экспрессируемых в образцах пациентов с DLBCL и RL
| miРНК | Уровень различийа | p-valueb | miРНК | Уровень различийа | p-valueb |
|---|---|---|---|---|---|
| miR-26b | ‒3.64 | 1.5 × 10‒13 | miR-29b | ‒2.12 | 1.1 × 10‒7 |
| miR-30b | ‒1.96 | 1.2 × 10‒4 | let-7c | ‒2.75 | 3 × 10‒6 |
| miR-150 | ‒12.47 | 3.6 × 10‒15 | let-7f | ‒1.76 | 2.9 × 10‒9 |
| miR-451a | ‒2.57 | 4.8 × 10‒3 | miR-9 | 1.55 | 7 × 10‒3 |
| miR-574 | ‒1.56 | 3.3 × 10‒3 | miR-23a | ‒1.35 | 1.7 × 10‒2 |
| let-7a | ‒2.33 | 1.1 × 10‒10 | miR-23b | ‒2.01 | 1 × 10‒3 |
| miR-124 | 1.90 | 1.2 × 10‒2 | miR-96 | 1.54 | 1.9 × 10‒2 |
| miR-144 | ‒1.78 | 5 × 10‒3 | miR-148b | ‒1.83 | 6.2 × 10‒12 |
| miR-15a | ‒1.47 | 1.1 × 10‒4 | miR-128 | ‒2.00 | 4.1 × 10‒7 |
| miR-16 | ‒1.75 | 9 × 10‒6 | miR-221 | ‒2.47 | 1.5 × 10‒4 |
| miR-196b | ‒2.50 | 1.7 × 10‒3 |
Наиболее значимые различия, более чем в 2 раза, в экспрессии miРНК зарегистрированы для 10 представителей: miR-26b, -150, -451a, -196b, -221, -29b, -23b, -128, let-7a и let-7c. Распределение относительных уровней экспрессии этих miРНК, включая медианное значение и межквартильный диапазон, представлено на рис. 1.
Рис. 1.
Относительные уровни дифференциально экспрессируемых miРНК в образцах DLBCL и RL. Горизонтальная черная линия в пределах бокса ‒ медиана, бокс ‒ межквартильный диапазон, усы – диапазон без выбросов, выбросы обозначены кружками. Для всех приведенных miРНК различия в экспрессии были статистически значимыми (p < 0.05 по критерию Манна‒Уитни).
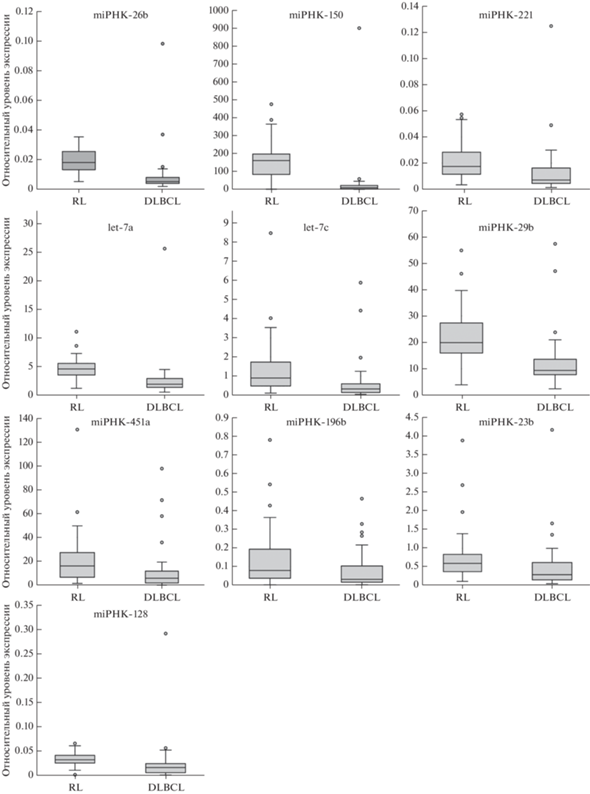
Таким образом, наибольший размах в изменении экспрессии среди исследованных miРНК выявлен для miR-150: ее уровень понижен более чем в 12 раз в клетках DLBCL в сравнении с неопухолевой тканью. По-видимому, аберрантная экспрессия этой miРНК ассоциирована с развитием опухоли.
Биоинформационный анализ генов-мишеней miРНК-150
Понимание механизмов регуляции генов относится к одной из основных задач молекулярной биологии и биоинформатики. С помощью ресурса miRPathDB 2.0 (https://mpd.bioinf.uni-sb.de/) определены экспериментально подтвержденные пути, которые значительно обогащены мишенями miR-150 и нарушения в которых могут быть ассоциированы с DLBCL (табл. 2).
Таблица 2.
Процессы, в регуляции которых участвуют гены-мишени miR-150
| Процесс | p-value | Гены-мишени |
|---|---|---|
| Активация В-клеток | 0.030 | CCR6, EP300, FLT3, MMP14, STAT5B, TP53 |
| Дифференцировка B-клеток | 0.019 | EP300, FLT3, MMP14, STAT5B, TP53 |
| Контроль клеточного цикла | 0.049 | BIRC5, EP300, POLD3, PRKCA, TP53 |
| Гемопоэз | 0.018 | CCR6, CREB1, EP300, FLT3, MMP14, MYB, PRKCA, STAT1, STAT5B, TP53, VEGFA, ZEB1 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Лимфоциты относятся к важнейшим клеточным компонентам иммунной системы. Большинство лимфом происходит из В-лимфоцитов, подвергшихся неопластической трансформации. Подтипы В-клеточной лимфомы гетерогенны в отношении генетических и клинических характеристик [22]. Развитие В-клеток представляет собой сложный процесс, в котором участвуют как факторы транскрипции и цитокины, так и miРНК [23]. S. Koralov и соавт. [24] показали, что в развитии В‑лимфоцитов участвует рибонуклеаза Dicer ‒ ключевой участник процессинга miРНК, ‒ из чего можно сделать вывод о том, что в регуляцию этого биологического процесса вовлечен сложный сигнальный каскад.
Мы провели анализ уровней экспрессии 29 miРНК в образцах DLBCL и RL и выявили наиболее значимые различия, более чем 2 раза, для 10 miРНК: miR-26b, -150, -451a, -196b, -221, -29b, -23b, -128, let-7a и let-7c. Согласно литературным данным, эти miРНК участвуют в регуляции нормального гемопоэза и, следовательно, их аберрантная экспрессия может быть вовлечена в развитие как миелоидных, так и лимфоидных опухолей [25‒31]. Стоит отметить, что экспрессия miR-150 снижена более чем в 12 раз (p = 3.6 × 10‒15) в образцах DLBCL в сравнении с тканями неопухолевых узловых образований. Таким образом, miR-150 может быть одним из ключевых участников злокачественной трансформации В-лимфоцитов.
На сегодняшний день опубликован ряд работ, отражающих роль miРНК в дифференцировке В-клеток и развитии В-клеточных лимфом [32]. miR-150 контролирует дифференцировку В-клеток, воздействуя на фактор транскрипции c-Myb [33]. c-Myb, играет важную роль во время развития В-клеток, в поддержании их пролиферации, а также в контроле клеточного цикла гемопоэтических клеток [34]. Нарушения на каждом из этих биологических процессов способствуют прогрессии опухолей различного генеза, характеризуя c‑Myb в качестве важного звена в развитии как солидных, так и гематологических опухолей. В исследованиях механизмов канцерогенеза лимфомы Беркитта выявлена ключевая роль генов ZDHHC11 и ZDHHC11B в поддержании пути MYC‒miR-150‒MYB, обеспечивающего развитие опухоли [35]. Лимфома Беркитта, как и DLBCL, ‒ это агрессивная В-клеточная лимфома. Показано, что гены MYC, MYB и ZDHHC11 участвуют и в онкогенезе DLBCL [36]. Таким образом, не исключено, что в развитии DLBCL могут быть задействованы аналогичные регуляторные пути, в которые вовлечена miR-150. М. Wang и соавт. [37] идентифицировали miR-150 в качестве супрессора опухоли, снижающего пролиферацию клеток лимфомы Беркитта, определив в качестве мишеней этой miРНК c-Myb и Survivin. В клетках NK/T-клеточной лимфомы повышенная экспрессия miR-150 коррелирует с усилением апоптоза и снижением пролиферации клеток, что подтверждает роль этой miРНК как супрессора; при этом гены DKC1 и AKT2 идентифицированы в качестве ее прямых мишеней [38]. Кроме того, miR-150 участвует в развитии Т-клеток, регулируя экспрессию NOTCH3, а также сигнальный путь AKT3/Bim [39, 40]. Снижение экспрессии miR-150 способствует мультиорганной инвазии и метастазированию Т-клеточной лимфомы за счет усиления экспрессии мишени ‒ CCR6 [41].
C фундаментальной точки зрения miR-150 можно считать регулятором развития лимфом. Кроме того, на сегодняшний день уже показан потенциал этой miРНК в качестве клинико-биологического маркера. Так, М. Mraz и соавт. [42] выявили, что у пациентов c хроническим лимфолейкозом повышенный уровень miR-150 в крови коррелирует с более длительной общей выживаемостью. А Х. Wang и др. [43] показали, что пониженная экспрессия miR-150 коррелирует с более коротким временем общей выживаемости и периодом без прогрессирования у пациентов с первичной желудочно-кишечной формой DLBCL.
Как отмечалось выше, miРНК ‒ это важные регуляторы нормального гемопоэза. В частности, miR-150 регулирует терминальный эритропоэз у человека [44]. J. Lu и соавт. [45] отмечали, что miR-150 модулирует развитие мегакариоцитарно-эритроцитарных предшественников, при этом уровень ее экспрессии значительно снижается в условиях повышенной потребности в эритропоэзе. Очень часто у пациентов с DLBCL заболевание сопровождается анемией, что позволяет рассматривать miR-150 в качестве одного из потенциальных регуляторов и этого физиологического процесса. Так, C. Apple и соавт. [46] обнаружили дифференциальную экспрессию miR-150, miR-223, miR-15а и miR-24 в костном мозге у пациентов с травмой тазобедренного сустава, отмечая важную роль этих miРНК в эритропоэтической дисфункции, связанной с анемией.
Анализ уровней экспрессии miРНК может быть использован в качестве биомаркеров не только в тканях, но и в плазме крови. H. Fayyad-Kazan и соавт. [47] считают, что уровни miR-150 и miR-342 в плазме можно рассматривать как перспективные биомаркеры в диагностике острого миелоидного лейкоза.
Таким образом, можно предположить, что miR-150 опосредует многие патофизиологические процессы, регулируя экспрессию своих генов-мишеней. На основании полученных данных miR-150 можно рассматривать в качестве перспективной терапевтической мишени с большим потенциалом в клинической практике.
Исследование выполнено при поддержке Российского фонда фундаментальных исследований (проект № 19-34-60024) и Российского научного фонда (проект № 20-14-00074). Исследование было финансировано в рамках государственного задания (проект № FWGZ-2021-0014).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам Институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. От всех пациентов получено информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Alaggio R., Amador C., Anagnostopoulos I., Attygalle A.D., Araujo I.B.O., Berti E., Bhagat G., Borges A.M., Boyer D., Calaminici M., Chadburn A., Chan J.K.C., Cheuk W., Chng W.J., Choi J.K., Chuang S.S., Coupland S.E., Czader M., Dave S.S., de Jong D., Du M.Q., Elenitoba-Johnson K.S., Ferry J., Geyer J., Gratzinger D., Guitart J., Gujral S., Harris M., Harrison C.J., Hartmann S., Hochhaus A., Jansen P.M., Karube K., Kempf W., Khoury J., Kimura H., Klapper W., Kovach A.E., Kumar S., Lazar A.J., Lazzi S., Leoncini L., Leung N., Leventaki V., Li X.Q., Lim M.S., Liu W.P., Louissaint A. Jr, Marcogliese A., Medeiros L.J., Michal M., Miranda R.N., Mitteldorf C., Montes-Moreno S., Morice W., Nardi V., Naresh K.N., Natkunam Y., Ng S.B., Oschlies I., Ott G., Parrens M., Pulitzer M., Rajkumar S.V., Rawstron A.C., Rech K., Rosenwald A., Said J., Sarkozy C., Sayed S., Saygin C., Schuh A., Sewell W., Siebert R., Sohani A.R., Tooze R., Traverse-Glehen A., Vega F., Vergier B., Wechalekar A.D., Wood B., Xerri L., Xiao W. (2022) The 5th edition of the World Health Organization classification of haematolymphoid tumours: lymphoid neoplasms. Leukemia. 36, 1720–1748.
Wang L., Qin W., Huo Y.J., Li X., Shi Q., Rasko J.E.J., Janin A., Zhao W.L. (2020) Advances in targeted therapy for malignant lymphoma. Signal Transduct. Target. Ther. 5(1), 15.
Fuertes T., Ramiro A.R., de Yebenes V.G. (2020) miRNA-based therapies in B cell non-Hodgkin lymphoma. Trends Immunol. 41(10), 932‒947.
Peng Y., Croce C.M. (2016) The role of microRNAs in human cancer. Signal Transduct. Target. Ther. 1, 15004.
Su Y., Sun B., Lin X., Zhao X., Ji W., He M., Qian H., Song X., Yang J., Wang J., Chen J. (2016) Therapeutic strategy with artificially-designed i-lncRNA targeting multiple oncogenic microRNAs exhibits effective antitumor activity in diffuse large B-cell lymphoma. Oncotarget. 7(31), 49143‒49155.
Due H., Schönherz A.A., Ryø L., Primo M.N., Jespersen D.S., Thomsen E.A., Roug A.S., Xiao M., Tan X., Pang Y., Young K.H., Bøgsted M., Mikkelsen J.G., Dybkær K. (2019) MicroRNA-155 controls vincristine sensitivity and predicts superior clinical outcome in diffuse large B-cell lymphoma. Blood Adv. 3(7), 1185‒1196.
Yang J.M., Jang J.Y., Jeon Y.K., Paik J.H. (2018) Clinicopathologic implication of microRNA-197 in diffuse large B cell lymphoma. J. Transl. Med. 16(1), 162.
Huang F., Jin Y., Wei Y. (2016) MicroRNA-187 induces diffuse large B-cell lymphoma cell apoptosis via targeting BCL6. Oncol. Lett. 11(4), 2845‒2850.
Fan Q., Meng X., Liang H., Zhang H., Liu X., Li L., Li W., Sun W., Zhang H., Zen K., Zhang C.Y., Zhou Z., Chen X., Ba Y. (2016) miR-10a inhibits cell proliferation and promotes cell apoptosis by targeting BCL6 in diffuse large B-cell lymphoma. Protein Cell. 7(12), 899‒912.
Farina F.M., Inguscio A., Kunderfranco P., Cortesi A., Elia L., Quintavalle M. (2017) MicroRNA-26a/cyclin-dependent kinase 5 axis controls proliferation, apoptosis and in vivo tumor growth of diffuse large B-cell lymphoma cell lines. Cell Death Dis. 8(6), e2890.
Yuan J., Zhang Q., Wu S., Yan S., Zhao R., Sun Y., Tian X., Zhou K. (2021) MiRNA-223-3p affects mantle cell lymphoma development by regulating the CHUK/NF-κB2 signaling pathway. OncoTargets Ther. 14, 1553‒1564.
Tian Y.Y., Jia C.M., Li Y., Wang Y., Jiang L., Liu A.C. (2016) Restoration of microRNA-373 suppresses growth of human T-cell lymphoma cells by repressing CCND1. Eur. Rev. Med. Pharmacol. Sci. 20(21), 4435‒4444.
Morales-Martinez M., Vega G.G., Neri N., Nambo M.J., Alvarado I., Cuadra I., Duran-Padilla M.A., Huerta-Yepez S., Vega M.I. (2020) MicroRNA-7 regulates migration and chemoresistance in non-Hodgkin lymphoma cells through regulation of KLF4 and YY1. Front. Oncol. 10, 588893.
Wu S.J., Chen J., Wu B., Wang Y.J., Guo K.Y. (2018) MicroRNA-150 enhances radiosensitivity by inhibiting the AKT pathway in NK/T cell lymphoma. J. Exp. Clin. Cancer Res. 37, 18.
Musilova K., Devan J., Cerna K., Seda V., Pavlasova G., Sharma S., Oppelt J., Pytlik R., Prochazka V., Prouzova Z., Trbusek M., Zlamalikova L., Liskova K., Kruzova L., Jarosova M., Mareckova A., Kornauth C., Simonitsch-Klupp I., Schiefer A.I., Merkel O., Mocikova H., Burda P., Machova Polakova K., Kren L., Mayer J., Zent C.S., Trneny M., Evans A.G., Janikova A., Mraz M. (2018) miR-150 downregulation contributes to the high-grade transformation of follicular lymphoma by upregulating FOXP1 levels. Blood. 132(22), 2389‒2400.
Witten L., Slack F.J. (2020) miR-155 as a novel clinical target for hematological malignancies. Carcinogenesis. 41, 2–7.
Chakraborty C., Sharma A.R., Sharma G., Lee S.S. (2020) Therapeutic advances of miRNAs: a preclinical and clinical update. J. Adv. Res. 28, 127‒138.
Sebestyén E., Nagy Á., Marosvári D., Rajnai H., Kajtár B., Deák B., Matolcsy A., Brandner S., Storhoff J., Chen N., Bagó A.G., Bödör C., Reiniger L. (2022) Distinct miRN-A expression signatures of primary and secondary central nervous system lymphomas. J. Mol. Diagn. 24(3), 224‒240.
Costé É., Rouleux-Bonnin F. (2020) The crucial choice of reference genes: identification of miR-191-5p for normalization of miRNAs expression in bone marrow mesenchymal stromal cell and HS27a/HS5 cell lines. Sci. Rep. 10(1), 17728.
de Leeuw D.C., van den Ancker W., Denkers F., de Menezes R.X., Westers T.M., Ossenkoppele G.J., van de Loosdrecht A.A., Smit L. (2013) MicroRNA profiling can classify acute leukemias of ambiguous lineage as either acute myeloid leukemia or acute lymphoid leukemia. Clin. Cancer Res. 19, 2187–2196.
Ragni E., Colombini A., De Luca P., Libonati F., Viganò M., Perucca Orfei C., Zagra L., de Girolamo L. (2021) miR-103a-3p and miR-22-5p are reliable reference genes in extracellular vesicles from cartilage, adipose tissue, and bone marrow cells. Front. Bioeng. Biotechnol. 9, 632440.
Esmeray E., Küçük C. (2020) Genetic alterations in B cell lymphoma subtypes as potential biomarkers for noninvasive diagnosis, prognosis, therapy, and disease monitoring. Turk. J. Biol. 44(1), 1‒14.
Souza O.F., Popi A.F. (2022) Role of microRNAs in B‑cell compartment: development, proliferation and hematological diseases. Biomedicines. 10(8), 2004.
Koralov S.B., Muljo S.A., Galler G.R., Krek A., Chakraborty T., Kanellopoulou C., Jensen K., Cobb B.S., Merkenschlager M., Rajewsky N., Rajewsky K. (2008) Dicer ablation affects antibody diversity and cell survival in the B lymphocyte lineage. Cell. 132(5), 860‒874.
Веряскина Ю.А., Титов С.Е., Ковынев И.Б., Федорова С.С., Поспелова Т.И., Жимулёв И.Ф. (2021) микроРНК при миелодиспластическом синдроме. Acta Naturae. 13(2), 4‒15.
Emmrich S., Rasche M., Schöning J., Reimer C., Keihani S., Maroz A., Xie Y., Li Z., Schambach A., Reinhardt D., Klusmann J.H. (2014) miR-99a/100~125b tricistrons regulate hematopoietic stem and progenitor cell homeostasis by shifting the balance between TGFβ and Wnt signaling. Genes Dev. 28(8), 858‒874.
Velu C.S., Baktula A.M., Grimes H.L. (2009) Gfi1 regulates miR-21 and miR-196b to control myelopoiesis. Blood. 113(19), 4720‒4728.
Felli N., Fontana L., Pelosi E., Botta R., Bonci D., Facchiano F., Liuzzi F., Lulli V., Morsilli O., Santoro S., Valtieri M., Calin G.A., Liu C.G., Sorrentino A., Croce C.M., Peschle C. (2005) MicroRNAs 221 and 222 inhibit normal erythropoiesis and erythroleukemic cell growth via kit receptor down-modulation. Proc. Natl. Acad. Sci. USA. 102(50), 18081‒18086.
Lee J.Y., Kim M., Heo H.R., Ha K.S., Han E.T., Park W.S., Yang S.R., Hong S.H. (2018) Inhibition of microRNA-221 and 222 enhances hematopoietic differentiation from human pluripotent stem cells via c-KIT upregulation. Mol. Cells. 41(11), 971‒978.
Kurkewich J.L., Boucher A., Klopfenstein N., Baskar R., Kapur R., Dahl R. (2017) The Mirn23a and Mirn23b microRNA clusters are necessary for proper hematopoietic progenitor cell production and differentiation. Exp. Hematol. 59, 14‒29.
Pelosi A., Careccia S., Lulli V., Romania P., Marziali G., Testa U., Lavorgna S., Lo-Coco F., Petti M.C., Calabretta B., Levrero M., Piaggio G., Rizzo M.G. (2013) miRNA let-7c promotes granulocytic differentiation in acute myeloid leukemia. Oncogene. 32(31), 3648‒3654.
Zheng B., Xi Z., Liu R., Yin W., Sui Z., Ren B., Miller H., Gong Q., Liu C. (2018) The function of microRNAs in B-cell development, lymphoma, and their potential in clinical practice. Front. Immunol. 9, 936.
Xiao C., Calado D.P., Galler G., Thai T.H., Patterson H.C., Wang J., Rajewsky N., Bender T.P., Rajewsky K. (2007) MiR-150 controls B cell differentiation by targeting the transcription factor c-Myb. Cell. 131(1), 146‒159.
Nakata Y., Shetzline S., Sakashita C., Kalota A., Rallapalli R., Rudnick S.I., Zhang Y., Emerson S.G., Gewirtz A.M. (2007) c-Myb contributes to G2/M cell cycle transition in human hematopoietic cells by direct regulation of cyclin B1 expression. Mol. Cell Biol. 27(6), 2048‒2058.
Dzikiewicz-Krawczyk A., Kok K., Slezak-Prochazka I., Robertus J.L., Bruining J., Tayari M.M., Rutgers B., de Jong D., Koerts J., Seitz A., Li J., Tillema B., G-uikema J.E., Nolte I.M., Diepstra A., Visser L., Kluiver J., van den Berg A. (2017) ZDHHC11 and ZDHHC11B are critical novel components of the oncogenic MYC-miR-150-MYB network in Burkitt lymphoma. Leukemia. 31(6), 1470‒1473.
Ziel-Swier L.J.Y.M., Liu Y., Seitz A., de Jong D., Koerts J., Rutgers B., Veenstra R., Razak F.R.A., Dzikiewicz-Krawczyk A., van den Berg A., Kluiver J. (2022) The role of the MYC/miR-150/MYB/ZDHHC11 network in Hodgkin lymphoma and diffuse large B-cell lymphoma. Genes (Basel). 13(2), 227.
Wang M., Yang W., Li M., Li Y. (2014) Low expression of miR-150 in pediatric intestinal Burkitt lymphoma. Exp. Mol. Pathol. 96(2), 261‒266.
Watanabe A., Tagawa H., Yamashita J., Teshima K., Nara M., Iwamoto K., Kume M., Kameoka Y., Takahashi N., Nakagawa T., Shimizu N., Sawada K. (2011) The role of microRNA-150 as a tumor suppressor in malignant lymphoma. Leukemia. 25(8), 1324‒1334.
Ghisi M., Corradin A., Basso K., Frasson C., Serafin V., Mukherjee S., Mussolin L., Ruggero K., Bonanno L., Guffanti A., De Bellis G., Gerosa G., Stellin G., D’Agostino D.M., Basso G., Bronte V., Indraccolo S., Amadori A., Zanovello P. (2011) Modulation of m-icroRNA expression in human T-cell development: targeting of NOTCH3 by miR-150. Blood. 117(26), 7053‒7062.
Sang W., Sun C., Zhang C., Zhang D., Wang Y., Xu L., Zhang Z., Wei X., Pan B., Yan D., Zhu F., Yan Z., Cao J., Loughran T.P. Jr., Xu K. (2016) MicroRNA-150 negatively regulates the function of CD4+ T cells through AKT3/Bim signaling pathway. Cell Immunol. 306–307, 35‒40.
Ito M., Teshima K., Ikeda S., Kitadate A., Watanabe A., Nara M., Yamashita J., Ohshima K., Sawada K., Tagawa H. (2014) MicroRNA-150 inhibits tumor invasion and metastasis by targeting the chemokine receptor CCR6, in advanced cutaneous T-cell lymphoma. Blood. 123(10), 1499‒1511.
Mraz M., Chen L., Rassenti L.Z., Ghia E.M., Li H., Jepsen K., Smith E.N., Messer K., Frazer K.A., Kipps T.J. (2014) miR-150 influences B-cell receptor signaling in chronic lymphocytic leukemia by regulating expression of GAB1 and FOXP1. Blood. 124(1), 84‒95.
Wang X., Kan Y., Chen L., Ge P., Ding T., Zhai Q., Yu Y., Wang X., Zhao Z., Yang H., Liu X., Li L., Qiu L., Qian Z., Zhang H., Wang Y., Zhao H. (2020) miR-150 is a negative independent prognostic biomarker for primary gastrointestinal diffuse large B-cell lymphoma. Oncol. Lett. 19(5), 3487‒3494.
Sun Z., Wang Y., Han X., Zhao X., Peng Y., Li Y., Peng M., Song J., Wu K., Sun S., Zhou W., Qi B., Zhou C., Chen H., An X., Liu J. (2015) miR-150 inhibits terminal erythroid proliferation and differentiation. Oncotarget. 6(40), 43033‒43047.
Lu J., Guo S., Ebert B.L., Zhang H., Peng X., Bosco J., Pretz J., Schlanger R., Wang J.Y., Mak R.H., Dombkowski D.M., Preffer F.I., Scadden D.T., Golub T.R. (2008) MicroRNA-mediated control of cell fate in megakaryocyte-erythrocyte progenitors. Dev. Cell. 14(6), 843‒853.
Apple C.G., Miller E.S., Kannan K.B., Stortz J.A., Loftus T.J., Lopez M.C., Parvataneni H.K., Patrick M., Hagen J.E., Baker H.V., Efron P.A., Mohr A.M. (2021) The role of bone marrow microRNA (miR) in erythropoietic dysfunction after severe trauma. Surgery. 169(5), 1206‒1212.
Fayyad-Kazan H., Bitar N., Najar M., Lewalle P., Fayyad-Kazan M., Badran R., Hamade E., Daher A., Hussein N., ElDirani R., Berri F., Vanhamme L., Burny A., Martiat P., Rouas R., Badran B. (2013) Circulating miR-150 and miR-342 in plasma are novel potential biomarkers for acute myeloid leukemia. J. Transl. Med. 11, 31.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


