Российские нанотехнологии, 2020, T. 15, № 1, стр. 52-62
ПОЛУЧЕНИЕ НАНОРАЗМЕРНЫХ ЧАСТИЦ ЗЕРНА И ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ИХ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗА И ВЫСОКОПЛОТНОГО СБРАЖИВАНИЯ ДРОЖЖАМИ Saccharomyces cerevisiae
В. В. Ревин 1, Н. А. Атыкян 1, *, Е. Н. Сидоров 2
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва
Саранск, Россия
2 ООО “МордовАлкоПром”
Саранск, Россия
* E-mail: kistig2@yandex.ru
Поступила в редакцию 30.04.2020
После доработки 31.05.2020
Принята к публикации 01.06.2020
Аннотация
Отработаны условия получения ультрадисперсных зерновых частиц нанометрового размера. Выявлено, что ультраизмельчение позволяет снизить температуру клейстеризации крахмала с 80 до 60°С. Подобраны оптимальные условия для мягкой водно-тепловой и ферментативной обработки с получением сусла стандартной и высокой плотности. В результате исключается одна из энергозатратных стадий подготовки зерна к сбраживанию (разваривание) и увеличивается выход целевого продукта (спирта) в среднем до 69.9 дал из 1 т условного крахмала. Происходит сокращение времени брожения в среднем на 16%. Предполагается, что разработкой высокоэффективного оборудования для получения наноразмерных частиц одной из доминирующих технологических схем производства биоэтанола станет предлагаемая схема, позволяющая значительно снизить себестоимость готовой продукции.
ВВЕДЕНИЕ
Производство биоэтанола, в том числе топливного назначения, – одна из динамично развивающихся отраслей во всем мире, особенно в свете истощения запасов нефтепродуктов. Ежегодный прирост объема производимого этанола достигает около 20%. На сегодняшний день мировыми лидерами в производстве этанола являются Бразилия и США. Государственная программа по расширению производства этанола реализуется также в Канаде и Евросоюзе. При этом в основном биоэтанол используется в качестве добавок к бензину, что способствует более полному сгоранию и уменьшению выбросов оксида углерода на 30%. Он также уменьшает выбросы токсичных веществ на 30%, а выбросы летучих органических соединений – более чем на 25%. Ожидается, что на биоэтанол будет приходиться основная часть роста потребления биотоплива в мире, так как затраты на его производство будут сокращаться быстрее, чем на производство биодизельного топлива. Новые технологии в области производства биотоплива касаются вовлечения непищевого возобновляемого растительного сырья (например, некондиционного зерна, растительных отходов сельского хозяйства и деревоперерабатывающей промышленности, водорослей и т.д.) в переработку. Для того чтобы эти технологии стали коммерчески жизнеспособными, необходимо решить ряд технических проблем.
Первая проблема: при получении этанола из зерна требуются значительные энергозатраты по переводу крахмала в растворимое состояние. Для зерна, подвергнутого сухому измельчению, ферментативный гидролиз крахмала осуществляют в две стадии: разваривание с добавлением термостабильной амилазы, что приводит к получению декстринов, и последующая инкубация с глюкоамилазой при более низких температурах, чтобы преобразовать декстрины в глюкозу (осахаривание). Комбинации времени и температуры пред-обработки варьируют в промышленности от 165°С (3–5 мин) до 90–105°С (1–3 ч). В технологиях мокрого помола вначале получают гранулированный крахмал, а затем без разваривания при температуре 30–32°С его гидролизуют с использованием специальных ферментных препаратов (так называемых ферментов гидролиза гранулированного крахмала (GSH)) [1–4]. Вместе с тем подходы к применению той же технологии для сухого помола и использование для этого ферментов GSH только начали разрабатываться. Одним из узких мест, мешающих внедрению GSH-ферментов, является размер частиц, получаемых при сухом помоле. Он составляет около 1 мм, а гранулы крахмала при мокром помоле имеют размер около 5–20 мкм [5]. То есть при тонком измельчении зерна до размеров частиц менее 100 мкм можно отказаться от разваривания и снизить температуру ферментативного гидролиза сырья [6, 7].
Вторая проблема: образование гигантских количеств отходов – послеспиртовой барды. В среднем на 1 л спирта образуется до 13 л барды. Решить эту проблему позволяет другой подход: одновременно с ультраизмельчением внедрение технологии высокоплотного сбраживания, которая направлена на уменьшение потребления технологической воды, затрат на ректификацию, сокращение выхода послеспиртовой барды и затрат на ее переработку, увеличение выхода основного продукта. При этом переход на новую технологию не требует капитальных вложений и минимизирует бактериальное загрязнение производства [8–10].
Проблема получения высококонцентрированных сусел и их сбраживания интенсивно изучается последние два десятилетия. За этот период были изучены питательные потребности классических дрожжей Saccharomyces cerevisiae в условиях повышенного осмотического давления, рассмотрены факторы, влияющие на выход целевого продукта [11–13], проанализирован геном и протеом дрожжей в условиях стрессовых нагрузок [14, 15], получены новые штаммы путем гибридизации или мутагенеза [16, 17]. Однако такой важный аспект, как влияние размера частиц сырья на эффективность гидролиза крахмала в концентрированных зерновых замесах, практически не исследован.
Исходя из изложенного, основной целью представленной работы является выяснение принципиального вопроса о влиянии размера частиц зернового сырья на эффективность ферментативного гидролиза и высокоплотного сбраживания дрожжами Saccharomyces cerevisiae при одновременном снижении времени сбраживания.
МЕТОДЫ
Сбраживание сусел осуществляли осмофильными коммерческими дрожжами Saccharomyces cerevisiae расы Ethanol Red (Fermentis, Франция). В качестве сырья использовали зерновую смесь пшеница:ячмень:рожь в соотношении 1:1:1 (классический вариант смеси, используемый на спиртовых заводах). Сорность зерновой смеси составляла 0.5%, влажность – 10.2%, крахмалистость смеси – 56.4%. Для приготовления сусла зерно подвергали двустадийному измельчению. На первом этапе на лабораторных зерновых мельницах MKM 6003 (Bosch, Китай) и ЛЗМ-1М (Россия) до размеров примерно около 1 мм. Дальнейшее измельчение зернового сырья осуществляли на планетарной шаровой мельнице Retsch РМ 100 (Retsch GmbH, Германия) при различных режимах работы – от 100 до 600 об.–1 и времени от 5 до 60 мин.
Полученные частицы анализировали на растровом электронном микроскопе TM 3000 (HITACHI, Япония) с системой микроанализа SwiftED3000 (Oxford Instruments, Великобритания). Разрешение микроскопа порядка 30 нм (30 000-кратное увеличение), глубина резкости 0.5 мм. Измерения исследуемого мелкодисперсного порошка проводили в высоком вакууме порядка 10–2–10–3 Па при ускоряющем напряжении 15 кВ. Для подготовки образца использовали метод сухого препарирования [18]. На рабочий столик прикрепляли проводящий углеродный скотч, затем столик аккуратно помещали в контейнер с исследуемым мелкодисперсным порошком. После налипания порошка на углеродную ленту рабочий столик встряхивали и обдували воздухом (специальный фен). После данной пробоподготовки столик помещали в электронный микроскоп для исследования. Распределение частиц по размерам определяли с помощью прибора Ласка 1К (Люмекс, Россия) и методом лазерного дифракционного анализа на приборе SALD-3101 (Shimadzu, Япония). Для анализа образцов навеску массой 25–50 мг суспендировали в 50 мл дистиллированной (деионизованной) воды, которую тщательно перемешивали и выливали в ультразвуковую ячейку анализатора. После 4–5 мин ультразвуковой обработки образец поступал в прибор и циркулировал через аналитическую ячейку до стабильных показаний прибора.
Профиль частиц изучали на лазерном микроинтерферометре Линника МИИ-4М (Ломо, Россия) методом лазерной интерференционной микроскопии (ЛИМ) [19]. Ультрадисперсное зерно суспендировали в дистиллированной воде, концентрация составляла 5%. Оценивали размер частиц, находящихся в супернатанте после того, как образцы отстаивались. Для измерений методом ЛИМ 2 мкл жидкости, взятой из средней части пробирки, помещали на зеркальную поверхность предметного стекла, накрывали покровным стеклом и помещали под микроскоп.
Для приготовления сусла из ультраизмельченного сырья готовили замесы с гидромодулем 1:2 (высокоплотное сусло) и в качестве контроля – 1:3.5 (стандартное сусло). Для проведения ферментативного гидролиза использовали коммерческие ферментные препараты Мезомей-2500, Глюкомей-8000 (Beijin Shifa Multi-Business Agency, Китай), Ламинекс БГ2, Максазим NNP DS+ (Genencor International Oy, Финляндия). Дозировку ферментных препаратов подбирали согласно паспортным данным. Температура предобработки была 60°С. Гидролиз проводили по схеме: внесение ферментных препаратов Мезомей-2500, Ламинекс БГ2, Максазим NNP DS, выдержка при температуре 60°С 30 мин, подкисление смеси до рН 4.2 1 н серной кислотой и внесение Глюкомей-8000. Продолжительность осахаривания составляла 1 ч. В ходе эксперимента контролировали растворимые вещества, вязкость, углеводный состав сусел.
Моделирование условий сбраживания проводили в ходе эксперимента, состоящего из двух этапов: активация сухих, лиофильно высушенных дрожжей и непосредственное сбраживание сусла. Все работы проводили в биореакторах BIOSTAT® A plus (Sartorius, Германия). Активацию вели на подготовленном по описанному выше способу сусле в течение 24 ч в режиме постоянного перемешивания при 150 об./мин и температуре 30°С. Сухие дрожжи вносили в концентрации 0.1 г/л. Сбраживание вели в анаэробных условиях на таком же сусле стационарно при оптимальной температуре в течение 72 ч. Активированные дрожжи в сусло для сбраживания вносили до конечной концентрации 100–120 млн. клеток/мл (в исходном инокуляте концентрация клеток составляла 700–750 млн./мл).
Вязкость замесов определяли на вискозиметре VT-04F (Rion Co., Ltd, Япония) при одной скорости вращения диска. Анализ видимых растворимых веществ проводили в прозрачном фильтрате сусла с применением автоматического рефрактометра модели PTR 46 (Inde Instruments Ltd, Великобритания). Углеводный состав сусел изучали методом высокоэффективной жидкостной хроматографии (ВЭЖХ) [20] на хроматографе LC20 Prominence (Shimadzu, Япония) с использованием колонок SupelcoGel Silica-LC-NH2. Подсчет количества и анализ жизнеспособности дрожжевых клеток осуществляли с применением анализатора жизнеспособности клеток Vi-CELL® (Beckman Coulter, США). Определяли накопление спирта в бражке согласно [21]. Показатели бражки определяли антроново-колориметрическим методом [22]. Все результаты, полученные в ходе эксперимента, подвергли статистической обработке с использованием ПК-программ Microsoft Excel 2000.
РЕЗУЛЬТАТЫ
При постановке эксперимента по подбору оптимального варианта для предварительного измельчения было использовано несколько способов механического помола, различающихся как принципом воздействия, так и его интенсивностью. Для проведения предварительного грубого измельчения были выбраны ножевые минимельницы MKM 6003 (Bosch, Китай) и ЛЗМ-1М (табл. 1). Измельчение до ультра- и наноразмерных величин в лабораторных условиях осуществляли на планетарных шаровых мельницах PM100.
Таблица 1.
Влияние продолжительности обработки сырья на мельницах на степень измельчения
| Тип мельницы | Процент прохода помола через сито в зависимости от продолжительности измельчения | ||||
|---|---|---|---|---|---|
| 35 с | 45 с | 60 с | 80 с | 120 с | |
| MKM 6003 | 47.4 ± 0.3 | 49.0 ± 0.2 | 55.1 ± 0.2 | 66.2 ± 0.1 | 94.1 ± 0.1 |
| ЛЗМ-1М | 22.1 ± 0.6 | 34.5 ± 0.4 | 43.2 ± 0.3 | 54.6 ± 0.4 | 73.2 ± 0.1 |
При сравнении двух типов оборудования при одинаковом времени измельчения выявлено, что за 120 с обработки на минимельнице MKM 6003 можно добиться достаточно тонкого измельчения. Исследование частиц методом ЛИМ подтвердило, что с увеличением продолжительности измельчения число мелких частиц возрастает (рис. 1). При использовании ЛЗМ-1М эффективный помол достигается лишь к 300 с (результаты в таблице не представлены).
Рис. 1.
Образцы зернового сырья, подвергнутые измельчению на MKM 6003 в течение 30 (а) и 80 с (б) (лазерная интерференционная микроскопия, увеличение ×750).

Вторым вариантом одностадийного помола являлось измельчение на планетарной шаровой мельнице РМ100. Отличительной особенностью данного типа мелющего оборудования является более медленное измельчение на начальных этапах помола. Однако при помоле свыше 20 мин зерно достаточно полно измельчается, и к 30-й минуте измельчения проход через сито с диаметром 0.63 мм составляет более 97% (табл. 2).
Таблица 2.
Влияние продолжительности обработки сырья на мельнице PM100 при 400 об.–1 на степень помола
| Размер ячеек сита, мм | Процент прохода помола через сито в зависимости от продолжительности измельчения | ||||
|---|---|---|---|---|---|
| 0.63 мм | 10 мин | 15 мин | 20 мин | 25 мин | 30 мин |
| 36.1 ± 0.6 | 48.9 ± 0.5 | 69.4 ± 0.4 | 88.3 ± 0.2 | 97.4 ± 0.3 | |
Таким образом, при использовании оборудования с режущим принципом действия достигается более эффективное измельчение целого зерна по сравнению с оборудованием с раскалывающе-истирающим принципом действия. В проведенном эксперименте это подтверждается временными и энергетическими затратами на измельчение единицы массы сырья (фактически 1.25 Вт/г на ЛЗМ-1М и 1.48 Вт/г на PM100 при равной степени помола). Скомбинировав измельчение на ЛЗМ-1М в течение 5 мин с последующим домолом на PM100 в течение 30 мин при 400 об.–1 или в течение 20 мин при 600 об.–1, получили наиболее тонкий помол. Обе пробы к концу помола характеризовались практически 100%-ным проходом через сито с размером ячеек 0.63 мм.
Для более подробной оценки эффективности измельчения сырья применяли лазерный дифракционный анализ. Как видно из рис. 2, увеличение продолжительности и интенсивности помола приводит к росту числа фракций с размером частиц от 10 до 50 мкм, а также менее 1 мкм. Для помолов, полученных на планетарной шаровой мельнице, характерно возрастание доли ультрадисперсной фракции. При использовании двухстадийного помола происходит дальнейшее увеличение дисперсности материала, в результате чего преобладающей фракцией ультрадисперсных частиц являются частицы диаметром 5–50 мкм, а также нанометрового диапазона. Это обусловлено повышением степени измельчения как зерен крахмала, так и зерновой оболочки.
Рис. 2.
Диаграммы анализа размера частиц, полученных при различных вариантах измельчения пшеницы: помол на MKM 6003 в течение 80 с (вариант 1); помол на ЛЗМ-1 в течение 5 мин (вариант 2); одностадийный помол – 30 мин на PM100 при 400 об.–1 (вариант 3); двухстадийный помол – 5 мин на ножевой мельнице ЛЗМ-1 с 30-минутным домолом на PM100 при 400 об.–1 (вариант 4); двухстадийный помол – 5 мин на ножевой мельнице ЛЗМ-1 с 20-минутным домолом на PM100 при 600 об.–1 (вариант 5).
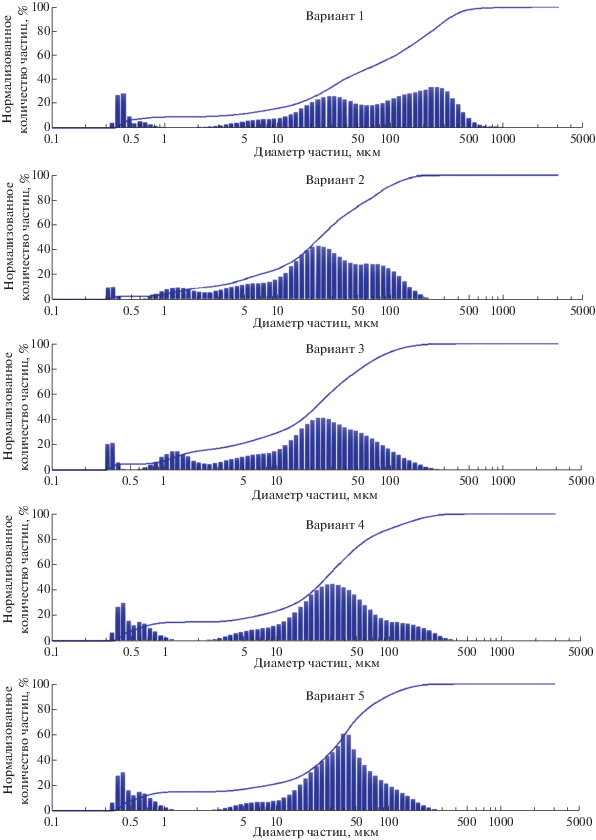
Таким образом, измерение фактического размера частиц полученной ультрадисперсной зерновой смеси показало, что при двухэтапном измельчении получаются образцы нанометрового (~10%) и микронного (от 10 до 100 мкм, и менее 10% – до 300 мкм) размеров (рис. 2 и 3).
При этом анализ профиля частиц показал, что они в основном представлены фрагментами с острыми краями и выступами, что характерно для шарового помола методом скалывания (рис. 4). Вариант 5 (двухстадийный помол: вначале пятиминутный помол на ножевой мельнице ЛЗМ-1, затем 20-минутный помол на планетарной шаровой мельнице PM100 при 600 об–1) использовали на первом этапе для контрольного эксперимента со стандартным гидромодулем 1:3.5. Зерно смешивали с водой и выдерживали 30 мин при температуре 60°С. Анализ показал, что в результате ультраизмельчения происходит частичное высвобождение простых сахаров даже без добавления гидролитических ферментов (табл. 3).
Рис. 4.
Профиль (а) и 3D-изображение (б) типовой частицы ультрадисперсного растительного сырья до гидролиза (получено с использованием ЛИМ).

Таблица 3.
Влияние степени измельчения зерна на концентрацию сахаров в водном экстракте ультраизмельченного зерна
| Измельчение | Сглюкозы, мг/мл | Ссахарозы, мг/мл | Смальтозы, мг/мл |
|---|---|---|---|
| Стандартное | 45.2 ± 0.95 | 4.67 ± 0.12 | 16.42 ± 0.07 |
| Ультрадисперсное зерно | 72.11 ± 0.84 | 3.21 ± 0.09 | 29.53 ± 0.57 |
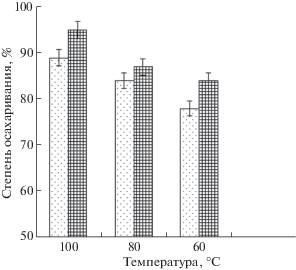
Исследование влияния температуры предварительной обработки зернового замеса контрольного варианта (вариант 5 измельчения) показал, что ультраизмельчение позволяет использовать более мягкие режимы для предобработки и последующего ферментативного гидролиза сырья. Было выявлено, что температура 60°С является достаточной для удовлетворительного гидролиза крахмала сырья (рис. 5).
Рис. 5.
Влияние температуры на степень осахаривания:  – зерно стандартной степени измельчения;
– зерно стандартной степени измельчения;  – зерно, измельченное по варианту 5.
– зерно, измельченное по варианту 5.
Далее готовили опытные образцы – концентрированные замесы с соотношением ультрадисперсное сырье:вода – 1:2. Дозировка ферментных препаратов соответствовала табл. 4.
Таблица 4.
Варианты внесения ферментных препаратов
| Вариант | Дозы внесения ферментов, ед. на г крахмала | |||
|---|---|---|---|---|
| α-Амилаза | Ксиланаза | Протеаза | Глюкоамилаза | |
| 1 | 2.0 | 0.40 | 0.040 | 6.20 |
| 2 | 2.2 | 0.44 | 0.044 | 6.80 |
| 3 | 2.5 | 0.50 | 0.050 | 7.75 |
| 4 | 3.0 | 0.60 | 0.060 | 9.3 |
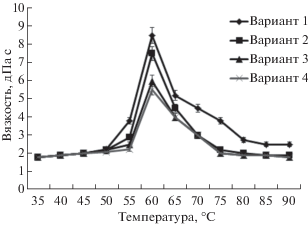
Для снижения энергозатрат на производство спирта в ходе исследований подбирали температуру предварительной обработки сырья. Проводили анализ вязкости высококонцентированных замесов с гидромодулем 1:2 при различных вариантах внесения ферментных препаратов (согласно табл. 4) с целью нахождения точки клейстеризации крахмала и выбора температуры подваривания (рис. 6).
Исследования показали, что точка клейстеризации крахмала зерновой смеси соответствует температуре 60°С. Для проведения водно-тепловой обработки при температуре сырья 60°С и обеспечения минимальной вязкости замесов в точке клейстеризации крахмала (рис. 6) были выбраны дозы внесения α-амилазы разжижающего действия в количестве 2.5 ед. и ксиланазы 0.5 ед. на 1 г условного крахмала (вариант 3).
На следующем этапе подбирали количество внесения глюкоамилазы и длительность процесса осахаривания по накоплению видимых сухих веществ в фильтратах гидролизатов (табл. 5).
Таблица 5.
Количество сухих веществ в фильтрате гидролизованного замеса
| Длительность ферментативной обработки, мин | Количество сухих веществ, °Bx | |||
|---|---|---|---|---|
| Дозировка глюкоамилазы, ед. на г крахмала | ||||
| 6.20 (вариант 1) | 6.80 (вариант 2) | 7.75 (вариант 3) | 9.3 (вариант 4) | |
| 30 | 12.2 ± 0.4 | 14.2 ± 0.3 | 15.8 ± 0.4 | 15.9 ± 0.1 |
| 60 | 16.3 ± 0.3 | 18.3 ± 0.2 | 20.4 ± 0.3 | 21.0 ± 0.3 |
| 90 | 22.1 ± 0.1 | 24.8 ± 0.1 | 26.2 ± 0.1 | 26.5 ± 0.1 |
| 120 | 22.4 ± 0.1 | 25.0 ± 0.1 | 26.4 ± 0.1 | 26.6 ± 0.1 |
Как видно из табл. 5, максимальное количество растворимых веществ наблюдалось при гидролизе высококонцентированных замесов с гидромодулем 1:2 в третьем и четвертом варианте и составило 26.4–26.6°Брикса (°Bx). Разница по растворимым веществам между ними составляет не более 1%, а по расходу ферментных препаратов 25%. Следовательно, предпочтительнее использовать дозировку ферментов по варианту 3.
На следующем этапе работы было исследовано влияние значения кислотности среды на активность фермента Глюкомэй-8000. Для этого после стадии разваривания водно-зерновой смеси с внесенным амилолитическим ферментом проводили подкисление 1 н раствором серной кислоты до значения 4.2. Изначальное значение рН смеси составляло в пределах 5.8–6.2. Для дальнейшего анализа были выбраны варианты дозирования ферментов, описанные в третьем варианте (табл. 4).
В процессе гидролиза установлено, что количество сухих веществ в сусле соответствовало значениям, полученным при гидролизе замеса с начальным значением рН. Анализ гидролизатов на содержание простых сахаров методом ВЭЖХ (рис. 7, табл. 6) показал, что снижение рН водно-зерновой смеси перед внесением глюкоамилазы увеличивает “атакуемость” субстрата, о чем можно судить по уменьшению содержания мальтозы и, соответственно, увеличению доли глюкозы.
Рис. 7.
Анализ полноты гидролиза зернового сусла методом ВЭЖХ (Silica-LC-NH2) в зависимости от степени помола: 1 – двухстадийный помол по варианту 5; 2 – одностадийный помол на ЛЗМ-1М 5 мин.
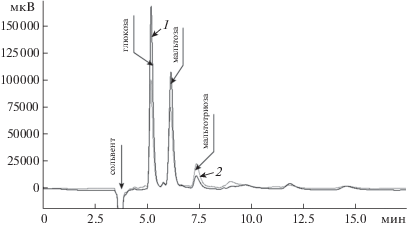
Таблица 6.
Углеводный состав сусел
| Количество ферментов (вариант) | Мальто- триоза, мг/мл | Мальто- декстрины, мг/мл | Фруктоза, мг/мл | Глюкоза, мг/мл | Мальтоза, мг/мл |
|---|---|---|---|---|---|
| 3 | 19.62 ± 0.21 | 56.20 ± 0.24 | 23.00 ± 0.13 | 84.90 ± 0.54 | 44.30 ± 0.23 |
| 3 (подкисление до рН 4.2) | 9.23 ± 0.17 | 23.70 ± 0.14 | 11.07 ± 0.45 | 105.40 ± 0.32 | 25.20 ± 0.14 |
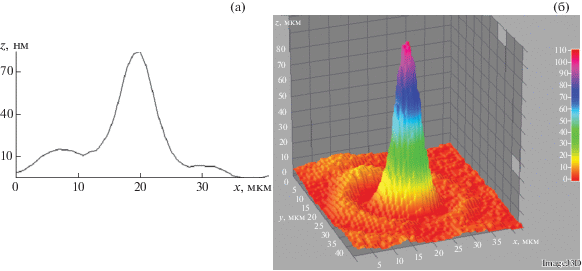
Анализ методом ЛИМ самих частиц показал, что в процессе ферментативного гидролиза происходит растворение полимеров зерна (в первую очередь крахмала). В результате в растворе остаются более мелкие частицы с острыми концами, представляющие собой осколки зерновых оболочек (рис. 8).
Рис. 8.
Профиль (а) и 3D-изображение (б) типовой частицы ультрадисперсного зернового сырья после ферментативного гидролиза (получено с использованием ЛИМ).
Важнейшей технологической задачей является подбор условий сбраживания высококонцентрированного сусла, и это явилось следующей задачей проводимого исследования.
Сбраживание осуществляли активированными дрожжами осмофильной расы Ethanol Red. Реактивацию культуры проводили в биореакторах, при температуре 30°С, перемешивании 150 об.–1 и интенсивной аэрации. Реактивацию проводили в течение времени, необходимого для накопления определенного количества дрожжевых клеток в миллилитре среды.
Как видно из табл. 7, количество внесенных засевных дрожжей является одним из важнейших факторов для обеспечения интенсивного протекания процесса брожения. Анализ зрелых бражек в образцах 1, 2, 3 (табл. 7) показал, что количество нерастворенного крахмала соответствует нормам, принятым в спиртовой промышленности из крахмалсодержащего сырья по низкотемпературным схемам водно-тепловой и ферментативной обработки. Отметим, что количество несброженных углеводов в первых двух образцах превышает нормы, предусмотренные типовым регламентом производства спирта из крахмалсодержащего сырья. Поэтому для сбраживания высококонцентрированного сусла целесообразно применять реактивированные дрожжи в количестве не менее 40 млн. клеток/см3 сусла.
Таблица 7.
Технологические показатели бражек
| Образец | Количество засевных дрожжей, млн. клеток/ см3 сусла | Количество углеводов, г/100 см3 | Крепость бражки, об. % | ||
|---|---|---|---|---|---|
| Собщ | Сру | Снк | |||
| 1 | 10 | 1.13 ± 0.11 | 1.05 ± 0.12 | 0.08 ± 0.01 | 8.79 ± 0.21 |
| 2 | 20 | 0.78 ± 0.09 | 0.72 ± 0.08 | 0.06 ± 0.01 | 9.32 ± 0.26 |
| 3 | 40 | 0.46 ± 0.01 | 0.42 ± 0.02 | 0.04 ± 0.01 | 11.85 ± 0.45 |
На следующем этапе было проанализировано накопление спирта на разные часы сбраживания. Для повышения рентабельности производства подбирали условия по снижению времени брожения (табл. 8).
Таблица 8.
Выход спирта
| Количество засевных дрожжей, млн. клеток/см3 сусла | Время брожения, ч | Крепость бражки, об. % |
|---|---|---|
| 40 | 60 | 11.24 ± 0.12 |
| 66 | 11.82 ± 0.03 | |
| 72 | 11.85 ± 0.03 |
Как видно из табл. 8, сбраживание в течение 60 ч позволяет получить достаточно высокий выход спирта и сократить общее время брожения на 12 ч (т.е. почти на 16%). Соответственно, сокращаются и затраты на производство единицы продукции.
ОБСУЖДЕНИЕ
Основная задача водно-тепловой обработки крахмалистого сырья состоит в его подготовке к осахариванию амилолитическими ферментами микроорганизмов. Осахаривание протекает наиболее полно и с наибольшей скоростью, если крахмал высвобожден из клеток и прошел стадии клейстеризации или растворения, что обеспечивает тесный контакт его с ферментами. Подготовка сырья к осахариванию проводится, как правило, путем тепловой обработки целого или измельченного сырья при повышенном давлении (разваривании), что может сопровождаться реакцией Майяра с образованием токсичных для дрожжей продуктов [23, 24]. Другой вариант – это предварительное механическое измельчение сырья до частиц определенных размеров (около 1 мм) с последующим развариванием под меньшим давлением. При этом снижаются температура и продолжительность разваривания, что позволяет уменьшить потери сбраживаемых веществ и сократить расход пара. Чем меньше размер частиц измельченного зерна, тем быстрее происходят набухание, гидратация [4], клейстеризация крахмала и связанное с ней повышение вязкости замесов, что следует учитывать при выборе температурного режима подваривания и доз ферментов. Поэтому в проведенном исследовании был выбран вариант с использованием ультраизмельченного сырья с размером частиц не более 300 мкм. В [6] показано, что уже при приготовлении водно-зернового замеса из ультрадисперсного сырья “тонкого” помола в растворимое состояние переходит большее количество углеводов, чем при использовании сырья стандартного измельчения.
В настоящей работе ультрадисперсное сырье использовано для приготовления высококонцентрированного сусла. Известно, что средний размер крахмальных зерен составляет от 0.2 до 2–5 мкм [1]. Следовательно, можно предположить, что в полученных ультрадисперсных частицах крахмальные зерна разрушены и не требуют воздействия жестких температурных режимов для разваривания. При использовании таких частиц для приготовления высокоплотного сусла узким местом является вязкость зерновых замесов при их водно-тепловой обработке [9, 10], которая обусловлена состоянием крахмала и наличием растворимых некрахмалистых полисахаридов – пентозанов и β-глюканов. Разжижение крахмала α-амилазой и ферментативный гидролиз пентозанов ксиланазой позволяют снизить вязкость замесов, получать и сбраживать сусла с высоким содержанием сухих веществ и в сочетании с тонким измельчением сырья снизить температурные режимы водно-тепловой обработки. При всех непрерывных способах разваривания крахмалистое сырье перерабатывается только в измельченном виде в смеси с водой [25, 26]. Из настоящей работы следует, что ультрадиспергирование позволяет существенно снизить точку клейстеризации крахмала до 60°С, что позволяет снизить и энергопотребление на стадии разваривания. Дальнейшая оптимизация условий позволила получить сусло с концентрацией растворимых сухих веществ 26.2°Bx, вязкостью 1.8 дПа ∙ с, содержанием глюкозы 125 г/л. Сбраживание данного сусла активированными дрожжами привело к накоплению в бражке спирта до 11.8 об.% из 26.2°Bx сухих веществ. Относительно невысокий выход спирта (хотя он и выше, чем при классическом сбраживании – 69.9 дал из 1 т условного крахмала и превышает нормативный показатель почти на 5%) может быть связан с увеличением концентрации этанола, в результате которого сумма стрессовых факторов превышает допустимый уровень для использованного штамма дрожжей. Другими словами, энергия, необходимая для поддержания (в первую очередь для АТФ-зависимого транспорта протонов), возрастает с увеличением концентрации этанола до тех пор, пока не станет равной общей энергии всей АТФ, полученной от гликолиза и образования этанола, после чего рост прекращается. Эта модель роста, как правило, наблюдается в высокоплотной ферментации [27, 28]. При этом этанол формируется как в процессе экспоненциальной, так и во время стационарной фазы роста дрожжей.
Кроме того, удалось сократить время брожения до 60 ч без существенного влияния на общий выход спирта. Дело в том, что в условиях высококонцентрированного сусла быстрее происходит потребление субстрата, так как скорость гидролиза и концентрация субстрата не являются лимитирующей стадией для транспорта сахаров в дрожжевую клетку и соответственно синтеза биоэтанола [29].
ВЫВОДЫ
Оптимальным вариантом измельчения зернового сырья является использование двухстадийного помола – 5 мин на ножевой мельнице ЛЗМ-1 и 20 мин на планетарной шаровой мельнице PM100 при 600 об.–1.
Температура клейстеризации крахмала ультрадисперсного зерна, полученного в результате двухстадийного помола, снижается с 80 до 60°С.
Максимальный гидролиз наночастиц зернового сырья достигается при внесении ферментов в дозировке 2.5 ед. α-амилазы, 0.5 ед. ксиланазы, 0.05 ед. протеазы, 7.75 ед. глюкоамилазы на 1 г условного крахмала.
В результате сбраживания высокоплотного сусла, полученного из ультрадисперсного зернового сырья, уже через 60 ч накапливается до 11.24 об. % спирта в бражке.
Исследования показали принципиальную возможность получения наноразмерных частиц зернового сырья. При этом наноразмерное сырье достаточно прогревать до 60°С, чтобы добиться клейстеризации крахмала. В результате исключается одна из энергозатратных стадий подготовки зерна к сбраживанию – разваривание. Наноразмерные частицы после мягкой водно-тепловой обработки эффективнее гидролизуются ферментами с получением сусла стандартной и высокой плотности. Сбраживание сусла, полученного из ультрадисперсного зернового сырья, происходит быстрее и позволяет увеличить выход целевого продукта (спирта) в среднем до 69.9 дал из 1 т условного крахмала. Единственным узким местом предлагаемой технологии выступает стадия измельчения сырья до наноразмерных частиц. Однако с разработкой высокоэффективного промышленного оборудования предлагаемая схема может быть широко внедрена в практику, в связи с чем резко снизится себестоимость производства биоэтанола.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-44-130002).
Список литературы
Kim J.C., Kong B.W., Kim M.J. // J. Food Sci. 2008. V. 73. P. 621. https://doi.org/10.1111/j.1750-3841.2008.00944.x
Bothast R.J., Schlicher M.A. // Appl. Microbiol. Biotechnol. 2005. V. 67. P. 19. https://doi.org/10.1007/s00253-004-1819-8
Chan-u-tit P., Laopaiboon L., Jaisil P., Laopaiboon P. // Energies. 2013. V. 6. P. 884. https://doi.org/10.3390/en6020884
Robertson G.H., Wong D.W.S., Lee C.C. et al. // J. Agric. Food Chem. 2006. V. 54. P. 353. https://doi.org/10.1021/jf051883m
Wilson J.D., Bechtel D.B., Todd T.C. et al. // Cereal Chemistry. 2006. V. 83 (3). P. 259. https://doi.org/10.1094/CC-83-0259
Драгунова Ю.Е., Атыкян Н.А., Ревин В.В. // Вестн. ОГУ. 2012. Т. 10. С. 72. http://vestnik.osu.ru/2012_10/14.pdf
Ревин В.В., Атыкян Н.А. Патент РФ 2407798. Опубл. 27.12.2010, Бюл. № 36. 3 с.
Deesuth O., Laopaiboon P., Jaisil P., Laopaiboon L. // Energies. 2012. V. 5. P. 3178. https://doi.org/10.3390/en5093178
Geddes C.C., Nieves I.U., Ingram L.O. // Curr. Opin. Biotechnol. 2011. V. 22 (3). P. 312. https://doi.org/10.1016/j.copbio.2011.04.012
Mussatto S.I., Dragone G., Guimaraes P.M. et al. // Biotechnol Adv. 2010. V. 28. P. 817. https://doi.org/10.1016/j.biotechadv.2010.07.001
Pereira F.B., Guimarães P.M.R., Teixeira J.A. // Bioresource Technol. 2010. V. 101. P. 7856. https://doi.org/10.1016/j.biortech.2010.04.082
Pradeep P., Reddy O.V.S. // Indian J. Microbiol. 2010 V. 50. P. 82. https://doi.org/10.1007/s12088-010-0006-0
Puligundla P., Poludasu R.M., Rai J.K. et al. // Ann. Microbiol. 2011. V. 61. P. 863. https://doi.org/10.1007/s13213-011-0207-8
Pham T.K., Wright P.C. // J. Proteome Res. 2008. V. 7. P. 4766. https://doi.org/10.1021/pr800331s
Li B.Z., Cheng J.S., Qiao B. et al. // J. Ind. Microbiol. Biotechnol. 2010. V. 37. P. 43. https://doi.org/10.1007/s10295-009-0646-4
Shigechi H., Fujita Y., Koh J. et al. // Biochem. Eng. J. 2000. V. 18. P. 149. https://doi.org/10.1016/j.bej.2003.08.003
Nevoigt E. // Microbiol. Mol. Biol. Rev. 2008. V. 72(3). P. 379. https://doi.org/10.1128/MMBR.00025-07
Revin V., Atykyan N., Zakharkin D. // Electronic J. Biotechnol. 2016. V. 20. P. 14. https://doi.org/10.1016/j.ejbt.2015.11.007
Шутова В.В., Юсипович А.И., Паршина Е.Ю. и др. // Прикл. биохимия и микробиология. 2012. Т. 48. № 3. С. 346. https://doi.org/10.1134/S000368381203012X
Гаврилина В.А., Сычев С.Н. Высокоэффективная жидкостная хроматография: аналитика, физическая химия, распознование многокомпонентных систем. СПб.: Лань, 2013. 256 с.
Tarko T., Tuszyński T. //Acta Sci. Pol., Technol. Aliment. 2005. V. 4 (1). P. 73. http://www.food.actapol.net/issue1/volume/7_1_2005.pdf
Полыгалина Г.В. Технохимический контроль спиртового и ликеро-водочного производства. М.: Колос, 1999. 333 с.
Bothast R.J., Schlicher M.A. // Appl. Microbiol. Biotechnol. 2005. V. 67. P. 19. https://doi.org/10.1007/s00253-004-1819-8
Wang P., Singh V., Xue H. et al. // Cereal Chem. 2007. V. 84. P. 10. https://doi.org/10.1094/CCHEM-84-1-0010
Yingling B., Zongcheng Y., Honglin W. et al. // Antonie van Leeuwenhoek. 2001. V. 99. P. 329. https://doi.org/10.1007/s10482-010-9494-5
Zhang L., Chen Q., Jin Y. et al. // Fuel Process. Technol. 2010. V. 91. P. 1845. https://doi.org/10.1016/j.fuproc.2010.08.009
Thomas K.C., Hynes S.H., Ingledew W.M. et al. // Appl. Biochem. Biotechnol. 1993. V. 43. P. 211. https://doi.org/10.1007/BF02916454
Thomas K.C., Hynes S.H., Ingledew W.M. // J. Appl. Microbiol. 2001. V. 90. P. 819. https://doi.org/10.1046/j.1365-2672.2001.01311.x
Devantier R., Pedersen S., Olsson L. // Appl. Microbiol. Biotechnol. 2005. V. 68. P. 622. https://doi.org/10.1007/s00253-005-1902-9
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии