Российские нанотехнологии, 2020, T. 15, № 1, стр. 79-88
НАНОСТРУКТУРИРОВАННЫЕ ЧАСТИЦЫ ДРЕВЕСИНЫ – ПЕРСПЕКТИВНЫЙ СУБСТРАТ ДЛЯ ПРОДУЦИРОВАНИЯ ЛИГНОЦЕЛЛЮЛОЛИТИЧЕСКИХ ФЕРМЕНТОВ ДЕРЕВОРАЗРУШАЮЩИМ ГРИБОМ Lentinus tigrinus
В. В. Шутова 1, *, В. В. Ревин 1
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва
Саранск, Россия
* E-mail: vshutova@yandex.ru
Поступила в редакцию 29.04.2020
После доработки 29.05.2020
Принята к публикации 29.05.2020
Аннотация
Доказана возможность использования наночастиц (НЧ) древесины для увеличения эффективности синтеза базидиомицетом Lentinus tigrinus лигнолитических и целлюлолитических ферментов. С помощью метода лазерной дифракции показано, что при увеличении времени измельчения до 40 мин размер преобладающих фракций снижается, обнаружены НЧ (размер частиц березы меньше, чем сосны). С помощью методов лазерной интерференционной микроскопии и динамического светорассеяния показано, что средний размер НЧ древесины березы при 30 мин измельчения составил 160.9 нм, а при 40 мин – 95.3 нм. При культивировании гриба L. tigrinus на грубоизмельченных частицах и НЧ древесины показано, что максимальные лигнолитическая и целлюлолитическая активности наблюдались на субстрате с НЧ березы на шестые сутки роста: для лакказы 528.4 ед./мг, пероксидазы 61.2 ед./мг, Mn-пероксидазы 4383 ед./мг, эндоглюканазы 69.2 ед./мг. Вероятно, существенное увеличение синтеза лигнолитических и целлюлолитических ферментов при культивировании базидиомицета с НЧ L. tigrinus обусловлено увеличением суммарной поверхности субстрата для ферментов гриба. Кроме того, НЧ древесины могут выступать в качестве индукторов биосинтеза ферментов лигноцеллюлазного комплекса.
ВВЕДЕНИЕ
Известно, что ультраизмельчение материалов проводят с помощью механической обработки с использованием высокоэнергонагруженных измельчителей, например шаровых мельниц, что позволяет получать частицы микронных размеров наряду с наноразмерными частицами. Такая высокая степень измельчения затрагивает молекулярные и надмолекулярный уровни организации вещества, что приводит к изменению структурных, физических и химических свойств материала, подвергаемого обработке. В большинстве случаев эти изменения можно называть механоактивацей ввиду повышения реакционной способности субстрата [1].
В биотехнологии применение наночастиц (НЧ) повышает эффективность протекающих биохимических процессов за счет увеличения доступности субстрата ферментам, синтезируемым при культивировании микроорганизмов. Например, при разрушении надмолекулярной структуры целлюлозно-лигнинного каркаса плотно упакованные структуры волокон древесины разрушаются и формируют НЧ, которые более эффективно взаимодействуют с ферментами [2]. Было показано, что использование ультраизмельчения лигноцеллюлозного сырья, в том числе с помощью ультразвука, повышает эффективность последующего ферментативного гидролиза целлюлазами для получения биоэтанола [3–5].
К лигнолитическим и целлюлолитическим ферментам обращено внимание многих исследователей, поскольку они имеют большой потенциал для применения в различных сферах промышленности. Минерализация лигнина представляет собой процесс, который катализируется комплексом лигнолитических ферментов, состоящим из внеклеточных оксидоредуктаз (лакказ и пероксидаз). Дереворазрушающие грибы являются единственными эукариотами, способными образовывать эти ферменты. Они играют решающую роль в деградации растительного сырья, а также многочисленных фенольных поллютантов, следовательно, и в биоремедиации загрязненных природных вод и промышленных стоков [6]. Интерес к применению лигнолитических ферментов грибов белой гнили возрастает в химической, топливной, пищевой, текстильной, целлюлозно-бумажной промышленности, косметике и сельском хозяйстве [7]. Предложено использование лигниназ в иммобилизованном виде [8].
Дереворазрушающий базидиальный гриб Lentinus tigrinus обладает мощным ферментативным комплексом лигниназ (лакказа (EC 1.10.3.2), Mn-зависимая пероксидаза (MnП EC 1.11.1.13), секреторная пероксидаза (ЕС 1.11.1.7)) [9, 10] и целлюлаз, важное место среди которых занимают эндоглюканазы (EC 3.2.1.4), способные неупорядоченно гидролизовать β-1-4-внутренние химические связи макромолекул целлюлозы [11]. Способность дереворазрушающих грибов к разложению древесины видоспецифична и зависит от их гидролитического и окислительного потенциалов [12, 13]. В биотехнологических системах уровень биосинтеза ферментов зависит от условий культивирования и состава питательной среды, например природы и концентрации источников углерода, азота и некоторых металлов (меди, марганца и кальция), pH и др. [13, 14]. Это открывает возможность того, что дереворазрушающие грибы могут использоваться в качестве биотехнологических агентов для биотрансформации персистентных ксенобиотиков фенольной природы или продуцентов, обладающих повышенной способностью к биоконверсии древесины [15, 16].
Цель настоящей работы – установление взаимосвязи между размером частиц различных пород древесины и активностью лигниназ и целлюлаз при глубинном культивировании гриба Lentinus tigrinus на ультраизмельченном древесном субстрате.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве продуцента ферментов лигноцеллюлазного комплекса в работе использовали штамм лигнолитического гриба Lentinus (Panus) tigrinus (Bulliard: Fries) Fries 317 (BKM F-3616 D).
Березовые и сосновые опилки получали распилом древесины с помощью дисковой циркулярной пилы. Ультрадисперсные древесные частицы (УДЧ) получали путем размола опилок с помощью планетарной шаровой мельницы Retsch PM-400 (Германия) при скорости вращения 400 об./мин в течение 30 и 40 мин.
Распределение частиц древесины по размерам изучали с помощью современных оптических методов: лазерной дифракции, лазерной интерференционной микроскопии (ЛИМ), и методом динамического светорассеяния (ДС). Метод лазерной дифракции использовали для оценки размеров частиц в помоле. Для этого готовили 5%-ную суспензию УДЧ и проводили измерения в проточной ячейке анализатора размера частиц Shimadzu SALD-3101 (WingSALD II:Version 2.1.0, Япония). Лазерную интерференционную микроскопию использовали для определения морфологии и плотности образца, измеряя оптическую разность хода (ОРХ), пропорциональную высоте объекта и показателю преломления [17]. Исследования проводили на автоматизированном интерференционном микроскопе на базе микроскопа МИИ-4М (“НИИ ОФИ”, Россия) с длиной волны излучения лазера 650 нм. Погрешность измерения в плоскости составляет около 0.5 мкм, а по высоте погрешность измерения ОРХ – около 5 нм.
Величина ОРХ (Φ) связана с высотой (z) следующим соотношением:
где n и n0 – показатели преломления частицы и раствора (для воды n0 = 1.333) соответственно.Для расчета толщины частиц целлюлозы ее показатель преломления принимался равным 1.468 [18]. Для определения размеров УДЧ их помещали в дистиллированную воду (5%) на 24 ч; 2 мкл супернатанта помещали на зеркальную поверхность стекла, накрывали покровным стеклом и помещали в микроскоп. В каждой пробе оценивали не менее 80 объектов. Для обработки изображений использовали программу FIJI (http://fiji.sc/). Достоверность различий оценивали с использованием критерия Манна–Уитни при р = = 0.05.
Для изучения распределения частиц древесины с помощью метода ДС супернатант разбавляли в 5 раз и помещали кювету с суспензией в модульный спектрометр динамического и статического рассеяния света Photocor Complex (Россия).
Для приготовления посевного материала гриб культивировали в колбах со 100 мл среды Чапека–Докса (г/л): NaNO3 – 3, KH2PO4 – 1, MgSO4 · · 7Н2О – 0.5, KCl – 0.5, FeSO4 ⋅ 7H2O – 0.01, CuSO4 ⋅ 5H2O – 0.22; pH – 6.0, с добавлением сахарозы (20–30 г/л) и лигносульфоната (15 г/л). Выращивание проводили в колбах Эрленмейера (объем 250 или 500 мл) на шейкере-инкубаторе ES-20/60 (BioSan, Латвия) при 200 об./мин при 26°С. Гриб со скошенного сусло-агара (размер инокулюма 1 × 1 см) вносили в колбы.
В экспериментах культуру гриба выращивали в тех же условиях 8 сут в колбах объемом 500 мл со 100 мл среды того же состава и 5% опилок (УДЧ и обычные). Для экспериментов в колбы вносили 10% жидкого посевного материала.
Режим стерилизации сред – 121°С, 30 мин.
Культуральную жидкость гриба центрифугировали при 7000 g в течение 10 мин для освобождения от взвешенных частиц и биомассы. Лигнолитическую и целлюлолитическую активность определяли спектрометрически на УФ-спектрофотометре Shimadzu UV-Mini-1240 (Япония). Белок в культуральной жидкости определяли по методу Бредфорда, используя в качестве стандарта бычий сывороточный альбумин.
Лакказную активность регистрировали по окислению пирокатехина [19]. За единицу активности принимали количество фермента, которое за 1 мин при 30°С образует 1 мкмоль продукта. Определение пероксидазной активности проводили по окислению о-дианизидина [20]. За единицу активности принимали количество фермента, которое за 1 мин при 20°С расщепляет 1 мкмоль субстрата. Mn2+-пероксидазную активность определяли по окислению фенолового красного [21]. За единицу активности принимали количество фермента, которое за 1 мин при 20°С образует 1 мкмоль продукта. Определение эндоглюканазной активности проводили по расщеплению натриевой соли карбоксиметилцеллюлозы в 0.05 М ацетатном буфере, рН 4.5, с 0.1 М NaCl. К 1 мл субстрата добавляли 1 мл КЖ, инкубировали 30 мин при 50°С и определяли редуцирующие сахара по реакции с динитросалициловой кислотой. За единицу активности принимали такое количество фермента, которое при действии на натриевую соль карбоксиметилцеллюлозы за 1 ч инкубации при 50°С образовывало 1 мг глюкозы [19].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
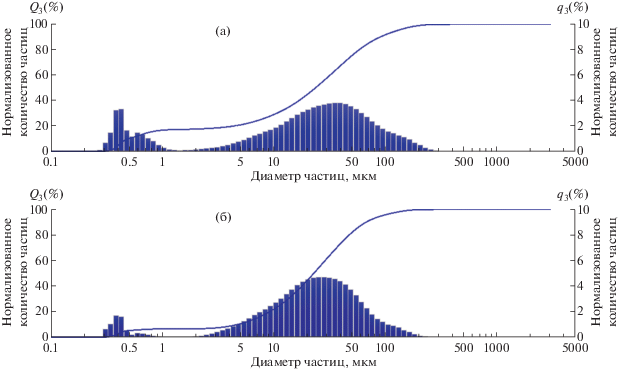
Измерение размеров УДЧ. Для того чтобы выявить корреляцию между размером частиц и активностью ферментов лигноцеллюлазного комплекса гриба при его глубинном культивировании с добавлением порошков древесины, получены серии образцов, различающихся размерами частиц. Чтобы учесть видовую специфичность гриба-продуцента по отношению к древесному субстрату, в опытах использовали два различных источника лигноцеллюлозы – древесину сосны и березы. Размеры частиц древесины в диапазоне от 100 нм до 1 мм определяли с помощью метода лазерной дифракции. Использование методов ЛИМ и динамического светорассеяния позволило определить размеры НЧ [3, 22–24].
Методом лазерной дифракции установлено, что при измельчении березы при 400 об./мин в течение 30 мин обнаружены частицы размером от 0.3 до 332 мкм (рис. 1а). Преобладающими являются фракции частиц размером от 20 до 70 мкм. Также обнаружены НЧ (290–400 нм), вклад отдельных фракций достигал 3.3%. При увеличении времени измельчения до 40 мин (рис. 1б) частиц размером свыше 100 мкм не обнаружено, преобладающая фракция частиц характеризуется размером 12–55 мкм.
На гистограмме УДЧ, полученных при измельчении древесины сосны в течение 30 мин, преобладающей является фракция с размерами частиц в интервале от 41 до 89 мкм, т.е. их средний размер больше, чем при получении УДЧ из древесины березы (рис. 2а). Кроме того, в этих условиях получено максимальное количество частиц размером более 100 мкм. При увеличении времени измельчения до 40 мин на гистограмме отсутствует фракция УДЧ размером более 100 мкм (рис. 2б). В обоих случаях (время размола 30 и 40 мин) вклад НЧ размером 400 нм и менее оказался меньше, чем вклад соответствующих фракций НЧ из древесины березы, и составил приблизительно 2%.
На рис. 3 показано, что в выбранном режиме ультраизмельчения березовых опилок (400 об./мин, 30 мин) образуются частицы не только различных размеров, но и формы. Фракционирование частиц по размеру проводили в воде. С помощью ДС установлено, что в супернатанте при измельчении древесины березы в течение 30 мин находятся фракции со средним диаметром 10.2, 113.7 и 605.4 нм, а также более крупные частицы, а при ультраизмельчении опилок в течение 40 мин – НЧ со средними размерами 30.4, 282.0 нм и более крупные частицы (рис. 4а). Размеры НЧ, полученные при ультраизмельчении сосновых опилок, были больше (рис. 4б).
Рис. 3.
Световое изображение частиц древесины березы после измельчения опилок в осадке (а) и в супернатанте (б). Режим помола 30 мин, 400 об./мин.

С помощью метода ЛИМ установлено, что средний диаметр наночастиц березы после 30 мин измельчения древесины составляет 160.9 нм, а при 40 мин – 95.3 нм, наиболее часто встречаемые (мода) значения 99.5 и 54.7 нм соответственно. В супернатанте также присутствуют частицы диаметром от ~30 нм и более 1 мкм, но превалируют частицы диаметром менее 1 мкм. Эти результаты соответствуют данным, полученным для УДЧ сосны: при режиме измельчения (400 об./мин, 40 мин) размер частиц составил 103.6 нм [3].
Итак, увеличение времени измельчения древесины приводит к снижению среднего размера частиц, что можно контролировать с помощью методов лазерной дифракции, ЛИМ и динамического светорассеяния.
НЧ древесины как индукторы биосинтеза лигниназ и целлюлаз при глубинном культивировании гриба L. tigrinus. Поскольку увеличение времени измельчения древесины приводит к снижению размеров частиц, в качестве субстратов для синтеза ферментов грибом L. tigrinus использовали частицы березы и сосны после измельчения при 400 об./мин в течение 40 мин. L. tigrinus выращивали в среде с лигносульфонатом, в которую добавляли грубодисперсные опилки и механоактивированные частицы березы и сосны (5% от объема среды). Интересно, что рост гриба происходил в виде глобул (пеллет) размером от 3.5 до 7 мм, которые были покрыты УДЧ.
Установлено, что максимальные концентрации внеклеточного белка в культуральной жидкости выявлены на шестые сутки при культивировании гриба на сосновых опилках и УДЧ березы (240 мкг/мл), меньше внеклеточного белка образовалось в среде с УДЧ сосны (178 мкг/мл).
Лакказа – медьсодержащая фенолоксидаза, которая может окислять субстраты фенольного и нефенольного происхождения с одновременным восстановлением кислорода в воде через радикальный механизм реакции [25]. При исследовании действия лигноцеллюлозного субстрата на изменение лакказной активности гриба L. tigrinus установлено, что она проявилась на вторые сутки культивирования, достигая максимального значения к шестым суткам на всех видах субстратов. Максимальная активность лакказы наблюдалась при культивировании гриба на среде с УДЧ из древесины березы и составила 88.2 ед./мл, несколько ниже – на УДЧ из древесины сосны, а минимальная – на сосновых опилках (рис. 5а). По-видимому, УДЧ древесины выступают в роли индукторов биосинтеза лакказ базидиомицетами, что соответствует данным [26].
Рис. 5.
Зависимость лакказной (а – общая, б – удельная) активности L. tigrinus от лигноцеллюлозного субстрата.
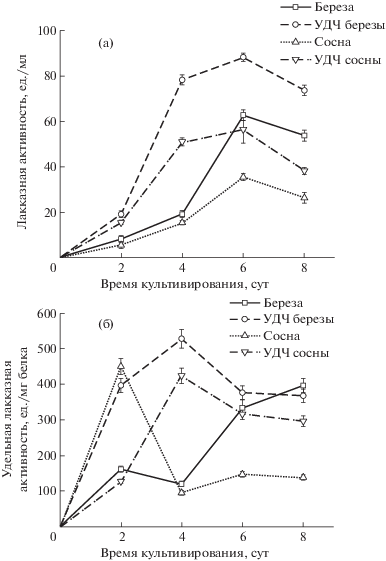
Удельная активность лакказы у L. tigrinus, выращенного на среде с добавлением УДЧ березы и сосны, достигает максимального значения на четвертые сутки культивирования (соответственно 528.4 и 424.2 ед./мг белка) (рис. 5б). В среде с сосновыми опилками максимальная активность наблюдалась на вторые сутки роста (450 ед./мг белка), а с березовыми – лишь к восьмым суткам. Удельная активность фермента (т.е. активность, нормированная на содержание внеклеточного белка) достигала максимума раньше, чем общая, за исключением варианта на среде с березовыми опилками.
Роль секреторной пероксидазы растительного типа в биодеградации лигнина изучена в меньшей степени, чем остальных ферментов. Известно, что она обладает широкой субстратной специфичностью и способна катализировать окисление множества различных химических соединений, включая фенольные соединения лигнина, за счет кислорода пероксида водорода [27]. При культивировании штамма на среде с УДЧ березы пероксидазная активность L. tigrinus проявилась на вторые сутки и достигла максимума на четвертые сутки (9.06 ед./мл) (рис. 6а). Пероксидазная активность на среде с добавлением НЧ из древесины сосны была ниже, чем на среде с добавлением НЧ древесины березы. Важно, что активность выше при культивировании L. tigrinus на НЧ древесины.
Рис. 6.
Зависимость пероксидазной (а – общая, б – удельная) активности L. tigrinus от лигноцеллюлозного субстрата.
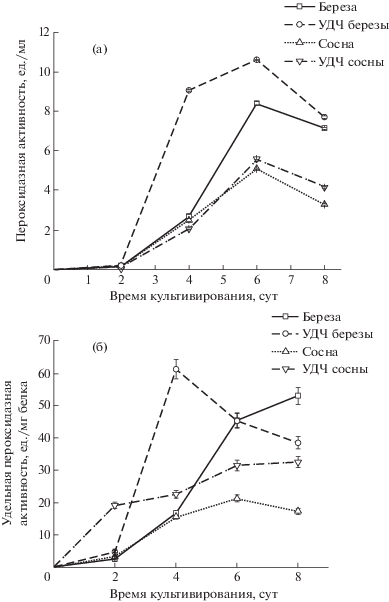
Показано, что максимальная удельная пероксидазная активность наблюдалась при культивировании гриба в среде с УДЧ березы на четвертые сутки роста (61.2 ед./мг белка), а на среде с УДЧ сосны к шестым суткам (рис. 6б). При выращивании гриба-продуцента на среде с березовыми опилками максимальная активность наблюдалась позже, на восьмые сутки (52.9 ед./мг белка).
Другим важным внеклеточным ферментом является MnП – фермент, который участвует в непосредственном разложении лигнина [28]. Установлено, что на всех видах субстрата MnП активность достигает максимума к шестым суткам культивирования (рис. 7а). На протяжении всего цикла культивирования продуцента на среде с добавлением УДЧ березы наблюдались высокие значения MnП активности, достигая максимального значения 113.2 ед./мл. Известно, что MnП эффективнее модифицирует лигнин хвойных по сравнению с лиственными породами древесины (28% против 18%). В образцах лиственных пород большему воздействию подвергаются гваяцильные единицы лигнина по сравнению с сирингильными (21% против 12%) [28]. В литературе имеются примеры влияния природы древесного субстрата на активность лигнолитических ферментов [29].
Рис. 7.
Влияние лигноцеллюлозного субстрата на динамику Mn-пероксидазной (а – общая, б – удельная) активности L. tigrinus.
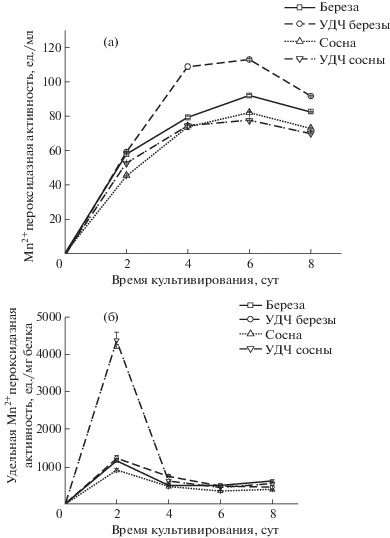
В отличие от общей MnП-активности удельная во всех вариантах достигала максимума раньше – на вторые сутки роста, при этом на среде с добавлением УДЧ сосны она составила 4383 ед./мг белка. В остальных вариантах значение удельной активности было ниже (рис. 7б).
При культивировании гриба L. tigrinus эндоглюканазная активность на средах с добавлением УДЧ древесины обеих пород была выше, чем на грубоизмельченных субстратах: ее максимум наблюдали на шестые сутки на всех средах, на среде с УДЧ березы значение активности составляет 2.32 ед./мл (рис. 8а). Эндоглюканазная активность гриба на УДЧ сосны имела близкое значение (2.28 ед./мл).
Рис. 8.
Влияние лигноцеллюлозного субстрата на эндоглюканазную (а – общая, б – удельная) активность L. tigrinus.

Максимальная удельная активность эндоглюканазы данного штамма наблюдалась к четвертым суткам во всех вариантах опыта, т.е. на двое суток раньше, чем общая (рис. 8б). Из полученных данных следует, что у гриба, растущего на УДЧ сосны, величина удельной активности самая высокая (69.2 ед./мг белка). Таким образом, значение активности и биосинтеза фермента больше при культивировании на НЧ.
При культивировании гриба L. tigrinus на средах с добавлением грубоизмельченной лигноцеллюлозы и УДЧ максимальная лигнолитическая активность наблюдается на субстрате с УДЧ березы, что согласуется с тем, что данный вид гриба главным образом обитает на лиственных породах деревьев. Целлюлолитическая активность выше на НЧ обеих пород древесины.
ЗАКЛЮЧЕНИЕ
С помощью планетарной шаровой мельницы получены ультрадисперсные частицы древесины березы и сосны. Методами лазерной дифракции, динамического светорассеяния и лазерной интерференционной микроскопии изучено распределение УДЧ по размерам. Показано, что в наблюдаемом диапазоне размеров частиц имеются фракции наночастиц, например, средний размер НЧ березы уменьшается с 160.9 до 95.3 нм при увеличении времени ультрадиспергирования с 30 до 40 мин (при 400 об./мин).
Показано, что при глубинном культивировании дереворазрушающего гриба L. tigrinus на средах с добавлением УДЧ, включая фракции наночастиц, происходило значительное увеличение активности ферментов лигнолитического и целлюлазного комплексов. Среди причин наблюдаемого явления можно выделить следующие: с одной стороны, при ультраизмельчении происходит разрушение лигноцеллюлозного каркаса древесины, что, в свою очередь, способствует увеличению доступности лигнина и целлюлозы к ферментам целлюлазного и лигнолитического комплексов, с другой стороны, УДЧ могут выступать в качестве индукторов биосинтеза этих ферментов, о чем может косвенно свидетельствовать факт локализации УДЧ на поверхности глобул мицелия гриба-продуцента. Существуют сообщения, что целлюлазная система грибов является индуцибельной, а не конститутивной, как считалось ранее. Простые сахара со временем подавляют экспрессию гемицеллюлаз, но не подавляют целлюлазы [30].
Таким образом, доказано, что активность ряда ферментов, участвующих в деградации лигнина и целлюлозы, увеличивается при культивировании гриба в средах с УДЧ. Этот процесс можно регулировать, контролируя режимы получения частиц и их размер с помощью методов лазерной дифракции, лазерной интерференционной микроскопии и динамического светорассеяния.
Исходя из полученных данных, можно утверждать, что УДЧ являются перспективными субстратами и индукторами в процессах биоконверсии древесины и получения лигнолитических и целлюлолитических ферментов дереворазрушающих базидиальных грибов.
Список литературы
Kajdas C. // Tribology in engineering. 2013. P. 209. https://doi.org/10.5772/50507
Menon V., Rao M. // Prog. Energy Combust. Sci. 2012. V. 38. P. 522. https://doi.org/10.1016/j.pecs.2012.02.002
Шутова В.В., Юсипович А.И., Паршина Е.Ю. и др. // Прикл. биохимия и микробиология. 2012. Т. 48. № 3. С. 346. https://doi.org/10.1134/S000368381203012X
Revin V.V., Atykyan N.A., Zakharkin D.O. et al. // J. Biotechnol. 2014. V. 185. P. S123. https://doi.org/10.1016/j.jbiotec.2014.07.423
Revin V., Atykyan N., Zakharkin D. // Electron J. Biotechnol. 2016. V. 20. P. 14. https://doi.org/10.1016/j.ejbt.2015.11.007
Baldrian P., Šnajdr J. // Enzyme Microb. Technol. 2006. V. 39. P. 1023. https://doi.org/10.1016/j.enzmictec.2006.02.011
Maciel M.J.M., Ribeiro H.C.T. // Electron J. Biotechnol. 2010. V. 13. № 6. P. 14. https://doi.org/10.2225/vol13-issue6-fulltext-2
Bilal M., Asgher M., Parra-Saldivar R. et al. //Sci. Total Environ. 2017. V. 576. P. 646. https://doi.org/10.1016/j.scitotenv.2016.10.137
Шутова В.В., Ревин В.В., Мякушина Ю.А. // Прикл. биохимия микробиология. 2008. Т. 44. № 6. С. 683. https://doi.org/10.1134/S0003683808060100
Кадималиев Д.А., Шутова В.В., Телятник В.И. и др. // Микробиология. 2014. Т. 83. № 4. С. 426. https://doi.org/10.7868/S0026365614040077
Baldrian P., Valášková V. // FEMS Microbiol. Rev. 2008. V. 32. № 3. P. 501. https://doi.org/10.1111/j.1574-6976.2008.00106.x
Wan C., Li Y. // Enzyme Microb. Technol. 2010. V. 47. P. 31. https://doi.org/10.1016/j.enzmictec.2010.04.001
Ревин В.В., Кадималиев Д.А., Шутова В.В., Самуилов В.Д. // Прикл. биохимия и микробиология. 2002. № 5. С. 529. https://doi.org/10.1023/A:1019920502658
Yamanaka R., Soares C.F., Matheus D.R., Machado K.M. // Brazilian J. Microbiol. 2008. V. 39. № 1. P. 78. https://doi.org/10.1590/S1517-83822008000100019
Pozdnyakova N.N., Jarosz-Wilkolazka A., Polak J. et al. // Biocatalysis Biotransformation. 2015. V. 33. № 2. P. 69. https://doi.org/10.3109/10242422.2015.1060227
Financie R., Moniruzzaman M., Uemura Y. // Biochem. Eng. J. 2016. V. 110. P. 1. https://doi.org/10.1016/j.bej.2016.02.008
Юсипович А.И., Берестовская Ю.Ю., Шутова В.В. и др. // Биофизика. 2011. Т. 56. Вып. 6. С. 1091. https://doi.org/10.1134/S0006350911060224
Kasarova S.N., Sultanova N.G., Ivanov C.D., Niko-lov I.D. // Opt. Mater. 2007. V. 29. P. 1481. https://doi.org/10.1016/j.optmat.2006.07.010
Синицын А.П., Черноглазов В.П., Гусаков А.В. // Итоги науки и техники. Сер. Биотехнология. 1990. Т. 25. ВИНИТИ. С. 25.
Ugarova N.N., Rozhkova G.D., Berezin I.V. // Biochem. Biophys Acta. 1979. V. 570. P. 31. https://doi.org/10.1016/0005-2744(79)90198-0
Glenn J.K., Gold M.H. // Arch. Biochem. Biophys. 1985. V. 242. № 2. P. 329. https://doi.org/10.1016/0003-9861(85)90217-6
Baker R.P., Taormina M.J., Jemielita M., Parthasarathy R. // J. Microscopy. 2015. V. 258. № 2. P. 105. https://doi.org/10.1111/jmi.12220
Yusipovich A.I., Parshina E.Y., Brysgalova N.Y. et al. // J. Appl. Phys. 2009. V. 105. P. 102037. https://doi.org/10.1063/1.3116609
Harding S., Harding J., Holman K. et al. // APS. 2017. V. 2017. P. M1. 312. Bibcode: 2014APS.MAR.H1177V
Mate D.M., Alcalde M. // Microb. Biotechnol. 2017. V. 10. № 6. P. 1457. https://doi.org/10.1111/1751-7915.12422
Tišma M., Znidaršič-Plazl P., Vasić-Rački D., Zelić B. // Appl. Biochem. Biotechnol. 2012. V. 166 (1). P. 36. https://doi.org/10.1007/s12010-011-9401-1
Wong D.W.S. // Appl. Biochem. Biotechnol. 2009. V. 157. № 2. P. 174. https://doi.org/10.1007/s12010-008-8279-z
MacDonald J., Goacher R.E., Abou-Zaid M., Master E.R. // Appl. Microbiol. Biotechnol. 2016. V. 100. № 18. P. 8013. https://doi.org/10.1007/s00253-016-7560-2
Mäkelä M.R., Lundell T., Hatakka A., Hildén K. // Fungal Biology. 2013. V. 117. № 1. P. 62. https://doi.org/10.1016/j.funbio.2012.11.006
Zhang J., Schilling J.S. // Fungal Genetics Biology. 2017. V. 106. P. 1. https://doi.org/10.1016/j.fgb.2017.06.003
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии