Российские нанотехнологии, 2020, T. 15, № 1, стр. 89-92
СТИМУЛИРУЮЩИЕ ЭФФЕКТЫ МНОГОСТЕННЫХ УГЛЕРОДНЫХ НАНОТРУБОК НА ИММОБИЛИЗОВАННЫЕ БАКТЕРИАЛЬНЫЕ КЛЕТКИ Gluconacetobacter sucrofermentas ВКПМ B-11267
С. Е. Тарасов 1, 2, *, Ю. В. Плеханова 1, А. Е. Быков 1, Н. А. Кленова 3, А. Н. Решетилов 1, 2
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН –
обособленное подразделение ФГБУН “ФИЦ ПНЦБИ РАН”
Пущино, Россия
2 Институт радиотехники и электроники им. В.А. Котельникова РАН
Москва, Россия
3 Самарский национальный исследовательский университет им. акад. С.П. Королева
(Самарский университет)
Самара, Россия
* E-mail: setar25@gmail.com
Поступила в редакцию 07.05.2020
После доработки 07.05.2020
Принята к публикации 14.05.2020
Аннотация
Бактериальные клетки Gluconacetobacter sucrofermentas иммобилизовали в гель хитозана на поверхности электрода, полученного матричной печатью. Исследовали характер изменения биоэлектрохимических параметров иммобилизованных бактерий под влиянием многостенных углеродных нанотрубок (МУНТ). Изучены электрохимические сигналы клеток при введении субстратов (глюкоза, этанол) тремя методами: хроноамперометрией, циклической вольтамперометрией и импедансной спектроскопией. Введение этилового спирта в концентрации 1 мМ приводит к снижению общего сопротивления электрода в ~40 раз. Модификация электрода с помощью МУНТ приводит к росту тока (в 8–10 раз), а также к дополнительному снижению общего сопротивления электрода в ~10 раз. Данные эффекты подобны влиянию субстратов и МУНТ на филогенетически близкие клетки Gluconobacter oxydans. Образование в процессе роста клеток оболочки из бактериальной целлюлозы принципиально не изменяло эффекты субстратов и МУНТ.
ВВЕДЕНИЕ
Gluconacetobacter sucrofermentas ВКПМ B-11267 филогенетически близки к бактериям Gluconobacter oxydans ВКМ 1280 [1, 2], которые, как показано в [3–5], являются эффективным объектом для формирования микробных биосенсоров. В данном исследовании выясним, насколько клетки G. sucrofermentas ВКПМ B-11267 могут быть эффективны при конструировании биосенсоров; влияет ли присутствие наноматериала на характер поведения клеток и какую роль играет оболочка этой бактериальной клетки – не приводит ли она к значительному росту сопротивления слоя иммобилизованных бактерий и значительной потери сигнала.
Бактерии G. sucrofermentas ВКПМ B-11267 являются продуцентом бактериальной целлюлозы [6, 7]. Бактериальная целлюлоза (БЦ) – перспективный материал для получения широкого спектра продуктов и наноматериалов. Она имеет большой потенциал использования в медицине как биоматериал для тканевой инженерии, создания раневых покрытий и трансдермальных терапевтических систем, может использоваться в диетологии в качестве носителя добавок для сбалансированного питания, в промышленной электронике для получения оптически прозрачных соединений с ультранизким коэффициентом теплового расширения, для изготовления акустических диафрагм, способна служить заменой растительной целлюлозы в производстве бумаги [7, 8]. Бактериальная целлюлоза является перспективным источником получения нанокристаллической целлюлозы и биокомпозитных материалов [9]. В настоящее время БЦ указанных бактерий широко используется для создания микробных топливных элементов [10].
Конечная цель настоящего исследования заключалась в том, чтобы оценить возможность использования БЦ как нового материала для иммобилизации широкого спектра клеток микроорганизмов и белков при формировании рецепторного элемента биосенсоров. На первом этапе изучения необходимо было оценить влияние БЦ на генерируемый бактериальными клетками сигнал, выяснить, могут ли клетки G. sucrofermentas ВКПМ B-11267 являться основой биорецептора. Для получения этих данных использовали биоэлектрохимические методы, а в качестве окисляемого субстрата – этиловый спирт и глюкозу.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение биосенсора. Культивирование бактериальных клеток G. sucrofermentas ВКПМ B-11267 (предоставлены сотрудниками кафедры биотехнологии, биоинженерии и биохимии Мордовского национального исследовательского университета им. Н.А. Огарева) описано в [11]. Для формирования биосенсора использовали 3-контактные электроды, полученные матричной печатью (ООО “КолорЭлектроникс”, Москва, Россия). На рабочий электрод наносили смесь суспензии клеток (1 мг сырого веса/мкл) с 2%-ным раствором хитозана, растворенным в 1%-ной уксусной кислоте [12]. Объемное соотношение в смеси “биокатализатор–хитозан” составляло 1:1. Затем электрод подсушивали при комнатной температуре в течение 30 мин. Концентрация биокатализатора на поверхности электрода составляла 0.12 мг сырой массы/мм2.
Электрохимические измерения. Измерения проводили в 25 мМ калий-фосфатном буферном растворе (рН 6.5), содержащем 10 мМ хлорида натрия. Объем измерительной ячейки составлял 2 мл. В качестве редокс-медиатора использовали 2,6-дихлорфенолиндофенол (ДХФИФ) в концентрации 40 мкМ. Электрохимические измерения проводили с помощью потенциостата/гальваностата “VersaSTAT 4” с модулем FRA (Princeton Applied Research, США). В качестве модифицирующего материала использовали многостенные углеродные нанотрубки (МУНТ) “Таунит-М” (ООО “НаноТехЦентр”, Тамбов, Россия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
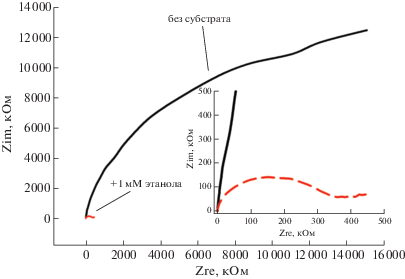
На рис. 1 представлены циклические вольт-амперные характеристики клеток G. sucrofermentas ВКПМ B-11267 в присутствии медиатора. Увеличение анодных токов в системе при добавлении 1 мМ этанола свидетельствует о том, что клетки производят активное окисление данного субстрата, что согласуется с аналогичным процессом у бактерий G. oxydans ВКМ 1280. Наличие процессов электронного переноса в системе в присутствии этанола подтвердили с помощью метода электрохимической импедансной спектроскопии (ЭИС). На рис. 2 представлены диаграммы Найквиста для скрин-принт-электродов, содержащих клетки G. sucrofermentas ВКПМ B-11267. Как видно из полученных данных, добавление субстрата снижает общее сопротивление системы и сопротивление переноса заряда более чем в 50 раз (с ~20 МОм до ~400 кОм). Сопротивление переноса заряда определяли как экстраполированную точку пересечения диаграммы с осью Zre (Zre – активное сопротивление) в области низких частот. Измерения проводили в диапазоне частот 40 кГц–0.1 Гц с амплитудой сигнала в 10 мВ.
Рис. 1.
Циклические вольтамперные характеристики скрин-принт-электрода с иммобилизованными клетками G. sucrofermentas в присутствии и в отсутствие 1 мМ этанола.

Рис. 2.
Диаграммы Найквиста для скрин-принт-электродов с клетками G. sucrofermentas в присутствии и в отсутствие 1 мМ этанола. На вставке представлена увеличенная область высоких частот. Zim – мнимое сопротивление.
Была проверена чувствительность бактерий к глюкозе, а также выполнена оценка влияния МУНТ на окислительную активность бактерий.
На рис. 3 представлены калибровочные зависимости для биосенсоров, содержащих клетки G. sucrofermentas ВКПМ B-11267, для двух субстратов – глюкозы и этанола в присутствии и в отсутствие углеродных нанотрубок. Показано, что добавление в систему углеродного наноматериала приводит к резкому росту получаемых сигналов биосенсоров для обоих рассмотренных субстратов. Отметим, что произошло изменение значения Констант Михаэлиса (КМ). Константа Михаэлиса является показателем сродства фермента к субстрату; его увеличение означает снижение сродства фермента к субстрату. Для системы с глюкозой в качестве субстрата значение КМ увеличилось с 0.75 до 1.66, что отображает снижение сродства фермента к субстрату. Для системы с этанолом наблюдали противоположный эффект – снижение значения КМ с 0.87 до 0.26. Эти данные совпадают с данными, полученными ранее для клеток G. oxydans в [5]. Этот эффект может свидетельствовать о том, что различные ферментные комплексы клеток по-разному взаимодействуют с углеродными нанотрубками, и влияние их на фермент может быть как положительным (увеличение сродства к субстрату, как в случае алкогольдегидрогеназы), так и отрицательным (уменьшение сродства к субстрату, как в случае глюкозодегидрогеназы). Полученные данные свидетельствуют о том, что изученные бактериальные клетки могут выступать в качестве биологической основы биосенсоров. Чувствительность биосенсоров и общий уровень сигналов увеличивались для обоих исследованных субстратов.
Рис. 3.
Калибровочные зависимости штамма G. sucrofermentas для стандартных электродов и электродов, модифицированных углеродными нанотрубками (НТ) при использовании глюкозы (1) и этанола (2) в качестве субстратов.

Представленные эксперименты были выполнены с клетками, отделенными от БЦ, выделяемой ими в процессе роста на питательной среде. На рис. 4 приведены сигналы биосенсора на основе клеток G. sucrofermentas, находящихся непосредственно в выделенной ими БЦ. Как видно из рисунка, БЦ не влияет на скорость роста сигнала, т.е. не препятствует прохождению субстрата и медиатора к клеткам и электроду, что предполагает возможность ее использования для создания биосенсора. В то же время при таком способе иммобилизации клеток на поверхности электрода сигнал биосенсора быстро снижается (на вставке показано изменение сигнала в течение шести суток, видно падение сигнала в ~10 раз), что свидетельствует, скорее всего, о вымывании клеток из БЦ на поверхности электрода.
ЗАКЛЮЧЕНИЕ
В заключение отметим, что в исследовании ставили задачу получить начальные данные о некоторых биоэлектрохимических характеристиках штамма G. sucrofermentas ВКПМ B-11267, который филогенетически близок к хорошо известному штамму G. oxydans ВКМ 1280. Представленные данные получены впервые. Указанный штамм интересен тем, что в процессе роста генерирует БЦ, которую в дальнейшем можно применять для создания биосенсоров. Показано, что клетки штамма достаточно активны и окисляют глюкозу и этиловый спирт. Выявлено, что сопряжение клеток с МУНТ позволяет получить положительный эффект, проявляющийся в росте тока и снижении общего сопротивления. В дальнейшем планируется выполнить расширенные исследования биоэлектрохимических параметров данного штамма и изучить возможность его эффективного использования в микробных биосенсорах и биотопливных элементах.
Исследование выполнено при финансовой поддержке Российского научного фонда (проект № 18-49-08005).
Список литературы
Gillis M., De Ley J. // Int. J. Syst. Evol. Microbiol. 1980. V. 30. № 1. P. 7.
Validation list № 64 // Int. J. Syst. Bacteriol. 1998. V. 48. P. 327.
Понаморева О.Н., Инджгия Е.Ю., Алферов В.А., Решетилов А.Н. // Электрохимия. 2010. Т. 46. № 12. С. 1503.
Plekhanova Y., Tarasov S., Bykov A., Reshetilov A. // IET Nanobiotechnology. 2019. V. 13. № 3. P. 332. https://doi.org/10.1049/iet-nbt.2018.5172
Plekhanova Y., Tarasov S., Bykov A. et al. // Biosensors. 2019. V. 9. № 4. P. 137. https://doi.org/10.3390/bios9040137
Евдокименко Д.А., Мажанова И.С., Соболева В.С., Сосова Э.Ю. // Вестник молодых ученых и специалистов Самарского университета. 2018. Т. 2 № 13. С. 35.
Кленова Н.А., Белоусова З.П., Писарева Е.В. и др. // Актуальная биотехнология. 2018. Т. 3. № 26. С. 33.
Wang J., Tavakoli J., Tang Y. // Carbohydrate Polymers. 2019. V. 219. P. 63.
Mohite B.V., Patil S.V. // Biotechnol. Appl. Biochem. 2014. V. 61. № 2. P. 101. https://doi.org/10.1002/bab.1148
Mashkour Me., Rahimnejad M., Mashkour Ma. // J. Power Sources. 2016. V. 325. P. 322.
Быков А.Г., Скрипачева О.В., Тарасов С.Е. и др. // Изв. Тульского гос. ун-та. Естественные науки. 2020. № 1. С. 17.
Wang X., Gu H., Yin F., Tu Y. // Biosens. Bioelectron. 2009. V. 24. № 5. P. 1527.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



