Российские нанотехнологии, 2020, T. 15, № 1, стр. 93-100
ОПРЕДЕЛЕНИЕ РАСПОЛОЖЕНИЯ И СТРУКТУРЫ АТФ-СИНТЕТАЗЫ В МЕМБРАНАХ МИТОХОНДРИЙ СЕРДЦА КРЫС С ПОМОЩЬЮ КРИО-ЭЛЕКТРОННОЙ ТОМОГРАФИИ
С. В. Нестеров 1, 2, *, Ю. М. Чесноков 3, 4, Р. А. Камышинский 3, 4, Л. С. Ягужинский 1, 2, 5, Р. Г. Василов 3
1 Институт цитохимии и молекулярной фармакологии
Москва, Россия
2 Московский физико-технический институт
Долгопрудный, Россия
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
4 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
5 Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского
МГУ им. М.В. Ломоносова
Москва, Россия
* E-mail: semen.v.nesterov@phystech.edu
Поступила в редакцию 30.04.2020
После доработки 30.04.2020
Принята к публикации 24.05.2020
Аннотация
Определена структура АТФ-синтетазы митохондрий сердца крыс методом крио-электронной томографии. Эксперименты проведены на фрагментах мембран митохондрий сердца без дополнительной очистки образцов, что позволяет исследовать ферменты митохондрий в условиях естественного фосфолипидного и белкового окружения. В результате применения субтомографического усреднения получена структура АТФ-синтетазы с разрешением около 13 Å, а также структура устойчивого димера АТФ-синтетаз с разрешением около 15 Å. Классификация полученных субтомограмм, содержащих АТФ-синтетазы, показала, что этот фермент всегда находится на изгибах фосфолипидного бислоя, при этом существуют две группы димеров АТФ-синтетаз, различающиеся кривизной мембраны в областях их локализации. На полученных трехмерных структурах достаточно хорошо различимы как внемембранные, так и внутримембранные субъединицы синтетазы, что свидетельствует о перспективности выбранного методического подхода по исследованию полиферментных систем в естественном окружении.
ВВЕДЕНИЕ
Работа является частью программы, направленной на детальное изучение структуры полиферментных систем, в первую очередь системы окислительного фосфорилирования митохондрий. Задачей работы было исследовать крупные фрагменты внутренней мембраны митохондрий, которые не подвергались специальной очистке, методами просвечивающей крио-электронной микроскопии (крио-ПЭМ). Для отработки метода, необходимого для решения поставленной задачи, была выбрана АТФ-синтетаза митохондрий сердца – достаточно хорошо изученный фермент, который ранее использовался авторами работы для исследования биохимических механизмов синтеза АТФ [1].
АТФ-синтетаза митохондрий представляет собой наноразмерную молекулярную машину, трансформирующую избыточную свободную энергию ионов водорода (концентрационный, электрический, сольватационный потенциалы) в энергию химической связи в молекуле АТФ [1, 2]. Изучение механизмов работы АТФ-синтетазы в течение последних десятилетий привлекает множество исследователей не только со стороны биологии, но и из смежных областей науки. Понимание механизмов работы этой природной машины, играющей ключевую роль в энергетическом обмене практически у всех форм жизни на Земле, может стимулировать разработку новых технических наноустройств, работающих на природоподобных принципах с коэффициентом полезного действия до 100% [3].
В последние годы достигнут значительный прогресс в понимании структуры и механизмов работы АТФ-синтетазы [4–7]. Большая часть работ посвящена исследованию структуры очищенного белка, практически лишенного естественного фосфолипидного и белкового окружения. Значительно меньше статей о структуре АТФ-синтетазы в естественном мембранном окружении, а в имеющихся работах пространственное разрешение полученных структур не превышает 26 Å [8, 9]. Современные методы крио-электронной томографии (крио-ЭТ) позволяют получить трехмерную реконструкцию изучаемого объекта в естественном функциональном окружении на основе серии проекционных крио-ПЭМ-изображений, полученных в широком диапазоне углов наклона. При наличии множества копий одинаковых макромолекул на томограммах можно провести выравнивание субтомограмм (областей томограмм, содержащих данные макромолекулы) друг относительно друга с последующим усреднением, что позволяет повысить соотношение сигнал/шум и, соответственно, пространственное разрешение реконструкции [10]. Благодаря использованию такого подхода в настоящей работе удалось получить трехмерные структуры мономера АТФ-синтетазы с разрешением около 13 Å и устойчивого димера АТФ-синтетазы с разрешением около 15 Å. При этом, несмотря на относительно низкий контраст электронной плотности между белком и фосфолипидом, удается различить общий контур мембранной части фермента, в частности с-кольца и a-субъединицы АТФ-синтетазы. Параллельно было проведено исследование структуры мембраны в местах крепления димеров АТФ-синтетаз и обнаружено два типа кривизны мембраны в этих участках.
МЕТОДЫ
Выделение митохондрий. Выделение субсарколемных митохондрий сердца крыс линии Вистар [11] проводили с помощью дифференциального центрифугирования по стандартной методике без использования протеаз, как описано в [12]. Для исследования использовали только тяжелую фракцию митохондрий (осаждаемая при 5000 g) и содержащую меньшее число немитохондриальных включений.
Подготовка сеток и нанесение образца. На первом этапе 9 мкл суспензии митохондрий (с концентрацией белка 0.3 мг/мл) смешивали с 1 мкл наночастиц коллоидного золота (10 nm Colloidal Gold Labeled Protein A, UMC Utrecht, Нидерланды). Далее с помощью пипетки 3 мкл полученного препарата наносили на медную сетку Lacey, покрытую тонким слоем аморфного углерода, предварительно подвергнутую процедуре обработки тлеющим разрядом в течение 30 с при токе 25 мА в установке PELCO easyGlow (Ted Pella, США) для придания гидрофильных свойств ее поверхности. С помощью автоматизированной системы Vitrobot Mark IV (Thermo Fisher Scientific, США) сетку с нанесенным препаратом в течение 2.5 с подвергали одновременному двустороннему сжатию фильтровальной бумагой для удаления излишков раствора с образцом и получения льда оптимальной толщины. Затем проводили процедуру витрификации – быстрое погружение сетки с тонкой пленкой препарата в жидкий этан, предварительно охлажденный до температуры жидкого азота, что приводит к фиксации исследуемых макромолекул в тонком слое аморфного льда. В течение всего эксперимента влажность в камере системы Vitrobot Mark IV составляла 95–100%, температура 4°С.
Крио-электронная томография. Исследование проводили с помощью крио-ПЭМ Titan Krios 60-300 TEM/STEM (Thermo Fisher Scientific, США), оснащенного высокочувствительным детектором электронов Falcon II (Thermo Fisher Scientific, США) и корректором сферических аберраций (Image corrector, CEOS, Германия) при ускоряющем напряжении 300 кВ.
Было получено 11 томографических серий, каждая из которых состояла из 61 изображения, полученного в результате наклона образца от –60° до 60° с угловым шагом в 2°. Данные получены с использованием программного обеспечения Tomography (Thermo Fisher Scientific, США) в режиме малых доз, что позволило минимизировать радиационные повреждения, сохраняя нативную структуру исследуемых объектов. Суммарное значение дозы электронов, прошедших через единицу площади образца за время экспозиции, составило ~100 э/Å2. Исследование проводили при использовании увеличения 18 000× (размер пикселя 3.7 Å) и значений дефокусировки в диапазоне [–6; –8] мкм.
Обработка данных крио-ЭТ. С полученным массивом изображений проводили процедуры кросс-корреляционного выравнивания и томографического восстановления с помощью программного обеспечения IMOD [13]. Процедуру томографического восстановления проводили с использованием метода одновременной итерационной реконструкции (Simultaneous Iterative Reconstruction Technique, SIRT) и метода обратно взвешенных проекций (Weighted Back Projection, WBP) [14]. В дальнейшем реконструкции, полученные методом SIRT, использовали для определения положения частиц в ручном и автоматическом режиме, а WBP для усреднения субтомограмм.
Наночастицы коллоидного золота, добавленные в раствор образца на этапе приготовления препарата, использовали для выравнивания полученных угловых серий. По результатам анализа восстановленных томографических серий для дальнейшей обработки были выбраны три томограммы, для которых погрешность выравнивания проекционных изображений по наночастицам золота не превышала размер 1 пикселя.
Мономеры АТФ-синтетаз. Для определения положений центров молекул АТФ-синтетаз использовали инструмент на основе сверточных нейронных сетей в программном пакете EMAN2.2 [15]. На первом этапе на томограммах, восстановленных методом SIRT (размер пикселя 7.4 Å, данные сжаты в 2 раза) с помощью программного пакета IMOD в ручном режиме, было выделено около 200 мономеров АТФ-синтетаз, которые использовались для получения начальной трехмерной реконструкции мономера (в дальнейшем использованного в качестве шаблона), а также обучения нейронной сети. Далее выполнялось сегментирование данных.
Для дальнейшего анализа были выбраны области томограмм (субтомограммы) кубической формы (ребро куба 40 пикселей, размер пикселя 7.4 Å), соответствующие координатам центров мономеров АТФ-синтетаз. На следующем шаге с помощью программного пакета Relion2 [16, 17] проводили экстракцию выбранных 16 265 субтомограмм из томографических серий, восстановленных методом WBP.
Оценку трехмерной функции передачи контраста проводили для каждой субтомограммы на основании значений дефокусировки, которые были установлены с помощью программы CTFFIND4 [18]. Выравнивание, усреднение (reference-free 3D auto-refinement) и трехмерную классификацию субтомограмм осуществляли в соответствии с протоколом, описанным в [19]. После классификации были получены два класса частиц, из которых был выбран один, визуально содержащий больше мелких деталей и характеризующийся равномерным контрастом.
На следующем этапе выполняли экстракцию 2768 частиц, принадлежащих выбранному классу, из несжатых томограмм (размер пикселя 3.7 Å), восстановленных методом WBP, после чего выполняли финальное субтомографическое усреднение частиц. Для финальной визуализации использовали программный пакет UCSF Chimera [20]. Пространственное разрешение трехмерной реконструкции, оцененное по параметру FSC = = 0.143 (Fourier Shell Correlation), составило 13 Å.
Димеры АТФ-синтетаз. Для получения трехмерной структуры димера АТФ-синтетазы использовали координаты мономеров, полученные на предыдущем шаге. Для получения начальной модели димера в ручном режиме было выделено около 200 димеров АТФ-синтетаз. Для дальнейшего анализа были выбраны субтомограммы размером 40 пикселей (размер пикселя 14.8 Å), в центре каждой из которых располагался димер АТФ-синтетазы; при этом в каждую субтомограмму попадало, как правило, несколько димеров. С помощью программы USCF Chimera [20] была сгенерирована маска, включающая в себя только центральный димер АТФ-синтетаз. С использованием этой маски проводили все дальнейшие усреднения по алгоритму, аналогичному усреднению для мономера. После трехмерной классификации данных было получено два класса субтомограмм: первый класс (10 008 частиц) характеризовался наличием только мономеров АТФ-синтетаз, в то время как второй класс (6114 частиц) показывал наличие димеров. Субтомограммы из второго класса были экстрагированы из томографических серий, восстановленных методом WBP (размер субтомограмм 80 пикселей, размер пикселя 7.4 Å, данные сжаты в 2 раза). Далее выполняли финальное субтомографическое усреднение выбранных частиц. Для финальной визуализации использовали программный пакет UCSF Chimera [20]. Пространственное разрешение трехмерной реконструкции, оцененное по параметру FSC = 0.143, составило 14.8 Å.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика исследуемых образцов. В результате пробоподготовки, описанной выше, фрагменты митохондрий были зафиксированы в тонком слое аморфного льда толщиной менее 300 нм. В полученных образцах внутренняя мембрана митохондрий образует связанные разветвленные структуры, схожие с кристами интактных митохондрий. Во всех наблюдаемых мембранах сохранялась одинаковая ориентация голов АТФ-синтетаз относительно мембраны в отличие от искусственно подготовленных препаратов, формируемых путем смешивания очищенных АТФ-синтетаз с липидом [21]. На некоторых изображениях наблюдались целые митопласты и даже небольшие митохондрии, сохраняющие внешнюю мембрану. Все наблюдаемые мембраны были расположены в толще образца, на удалении от межфазной границы вода–воздух, что исключало нежелательный эффект денатурации белка, искажающий результаты многих исследований методом анализа проекций одиночных частиц [22].
Пример крио-ПЭМ-изображения образца мембран митохондрий, отобранного для исследований, показан на рис. 1.
Рис. 1.
Характерное крио-ПЭМ-изображение образца мембран митохондрий. Широкие темные линии по краям изображения – углеродная сетка. Темные точки – наночастицы золота.

Структура мономера АТФ-синтетазы. На рис. 2 показана трехмерная реконструкция мономера АТФ-синтетазы с разным пороговым уровнем отображения изоповерхности. Достигнутое разрешение (13 Å по критерию FSC = 0.143, рис. 3б) позволяет достаточно однозначно различить отдельные субъединицы АТФ-синтетазы и их взаимную ориентацию (рис. 3а).
Рис. 2.
Трехмерная реконструкция мономера АТФ-синтетазы в различных проекциях с низким (а, б) и высоким (в, г) порогом отображения изоповерхности. При высоком пороге часть менее плотных фрагментов белка (в основном мембранная часть) не отображается. На рис. г видно роторную γ-субъединицу внутри α3β3-кольца (“головы”) синтетазы.

Рис. 3.
Структура АТФ-синтетазы быка (PDB: 5ARE), вписанная в трехмерную реконструкцию АТФ-синтетазы, полученную в настоящей работе (а). График объемной корреляции Фурье для оценки разрешения полученной структуры, демонстрирующий разрешение 12.9 Å по критерию FSC = 0.143 (б).
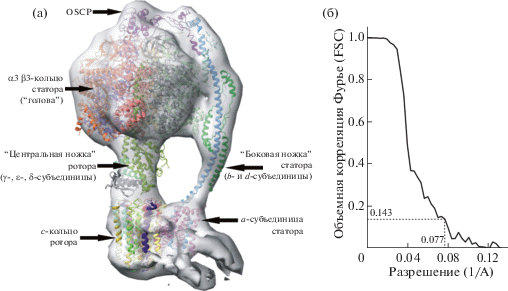
Сравнение полученной структуры мономера АТФ-синтетазы с литературными данными. Пространственное разрешение трехмерной структуры мономера АТФ-синтетазы, полученной в данной работе, превышает разрешение, полученное другими авторами при исследованиях природных [23] и искусственных [8, 21] мембран. Тем не менее из-за недостаточно высокого исходного разрешения томограмм в настоящей работе не удалось провести отбор структур АТФ-синтетаз, различающихся по конформации, как это сделано в передовых крио-ПЭМ-исследованиях очищенных препаратов с применением метода анализа проекций одиночных частиц [5, 24]. Модификация экспериментальных или программных алгоритмов для обеспечения возможности различения разных конформаций АТФ-синтетазы является задачей будущих исследований.
Проведено сравнение полученной модели с наиболее близкой известной структурой АТФ-синтетазы более высокого разрешения – АТФ-синтетазой быка, полученной с помощью крио-ПЭМ-методом анализа проекций одиночных частиц [24]. Из нескольких опубликованных конформаций АТФ-синтетазы полученная в настоящей работе структура лучше всего совпала с конфигурацией 1b (структура 5ARE из белкового банка данных PDB). Помимо указанной выше проблемы классификации разных конформаций различие структур может быть обусловлено небольшими межвидовыми различиями между бычьей и крысиной АТФ-синтетазами.
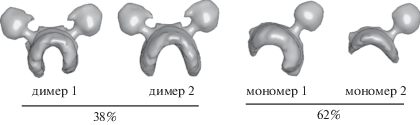
Определение взаимного положения АТФ-синтетаз в мембране. Структура димера. Как известно, АТФ-синтетазы различных организмов образуют устойчивые димеры, угол между которыми фиксирован за счет присоединения специальных регуляторных белков [25]. В исследуемых образцах значительная часть наблюдаемых АТФ-синтетаз образовывала димеры. По результатам субтомографического усреднения и трехмерной классификации все АТФ-синтетазы были разделены на четыре основные класса (рис. 4). Показано, что основную долю наблюдаемых частиц составляют мономеры АТФ-синтетаз (62%). При этом как для мономеров, так и для димеров получены два подтипа, различающихся кривизной окружающего фосфолипидного бислоя.
Рис. 4.
Классификация АТФ-синтетаз. Два подтипа димеров, так же как и два подтипа мономеров, различаются кривизной окружающего фосфолипидного бислоя. В модели мономеров прослеживается сходство с моделью димера, но электронная плотность в районе F1-субъединицы (“головы”) парной АТФ-синтетазы находится на уровне шума.
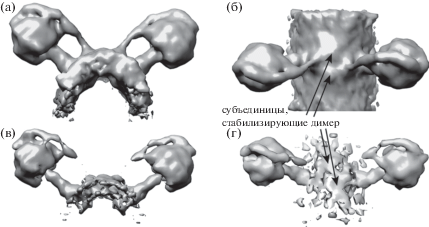
На рис. 5 приведена трехмерная реконструкция димера АТФ-синтетазы с разрешением 14.8 Å (по критерию FSC = 0.143). Важно отметить, что все димеры АТФ-синтетаз в исследуемых образцах митохондрий сердца крыс имели одинаковые углы между мономерами, приблизительно равные 95°. На трехмерной структуре димера различимы вспомогательные субъединицы, обеспечивающие крепкую связь между мономерами. Полученная структура хорошо совпадает со структурой димера АТФ-синтетазы дрожжей, имеющей такой же угол между мономерами [26].
Рис. 5.
Трехмерная реконструкция димера АТФ-синтетазы в различных проекциях с низким (а, б) и высоким (в, г) порогом отображения изоповерхности. При высоком пороге часть менее плотных фрагментов (в основном фосфолипидный бислой) не отображается. Угол между мономерами в димере ~95°, расстояние между центрами “голов” ~28 нм.
Олигомеризация АТФ-синтетаз, формирование трубчатых крист. На полученных томографических изображениях мембран митохондрий наблюдались различные типы упаковки АТФ-синтетаз в мембранах. Подавляющее большинство АТФ-синтетаз в трубчатых структурах находится в димерной форме, формируя изгибы мембран. Наиболее плотная и симметричная упаковка синтетаз, образующая длинную трубчатую кристу, показана на рис. 6.
Рис. 6.
Пример томографических изображений и трехмерная реконструкция фрагмента трубчатой кристы. Вся криста состоит из повторяющихся сегментов, состоящих из трех линий димеров АТФ-синтетаз. Разные ряды димеров на реконструкциях окрашены различными оттенками серого. Расстояние между центрами голов АТФ-синтетаз в соседних димерах одной линии составляет 12–14 нм. Каждая линия смещена относительно других на треть от этого расстояния (3–5 нм). На рис. а, в и г показаны три различных проекции реконструированного участка трубчатой кристы. На рис. б показаны три различных томографических среза, соответствующих сечениям 1–3 модели рис. а. Реконструкция выполнена с использованием структуры димера АТФ-синтетазы. Масштабные отрезки 14 нм.

Способность АТФ-синтетаз быть структурообразующим элементом мембраны описана для других видов эукариот [8, 27]. Отметим, что симметричная плотная гексагональная упаковка АТФ-синтетаз в трубчатой кристе (рис. 6), также как и структура димера АТФ-синтетаз сердца крыс (рис. 5), описана (насколько нам известно) в настоящей работе впервые. Топология складок внутренней мембраны влияет на функционирование митохондрий, существует специальная система регуляции, перестраивающая ультраструктуру митохондрий в стрессовых условиях [28].
ЗАКЛЮЧЕНИЕ
С помощью крио-электронной томографии проведено исследование структуры АТФ-синтетазы митохондрий сердца крыс без экстракции фермента из фрагментов митохондриальных мембран и иной очистки. Значимым результатом проведенной работы является получение трехмерной структуры мономера АТФ-синтетазы с помощью субтомографического усреднения с разрешением около 13 Å, что позволило визуализировать как внемембранные, так и внутримембранные субъединицы АТФ-синтетазы: с-кольцо и а-субъединицу.
По результатам работы выделены два состояния мембраны в области крепления димеров АТФ-синтетаз. Показано, что положение мономеров в димере АТФ-синтетаз строго фиксировано (угол 95°), но при этом кривизна мембраны на расстоянии 30–50 нм от димера может различаться.
Полученные результаты указывают на перспективность выбранного направления исследований по определению структуры мультиферментных систем в природных мембранах без специальной очистки.
Работа выполнена при поддержке НИЦ “Курчатовский институт” в рамках тематического плана “Изучение процессов генерации, передачи и распределения энергии в живых организмах” и в соответствии с приказом № 1360.
Список литературы
Yaguzhinsky L.S., Boguslavsky L.I., Volkov A.G., Rakhmaninova A.B. // Nature. 1976. V. 259. № 5543. P. 494. https://doi.org/10.1038/259494a0
Еремеев С.А., Ягужинский Л.С. // Биохимия. 2015. Т. 80. № 5. С. 682. https://doi.org/10.1134/S0006297915050089
Kinosita K., Yasuda R., Noji H., Adachi K. // Philos. Trans. R. Soc. B. Biol. Sci. 2000. V. 355. № 1396. P. 473. https://doi.org/10.1098/rstb.2000.0589
Boyer P.D. // Biochim. Biophys. Acta. Bioenerg. 1993. V. 1140. № 3. P. 215. https://doi.org/10.1016/0005-2728(93)90063-L
Murphy B.J., Klusch N., Langer J. et al. // Science. American Association for the Advancement of Science. 2019. V. 364. № 6446. https://doi.org/10.1126/science.aaw9128
Vahidi S., Bi Y., Dunn S.D., Konermann L. // Proc. Natl. Acad. Sci. National Acad. Sci. 2016. V. 113. № 9. P. 2412. https://doi.org/10.1073/pnas.1520464113
Watanabe R., Tabata K.V., Iino R. et al. // Nat. Commun. 2013. V. 4. № 1. P. 1. https://doi.org/10.1038/ncomms2631
Blum T.B., Hahn A., Meier T. et al. // Proc. Natl. Acad. Sci. U. S. A. 2019. V. 116. № 10. P. 4250. https://doi.org/10.1073/pnas.1816556116
Mühleip A.W., Joos F., Wigge C. et al. // Proc. Natl. Acad. Sci. 2016. P. 201525430. https://doi.org/10.1073/pnas.1525430113
Wan W., Briggs J.A.G. // Methods Enzymol. 2016. V. 579. P. 329. https://doi.org/10.1016/bs.mie.2016.04.014
Palmer J.W., Tandler B., Hoppel C.L. // J. Biol. Chem. 1977. V. 252. № 23. P. 8731.
Nesterov S.V., Skorobogatova Y.A., Panteleeva A. A. et al. // Chem. Biol. Interact. 2018. V. 291. P. 40. https://doi.org/10.1016/j.cbi.2018.06.004
Kremer J.R., Mastronarde D.N., McIntosh J.R. // J. Struct. Biol. 1996 V. 116. № 1. P. 71. https://doi.org/10.1006/jsbi.1996.0013
Radermacher M. // Electron Tomography / Ed. Frank J. New York: Springer, 2006. P. 245. https://doi.org/10.1007/978-0-387-69008-7_9
Galaz-Montoya J.G., Flanagan J., Schmid M.F., Ludtke S.J. // J. Struct. Biol. 2015. V. 190. № 3. P. 279. https://doi.org/10.1016/j.jsb.2015.04.016
Scheres S.H.W. // J. Struct. Biol. 2012. V. 180. № 3. P. 519. https://doi.org/10.1016/j.jsb.2012.09.006
Kimanius D., Forsberg B.O., Scheres S.H., Lindahl E. // eLife. 2016. V. 5. P. e18722. https://doi.org/10.7554/eLife.18722
Rohou A. // J. Struct. Biol. 2015. V. 192. № 2. P. 216. https://doi.org/10.1016/j.jsb.2015.08.008
Bharat T.A.M., Scheres S.H.W. // Nat. Protoc. 2016. V. 11. № 11. P. 2054. https://doi.org/10.1038/nprot.2016.124
Pettersen E.F., Goddard T.D., Huang C.C. et al. // J. Comput. Chem. 2004. V. 25. № 13. P. 1605. https://doi.org/10.1002/jcc.20084
Jiko C., Davies K.M., Shinzawa-Itoh K. et al. // eLife / Ed. Scheres S.H. eLife Sciences Publications, Ltd, 2015. V. 4. P. e06119. https://doi.org/10.7554/eLife.06119
D’Imprima E., Floris D., Joppe M. et al. // eLife. 2019. V. 8. https://doi.org/10.7554/eLife.42747
Buzhynskyy N., Sens P., Prima V. et al. // Biophys. J. 2007. V. 93. № 8. P. 2870. https://doi.org/10.1529/biophysj.107.109728
Zhou A., Rohou A., Schep D.G. et al. // eLife / ed. Harrison S.C. eLife Sciences Publications, Ltd, 2015. V. 4. P. e10180. https://doi.org/10.7554/eLife.10180
Davies K.M., Strauss M., Daum B. et al. // Proc. Natl. Acad. Sci. 2011. V. 108. № 34. P. 14121. https://doi.org/10.1073/pnas.1103621108
Guo H., Bueler S.A., Rubinstein J.L. // Science. American Association for the Advancement of Science. 2017. V. 358. № 6365. P. 936. https://doi.org/10.1126/science.aao4815
Davies K.M., Daum B., Gold V.A.M. et al. // JoVE J. Vis. Exp. 2014. № 91. P. e51228. https://doi.org/10.3791/51228
Patten D.A., Wong J., Khacho M. et al. // EMBO J. 2014. V. 33. № 22. P. 2676. https://doi.org/10.15252/embj.201488349
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


