Российские нанотехнологии, 2020, T. 15, № 1, стр. 101-107
ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ НОВЫХ МЕТАЛЛООРГАНИЧЕСКИХ КОМПЛЕКСОВ НА ОСНОВЕ СУРЬМЫ(III) НА ФОТОХИМИЧЕСКУЮ АКТИВНОСТЬ ФОТОСИСТЕМЫ II И АКТИВНОСТЬ ХЛОРОПЛАСТНЫХ КАРБОАНГИДРАЗЫ И ГЛУТАТИОНРЕДУКТАЗЫ
Л. Халилова 1, 2, М. В. Родионова 2, М. С. Карачан 3, Н. Карачан 3, С. Алвасел 4, В. Д. Креславский 2, 5, С. К. Жармухамедов 5, С. И. Аллахвердиев 1, 2, 4, 5, *
1 Институт молекулярной биологии и биотехнологии, НАН Азербайджана
Баку, Азербайджан
2 Институт физиологии растений им. К.А. Тимирязева РАН
Москва, Россия
3 Факультет химии, Университет Гази
Анкара, Турция
4 Факультет зоологии, Колледж науки, Университет короля Сауда
Эр-Рияд, Саудовская Аравия
5 Институт фундаментальных проблем биологии РАН
Пущино, Россия
* E-mail: suleyman.allakhverdiev@gmail.com
Поступила в редакцию 03.05.2020
После доработки 27.05.2020
Принята к публикации 28.05.2020
Аннотация
Известно, что комплексы ряда металлов являются ингибиторами тех или иных физиологических процессов в фотосинтезирующих организмах. С целью поиска новых эффективных ингибиторов синтезированы и исследованы шесть новых комплексов сурьмы(III) на предмет ингибирования фотохимической активности фотосистемы II (ФСII) и ключевых хлоропластных ферментов, таких как карбоангидраза и глутатионредуктаза. Обнаружено, что ряд комплексов эффективно ингибирует карбоангидразную активность ФСII, но менее эффективно – фотохимическую активность этой фотосистемы. При этом все комплексы ингибировали активность хлоропластной глутатионредуктазы.
ВВЕДЕНИЕ
Сокращение пригодных для сельского хозяйства земель и увеличение населения земли приводят к увеличению спроса на продукты питания. Защита посевов от сорняков является одним из факторов повышения эффективности производства зерна [1, 2]. Многие сорняки со временем приобретают устойчивость к гербицидам, поэтому актуальной проблемой является синтез новых ингибиторов роста и развития сорняков. Для этой цели нужны соединения, которые могли бы эффективно подавлять фотосинтетическую активность и/или активность ключевых ферментов растений, важных для поддержания роста и фотосинтеза сорняков.
Ингибиторы фотосинтеза подавляют течение световых реакций фотосинтеза, которые реализуются через мультиферментный комплекс, состоящий из двух связанных фотосистем: фотосистема II (ФСII) и фотосистема I, преобразующие энергию поглощенного света в энергию химических связей в виде аденозинтрифосфата (АТФ) и восстановительных эквивалентов никотинамидадениндинуклеотидфосфата (НАДФН), потребляемых в темновой фазе фотосинтеза – цикле Кальвина [3]. При этом ФСII является одной из ключевых мишеней действия ингибиторов на сорняки [4]. Ингибиторы связываются с ключевым белком D1 ФСII, необходимым для нормального функционирования фотосистемы, в результате снижается поток электронов от воды к НАДФН и тем самым ингибируется синтез АТФ и уменьшается содержание восстановительных эквивалентов. Согласно [5, 6] ФСII обладает карбоангидразной активностью. Карбоангидраза – один из ключевых ферментов во многих биологических процессах, который регулирует гомеостаз и транспорт СО2, что важно для поддержания фотосинтеза и дыхания, уровня рН и секреции электролитов в различных тканях [7]. Все это предполагает, что карбоангидраза может быть мишенью потенциальных ингибиторов, подавляющих активность ФСII.
С другой стороны, ингибиторы могут применяться не только для синтеза соединений, обладающих свойствами гербицидов, используемых для защиты растений от сорняков, но и использоваться для исследования функций конкретных ферментов, важных для функционирования фотосинтетического аппарата (ФА), в частности карбоангидразы и ферментов аскорбат-глутатионового цикла [8–11]. Ферменты метаболизма глутатиона могут быть еще одной мишенью для ингибирующего действия новых химических соединений. Глутатион присутствует в восстановленной (GSH) и окисленной (GSSG) формах и вместе с ферментами, такими как глутатионредуктаза (ГР) и глутатионтрансфераза, является важной частью антиоксидантной системы защиты растений от окислительного стресса [12, 13]. При этом важную физиологическую роль играет восстановленный глутатион [12]. Глутатионредуктаза играет ключевую роль в ответе на окислительный стресс при действии различных стрессовых факторов окружающей среды, поддерживая основной пул восстановленного глутатиона [12, 13], и ее ингибирование может негативно повлиять на сорняк, ингибируя активность его антиоксидантной системы. Так, было показано, что активность ГР играет важную роль при действии ряда стрессовых факторов, таких как засуха, экстремальные температуры и действие гербицидов на растения [14].
Комплексы сурьмы обладают противораковой и противопаразитарной активностью, поэтому используются в медицине [15]. Однако они могут применяться и как ингибиторы фотосинтетической активности. Так, на примере клеток Synechocystis sp показано, что сурьма (Sb) подавляет активность ФСII, ингибируя электронный транспорт от QА к QВ, а также подавляет выделение кислорода [16]. Карбоангидразная активность хлоропластов тесно связана с их фотохимической активностью, в частности карбоангидразная активность ФСII необходима для ее оптимального функционирования [5, 11]. По-видимому, сурьма ингибирует карбоангидразную активность хлоропластов. Также известно, что комплексы сурьмы ингибируют активность ГР [17].
В этой связи в настоящей работе было изучено ингибирующее действие новых металлоoрганических комплексов на основе сурьмы(III) на фотохимическую активность ФСII и активность хлоропластных карбоангидразы и глутатионредуктазы.
МАТЕРИАЛЫ И МЕТОДЫ
Фотохимически активные фрагменты тилакоидной мембраны, обогащенные ФСII (мембранные препараты ФСII, далее препараты), получали из листьев растений гороха Pisum sativum, выращенных в течение двух–трех недель.
Все соединения и ферменты были приобретены у Sigma-Aldrich (США) и использовались без дальнейшей очистки. Для приготовления исходных растворов комплексов использовали диметилсульфоксид (ДМСО). Фрагменты тилакоидной мембраны, обогащенные ФСII (далее препараты), выделяли из листьев Spinacia oleraceae согласно методике [18] и хранили при –80°С. Концентрацию хлорофилла (а + b) в препаратах определяли в 80%-ном ацетоне согласно Arnon [19] с использованием спектрофотометра Shimadzu UV-1900 (Япония). Использовали ГР из хлоропластов шпината. Исходный раствор ГР готовили, используя 100 единиц фермента на 10 мл фосфатного буфера (0.2 М, рН 7.2), который хранили при 4°С. Описание методик измерения активностей карбоангидразы и ГР даны в [20]. При этом вместо α-карбоангидразы растений в качестве модельного фермента был использован изофермент α-карбоангидразы из бычьих эритроцитов, аминокислотная последовательность которого сходна с α-карбоангидразами растений.
Для анализа фотохимической активности ФСII с помощью флуориметра (XE-PAM, Heinz Walz, Германия) с использованием программного обеспечения Power Graph Professional 3.3 измеряли кинетику фотоиндуцированных изменений выхода флуоресценции хлорофилла ФСII (${{F}_{{v}}}$), связанных с фотовосстановлением первичного акцептора электронов ФСII, пластохинона QA. Измерения проводили в 1 см кварцевой кювете при 20°C и постоянном перемешивании.
Среда для измерения содержала 25 мМ MES–NaOH (рН 6.5), 10 мМ NaCl и 300 мМ сахарозы. Общий объем измерительной смеси составлял 1 мл. Концентрация образца по хлорофиллу составляла 10 мкМ мл–1. В ходе измерений были определены уровни флуоресценции F0 и Fmax – минимальный и максимальный выход флуоресценции хлорофилла соответственно, уровень переменной флуоресценции (${{F}_{v}}$ = Fmax – F0), а также максимальный квантовый фотохимический выход ФСII (${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$). Минимальный выход флуоресценции F0 измеряли при слабых зондирующих импульсах измерительного света (λ = 490 нм; интенсивность света – 4 мкмоль фотонов м–2 с–1) в адаптированных к темноте образцах. Для регистрации Fmax образцы, адаптированные к темноте, подвергали воздействию света насыщающей интенсивности (1000 мкмоль фотонов м–2 с–1).
Ингибирование фотохимической активности ФСII регистрировали после 3 мин темновой инкубации препаратов в присутствии комплексов Sb(III) или 1% ДМСО.
Химические формулы шести комплексов, включающих Sb(III), использованных в работе, приведены в табл. 1.
Таблица 1.
Химические формулы исследованных металлоорганических комплексов на основе ионов сурьмы Sb(III)
| Комплекс | Химическая формула |
|---|---|
| 1 | (Бис-(5-хлор-N-(2-пиримидин)-2-тиофенкарбоксамидтрихлорсурьма(III) |
| 2 | N-2-пиримидин-2-пиперидинкарбоксамидтрихлорсурьма(III) |
| 3 | NN,N-(1,2-фенил)-2-дипирролинкарбоксамидтрибромсурьма(III) |
| 4 | N-2-пиримидин-2-пирролинкарбоксамидтрихлорсурьма(III) |
| 5 | 2-Амино-5-(1Н-тетразол-5-илтио)-4,6-диметоксипиримидин-2-пирролинкарбоксамидтрихлорсурьма(III) |
| 6 | N-2-бензотиазол-2-пирролидинкарбоксамидтрибромсурьма(III) |
РЕЗУЛЬТАТЫ
На основе данных фотоиндуцированных изменений выхода флуоресценции хлорофилла в результате фотовосстановления первичного стабильного акцептора электронов ФСII QA оценили влияние комплексов Sb(III) на максимальный квантовый выход ФСII (${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$), который отражает фотосинтетическую активность фотосистемы. Величина ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ уменьшалась при наличии комплексов Sb(III). Однако достоверные величины снижения были не столь значительными и находились в пределах 4–7% (табл. 2). Здесь начальное соотношение ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ (где Fmax = F0 + ${{F}_{v}}$) было принято за 100%. При этом уровень ${{F}_{v}}$ уменьшался (рис. 1), за счет чего снижалось соотношение ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$, в то время как уровень начальной флуоресценции F0 и наклоны кривых спада флуоресценции в темноте не изменялись (не ускорялись и не замедлялись) в отличие от вариантов с добавками диурона и феррицианида калия.
Таблица 2.
Изменение величин, характеризующих уровни F0, Fmax, ${{F}_{{v}}}$, соотношения ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ и скорости темнового спада Fm (ΔFmax) кинетик индукции флуоресценции хлорофилла, измеренных в стационарных условиях
| Вариант/параметр | F0 | Fmax | ${{F}_{{v}}}$ | (${{F}_{{v}}}$(Sb)/${{F}_{{v}}}$(к)) × 100% | ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ | СА,% | Изменение ΔFmax |
|---|---|---|---|---|---|---|---|
| Контроль | 1.0 | 5.529 | 4.529 | 100 | 0.819 | 100 | – |
| 1 | 1.0 | 4.832 | 3.832 | 84.6 | 0.793 | 96.8±0.2 | нет |
| 2 | 1.0 | 4.385 | 3.385 | 74.7 | 0.772 | 94.3±0.3 | нет |
| 3 | 1.0 | 4.653 | 3.653 | 80.7 | 0.785 | 95.8±0.2 | нет |
| 4 | 1.0 | 4.200 | 3.200 | 70.7 | 0.762 | 93.0±0.4 | нет |
| 5 | 1.0 | 4.952 | 3.952 | 87.3 | 0.798 | 97.5±0.2 | нет |
| 6 | 1.0 | 5.000 | 4.000 | 88.3 | 0.801 | 97.8±0.2 | нет |
| Диурон | 1.8 | 5.12 | 3.32 | замедление | |||
| Fe | 1.0 | 5.34 | 4.34 | ускорение |
Примечание. Снижение активности ФСII (СА) после внесения Sb оценено как ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ (+Sb)/${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$, к – контроль, принятый за 100%. Fe – Ferricyanid. Погрешности величин ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ не превышали 0.005.
Рис. 1.
Типичные кинетики индукции флуоресценции хлорофилла, связанные с фотовосстановлением первичного донора электрона, пластохинона QA, измеренные в стационарных условиях в отсутствие ингибирующих агентов (кинетика 1) и в присутствии комплекса Sb(III) 4 в концентрации 0.1 мМ (кинетика 2). Концентрация субхлоропластных мембранных частиц (BBY-частиц), измеренная по хлорофиллу, равна 10 мкг в мл. Треугольниками показано включение слабого измерительного света (λ = 490 нм, 4 мкмоль фотонов м-2 с–1), стрелками, направленными вверх и вниз, соответственно включение и выключение действующего света (λ > 600 нм, 1000 мкмоль фотонов м–2 с–1).
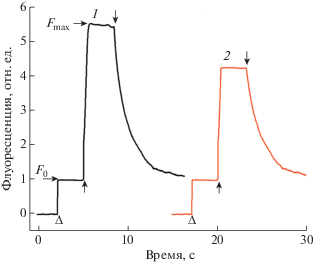
Известно, что диурон блокирует, а феррицианид ускоряет окисление восстановленного первичного акцептора электрона QA. Это проявляется, в том числе, как изменение скорости темного спада величины Fmax (замедление или ускорение соответственно в присутствии диурона или Fe3Cy).
Подобный эффект может наблюдаться в случае нарушения работы водоокисляющего комплекса, в результате чего окисление воды в PSII и выделение O2 ингибируются. По-видимому, внесение экзогенных доноров электрона, таких как тетраметил-п-фенилендиаминдигидрохлорид и ферроцианид калия, может восстановить значение ${{F}_{v}}$ и квантовый выход ФСII. Для проверки этого эффекта в реакционную смесь с комплексами Sb(III) добавляли 1 мМ ферроциананида калия, что приводило к восстановлению как ${{F}_{v}}$, так и величины ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$ (табл. 2).
Влияние комплексов Sb(III) на активность карбоангидразы. Влияние комплексов Sb(III) на активность карбоангидразы ФСII было изучено при увеличении времени инкубации. Это связано с тем, что ингибирующий эффект некоторых соединений может возрастать с увеличением времени инкубации, что может косвенно свидетельствовать о необратимом действии этого соединения [21]. Показано, что некоторые комплексы Sb(III), такие как 2, 3 и 6, действуют на активность фермента значительно сильнее при увеличении времени инкубации (рис. 2а). При этом другие комплексы (1, 5) проявляли более сильное влияние на активность ФСII-карбоангидразы, чем на активность α-карбоангидразы (рис. 2б).
Рис. 2.
Влияние исследованных комплексов на основе ионов сурьмы (Sb(III)) на карбоангидразную активность (КАА) α-карбоангидразы из сыворотки быка после инкубации фермента в присутствии комплекса в течение 2 и 30 мин – соответственно незаштрихованные и заштрихованные столбцы (а), и на КАА ФСII, измеренную на BBY-частицах (б).

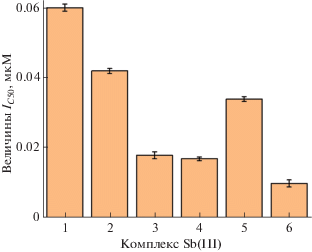
Влияние комплексов Sb(III) на активность глутатионредуктазы. Были получены типичные кинетики окисления НАДФН в результате реакции восстановления окисленного глутатиона электронами, получаемыми от восстановленного НАДФН, катализируемой ГР в отсутствие комплексов Sb(III)) (кинетика 1) и в присутствии комплекса 6 в концентрации 0.004 мкМ (кинетика 2) (рис. 3). На рисунке можно видеть, что комплекс оказывает значительный ингибирующий эффект на реакцию окисления. При исследовании ингибирующего действия комплексов Sb(III) на активность ГР были рассчитаны значения полумаксимального ингибирования IC50, которые были получено после 5 мин инкубации комплексов Sb(III) с ГР (рис. 3, 4). Комплекс 6 показал максимальное ингибирование в концентрации 0.01 мкМ, тогда как в присутствии комплекса Sb(III) 1 в концентрации 0.06 мкМ был обнаружен лишь минимальный эффект. У остальных комплексов выявлены промежуточные между ними величины (рис. 4).
Рис. 3.
Типичные кинетики уменьшения поглощения при 340 нм, связанные с окислением НАДФН в результате реакции восстановления окисленного глутатиона электронами, получаемыми от восстановленного НАДФН, катализируемой ферментом глутатионредуктазой в отсутствие ингибирующего агента (иcследуемые комплексов Sb(III)) (кинетика 1), и в присутствии комплекса 6 в концентрации 0.004 мкМ (кинетика 2). Стрелкой показан момент внесения окисленного глутатиона.
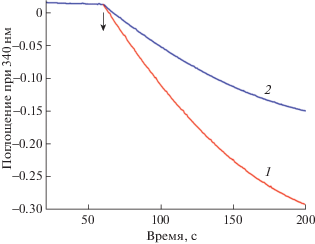
Рис. 4.
Величины IC50 – концентрации полумаксимального ингибирования исследованными комплексами Sb(III) реакции восстановления окисленного глутатиона электронами, получаемыми от восстановленного НАДФН. Реакция катализировалась ферментом глутатионредуктазой из хлоропластов шпината.
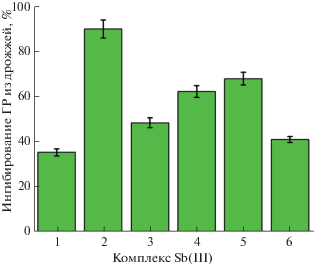
Также была рассчитана эффективность ингибирования комплексами Sb(III) реакции восстановления окисленного глутатиона электронами, получаемыми от восстановленного НАДФН (рис. 5). Реакция катализировалась ферментом глутатионредуктазой из дрожжей. Наиболее эффективное ингибирование было с комплексом 2.
Рис. 5.
Эффективность ингибирования комплексами Sb(III) (0.1 мМ) реакции восстановления окисленного глутатиона электронами, получаемыми от восстановленного НАДФН, Реакция катализировалась ферментом глутатионредуктазой из дрожжей.
Таким образом, тестируемые соединения по-разному влияют на активность ферментов: соединение 1 значительно ингибировало активность глутатионредуктазы хлоропластов, тогда как комплексы 2, 3, 6 были эффективны в отношении ингибирования активности карбоангидразы.
ОБСУЖДЕНИЕ
В последнее десятилетие были получены доказательства того, что карбоангидраза и глутатионредуктазный пул поддерживают функционирование ФСII [5, 7, 11, 22]. Однако роль этих ферментов в процессах фотосинтеза мало изучена.
Ингибирующий анализ является одним из подходов к исследованию функций ключевых ферментов ФA, в частности карбоангидразы и ГР. При этом важно использовать ингибиторы, которые специфически уменьшают только активность карбоангидразы или ГР, не влияя на фотосинтетическую активность. В этом случае важен скрининг большого количества соединений, которые предположительно могли бы ингибировать активности этих ферментов.
Ранее был проведен скрининг 30 новых органических соединений и их комплексов с атомом металла в качестве возможных ингибиторов α-карбоангидразы и β-карбоангидразы, а также фотосинтетической активности ФСII [9]. Было выявлено несколько групп этих соединений, которые ингибировали разные активности. Авторы связали различия в ингибирующей активности соединений с различиями в их структуре. При исследовании ряда комплексов сурьмы также было показано, что они могут ингибировать фотосинтез [10]. В [20] показано, что ряд медьсодержащих комплексов ингибирует активности глутатионредуктазы и карбоангидразы ФСII, при этом только некоторые из них ингибировали фотосинтетический электронный транспорт.
Известно, что многие комплексы сурьмы обладают противораковой и противопаразитарной активностью [15]. Менее исследовано направление по использованию комплексов сурьмы для ингибирования фотосинтеза [9, 10].
В настоящей работе путем тестирования ингибирующего воздействия шести комплексов Sb(III) на активность хлоропластной глутатионредуктазы и карбоангидразы ФСII продемонстрировано различное действие комплексов Sb(III) на активность этих ферментов. Одно из соединений 1 значительно ингибировало активность ГР хлоропластов, тогда как несколько других были эффективны в качестве ингибиторов активности карбоангидразы. Вероятно, этот эффект зависит от структуры этих соединений. Например, ингибирование карбоангидразы для соединения 5 было незначительным.
Возможно, эти вещества ингибируют карбоангидразу путем связывания с активным центром ионов Zn2+, как это предлагается для ароматических и гетероциклических сульфаниламидов [23], блокируя обмен Н+ или ОН–.
Можно также предположить, что несколько комплексов Sb(III) могут нарушать GSSG-связывающий сайт ГР, но НАДФН-связывающий сайт может оставаться активным. Кроме того, свободные ионы Sb(III) способны вызывать окислительное повреждение ФА из-за образования активных форм кислорода. Так, в корнях и листьях растений подсолнечника (Helianthus annuus L.) сурьма вызывала значительное окислительное повреждение, влияющее на рост растения, накопление некоторых минеральных элементов и эффективность работы ФА [24].
ФСII является одной из самых чувствительных компонентов ФА при действии различных стрессовых факторов благодаря большому количеству активных форм кислорода (АФК), которые в ней генерируются [25].
Снижение активности этой фотосистемы в стрессовых условиях часто бывает следствием стресс-индуцированных нарушений электронного транспорта как на донорной, так и на акцепторной стороне. При этом изменяются различные флуоресцентные показатели, которые характеризуют ее активность, прежде всего максимальный квантовый выход ФСII ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$. Введение комплексов Sb(III) приводило только к снижению амплитуды Fmax, но не изменяло величину F0. Это может свидетельствовать об обратимом действии этих комплексов на ФСII, не затрагивающем процесс переноса энергии на активный центр этой фотосистемы и первичное разделение зарядов в активном центре. Снижение амплитуды максимальной флуоресценции Fmax является признаком воздействия стрессора на донорную сторону ФСII. Обнаруженные восстановление уровня ${{F}_{v}}$ в присутствии искусственных доноров электрона и восстановление величины ${{F}_{{v}}}{\text{/}}{{F}_{{{\text{max}}}}}$, отражающей активность ФСII, подтверждают это предположение. Следовательно, комплексы Sb(III) подавляют транспорт электронов на донорной стороне ФСII.
По-видимому, ионы Sb(III) вытесняют ионы хлора из их сайтов связывания на донорной стороне ФСII, которые тесно связаны с кластером Mn4CaO5, следовательно, эта замена может нарушить структуру водоокисляющего комплекса ФСII и ухудшить перенос электрона на донорной стороне ФСII.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о том, что среди новых комплексов сурьмы есть соединения, ингибирующие фотохимическую активность ФСII, активность карбоангидразы и глутатионредуктазы и могут найти применение как прототип гербицидов, подавляющих фотосинтез. Особенно эффективны в ингибировании фотохимической активности комплексы 2 (N-2-пиримидин-2-пиперидинкарбоксамидтрихлорсурьма(III)) и 4 (N-2-пиримидин-2-пирролинкарбоксамидтрихлорсурьма(III)). При этом комплекс 2 эффективен в ингибировании активности карбоангидразы и глутатионредуктазы. Вероятно, это связано с наличием в формуле комплекса пиперидина, обладающего сильными основными свойствами. Отсюда следует, что полученные данные об ингибирующей активности новых комплексов Sb(III) могут быть полезны при разработке новых лекарств и антибиотиков (фунгицидов). Однако для окончательного вывода необходимы дальнейшие исследования с использованием достаточно широкого набора таких комплексов.
Исследование выполнено при финансовой поддержке Российского научного фонда (грант № 19-14-00118). C. Алвасел благодарит Программу стипендирования выдающихся ученых Университета короля Сауда, Саудовская Аравия (Distinguished Scientists Fellowship Program, King Saud University, Saudi Arabia) за финансовую поддержку.
Список литературы
Duke S.O., Dayan F.E. // Comprehensive biotechnology / Ed. Murray M.-Y. Amsterdam: Elsevier Press, 2011. V. 4. 2nd edn. P. 23.
Федоров В.Г., Федорова Н.В. Защита посевов от сорняков как фактор повышения эффективности производства зерна // Современные проблемы науки и образования. 2015. № 1. Ч. 1. http://science-education.ru/ru/article/view?id=18654
Allakhverdiev S.I. // J. Photochem. Photobiol. B. 2011. V. 104. P. 1.
Жармухамедов С.К. Автореф. “Выявление и изучение механизма действия новых химических ингибиторов переноса электрона в фотосистеме-2 растений” Дисс. … к.б.н. 03.00.04 / Ин-т почвоведения и фотосинтеза. Пущино, 1993. 17 с.
Shitov A.V., Pobeguts O.V., Smolova T.N. et al. // Biochemistry (Moscow). 2009. V. 74. P. 509.
Shitov A.V., Zharmukhamedov S.K., Shutova T.V. et al. // J. Photochem. Photobiol. B. 2011. V. 104. P. 366.
Supuran C.T. // Biochem. J. 2016. V. 473. № 14. P. 2023.
Karacan M.S., Yakan C., Yakan M. et al. // Biochim. Biophys. Acta. Bioenergetics. 2012. V. 1817. P. 1229.
Karacan M.S., Zharmukhamedov S.K., Mamas S. et al. // J. Photochem. Photobiol. B. 2014. V. l37. P. 156. https://doi.org/10.1016/j.jphotobiol.2013.12.002
Karacan M.S., Rodionova M.V., Tunc T. et al. // Photosynth. Res. 2016. V. 130. № 1–3. P. 167. https://doi.org/10.1007/s11120-016-0236-z
Shitov A.V., Terentyev V.V., Zharmukhamedov S.K. et al. // Biochim. Biophys. Acta. Bioenergetics. 2018. V. 1859. P. 292.
Noctor G., Mhamdi A., Chaouch S. et al. // Plant Cell. Environ. 2012. V. 35. № 2. P. 454.
Толпыгина О.А. // Бюллетень ВСНЦ СО РАМН. 2012. № 2 (843). Ч. 2. С. 176.
Noctor G., Foyer C.H. // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1998. V. 49. P. 249.
Mjos K.D., Orvig C. // Chem. Rev. 2014. V. 114. № 8. P. 4540.
Zhang D.Y., Pan X.L., Mu G.J., Wang J.L. // J. Appl. Phycol. 2010. V. 22. P. 479.
Wyllie S., Fairlamb A.H. // Biochem. Pharmacol. 2006. V. 71. № 3. P. 257.
Schiller H., Dau H. // J. Photochem. Photobiol. B. 2000. V. 55. P. 138.
Arnon D.I. // Plant. Physiol. 1949. V. 24. P. 1.
Rodionova M.Y., Zharmukhamedov S.K, Karacan M.S. et al. // Photosynth. Res. 2017. V. 133 (1–3). P. 139.
Deponte M., Urig S., Arscott L.D. et al. // J. Biol. Chem. 2005. V. 280. № 21. P. 20628.
Ding S., Lei M., Lu Q. et al. // Biochim. Biophys. Acta. Bioenergetics. 2012. V. 1817. № 11. P. 1979.
Supuran C.T., Scozzafava A., Casini A. // Med. Res. Rev. 2003. V. 23 (2). P. 146.
Ortega A., Carrido I., Casimoro I., Espinosa F. // PLoS One. 2017. V. 12(9). e0183991.
Pospišil P. // Biochim. Biophys. Acta. Bioenergetics. 2009. V. 1787. P. 1151.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


