Российские нанотехнологии, 2020, T. 15, № 2, стр. 164-170
КИНЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПРОЦЕССА ПОЛУЧЕНИЯ НАНОПОРОШКА НИКЕЛЯ ХИМИКО-МЕТАЛЛУРГИЧЕСКИМ МЕТОДОМ
Т. Х. Нгуен 1, 2, В. М. Нгуен 3, *, В. Н. Данчук 1, М. Х. Нгуен 2, Х. В. Нгуен 1, С. З. Танг 4
1 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
2 Государственный технический университет им. Ле Куй Дона
Ханой, Вьетнам
3 Институт исследований и разработок, yниверситет Дуя Тана
Дананг, Вьетнам
4 Российско-вьетнамский тропический центр
Ханой, Вьетнам
* E-mail: chinhnhan88@gmail.com
Поступила в редакцию 18.05.2020
После доработки 18.05.2020
Принята к публикации 29.05.2020
Аннотация
Проведено исследование кинетических характеристик процесса получения нанопорошка (НП) никеля химико-металлургическим методом. Нанопорошок Ni получали водородным восстановлением НП оксида никеля в трубчатой печи при температурах от 240 до 280°С. Нанопорошок NiO заранее получали термическим разложением при 300°С гидроксида никеля Ni(OH)2, синтезированного химическим осаждением из водного раствора нитрата никеля 10 мас. % и щелочи NaOH 10 мас. % при комнатной температуре, рН = 9. Установлено, что процесс восстановления НП NiO становится более интенсивным при температурах выше 250°С. Константа скорости процесса восстановления при 280°C примерно в 2.5 раза больше, чем в случае восстановления при 240°С. Длительность процесса восстановления при 280°C сократилась больше чем в 2 раза по сравнению со случаем восстановления при 240°С. На основании расчета энергии активации процесса восстановления НП NiO в изотермии сделано предположение о кинетическом режиме лимитирования процесса. Выявлено, что наночастицы Ni, полученные водородным восстановлением его оксида, имеют средний размер в интервале 60–120 нм и каждая из них соединена с несколькими соседними частицами перешейками.
ВВЕДЕНИЕ
В настоящее время получение нанопорошка (НП) Ni с заданными свойствами имеет большое практическое значение [1]. Нанопорошок Ni широко применяют в разных областях техники и промышленности, например для создания магнитных материалов; получения эластичных слоистых электропроводящих материалов; создания мелкодисперсных покрытий на керамических, кварцевых, металлических, пластмассовых, композиционных изделиях любой сложности формы; активации процессов спекания порошковых материалов; создания эффективных катализаторов и адсорбентов; при изготовлении конденсаторов, электронных микросхем и т.д. [2–12]. Получение НП Ni проводится различными механическими и физико-химическими методами, большинство которых характеризуется высокими энергозатратами, пониженной производительностью. Химико-металлургический метод, заключающийся в химическом осаждении кислородсодержащих соединений металлов с последующим термическим разложением и восстановлением, обладает рядом преимуществ, таких как низкие затраты, экологическая чистота, возможность контролировать свойства продуктов в ходе их получения [13–15].
Наиболее долгой и энергозатратной стадией процесса является восстановление из-за необходимости поддерживать заданную температуру до полного протекания реакций. Увеличение температуры восстановления приводит к ускорению процессов спекания наночастиц (НЧ) и формированию порошков микронных размеров [6, 13, 14].
Отмечено, что широкое внедрение НП Ni сдерживается их высокой стоимостью, которая является следствием того, что заключительный этап – восстановление – идет очень медленно при условиях низких температур для формирования наноразмерных частиц. Поэтому изучение кинетических характеристик процесса восстановления для установления рационально временно-температурных режимов при получении НП Ni является важной научно-практической задачей [16–18].
В связи с изложенным выше цель настоящей работы – получение НП Ni химико-металлургическим методом, изучение свойств исходных, промежуточных и конечных продуктов, а также расчет кинетических параметров процесса получения НП Ni водородным восстановлением.
МАТЕРИАЛЫ И МЕТОДИКИ
В качестве материалов для получения НП Ni использовали НП NiO, синтезированный термическим разложением НП гидроксида никеля, который заранее получали химическим осаждением из водных растворов нитрата никеля Ni(NO3)2 (10 мас. %) и щелочи NaOH (10 мас. %) при комнатной температуре, рН = 9, и непрерывном перемешивании. Получение гидроксида никеля проходит по реакции
Контроль рН осуществляли pH-метром марки “Эксперт 001”, погрешность измерений составляла ± 0.03. С помощью центрифуги полученный осадок Ni(OH)2 промывали до полной отмывки ионов растворенной соли, которую контролировали по рН раствора над осадком. Затем осадок сушили при комнатной температуре в течение двух суток.
После этого высушенный Ni(OH)2 измельчали в специальной мельнице “Fritsch Pulverisette 2”. Полученный порошок прокаливали в муфельной печи “SNOL 10/11” при температуре 300°C в течение 5 ч по реакции
Полученный НП NiO использовали для дальнейшего исследования.
Исследование кинетики восстановления НП NiO проводили в трубчатой печи “SNOL 0.2/1250” в атмосфере водорода при различных температурах. В ходе процесса протекала следующая реакция:
Источником водорода служил генератор водорода “САМ-1”, относительная влажность полученного водорода не превышала 1%, температуры восстановления выбирали в интервале от 240 до 280°С на основе данных термогравиметрического анализа (ТГА) [18].
Фазовый состав (качественный и количественный) порошковых образцов определяли методом рентгенофазового анализа (РФА) на рентгеновском дифрактометре “Дифрей-401” (Россия) (CrKα-излучение) при комнатной температуре.
Величину удельной поверхности (Sуд) образцов измеряли методом БЭТ по низкотемпературной адсорбции азота на анализаторе NOVA 1200е (США). Точность измерения составляет ±5%. Средний размер частиц порошков вычисляли по данным измерений величины Sуд, используя формулу
где ρ – пикнометрическая плотность, кг/м3; Sуд – удельная поверхность, м2/кг; Dср – средний размер частиц, м.Размерные характеристики и морфологию полученных НЧ порошков исследовали методом электронной микроскопии на сканирующем электронном микроскопе (СЭМ) JSM 6700F (Япония).
Расчет степени превращения (α) (отношение количества реагента, который вступил в реакцию, к его исходному количеству) проводили по формуле
где m0 – начальная масса оксида NiO, г; mt – масса NiО, участвующая в реакции через время t, г.Кинетика процессов получения НП Ni водородным восстановлением была изучена с помощью модели “сокращающейся сферы” Грея–Веддингтона [19, 20]. Использование этой модели позволяет рассчитать константы скорости процесса (k) по формуле
где k – константа скорости, с–1; t – время протекания реакции, с; α – степень превращения, д.е.Расчет энергии активации (Еа) проводили по экспериментальным данным, полученным в изотермических условиях, используя интегральную форму уравнения Аррениуса:
где k – константа скорости реакции; A – константа, называемая предэкспоненциальным множителем; Еa – энергия активации, Дж/моль; Т – температура, К; R – газовая постоянная, Дж/(моль·К).РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
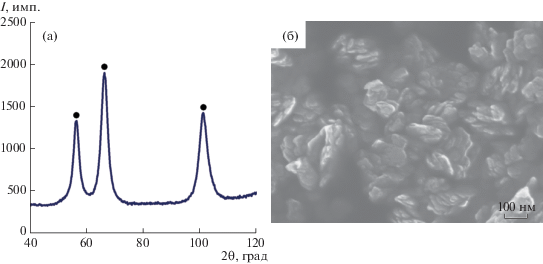
Структура и морфология исходного материала НП NiO для получения НП Ni водородным восстановлением показаны на рис. 1.
Рентгенофазовый анализ (рис. 1а) показал, что исходный образец содержит чисто кристаллическую оксидную фазу NiO, других фаз не обнаружено. Из рис. 1б видно, что НЧ NiO обладают дискообразной формой (чешуйки) с очень малой толщиной. Такие частицы, в свою очередь, образуют плотные агрегаты. Значение удельной поверхности НП NiO составило 35.6 м2/г, что соответствует величине среднего размера частиц ~25 нм.
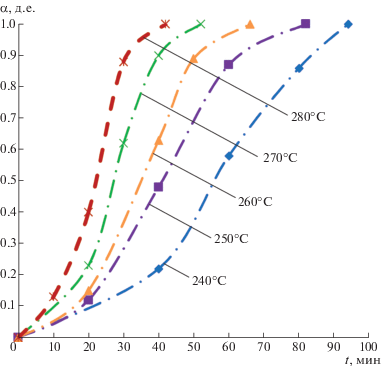
С целью исследования кинетических характеристик процесса восстановления НП NiO в изотермических условиях были получены зависимости степени превращения α от времени при различных температурах: 240, 250, 260, 270, 280°С. Эти температуры находятся в интервале интенсивного протекания процесса восстановления, которые показали данные ТГА в [18]. Проведение восстановления при температуре, большей 280°С, как показали авторы [7], приводит к нежелательному ускорению процессов агрегации и спекания формирующихся НЧ металлов.
На рис. 2 приведены кривые зависимости степени превращения α от времени восстановления t при различных температурах. Из рисунка видно, что процесс восстановления НП NiO начинает сильно ускоряться при температурах выше 250°С. Восстановление при температуре 240°C идет достаточно медленно. При температуре максимальной скорости восстановления 280°С время полного восстановления составило 42 мин, т.е. оно сократилось больше чем в 2 раза по сравнению со случаем восстановления при 240°C (при данной температуре время полного восстановления составило 94 мин).
Величины констант скорости восстановления k процессов восстановления НП NiO при разных температурах рассчитывали по модели Грея–Веддингтона (1). Результат определения значений степени превращения α (в зависимости от времени), констант скорости восстановления k (в зависимости от температуры) представлен в табл. 1.
Таблица 1.
Значения степени превращения α и константы скорости k
| Температура восстановления, °С |
t, мин | α, д.е. | k × 104, с–1 |
|---|---|---|---|
| 240 | 40 | 0.22 | 1.582 |
| 60 | 0.58 | ||
| 80 | 0.86 | ||
| 94 | 1 | ||
| 250 | 20 | 0.12 | 2.015 |
| 40 | 0.48 | ||
| 60 | 0.87 | ||
| 82 | 1 | ||
| 260 | 20 | 0.15 | 2.447 |
| 40 | 0.63 | ||
| 50 | 0.89 | ||
| 66 | 1 | ||
| 270 | 20 | 0.23 | 3.135 |
| 30 | 0.62 | ||
| 40 | 0.90 | ||
| 52 | 1 | ||
| 280 | 10 | 0.13 | 3.990 |
| 20 | 0.40 | ||
| 30 | 0.88 | ||
| 42 | 1 |
По данным табл. 1 видно, что константа скорости восстановления при 280°C примерно в 2.5 раза выше значения, полученного в случае восстановления при 240°C.
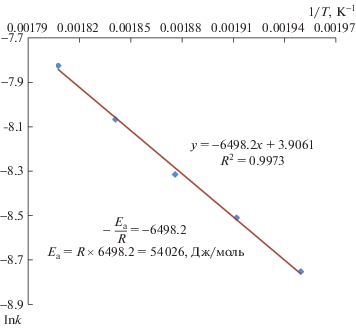
Для определения энергии активации Ea процесса восстановления в изотермических условиях были построены графики зависимости логарифма константы скорости от обратной температуры по уравнению (2) (рис. 3).
Величина Еа процессов восстановления НП NiO, рассчитанная по данным рис. 3, составила ~54 кДж/моль. Сравнивая полученное значение Еа с данными [20], можно подтвердить, что процесс восстановления НП NiO протекает в кинетическом режиме реагирования. В данном режиме рациональным способом ускорения процесса является повышение температуры.
Следует отметить, что хотя в данном случае повышение температуры является целесообразным решением для ускорения процесса восстановления НП NiO, проведение восстановления при высоких температурах может приводить к ускоренному протеканию процессов агрегирования и спекания полученных металлических НЧ.
Далее представлены результаты исследования свойств НП Ni, полученных при температуре максимальной скорости восстановления 280°C.
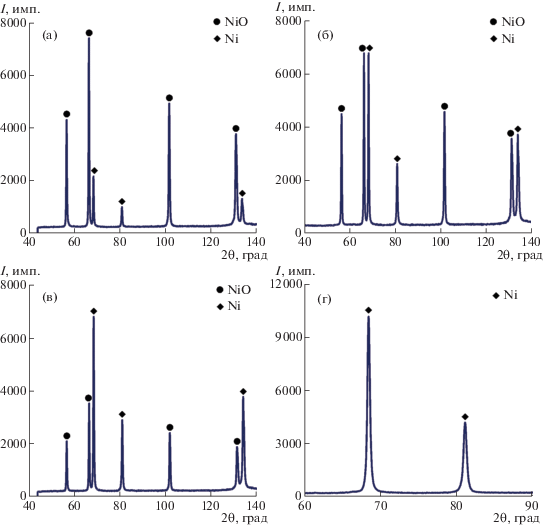
Образцы исследовали методом качественного и количественного РФА. На рис. 4 приведены рентгенограммы промежуточных и конечного продуктов процессов водородного восстановления НП NiO при 280°С.
Рис. 4.
Рентгенограммы промежуточных и конечного образцов: а – полученного после 10 мин; б – 20 мин; в – 30 мин; г – 42 мин.
Результат количественного фазового анализа образцов (основанного на изучении зависимости интенсивности дифракционных отражений от содержания фазы в исследуемом материале) представлен в табл. 2.
Таблица 2.
Результат количественного фазового анализа полученных образцов
| Образец | Количество фазы, ат. % | |
|---|---|---|
| NiO | Ni | |
| НП NiO, исходный | 100 | 0 |
| После 10 мин | 87 | 13 |
| После 20 мин | 60 | 40 |
| После 30 мин | 12 | 88 |
| После 42 мин, чистый НП Ni | 0 | 100 |
Данные РФА образцов на рис. 4 и в табл. 2 хорошо согласуются с кинетическими данными. Показано, что со временем восстановления интенсивность пиков металлической фазы в образцах увеличивается (рис. 4), а интенсивность пиков оксидной фазы непрерывно падает, соответственно, количество металлической фазы Ni растет. Результат количественного РФА (табл. 2) выявил, что после первых 20 мин восстановления содержание металлического Ni составило лишь 40 об. %, а выдержка в течение следующих 20 мин позволяет почти полностью восстановить образец NiO. Процесс восстановления закончился за 42 мин с образованием 100 об. % металлической фазы – НП Ni. Отметим, что за 20 мин в середине этапа (с 10-й до 30-й минуты) количество образовавшегося Ni составляет ~75 об. %, т.е. в ~3 раза больше, чем общее количество Ni, образовавшегося в начальном (от нулевой до 10-й минуты) и конечном (от 30-й до 42-й минуты) интервалах времени. Таким образом, автокаталитическая (ускоряющая) стадия процесса восстановления НП NiO при 280°С протекает приблизительно в интервале от 10-й до 30-й минуты выдержки.
Рентгенофазовый анализ конечного образца (рис. 4г) показал, что образец содержит только ГЦК-фазу Ni.
На рис. 5 представлены СЭМ-изображения промежуточных и конечного образцов восстановления НП NiO при 280°С. Видно, что для образца, полученного после 10 мин (рис. 5а), восстановление идет по фракциям, при этом восстановленная фракция образца представляет собой очень мелкие НЧ металлического никеля, которые имеют тенденцию образовывать агрегаты в виде хлопьев (белого цвета на микрофотографии). Для образца, полученного после 20 мин (рис. 5б), восстановление протекает почти по всей поверхности. При этом металлические НЧ начинают расти и обладать определенной формой. В образце, полученном после 30 мин восстановления (рис. 5в), осталась малая невосстановленная фракция, а НЧ металла продолжают свой рост и большинство их имеет округлую форму. Образец, полученный после 42 мин восстановления (рис. 5г), практически восстановлен. По сравнению с предыдущими образцами НЧ Ni в образце конечного продукта обладают гораздо бóльшим размером (порядка 60–120 нм) вследствие большего времени их роста при длительной выдержке. При этом НЧ находятся главным образом в спеченном состоянии, каждая из них соединена с несколькими соседними частицами перешейками.
Рис. 5.
СЭМ-изображения промежуточных и конечного образцов: а – полученного после 10, б – 20, в – 30, г – 42 мин.

Данные исследования удельной поверхности НЧ полученных образцов методом БЭТ (табл. 3) хорошо согласуются с результатом микроскопического анализа. Показано, что с увеличением времени проведения восстановления величина удельной поверхности НЧ полученных образцов быстро падает, соответственно, их средний размер увеличивается. Установлено, что в ходе восстановления процессы спекания и агрегирования образованных металлических НЧ приводят к значительному уменьшению величины Sуд конечного продукта по сравнению с исходным материалом (от 35.6 у НП NiO до 8.8 м2/г у НП Ni).
ВЫВОДЫ
Исследованы кинетические характеристики процесса водородного восстановления НП NiO при температурах от 240 до 280°С. Установлено, что константа скорости восстановления при 280°C примерно в 2.5 раза больше, чем в случае восстановления при 240°С, соответственно, длительность процесса при этом сократилась больше чем в 2 раза. Восстановление НП NiO начинает сильно ускоряться при температурах выше 250°С.
Величина энергии активации процессов восстановления НП NiO составила ~54 кДж/моль, что свидетельствует о кинетическом режиме реагирования. В данном режиме рациональным способом ускорения процесса является повышение температуры.
По-видимому, автокаталитическая (ускоряющая) стадия процесса восстановления НП NiO при 280°С протекает в интервале от 10 до 30 мин выдержки.
Выявлено, что НЧ Ni, полученные водородным восстановлением его оксида при 280°С, имеют размер 60–120 нм со средним значением 77 нм, которые находятся в спеченном состоянии и каждая из них соединена с несколькими соседними частицами перешейками.
Список литературы
Springer Handbook of Nanotechnology / Ed. Bhushan B. 4th edition. Berlin: Springer-Verlag Heidelberg, 2017. 1500 p.
Alymov M.I., Rubtsov N.M., Seplyarskii B.S. et al. // Nanotechnologies in Russia. 2017. V. 12. P. 577.
Alymov M.I., Rubtsov N.M., Seplyarskii B.S. et al. // Nanotechnologies in Russia. 2018. V. 13. P. 557.
Kesarla M.K., Reddy N.N.K., Ortiz-Chi F. et al. // Mater. Chem. Phys. 2020. V. 240. № 122. P. 157.
Nguyen V.M., Karunakaran G., Nguyen T.H. et al. // Lett. Mater. 2020. V. 10 (2). P. 174.
Сидорова Е.Н., Дзидзигури Э.Л., Левина В.В. // Металлы. 2008. № 6. С. 78.
Van Minh N., Konyukhov Y., Karunakaran G. et al. // Metals and Materials International. 2017. V. 23. № 3. P. 532.
Banik S., Mahajan A. // Mater. Chem. Phys. 2019. V. 235 (121). P. 747.
Alymov M.I., Leontieva O.N. // Nanostructured Materials. 1995. V. 6. № 1–4. P. 393.
Dulina I., Lobunets T., Klochkov L., Ragulya A. // Nanoscale Res. Lett. 2015. V. 10. P. 156.
Wei Z., Yan P., Feng W. // Mater. Charact. 2006. № 57. P. 176.
Jung K.Y., Lee J.H., Koo H.Y. et al // Mater. Sci. Eng. B. 2007. V. 137. № 1–3. P. 10.
Ryzhonkov D.I., Konyukhov Yu.V., Nguyen V.M. // Nanotechnologies in Russia. 2017. V. 12. № 11–12. P. 620.
Nguyen V.M., Konyukhov Yu.V., Ryzhonkov D.I. // Steel in Translation. 2018. V. 48. № 2. P. 73.
Konyukhov Yu.V., Nguyen V.M., Ryzhonkov D.I. // Inorgan. Mater. Appl. Res. 2019. V. 10. № 3. P. 706.
Шамро Э.А., Вязьмин О.А., Евланов С.Ф. // Цветные металлы. 1970. № 12. С. 10.
Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. Теория металлургических процессов. М.: Металлургия. 1989. 392 с.
Нгуен В.М., Конюхов Ю.В., Рыжонков Д.И., Котов С.И. // Изв. вузов. Порошковая металлургия и функциональные покрытия. 2016. № 1. С. 4.
Колпакова Н.А., Романенко С.В., Колпаков В.А. Сборник задач по химической кинетике. Томск: Изд-во ТПУ, 2008. 280 с.
Schmalzried H. Chemical Kinetics of Solids. Weinheim: VCH. 1995. 700 p.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии