Российские нанотехнологии, 2020, T. 15, № 3, стр. 309-315
АЛЬТЕРНАТИВНЫЕ ПРОТОНПРОВОДЯЩИЕ МАТЕРИАЛЫ НА ОСНОВЕ КАЛИКСАРЕНОВ И НИЗКОМОЛЕКУЛЯРНЫХ КИСЛОТ ДЛЯ НИЗКОТЕМПЕРАТУРНЫХ ТОПЛИВНЫХ ЭЛЕМЕНТОВ И СЕНСОРОВ
Л. В. Шмыглева 1, Р. Р. Каюмов 1, Ю. А. Добровольский 1, 2, *
1 Институт проблем химической физики РАН
Черноголовка, Россия
2 Южно-Российский государственный политехнический университет (НПИ) им. М.И. Платова
Новочеркасск, Россия
* E-mail: dobr@icp.ac.ru
Поступила в редакцию 16.06.2020
После доработки 16.06.2020
Принята к публикации 03.07.2020
Аннотация
Синтезированы кристаллические электролиты в системе “каликсаренсульфокислота–низкомолекулярные кислоты” и изучены особенности их строения и параметры протонного переноса в широком диапазоне относительной влажности (RH = 20–75%) и температур (от +50 до –80°C). Показано, что введение кислот в наноразмерную чашу каликсарена приводит к образованию супрамолекулярных комплексов трех типов. Структурные особенности полученных материалов влияют на электротранспортные свойства таких систем. Наибольшей протонной проводимостью, достигающей 0.08 См/см при RH = 75% и 25°C, обладают комплексы, близкие по своей структуре к исходной каликсаренсульфокислоте.
ВВЕДЕНИЕ
Твердые электролиты различной природы представляют большой интерес как с фундаментальной, так и с практической точки зрения. Они широко используются во многих современных электрохимических устройствах, например в топливных элементах. Существует большое количество твердых протонпроводящих электролитов, однако в силу наличия у них тех или иных недостатков продолжается поиск новых материалов или модификация имеющихся.
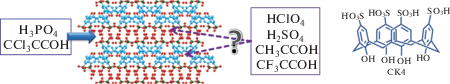
В данной работе рассмотрим перспективный класс электролитов – каликсаренсульфокислоты. Каликсарены представляют собой кристаллические циклические соединения с различным количеством ароматических звеньев. Они относятся к супрамолекулярным соединениям с изменяемыми размерами полости (для каликсарена с четырьмя ароматичесими кольцами размер такой полости составляет ~10 Å), способным образовывать комплексы “гость–хозяин” с небольшими молекулами, как с заряженными, так и неполярными [1–4]. Приобретая таким образом новые свойства, каликсарены становятся перспективным классом соединений с точки зрения их использования в различных областях применения: в биологии и медицине [5–10], в катализе [11], в области определения и абсорбции загрязнений в воде [12, 13].
Если каликсарен по верхнему ободу содержит кислотную группу (–PO3H, –SO3H), то он становится гидрофильным, и структура разделяется на две подрешетки с чередующимися слоями (рис. 1). Один слой состоит из органических анионов, ориентированных друг относительно друга нижним ободом [14–18]. Другой слой содержит протоны кислотных групп, координированных молекулами воды. При этом молекулы воды связаны друг с другом посредством водородных связей, что создает предпосылки для эффективного протонного транспорта. В [19–21] была обнаружена высокая протонная проводимость (до 0.1 См/см) таких соединений, что открывает возможность их использования в низкотемпературных твердотельных топливных элементах, потенциометрических газовых сенсорах [22, 23] и суперконденсаторах.
Исследование особенностей протонного переноса в гидрате каликс[4]аренсульфокислоты показало, что благодаря сильной связанности гидратного слоя значительное изменение количества воды в нем (которое наблюдается при изменении влажности окружающей среды) не приводит к значительным изменениям в параметрах протонного переноса. Кроме того, значительная подвижность молекул воды позволяет надеяться на то, что часть молекул воды можно заменить молекулами кислот аналогично тому, как это было сделано в Нафионе [24]. Это может привести к улучшению электротранспортных характеристик. Однако возможен и другой тип взаимодействия кислот-“гостей” с каликсаренами: они могут входить внутрь чаши каликсарена, образуя слабые связи с фенольными группами. В [25, 26] была показана возможность создания подобных комплексов с низкомолекулярными кислотами.
Для исследований выбраны каликс[4]аренсульфокислота в качестве основного компонента и низкомолекулярные кислоты в качестве “гостей” (рис. 1). Цель работы – выяснить влияние кислот-“гостей” на процессы протонного переноса в таких электролитах.
МАТЕРИАЛЫ И МЕТОДИКА ЭКСПЕРИМЕНТА
Исходные реактивы. Гидрат 25,26,27,28-тетрагидроксикаликс[4]арен-5,11,17,23-тетрасульфокислоты (СК4) был получен путем сульфирования исходного каликсарена по известной методике [27].
Замещенные уксусные кислоты CH3COOH, CF3COOH и CCl3COOH, а также неорганические кислоты HClO4, H2SO4 и H3PO4 марки “ХЧ”, реактивы для синтеза сульфированных каликс [4]аренов необходимой чистоты фирмы “Sigma-Aldrich” приобретены коммерчески.
Получение комплексов. Комплексы с органическими кислотами получали путем смешивания СК4 с более чем четырехкратным избытком соответствующей уксусной кислоты в присутствии воды до полного растворения. Полученные растворы замораживали в жидком азоте и высушивали в лиофильной сушке в течение 21 ч до достижения давления насыщенных паров 0.04 мбар. По результатам исследования методом ЯМР в составе полученных комплексов на одну молекулу СК4 приходится одна молекула кислоты-“гостя”. Комплексы с неорганическими кислотами смешивали с водным раствором соответствующей кислоты в мольном соотношении СК4:кислота = = 1:1 и упаривали при 60°C до сухого остатка.
Термическую устойчивость образцов определяли методом синхронного термического анализа (СТА) с масс-спектрометрическим анализом продуктов разложения на приборах фирмы Netzsch STA 409 PC Luxx® и QMS 403 C Aëolos. Кривые термогравиметрического анализа (ТГА) и дифференциальной сканирующей калориметрии (ДСК) были записаны в температурном интервале 35–200°C в аргоне при скорости нагрева 10°C/мин.
ИК-спектроскопия. Приготовленные образцы анализировали методами ИК-спектроскопии поглощения и спектроскопии ИК-нарушенного полного внутреннего отражения (НПВО) (вакуумный ИК-фурье-спектрометр Vertex 70V с приставкой RAMII и алмазной приставкой фирмы Bruker, λв = 1064 нм с разрешением 4 см–1.
Рентгено-фазовый анализ (РФА). Рентгенограммы регистрировали на дифрактометре АДП-2-01 (СuКα-излучение, Ni-фильтр) с использованием программы для автоматизации процессов получения, обработки и анализа данных X-RAY, разработанной для рентгеновских дифрактометров серии ДРОН.
Импедансометрия. Для определения значений удельной протонной проводимости исследуемых соединений использовали метод импедансной спектроскопии.
Исследуемые порошкообразные образцы в ячейке с углеродными электродами представляли собой прессованные таблетки диаметром 5 мм. Исследования проводили в интервалах относительной влажности (RH) от 10 до 75% (время выдерживания составляло 7 дней) и температуры от –80 до +50°С, время термостатирования определяли стабилизацией импеданса образца. Протонную проводимость измеряли на импедансметре Z-3000 фирмы ООО “Элинс” в диапазоне частот 3 МГц–1 Гц. Амплитуда внешнего переменного сигнала составляла 10–100 мВ в зависимости от импеданса образца без поляризации постоянным током. Частотную зависимость сопротивления анализировали графоаналитическим методом [28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наличие новых пиков на порошкограммах образцов, выдержанных при RH = 32%, подтверждает образование комплексов СК4 с кислотами (рис. 2). По виду порошкограмм всех образцов можно предположить наличие трех типов структур. К первому типу относятся образцы с фосфорной и трихлоруксусной кислотами, строение которых, по-видимому, близко к строению исходного СК4. Вероятно, в этом случае молекулы кислоты-“гостя” вместе с молекулами воды находятся в межслоевом пространстве, практически не меняя положение основных пиков исходного СК4. Остальные четыре комплекса с неорганическими и замещенными уксусными кислотами обладают соответственно II и III типом строения. И если для двух первых типов самый интенсивный пик лежит в области 17°–18°, то для III типа он расположен при 22.6°, а в области 17° и 19° расположены два двойных пика одинаковой интенсивности. Не исключено, что такое различие может говорить о встраивании кислоты-“гостя” в слой органических анионов СК4 со стороны гидроксигрупп.
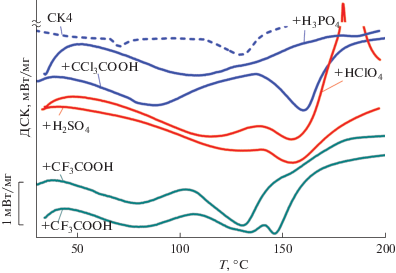
По данным СТА все образцы, выдержанные при RH = 32%, стабильны при комнатных температурах, а процесс дегидратации всех образцов начинается при повышенных температурах и проходит в несколько этапов (рис. 3). Хотя процесс потери воды, как и в случае чистого СК4, происходит в несколько этапов, определение абсолютного содержания воды в образцах не представляется возможным в силу начала распада комплексов. Тем не менее по первому пику дегидратации можно провести оценку количества адсорбированной воды на комплексную молекулу, состоящую из молекулы СК4 и молекулы кислоты-“гостя” (mad в табл. 1). В случае комплексов с неорганическими кислотами-“гостями” пик потери адсорбированной воды наблюдается при температурах 110–120°С. Для органических кислот этот максимум находится при более низких температурах 80–90°С. Полученные образцы хорошо разделяются на три типа по величине mad = = 6, 8 и 4 для I, II и III типа строения соответственно (табл. 1). Такая схожесть в структуре и влагосодержании, вероятно, должна иметь влияние на протонпроводящие свойства полученных материалов. Оценить корреляцию степени гидратации с природой кислоты-“гостя” невозможно из-за отсутствия данных по абсолютному содержанию воды в образцах.
Таблица 1.
Данные синхронного термического анализа исследуемых образцов
| СК4 | СК4 + H3PO4 | СК4 + CCl3COOH | СК4 + HClO4 | СК4 + H2SO4 | СК4 + CH3COOH | СК4 + CF3COOH | |
|---|---|---|---|---|---|---|---|
| Тип | I | II | III | ||||
| mad H2O/CK4 | 8.4 | 7.4 ± 1 | 5.4 ± 1 | 8.5 ± 1 | 8.8 ± 1 | 3.7 ± 1 | 3.8 ± 1 |
| T1, °C | 71 | 109 | 89 | 121 | 130 | 80 | 81 |
| T2, °C | 131 | 160 | 154 | 155 | 130 | 134, 146 | |
Второй эндотермический процесс соответствует удалению связанной воды и распаду комплексов с галогензамещенными уксусными кислотами, максимум пика находится в области T2 = = 146–160°C (рис. 3); процесс распада сопровождается выделением продуктов разложения уксусных кислот СO2, CH3, CF3. В этой же области происходит второй этап дегидратации исходного СК4. Повышение температуры свыше 200°C приводит к разложению самого аниона каликсарена с сульфогруппами.
По данным ИК-спектроскопии полученные образцы имеют такую же широкую, как у СК4, полосу с максимумом при 2950 см–1 (плечо при ~3400 см–1), отнесенную к валентным колебаниям ν(ОН) иона оксония, гидроксония или высшего гидрата, и полосу с максимумом при 1694–1720 см–1, отнесенную к деформационным колебаниям δ(НОН) иона ${{{\text{H}}}_{5}}{\text{O}}_{2}^{ + }$. Под влиянием насыщения СК4 кислотами частота колебания ν(ОН) фенольной группы понижается на 60–75 см–1. Этот факт может указывать на образование водородной связи между теми гидратами протона, которые принадлежат добавленной кислоте, и фенольной группой. На фоне поглощения СК4 проявляются две отчетливо различимые полосы валентных симметричного νs(CO2) и антисимметричного νas(CO2) колебаний анионов ССl3COO– и СF3COO–, а также анионов двух других кислот-“гостей” ${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - }$ и ${\text{HSO}}_{4}^{ - }$.
Эксперимент показал сложную зависимость протонной проводимости (σ) полученных соединений “гость–хозяин” от природы кислоты-“гостя”. На рис. 4 представлены результаты исследования протонной проводимости σ полученных комплексов. Как видно, добавление кислоты приводит к снижению протонпроводящих свойств в полученных образцах при низкой относительной влажности окружающей среды (10–20%). Только комплекс с фосфорной кислотой имеет проводимость в 2–3 раза выше исходного СК4 (от 7 до 28 мСм/см в диапазоне RH = 20–43%). Это может объясняться тем, что содержание воды в данном электролите является наибольшим по сравнению с другими образцами. В пользу этого предположения говорит ограниченный диапазон стабильности комплекса – при влажности окружающей среды выше 43 отн. % образец растворяется в собственной кристаллизационной воде. При достижении высоких значений влажности окружающей среды различия в протонной проводимости исследуемых материалов нивелируются, и σ = = (5.8 ± 1.4) × 10–2 См/см при 25°C и RH = 75%, достигая проводимости исходного СК4.
Рис. 4.
Зависимости протонной проводимости образцов СК4 с кислотами от относительной влажности окружающей среды (25°C).
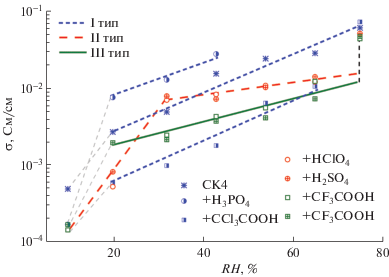
Как и предполагалось, схожесть строения влияет на характер протонной проводимости исследуемых комплексов при изменении влажности. На рис. 4 видно, что образцы с разным типом строения имеют разные зависимости протонной проводимости. Так, при увеличении влажности окружающей среды комплексы с фосфорной и трихлоруксусной кислотами имеют схожие с исходным СК4 характеры протонной проводимости. Данный тип материалов имеет самую сильную зависимость протонной проводимости от влажности. Величина b при аппроксимации экспериментальных данных прямой lgσ = a + bRH равна (26 ± 3) × 10–3. Характеры проводимости c уксусной и трифторуксусной кислотами в силу своей изоструктурности идентичны и имеют более слабую зависимость от влажности: b = (15 ± 1) × × 10–3 (в диапазоне RH = 20–65% σ увеличивается от 0.002 до 0.010 См/см).
Протонпроводящие свойства комплексов с хлорной и серной кислотами (II тип) отличаются от двух других тем, что имеют резкую зависимость протонной проводимости вплоть до 32 отн. % (для I и III типов это значение лежит в области 20 отн. %). Однако дальнейшее увеличение влажности окружающей среды практически не влияет на изменение протонной проводимости таких комплексов: b = (8 ± 2) × 10–3 (в диапазоне RH = = 32–65% σ увеличивается от 0.008 до 0.013 См/см).
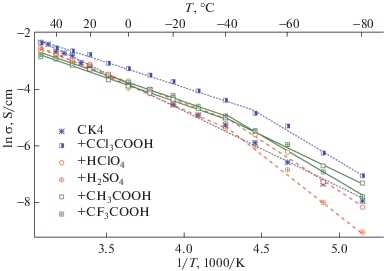
Температурные зависимости проводимости полученных комплексов (рис. 5) в области температур от +50 до –40°C носят линейный характер в координатах Аррениуса. Для исходного СК4 в области –20°C может появиться перегиб, наличие которого зависит от метода подготовки образца и, как следствие, влагосодержания [29]. Ожидалось, что увеличение количества протонов увеличит проводимость, а связывание кислотами лишней воды не даст воде замерзнуть, как это наблюдается для допированной кислотами полимерной мембраны Нафион [24]. Однако при охлаждении образцов ниже –40 °C на температурных зависимостях наблюдается перегиб, наличие которого свидетельствует о фазовом переходе, связанном, по-видимому, с замерзанием воды в образце, сопровождающeмся почти двукратным увеличением энергетических барьеров проводимости.
Энергии активации проводимости, рассчитанные из температурных зависимостей в положительной области температур до фазового перехода, представлены на рис. 6. При низких значениях RH энергии активации проводимости всех комплексов почти в 2 раза выше СК4 (0.24 эВ). Зависимости энергии активации проводимости от влажности окружающей среды носят нелинейный характер. Вид этих зависимостей подтверждает схожесть структурных особенностей, влияющих на транспортные свойства комплексов. Для образцов с H3PO4 и CCl3COOH (I тип структуры) наблюдается ступенчатая зависимость энергии активации проводимости, первая ступень с энергией 0.27 эВ схожа с таковой для исходного СК4, но наблюдается в более широком диапазоне RH от 20 до 54% (рис. 6). Дальнейшее увлажнение приводит к скачкообразному падению энергии активации проводимости до 0.15 эВ. Зависимость энергии активации проводимости образцов со структурой II и III типов резко отличается своим типичным спадом при увлажнении. Для образцов II типа энергия активации проводимости уменьшается экспоненциально до 0.16 эВ при RH = 32%, при дальнейшем увеличении RH до 75% ее величина не изменяется. Для III типа электролитов падение линейно: от 0.48–0.49 эВ при RH = 10% до 0.10 и 0.14 эВ при RH = = 54% (рис. 6), дальнейшее увлажнениe образцов приводит к увеличению энергии активации проводимости, как и в случае I типа.
Рис. 6.
Зависимость энергии активации проводимости от относительной влажности окружающей среды образцов СК4 с кислотами.

Как можно заметить, для исходного СК4 наблюдается атипичное возрастание энергии активации проводимости при RH свыше 45%. Введение низкомолекулярных кислот в структуру приводит к сдвигу этой аномальной области в сторону бóльших влажностей (RH = 55–60%).
ЗАКЛЮЧЕНИЕ
Исследованы супрамолекулярные соединения в системе “каликсаренсульфокислота–низкомолекулярные кислоты” и изучены особенности их строения и параметры протонного переноса. Показано, что комплексы обладают тремя типами структур, которые влияют на их влагосодержание, а следовательно, и на протонпроводящие свойства. Обнаружено, что в области высоких влажностей окружающей среды энергия активации проводимости составляет 0.10–0.15 эВ для всех изученных соединений, при этом уникальное явление увеличения энергии активации проводимости с ростом влажности, свойственное исходному СК4, происходит при более высоких значениях влажности. В целом несмотря на то что, за исключением ортофосфорной кислоты, образование комплексов “гость–хозяин” приводит к снижению величины протонной проводимости, наблюдается уменьшение зависимости электротранспортных свойств таких материалов от влажности окружающей среды, что должно положительно сказаться на возможности их применения в электрохимических устройствах.
Работа выполнена по теме Государственного задания, № государственной регистрации АААА-А19-119061890019-5.
Список литературы
Hardie M.J., Makha M., Raston C.L. // Chem. Commun. 1999. V. 23. P. 2409. https://doi.org/10.1039/A907469D
Ling I., Alias Ya., Raston C.L. // New J. Chem. 2010. V. 34. P. 1802. https://doi.org/10.1039/C0NJ00317D
Мустафина А.Р., Скрипачева В.В., Коновалов А.И. // Успехи химии. 2007. Т. 76. № 10. С. 979. https://doi.org/10.1070/RC2007v076n10ABEH003727
Garnier L., Sarraute S., Israeli Y. et al. // J. Phys. Chem. B. 2018. V. 122. P. 11953. https://doi.org/10.1021/acs.jpcb.8b09127
Daze K.D., Jones C.E., Lilgert B.J. et al. // Can. J. Chem. 2013. V. 91. P. 1072. https://doi.org/10.1139/cjc-2013-0186
Guo D.-Sh., Liu Y. // Acc. Chem. Res. 2014. V. 47. P. 1925. https://doi.org/10.1021/ar500009g
Oguz M., Gul A., Karakurt S., Yilmaz M. // Bioorgan. Chem. 2020. V. 94 P. 1032073. https://doi.org/10.1016/j.bioorg.2019.103207
Tauran Y., Cerón-Carrasco J.P., Rhimi M. et al. // Antibiotics. 2019. V. 8. P. 73. https://doi.org/10.3390/antibiotics8020073
Nikolova V.K., Kirkova C.V., Angelova S.E., Dudev T.M. // Beilstein J. Org. Chem. 2019. V. 15. P. 1321. https://www.beilstein-journals.org/bjoc/content/pdf/1860-5397-15-131.pdf
Abranches P.A.S., Varejao E.V.V., da Silva C.M. et al. // RSC Adv. 2015. V. 5. P. 44317. https://doi.org/10.1039/C5RA05423K
Basilio N., Pessego M., Acuna A., Garcia-Rio L. // ChemCatChem. 2019. V. 21. P. 5397. https://doi.org/10.1002/cctc.201901254
Zheng Z., Yu H.J., Geng W.C. et al. // Nat. Commun. 2019. V. 10. P. 5762. https://doi.org/10.1038/s41467-019-13775-1
Maity D., Kumar A., Gunupuru R., Paul P. // Colloids Surf. A. 2014. V. 455. P. 122. https://doi.org/10.1016/j.colsurfa.2014.04.047
Martin A.D., Raston C.L. // Chem. Commun. 2011. V. 47. P. 9764. https://doi.org/10.1039/C1CC12048D
Atwood J.L., Hamada F., Robinson K.D. et al. // Nature. 1991. V. 349. P. 683. https://doi.org/10.1038/349683a0
Coleman A.W., Bott S.G., Morley S.D. et al. // Angew. Chem., Int. Ed. Engl. 1988. V. 10. P. 1361. https://doi.org/10.1002/anie.198813611
Clark T.E., Makha M., Sobolev A.N. et al. // Chem.–Eur. J. 2008. V. 14. P. 3931. https://doi.org/10.1002/chem.200701472
Clark T.E., Makha M., Sobolev A.N. et al. // Cryst. Growth Des. 2009. V. 9. P. 3575.
Shmygleva L.V., Pisareva A.V., Pisarev R.V. et al. // Rus. J. Electrochem. 2013. V. 49. P. 801. https://doi.org/10.1134/S1023193513080181
Shmygleva L.V., Sanginov E.A., Kayumov R.R. et al. // Rus. J. Electrochem. 2015. V. 51. P. 468. https://doi.org/10.1134/S1023193515050134
Pisareva A.V., Pisarev R.V., Karelin A.I. et al. // Rus. Chem. Bull. 2012. V. 1. P.1892. https://doi.org/10.1007/s11172-012-0263-7
Leonova L., Shmygleva L., Ukshe A. et al. // Sensors Actuators B. 2016. V. 230. P. 470. https://doi.org/10.1016/j.snb.2016.02.083
Kumar S., Chawla S., Zou M.C. // J. Incl. Phenom. Macrocycl. Chem. 2017. V. 88. P. 129. https://doi.org/10.1007/s10847-017-0728-2
Kayumov R.R., Shmygleva L.V., Dobrovolsky Yu.A. // Russ. J. Electrochem. 2015. V. 51. P. 556. https://doi.org/10.1134/S1023193515060099
Shmygleva L.V., Kayumov R.R, Karelin A.I., Dobrovol’skii Yu.A. // Russ. J. Electrochem. 2018. V. 54. P. 409. https://doi.org/10.1134/S1023193518050075
Shmygleva L.V., Kayumov R.R., Dobrovolsky Yu.A. // Solid State Ionics. 2017. V. 302. P. 202. https://doi.org/10.1016/j.ssi.2016.12.026
Scharff J.-P., Mahjoubi M. // New. J. Chem. 1991. V. 15. P. 883.
Графов Б.М., Укше Е.А. Электрохимические цепи переменного тока. М.: Наука, 1973. 128 с.
Shmygleva L.V., Freyman V.M., Vinyukov A.A., Dobrovolsky Yu.A. // Solid State Ionics. 2020. V. 353. P. 115378. https://doi.org/10.1016/j.ssi.2020.115378
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии