Российские нанотехнологии, 2020, T. 15, № 4, стр. 532-539
ВЛИЯНИЕ НАНОЧАСТИЦ ГИДРОКСИАПАТИТА СИНТЕТИЧЕСКОГО И ПРИРОДНОГО ПРОИСХОЖДЕНИЯ НА СВОЙСТВА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА
Ю. А. Нащекина 1, 2, *, И. П. Добровольская 2, 3, Е. М. Иванькова 2, 3, В. Е. Юдин 2, 3
1 Институт цитологии РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
3 Институт высокомолекулярных соединений РАН
Санкт-Петербург, Россия
* E-mail: nashchekina.yu@mail.ru
Поступила в редакцию 02.07.2020
После доработки 05.10.2020
Принята к публикации 06.10.2020
Аннотация
Синтез новых форм гидроксиапатита (ГА) и исследование их взаимодействия с живыми клетками являются перспективным направлением современных нанотехнологий в области химии и клеточной биологии. Проведен сравнительный анализ взаимодействия наночастиц ГА различного происхождения с живыми клетками. С помощью метода сканирующей электронной микроскопии показано, что частицы нативного ГА (НГА), выделенного из нативной костной ткани, в несколько раз превышают размеры синтетического ГА (СГА), синтезированного методом осаждения. Размер пор и удельная поверхность у СГА более чем в 3 раза превышают аналогичные параметры НГА. Присутствие СГА в культуральной среде вместе с мезенхимными стромальными клетками снижает их адгезию, распластанность и пролиферацию в отличие от присутствия частиц НГА, которые практически не оказывают негативного влияния на рост и размножение живых клеток.
ВВЕДЕНИЕ
Использование наночастиц размером 1–100 нм для физических, биомедицинских и фармацевтических задач обусловлено их уникальными физическими, химическими и биологическими свойствами [1, 2]. Благодаря достижениям современных нанотехнологий стало возможно не только синтезировать, но и исследовать свойства широкого спектра наноразмерных объектов. Перспективным материалом для использования в регенеративной медицине является гидроксиапатит (ГА), свойства которого зависят как от состава, так и от размера кристаллов. Гидроксиапатит является природной минеральной формой апатита кальция Ca10(PO4)6(OH)2, который, например, составляет до 70 мас. % человеческой кости и зубов. Гидроксиапатит широко использовался в качестве наполнителя для замены ампутированной кости или в качестве покрытия, способствующего врастанию кости в протезы во многих хирургических областях, таких как реконструктивные операции [3, 4] и дентальная имплантология [5]. Гидроксиапатит также используется для восстановления ранних повреждений эмали зубов [6].
Помимо костной пластики, благодаря высокой биосовместимости и биоактивности ГА успешно применяется в производстве косметики и средств гигиены. Использование наноразмерных форм ГА в биомедицинских областях постоянно растет благодаря высокой эффективности генной трансфекции при доставке лекарств, а также хорошим механическим свойствам. Отметим, что физико-химические и структурные свойства фосфатов кальция сильно зависят от условий их приготовления [7–9]. Они могут быть изготовлены с использованием множества различных методов, таких как гидротермальный синтез, золь-гель-синтез, влажно-химическое осаждение и микроволновая обработка [10–13]. Широкое распространение получил ГА, выделенный из природных источников [14]. В зависимости от происхождения, синтетического или природного, ГА имеет свои достоинства и недостатки. Небольшое количество сравнительных исследований по применению ГА различного происхождения к биологическим объектам не позволяет дать однозначного заключения и выделить преимущества того или иного способа получения ГА или источников его сырья.
Во многих работах показано, что в зависимости от физико-химических свойств ГА может вызывать различные биологические реакции [15–17]. Было показано, что на клетки и ткани после имплантации оказывают влияние не только продукты деградации частиц ГА, но и сами частицы, а также их составляющие, которые могут выходить из кристаллической структуры ГА при взаимодействии с окружающей средой. Имеются данные по исследованию влияния формы, размеров или поверхностного заряда частиц ГА на поведение клеток [18–20].
Несмотря на совокупность уникальных свойств, широкого спектра способов синтеза, роста числа применений для биомедицинских задач, природа взаимодействия между наночастицами ГА и клетками еще не полностью изучена [21, 22].
Целью настоящего исследования является комплексная оценка влияния частиц ГА синтетического и природного происхождения, имеющих различные физико-химические характеристики, на поведение мезенхимных стромальных клеток (МСК) костного мозга.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение наночастиц ГА методом осаждения. Синтетические наночастицы ГА (СГА) кальция получали с помощью метода осаждения из смеси фосфорной кислоты H3PO4 и нитрата кальция Ca(NO3)2 в Институте химии СПбГУ [23].
Диапазон pH (10) и температуру синтеза (240°С) определяли по образованию частиц с проявлением примесных фаз и хорошей кристалличностью. Для смешивания исходных реагентов использовали магнитные мешалки. Полученную смесь переносили в автоклав Teflon емкостью 180 мл. Затем проводили нагрев закрытого резервуара и выдерживали его при заданной температуре в течение одного часа. Образовавшийся белый осадок отделяли с помощью центрифугирования (Sigma 2-16P) и промывали дистиллированной водой чередованием стадий встряхивания и сбора несколько раз. Далее готовые продукты подвергали сублимационной сушке.
Получение нативного ГА. Нативный ГА (НГА) [14] был получен коллегами из Института механики горных пород, из лаборатории композитов и углеродных материалов (Прага, Чехия). Кости животных резали на части необходимого размера и удаляли примеси костного мозга и мягких тканей нагреванием в 2%-ном растворе NaCl при давлении 0.2 МПа и температуре 150°С. Полученную пастообразную смесь обeзжиривали в растворе ацетона и диэтилового эфира в объемном соотношении 3:2 на протяжении 24 ч. Далее образцы обрабатывали 4%-ным раствором NaOH при температуре 70°С в течение 24 ч. После чего продукт отжигали при температуре 500°С, атмосферном давлении и естественной влажности до постоянной массы. Полученный материал промывали дистиллированной водой и подвергали термообработке при 105°С.
МСК костного мозга. Клетки выделяли из плоских костей таза новорожденного кролика, высевали (1 ⋅ 106 кл./см2) на чашки Петри и культивировали в среде αMEM (Sigma, США), содержащей 10% эмбриональной бычьей сыворотки (Gibco, США) и смесь пенициллина и стрептомицина (Invitrogen, Великобритания), при 5% СО2 и температуре 37°С. В экспериментах использовали клетки 2–6 пассажей.
Метод Бренауэра–Эммета–Тейлора (БЭТ). Удельную поверхность ГА измеряли с помощью анализатора поверхности NOVA-1200e (США). Перед началом измерений матрицу измельчали до частиц размером около 1 мм. Измельченный образец матрицы массой не меньше 200 мг помещали в ячейку и дегазировали в течение 1.5 ч, используя соответствующий режим прибора. По разнице масс ячейки после дегазации и пустой ячейки находили массу высушенного дегазированного образца. Далее ячейку помещали в сосуд Дьюара с жидким азотом и при давлении 30 мм. рт.ст. снимали изотерму адсорбции.
МТТ-тест. Жизнеспособность клеток оценивали с помощью МТТ-теста. Для эксперимента частицы ГА концентрацией 0.3 г/мл инкубировали в среде αMEM в течение 5 сут. Среду с частицами вносили в лунки 96-луночной платы, куда потом сеяли МСК (по 3 тыс. на лунку) и добавляли 10% эмбриональной бычьей сыворотки. В качестве контроля использовали клетки, культивируемые в ростовой среде с сывороткой без частиц ГА. Количество жизнеспособных клеток оценивали после окраски МСК раствором MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) (Sigma, США). МТТ растворяли в среде αMEM до конечной концентрации 5 мг/мл, вносили в лунку и оставляли на 2 ч. Через 2 ч экспозиции при 5% СО2 и температуре 37°С живые клетки восстанавливали желтый МТТ до темно-фиолетовых гранул формазана. Гранулы формазана растворяли диметилсульфоксидом (Sigma, США) и измеряли оптическую плотность раствора на иммуноферментном анализаторе (“Флюорофот”, ПРОБАНАУЧПРИБОР, Россия) на длине волны 570 нм.
Лазерная сканирующая микроскопия. Для оценки морфологии клеток в присутствии гидроксиапатита МСК окрашивали родамин-фаллоидином для выявления актинового цитоскелета. Частицы ГА в концентрации 0.3 г/мл предварительно инкубировали в среде αMEM в течение пяти суток. Затем ростовую среду с частицами ГА вносили в чашку Петри с покровным стеклом, на которое сеяли МСК (10 тыс.) и добавляли 10% эмбриональной бычьей сыворотки. В качестве контроля использовали клетки, культивируемые в ростовой среде с сывороткой без частиц ГА. По истечении одних суток культивирования неприкрепившиеся клетки удаляли, прикрепившиеся МСК промывали раствором PBS (Биолот, Россия) и фиксировали в 4%-ном растворе формалина (Sigma, США), затем добавляли раствор 0.1%-ного тритона Х-100 (Sigma, США) и раствор родамина фаллоидина (10 ед/мл) (Invitrogen, Великобритания). После каждой обработки препараты трижды промывали PBS. Ядра окрашивали DAPI (Invitrogen, Великобритания). Актиновые филаменты визуализировали с помощью сканирующего лазерного конфокального микроскопа (LSM 5 Pascal, Германия).
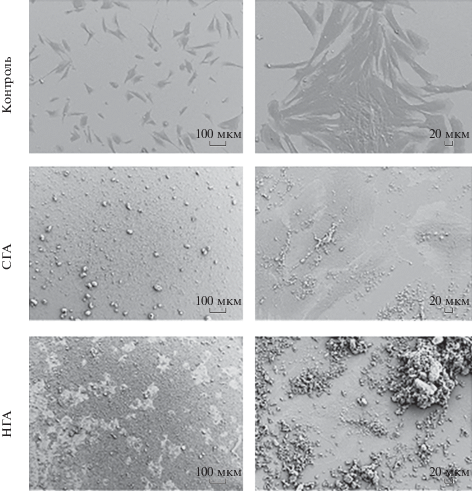
Сканирующая электронная микроскопия. Морфологию клеток после семи суток культивирования оценивали с помощью сканирующей электронной микроскопии (СЭМ). Образцы фиксировали 1%-ным раствором глутарового альдегида с последующей обработкой раствором этилового спирта. После фиксации на образцы напыляли тонкий слой платины и исследовали с помощью сканирующего электронного микроскопа “SUPRA 55VP” (“Carl Zeiss”).
Статистическая обработка результатов. Статистическую обработку результатов, полученных в пяти повторениях экспериментов, обрабатывали в программе “Microsoft Excel 2007”, определяя среднее значение и стандартную ошибку среднего. Для сравнения результатов использовали t-критерий Стьюдента. Различия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ
Структурные свойства наночастиц ГА. При анализе СЭМ-изображений можно сделать заключение, что размеры НГА варьируются в широком диапазоне – от десятков до нескольких сот нанометров. На рис. 1 видно, что НГА в отличие от СГА собираются в конгломераты, причем доля конгломератов значительно выше доли наночастиц, размер которых не превышает несколько нанометров. Также эти конгломераты имеют плотную структуру в отличие от рыхлой пористой структуры СГА, который состоит из наночастиц размером не более 10 нм.
Методом БЭТ были определены удельная поверхность и пористость частиц ГА, которые представлены в табл. 1. Из таблицы видно, что удельная поверхность и объем пор, занимаемых наночастицами СГА, более чем в 3 раза превышает аналогичные параметры для наночастиц НГА.
Таблица 1.
Удельная поверхность и пористость частиц гидроксиапатита
| Гидроксиапатит | Объем пор, см3/г | Удельная поверхность, м2/г |
|---|---|---|
| Синтетический | 0.19 | 69.3 |
| Нативный | 0.05 | 13.6 |
Оптическая микроскопия. Важным параметром, влияющим на свойства клеток, в том числе на их морфологию, является количество наночастиц ГА, взаимодействующих с клетками, или концентрация наночастиц в ростовой среде. Для оценки влияния концентрации наночастиц на МСК в культуральную среду одновременно с посевом клеток вносили разное количество наночастиц ГА – 5, 10 и 20%. По истечении одних суток после посева МСК в контрольном образце имеют типичную для этого типа клеток вытянутую веретеновидную форму (рис. 2). При добавлении в культуральную среду разного количества наночастиц СГА вся поверхность культуральной чашки равномерно покрывается частицами. Независимо от концентрации частиц в инвертированном оптическом микроскопе присутствия клеток не наблюдали, что свидетельствует о том, что или все клетки покрыты наночастицами СГА, или при одновременном внесении в культуральную чашку суспензии МСК и наночастиц СГА клетки не адгезируют на поверхности культурального сосуда.
Рис. 2.
Микрофотографии МСК в присутствии наночастиц ГА после одних суток культивирования. 5, 10 и 20% – концентрация частиц ГА в питательной среде.

При одновременном внесении в культуральную чашку МСК и наночастиц НГА с помощью оптической микроскопии среди осевших частиц НГА можно наблюдать адгезировавшие и распластанные клетки веретеновидной формы. Отметим, что при всех трех концентрациях НГА в инвертированный микроскоп видны клетки среди осевших частиц (светлые поля). В образцах с содержанием НГА 5% можно оценить веретеноподобную структуру МСК (рис. 2).
Лазерная сканирующая микроскопия. Для оценки морфологических особенностей МСК, культивируемых в присутствии наночастиц ГА, питательную среду вместе с частицами удаляли, а клетки фиксировали и окрашивали флуоресцентным красителем. Результаты лазерной сканирующей микроскопии представлены на рис. 3. После одних суток культивирования клетки в контрольном образце хорошо распластаны. На рис. 3 видны хорошо сформированные нити актина по всей площади распластанной клетки. В присутствии СГА количество адгезировавших клеток по истечении одних суток после посева существенно уступает контролю. В поле зрения микроскопа видно только несколько клеток. Степень распластанности этих клеток также уступает контролю, клетки в большинстве округлые и актин сосредоточен в приядерной области. При описании клеток, культивируемых в присутствии НГА, наблюдали достаточно большое количество хорошо распластанных МСК на поверхности культурального сосуда в присутствии 5% НГА. Внешний вид клеток и их количество в этом образце не отличаются от контрольного образца – без наночастиц ГА. При увеличении концентрации НГА в культуральной среде до 10% количество прикрепившихся к культуральному пластику клеток существенно уменьшается. В поле зрения наблюдали только несколько клеток, имеющих веретеновидную форму, типичную для данного типа клеток, в отличие от клеток, культивируемых в присутствии такого же количества СГА. При увеличении концентрации СГА в культуральной среде до 20% количество прикрепившихся клеток и их морфология аналогичны клеткам, культивируемым в присутствии 10% СГА (рис. 3).
Рис. 3.
Организация актинового цитоскелета МСК после одних суток культивирования в присутствии частиц ГА (окраска родамин-фаллоидином – красный, DAPI – синий); 5, 10 и 20% – концентрация частиц ГА в ростовой среде.

Сканирующая электронная микроскопия. Оценку непосредственного контакта клеток с частицами ГА проводили с помощью СЭМ (рис. 4). После одних суток культивирования культуральную среду удаляли, а клетки фиксировали. Данные СЭМ подтверждают результаты, полученные с помощью оптической и конфокальной микроскопии. При совместном культивировании клеток и СГА при небольшом увеличении наблюдали полное покрытие СГА всей поверхности чашки. Отметим, что СГА также частично собирается в конгломераты, о чем свидетельствуют частицы, размеры которых достигают нескольких десятков микрон. При совместном культивировании МСК с НГА с помощью СЭМ визуализировали поверхность чашки, которая покрыта частицами дискретно. Причем области, не покрытые частицами, занимают распластанные клетки. При более детальном изучении адгезировавших и распластанных клеток наблюдали МСК, покрытые частицами ГА как природного, так и синтетического происхождения. В присутствии НГА клетки покрыты крупными конгломератами, а при внесении СГА клетки покрыты более мелкими частицами.
МТТ-анализ. Количественную оценку жизнеспособности МСК, культивируемых в присутствии частиц ГА, проводили с помощью МТТ-анализа. По истечении 1 и 6 сут культивирования клетки обрабатывали раствором МТТ. Формазон, образующийся в живых клетках, определяли спектрофотометрически. На рис. 5 видно, что присутствие наночастиц ГА в культуральной среде незначительно снижает адгезионную способность МСК к культуральному пластику. При дальнейшем культивировании наблюдали незначительный цитотоксический эффект СГА на культивируемые клетки. После шести суток культивирования количество клеток в присутствии СГА уступает количеству клеток в контрольном образце. Пролиферация МСК в присутствии НГА не отличается от контроля.
ОБСУЖДЕНИЕ
Химический состав и кристаллическая структура наночастиц ГА аналогичны микроструктуре натуральных костей и зубов [24, 25]. Именно структура ГА придает особые биологические характеристики, такие как неиммуногенность, хорошая биосовместимость, высокая остеокондуктивность и остеоиндуктивность [26–28]. Многочисленные исследования продемонстрировали отличную биосовместимость ГА с различными клеточными культурами. В [29, 30] представлены результаты влияния размера наночастиц на адгезию и пролиферацию клеток. Однако, как показало настоящее исследование, не только структурные характеристики и размеры наночастиц влияют на культивируемые клетки, но и совместное культивирование клеток и частиц ГА, а также происхождение частиц.
Результаты, полученные с помощью прямых методов диагностики: электронной, оптической и конфокальной микроскопии, демонстрируют идентичную зависимость поведения клеток от вида ГА. При культивировании МСК в присутствии СГА частицы полностью покрывают поверхность чашки вместе с клетками. При внесении в чашку МСК вместе с НГА наблюдается дискретное распределение частиц по поверхности чашки. Даже с помощью инвертированного микроскопа можно фиксировать распластанные клетки между частицами НГА. Полученные результаты могут быть объяснены двумя процессами. Первая причина дискретного распределения НГА на поверхности культуральной чашки связана с интенсивным взаимодействием МСК с частицами НГА. Клетки активно раздвигают частицы НГА, оседающие из питательной среды на поверхность культурального сосуда. При этом в чашках с СГА такой картины не наблюдается, что может быть причиной отсутствия какого-либо взаимодействия клеток с СГА. Второе предположение заключается в разной скорости осаждения частиц различного происхождения и соотношении этой скорости со скоростью осаждения клеток. Такой механизм, по-видимому, наиболее объективно описывает полученные результаты. При одновременном посеве клеток и СГА первыми на поверхность культуральной чашки оседают клетки, и наночастицы СГА покрывают клетки после их распластывания. Поэтому с помощью оптической и сканирующей электронной микроскопии можно наблюдать только поверхность культуральной чашки, которая полностью покрыта частицами.
При одновременном внесении в культуральную чашку МСК и НГА более тяжелые частицы природного ГА первыми оседают на поверхность чашки, а оседающие за ними клетки способны “раздвинуть” частицы НГА. Разная скорость осаждения частиц, полученных из разных источников, подтверждает данные БЭТ и СЭМ. Удельная поверхность и объем пор у СГА более чем в 3 раза меньше, чем при аналогичных параметрах для НГА. Чем больше удельная поверхность частиц и объем пор, тем меньше плотность, следовательно, более легкие частицы имеют меньшую скорость осаждения. Очевидно, что эта скорость осаждения меньше скорости осаждения самих клеток. Выдвинутые предположения требуют дальнейших исследований. На основании полученных результатов можно сделать вывод, что в присутствии НГА количество жизнеспособных клеток больше по сравнению с МСК, культивируемых вместе с СГА.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-73-30003).
Список литературы
Zhou H., Lee J. // Acta. Biomater. 2011. V. 7. P. 2769. https://doi.org/10.1016/j.actbio.2011.03.019
Chen L., Mccrate J.M., Lee J.C.-M., Li H. // Nanotechnology. 2011. V. 22. P. 105708. https://doi.org/10.1088/0957-4484/22/10/105708
Matsumine A., Kusuzaki K., Matsubara T. et al. // J. Surg. Oncol. 2006. V. 93. P. 212. https://doi.org/10.1002/jso.20355
Dorozhkin S.V., Epple M. // Angew. Chem. Int. Ed. Eng. 2002. V. 41. P. 3130. https://doi.org/10.1002/1521-3773(20020902)
John L., Janeta M., Szafert S. // Mater. Sci. Eng. C. 2017. V. 78. P. 901. https://doi.org/10.1016/j.msec.2017.04.133
Brunton P.A., Davies R.P., Burke J.L. et al. // Br. Dent. J. 2013. V. 215. P. E6. https://doi.org/10.1038/sj
Okada M., Furuzono T. // Sci. Technol. Adv. Mater. 2012. V. 13. P. 064103. https://doi.org/10.1088/1468-6996/13/6/064103
Zhao X.-Y., Zhu Y.-J., Chen F. et al. // Cryst. Eng. Commun. 2013. V. 15. P. 7926. https://doi.org/10.1039/C3CE41255E
Kolodziejczyk M., Smolen D., Chudoba T. et al. // Tissue Eng. Regener. Med. 2014. V. 8. P. 235.
Bilton M., Milne S.J., Brown A.P. // J. Inorg. Non-Met. Mater. 2012. V. 2. P. 1. https://doi.org/10.4236/ojinm.2012.21001
Abidi S.S.A., Murtaza Q.J. // Mater. Sci. Technol. 2014. V. 30. P. 307. https://doi.org/10.1016/j.jmst.2013.10.011
Smolen D., Chudoba T., Malka I. et al. // Int. J. Nanomed. 2013. V. 8. P. 653. https://doi.org/10.2147/ijn.s39299
Nayak A.K. // Int. J. Chem. Technol. Res. 2010. V. 2. P. 903.
Šupová M. // J. Nanosci. Nanotechnol. 2014. V. 14. P. 1. https://doi.org/10.1166/jnn.2014.8895
Zhao X., Ng S., Heng B.C. et al. // J. Arch. Toxicol. 2013. V. 87. P. 1037. https://doi.org/10.1007/s00204-012-0827-1
Wiesner M.R., Lowry G.V., Alvarez P. et al. // Environ. Sci. Technol. 2006. V. 40. P. 4336. https://doi.org/10.1021/es062726m
Maynard A.D., Aitken R.J., Butz T. et al. // Nature 2006. V. 444. P. 267. https://doi.org/10.1038/444267
Motskin M., Wright D.M., Muller K. et al. // Biomaterials. 2009. V. 30. P. 3307. https://doi.org/10.1016/j.biomaterials.2009.02.044
Chen L., Mccrate J.M., Lee J.C.-M., Li H. // Nanotechnology. 2011. V. 22. P. 105708. https://doi.org/10.1088/0957-4484/22/10/105708
Нащекина Ю.А., Чабина А.С., Осмоловская и др. // Цитология. 2018. № 10. С. 813.
Idaszek J., Kijeńska E., Łojkowski M., Swieszkowski W. // Appl. Surf. Sci. 2016. V. 388. P. 762. https://doi.org/10.1016/j.apsusc.2016.03.038
Kijeńska E., Zhang S., Prabhakaran M.P. et al. // Int. J. Polym. Mater. Polym. Biomater. 2016. V. 65. P. 807. https://doi.org/10.1080/00914037.2016.1163561
Добровольская И.П., Царев Н.С., Осмоловская О.М. и др. // Журн. прикл. химии. 2018. Т. 91. С. 328.
Webster T.J., Ergun C., Doremus R.H. et al. // Biomaterials. 2001. V. 22. P. 1327. https://doi.org/10.1016/s0142-9612(00)00285-4
Hench L.L., Polak J.M. // Science. 2002. V. 295. P. 1014. https://doi.org/10.1126/science.1067404
Cai Y., Liu Y., Yan W. et al. // J. Mater. Chem. 2007. V. 17. P. 3780.
Kalita S.J., Bhardwaj A., Bhatt H.A. // Mater. Sci. Eng. C. 2007. V. 27. P. 441.
Tran N., Webster T.J. // Acta. Biomater. 2011. V. 7. P. 1298. https://doi.org/10.1016/j.actbio.2010.10.004
Laranjeira M.S., Fernandes M.H., Monteiro F.J. // J. Biomed. Mater. Res. A. 2010. V. 95. P. 891. https://doi.org/10.1002/jbm.a.32916
Chen L., Mccrate J.M., Lee J.C.M., Li H. // Nanotechnol. 2011. V. 22. P. 105708. https://doi.org/10.1088/0957-4484/22/10/105708
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии