Российские нанотехнологии, 2020, T. 15, № 4, стр. 513-522
КРАТКОСРОЧНОЕ ВВЕДЕНИЕ НАНОЧАСТИЦ ФУЛЛЕРЕНА С60 В ТОНКУЮ КИШКУ КРЫСЫ ИНДУЦИРУЕТ БЫСТРОЕ РАЗВИТИЕ ПАТОЛОГИИ ГЕПАТОЦИТОВ
А. Г. Масютин 1, 3, *, М. В. Ерохина 1, 3, В. А. Шипелин 2, 4, И. В. Гмошинский 2, Г. Е. Онищенко 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Федеральный исследовательский центр питания, биотехнологии и безопасности пищи
Москва, Россия
3 Центральный научно-исследовательский институт туберкулеза
Москва, Россия
4 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: imber.acidis@gmail.com
Поступила в редакцию 30.06.2020
После доработки 31.08.2020
Принята к публикации 09.09.2020
Аннотация
Фуллерены С60 применяются в различных областях промышленности, в связи с чем актуальны вопросы изучения их биобезопасности для живых организмов, биораспределения по органам и тканям лабораторных животных и индукции ими клеточных патологий. В последние годы эффективность в выявлении углеродных наночастиц в биологических образцах показали методы аналитической и трансмиссионной электронной микроскопии (ТЭМ). Комбинация этих методов позволяет выявить индуцируемые наночастицами патологические изменения в клетках и детектировать в них скопления наночастиц. Целью работы было выявить клеточные патологии при прямом краткосрочном введении наночастиц фуллерена С60 в желудочно-кишечный тракт (ЖКТ) крыс и провести детекцию наночастиц в образцах тонкой кишки и печени. Гистологический и ультраструктурный анализ не выявил патологических изменений в тонкой кишке, но были показаны дистрофические изменения гепатоцитов в виде накопления липидных включений. Методы высокоэффективной жидкостной хроматографии и аналитической ТЭМ не выявили скоплений наночастиц фуллерена С60 в исследуемых образцах. Вероятно, гепатостеатоз может являться следствием непрямого воздействия наночастиц С60 на клетки печени. По-видимому, в ЖКТ происходит модификация поверхности фуллерена С60 и его контакт с клетками тонкого кишечника индуцирует синтез провоспалительных цитокинов с их последующим попаданием в печень, приводя к быстрому развитию жировой дистрофии. Выявление и идентификация модифицированных наночастиц С60 и их метаболитов, в свою очередь, являются сложной задачей, которая в перспективе может быть решена с использованием метода меченых атомов, масс-спектрометрии и современных метаболомных технологий.
ВВЕДЕНИЕ
Фуллерены и их производные находят широкое применение в различных областях промышленности в качестве компонентов лекарственных препаратов (в том числе противовирусного действия) [1], агрохимикатов [2, 3] и предлагаются для использования в качестве пищевых добавок [4, 2 ]. Для более широкого внедрения фуллеренов необходимо получение более точных данных об их биораспределении по органам и тканям лабораторных животных и вызываемых клеточных патологиях.
Проникновение фуллерена С60 в организм зависит от целого ряда факторов, таких как размер частиц, путь их поступления и способность к преодолению биологических барьеров, состав раствора, а также наличие модификаций в структуре молекулы С60 [5]. Последнее обусловлено высокой реакционной способностью фуллерена С60 в реакциях присоединения нуклеофилов [6].
На модели внутрибрюшинного введения было показано, что нативные фуллерены С60 могут обнаруживаться в печени в клетках Купфера, клетках Ито и в гепатоцитах, но при этом не оказывают значимого токсического эффекта [6], за исключением накопления липидов в звездчатых клетках. В свою очередь, модифицированные молекулы фуллерена С60 могут оказывать токсический эффект: 25 мг/кг метанофуллеренов являются летальной дозой для крыс. Также известно, что некоторые виды модифицированных С60 могут оказывать влияние на иммунную систему [7].
В последние годы эффективность в выявлении наночастиц различной химической структуры в биологических образцах демонстрируют методы трансмиссионной электронной микроскопии высокого разрешения, а также аналитической электронной микроскопии [8, 9]. Последняя включает в себя совокупность методов, дающих информацию о химических свойствах образца [10]. К ним относятся дифракция электронов, позволяющая детектировать и идентифицировать кристаллические структуры [11], и другие методы, основанные на различных типах взаимодействия пучка электронов с образцом. Комбинация этих методов может позволить одновременно выявить индуцируемые наночастицами патологические изменения в клетках и тканях и детектировать в них скопления наночастиц [12, 13]. Таким образом, целью данной работы было выявить клеточные патологии в органах крысы при прямом краткосрочном введении наночастиц фуллерена С60 в желудочно-кишечный тракт, а также провести детекцию фуллерена С60 методами аналитической высокоразрешающей электронной микроскопии.
МАТЕРИАЛЫ И МЕТОДЫ
Наноматериал. В работе использовали промышленные частицы “Фуллерен С60” (чистота 99.8%, производства ЗАО “Фуллерен-центр”, Нижний Новгород), в качестве диспергирующего агента использовали 2 мас. % водного раствора пищевого кукурузного крахмала (КЗ “Гулькевичский” Россия). Концентрация фуллерена С60 в дисперсионной среде составила 3 мг/мл. Перед введением раствор обрабатывали в течение 3 мин на ультразвуковом процессоре Ultrasonic processor (произв. Cole-Parmer, США) с водяным охлаждением при мощности импульса 30 Вт/мл и частоте 20 кГц.
Ход эксперимента. Эксперимент проведен на 12 крысах-самцах аутбредной линии Wistar (по шесть животных в контрольной и экспериментальной группах), полученных из питомника “Столбовая” средней массой тела 194 ± 4 г (M ± m), содержавшихся в виварии ФГБУН “ФИЦ питания и биотехнологии” в условиях потребления стандартного сбалансированного рациона для грызунов и обратноосмотической воды без ограничений. Исследование на животных выполняли после 16-часового голодания. 1 г гексенала растворяли в 20 мл физиологического раствора и вводили животным внутрибрюшинно 5%-ный раствор в количестве 0.3 мл. После наступления наркоза вскрывали брюшную полость, делали разрез вдоль белой линии живота, находили подвздошную кишку. Далее выделяли участок подвздошной кишки длиной 5–5.5 см и изолировали его путем накладывания лигатур сперва проксимально (затягивается полностью), затем дистально (затягивается после введения раствора композиции фуллерена С60, контрольного раствора крахмала или физиологического раствора). Наложение лигатур проводили осторожно, не затрагивая крупных сосудов брыжейки и нервных сплетений. Объем вводимого раствора составил 1 см3, затем брюшную полость зашивали. Через 3 ч после введения суспензии крыс под действием 1.5 мл раствора гексенала умерщвляли обескровливанием. На гистологический анализ и электронную микроскопию отбирали по фрагменту от кишки и печени. На анализ методом высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания фуллерена С60 брали остаточную часть печени. Контрольным животным вводили суспензию крахмала.
Культивирование макрофагальных клеток для детекции С60. Использовали THP-1 – клетки острой моноцитарной лейкемии человека (Российская коллекция клеточных культур, Санкт-Петербург). Клетки культивировали в среде RPMI-1640 с добавлением 2 мМ L-глутамина, 10%-ной эмбриональной телячьей сыворотки (HyClone, США) при 37°С и 5% СО2. Макрофагальную дифференцировку индуцировали добавлением 100 нМ форболового эфира (Sigma, США). На третьи сутки дифференцировки добавляли суспензию С60 в концентрации 50 мкг/мл и фиксировали клетки через 12 ч.
Световая микроскопия. Гистологические препараты изготавливали по стандартной методике: кусочки печени и тонкой кишки фиксировали формалином на фосфатном буфере, обезвоживали в спиртах восходящей концентрации и заключали в парафин. Парафиновые блоки нарезали на микротоме, полученные срезы окрашивали гематоксилином и эозином и заключали в канадский бальзам.
Срезы из эпоксидных блоков толщиной 1 мкм изготавливали на пирамитоме LKB Pyramitome 11800, оборудованном стеклянным ножом, и окрашивали 1%-ным водным раствором метиленового синего и 1%-ным водным раствором тетраборнокислого натрия. Анализ препаратов проводили под микроскопом Leiсa DM 1000.
Трансмиссионная электронная микроскопия. Объекты фиксировали 2.5%-ным глутаровым альдегидом (Ted Pella, INC) на 0.1 М фосфатном буфере в течение 2 ч. Далее отмывали от фиксатора и дофиксировали 1%-ным раствором тетраоксида осмия (OsO4) в течение 2 ч при +4°С. Обезвоживание образцов проводили в спиртах восходящей концентрации и ацетоне, после чего заключали в эпоксидную смолу (Epoxy embedding medium for microscopy, Fluka, Швейцария). Срезы с полученных блоков получали на ультрамикротоме (Leica, Германия) и окрашивали по Рейнольдсу. Полученные препараты исследовали с помощью аналитического электронного микроскопа “JEM 2100” (Jeol, Япония).
Дифракция электронов. Детекцию наночастиц фуллеренов С60 проводили с помощью аналитического электронного микроскопа JEM-2100 (Jeol, Япония). Для аналитического исследования использовали срезы толщиной 80–100 нм, помещенные на медные сеточки.
Для поиска электронно-плотных кристаллических объектов использовали режим темного поля.
Методика оценки биораспределения фуллерена С60 с использованием ВЭЖХ. Содержание С60 исследовали в гомогенатах печени крыс, приготовленных на 0.154 М KCl в 0.05 М Трис-HCl-буфере, рН 7.4, в соотношении 1:4 (масса:объем). Методика экстракции С60 из внутренних органов и его определения с использованием метода ВЭЖХ на обращенной фазе была подробно описана в [14]. Количественный анализ С60 проводили с использованием системы ВЭЖХ Agilent 1200 с колонкой “ZORBAX C18” (размер 4.6 × 150 мм, заполненной С18 фазой с размером гранул 5 мкм) и программного обеспечения для обработки хроматограмм ChemStation B02.03. Для построения стандартного графика готовили растворы С60 в толуоле следующих концентраций: 0.1, 0.075, 0.05, 0.02, 0.01, 0.005, 0.002, 0.001, 0.0005, 0.0002, 0.0001 мг/мл. Каждый образец экстракта и контроля вводили в систему ВЭЖХ в объемах 10 и 100 мкл и анализировали в двух повторах.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ ультраструктуры энтероцитов тонкой кишки крыс и гепатоцитов печени после воздействия наночастиц фуллерена С60. Методика введения в изолированный участок подвздошной кишки является классической при изучении процессов всасывания нативных наночастиц [15]. Анатомические и гистологические особенности этого отдела кишечника являются оптимальными для изучения проникновения именно нативных наночастиц фуллерена С60, так как в этом участке нет прямого сообщения с крупными желчными протоками и наночастицы не подвергаются воздействию желчи и основных кишечных ферментов. Токсины, образующиеся в кишечнике, всасываются в кровь и обезвреживаются в печени.
Гистологический анализ подвздошной кишки экспериментальных животных показал, что ворсинки кишки не деформированы и в них не выявляются патологические изменения. Основу ворсинок составляет соединительная ткань собственной пластинки слизистой оболочки. Соединительная ткань содержит небольшое количество гладкомышечных клеток. Повышенной инфильтрации лейкоцитарными клетками не наблюдается. Бокаловидные клетки располагаются на кишечных ворсинках поодиночке среди энтероцитов, достоверных различий между контрольными и опытными образцами не выявлено (рис. 1а, 1б).
Рис. 1.
Подвздошная кишка крыс после введения фуллерена С60. Ворсинки кишки, окраска гематоксилином и эозином: а – контроль, б – через 3 ч контакта с суспензией С60; ультраструктура энтероцитов, трансмиссионная электронная микроскопия, контрастирование по Рейнольдсу: в – контрольный образец, г – энтероциты после контакта с С60; д – микроворсиночная область, контроль, е – область микроворсинок после контакта с С60; ж – клеточные контакты соседних энтероцитов, контроль, з – клеточные контакты энтероцитов после контакта с суспензией С60.
Электронно-микроскопический анализ тонкой кишки контрольных и экспериментальных животных показал, что энтероциты демонстрируют типичное для этих клеток строение: клетки поляризованные, ядра имеют вытянутую форму и расположены в базальной области клеток, в околоядерном пространстве локализованы цистерны комплекса Гольджи (рис. 1в, 1г). На апикальной поверхности клеток расположены многочисленные микроворсинки (рис. 1д, 1е). Зона контактов представлена плотными, щелевыми контактами и десмосомами (рис. 1ж, 1з). Ультраструктурных изменений в энтероцитах при краткосрочном введении фуллерена С60 выявлено не было.
Стандартный гистологический анализ образцов печени экспериментальных и контрольных животных показал, что паренхима печени образована печеночными дольками, основу которых образуют гепатоциты, расположенные тяжами. Все дольки соединены между собой междольковой, межсегментарной соединительной тканью (рис. 2а, 2б). При исследовании обнаружены дистрофические изменения в гепатоцитах во всех опытных образцах печени крыс в виде образования жировых капель разного размера (рис. 2в). На полутонких срезах жировые капли выявляются при контрастировании материала тетраоксидом осмия (рис. 2г).
Рис. 2.
Жировая дистрофия гепатоцитов после краткосрочного введения фуллерена С60 в тонкую кишку крыс: а, в – окрашивание гематоксилином и эозином, б, г – окрашивание метиленовым синим и контрастирование OsO4: а, б – контроль, в, г – печень крысы через 3 ч после инъекции С60 в тонкий кишечник. Световая микроскопия.

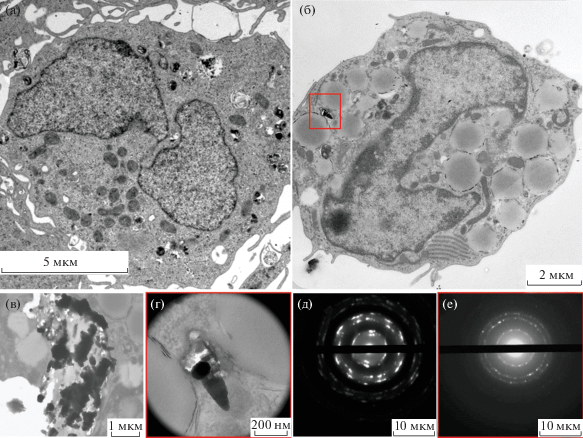
При ультраструктурном исследовании выявлено, что в отличие от ядер округлой формы в гепатоцитах контрольных животных (рис. 3а) ядра гепатоцитов экспериментальных животных деформированы и имеют многочисленные впячивания ядерной оболочки, в результате чего приобретают извилистую форму (рис. 3б). В цитоплазме гепатоцитов локализованы многочисленные жировые включения разного размера (от 500 нм до 5 мкм) (рис. 3в) и выявляются отдельные зоны с набухшими митохондриями (рис. 3г). Такие митохондрии характеризуются пониженной электронной плотностью, наблюдается набухание матрикса и разрушение крист.
Рис. 3.
Ультраструктура гепатоцитов печени, трансмиссионная электронная микроскопия, окрашивание по Рейнольдсу: а – контрольный образец через 3 ч после введения физиологического раствора, б – опытный образец, через 3 ч после введения суспензии фуллеренов С60, в – скопление липидных капель в гепатоцитах экспериментальных животных, г – набухание митохондрий в гепатоцитах экспериментальных животных.

Таким образом, методы световой и электронной микроскопии подтвердили появление патологических изменений в гепатоцитах печени и их отсутствие в энтероцитах подвздошной кишки.
ДЕТЕКЦИЯ АГРЕГАТОВ И СКОПЛЕНИЙ НАНОЧАСТИЦ ФУЛЛЕРЕНА С60 В ОРГАНАХ КРЫСЫ
Выявление наночастиц фуллерена С60 в печени методом ВЭЖХ. Высокоэффективная жидкостная хроматография является основным методом детекции фуллерена С60 в биологических образцах [16–18]. Метод основан на гидрофобных взаимодействиях молекул фуллерена с неподвижной С18-фазой в потоке более гидрофильного растворителя. Проточное детектирование фуллерена осуществляется по его оптической плотности при длине волны 340 нм. Как видно из представленных данных калибровки С60 (рис. 4а, 4б), стандартный график, полученный в интервале концентраций фуллерена от 10 до 100 нг/мм3, является нелинейным с “изломом” в окрестности концентрации 50 нг/мм3. Таким образом, имеет место кажущееся отклонение от закона Ламберта–Бера, связанное, вероятно, с образованием при концентрации более 50 нг/мм3 мультимолекулярных агрегатов (мицелл) фуллерена в подвижной фазе, имеющих меньший коэффициент экстинкции при выбранной длине волны, чем истинный (молекулярный) раствор фуллерена, стабильный при меньших концентрациях. Для высоких концентраций фуллерена С60 (от 20 и до 1000 нг в образце) стандартный график является линейным, т.е. закон Ламберта–Бера в точности соблюдается. Хроматограмма контрольного образца С60, снимаемая после серии анализов каждого опытного образца, представлена на рис. 4в. Результаты ВЭЖХ анализа экстрактов из органов животных опытной группы показали отсутствие С60 в исследованных образцах в пределах чувствительности метода (пример – хроматограмма экстракта печени на рис. 4г).
Рис. 4.
ВЭЖХ-хроматограммы и калибровочные графики С60: а – калибровочный график С60 в толуоле с концентрацией фуллерена от 0.1 до 0.002 мг/мл. Построение графика методом наименьших квадратов (линейная регрессия); б – калибровочный график С60 в толуоле с концентрацией фуллерена от 0.001 до 0.0001 мг/мл; в – пример отсутствия пика С60 на хроматограмме экстракта из печени крыс; г – хроматограмма контрольного образца С60.

Таким образом, исследование образцов печени животных с помощью ВЭЖХ показало отсутствие фуллерена С60 во всех случаях в пределах чувствительности метода. Отметим, что у данного метода есть ограничение – он определяет только фуллерен с химической формулой С60, применяемый при калибровке хроматографической колонки [19, 20]. Однако при биотрансформации фуллерена С60 в биологических средах его гидрофобность и, следовательно, время удержания на колонке изменяются непредсказуемым образом, вследствие чего его детекция методом ВЭЖХ становится невозможной. Это может приводить к занижению содержания наноматериала в экспериментальных клетках и органах. Вопрос о биотрансформации фуллеренов и о возникающих модификациях исследован недостаточно. Так, на образцах цельной крови, гомогенатов и микросомальных фракций печени крыс, в которые добавляли фуллерен С60 в различных концентрациях и изучали при помощи метода ВЭЖХ, было выявлено значительное снижение его концентрации в течение 24 ч, что свидетельствовало о нестабильности фуллерена С60 в биологических средах [14].
ДЕТЕКЦИЯ С60 В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ МЕТОДАМИ ТРАНСМИССИОННОЙ ЭЛЕКТРОННОЙ МИКРОСКОПИИ (ТЭМ)
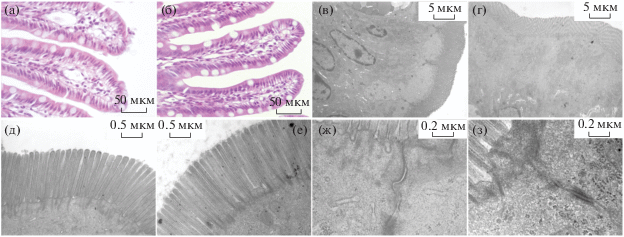
Характеристика наноматериала методами ТЭМ. Известно, что фуллерены С60 представляют собой наноразмерные частицы диаметром около 1 нм, 60 атомов углерода в которых упакованы наподобие формы футбольного мяча и способны упаковываться, формируя моно- и поликристаллы разнообразных размеров и форм. На ультратонких срезах, полученных с наночастиц С60 в эпоксидной смоле, детектируются отдельные агрегаты и скопления фуллерена С60 размером от 10 до 400 нм (рис. 5а, 5б). Применение метода дифракции электронов к наночастицам образца показало, что агрегаты разных размеров дают электронограммы, формирующие яркие центральные кольца и подтверждающие химическую структуру, характерную для фуллерена С60 (рис. 5в, 5г).
Рис. 5.
Характеристика агрегатов С60 методами электронной микроскопии: а – крупный агрегат С60, б – агрегаты С60 средних и мелких размеров; в, г – электронограммы, снятые с агрегатов С60 для а и б соответственно.
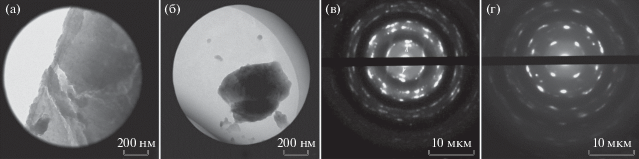
Детекции С60 в биологических образцах методами ТЭМ. Для отработки метода – анализа С60 в биологических образцах методом ТЭМ – была проведена детекция С60 в макрофагах человека линии THP-1 после их инкубации с С60. В отличие от контрольных образцов (рис. 6а) такие макрофаги характеризуются развитием жировой дистрофии – появлением в цитоплазме жировых капель размером 0.5–2 мкм (рис. 6б), выявлены как скопления электронно-плотных частиц (1–10 мкм), так и их отдельные агрегаты (100–200 нм) (рис. 6в, 6г). Методом дифракции электронов данные скопления были идентифицированы как фуллерены С60 (рис. 6д, 6е). Таким образом, в биологических образцах с признаками патологических изменений методом ТЭМ возможно детектировать фуллерен С60 в виде агрегатов размером не менее 100–200 нм.
Рис. 6.
Макрофаги THP-1 после инкубации с фуллеренами С60 в течение 12 ч. Трансмиссионная электронная микроскопия, окрашивание по Рейнольдсу: а – контроль, б – 12 ч инкубации с С60. Рамкой показано электронно-плотное включение С60; в, г – агрегаты С60 разного размера и их электронограммы (д, е).
В результате ультраструктурного исследования энтероцитов методом темного поля в районе микроворсинок были обнаружены только электронно-плотные частицы размером до 10 нм (рис. 7а, показано стрелкой). В цитоплазме энтероцитов электронно-плотных скоплений размером 100–200 нм, которые можно было отнести к агрегатам фуллеренов С60, обнаружено не было. При ультраструктурном исследовании печени были обнаружены только электронно-плотные включения в жировых вакуолях, которые образуются при контрастировании материала тетраоксидом осмия (рис. 7б, показано стрелкой).
Рис. 7.
Электронно-плотные включения в области микроворсинок энтероцитов (а) и жировых вакуолях гепатоцитов (б) экспериментальных животных (фиксация и проводка без контрастирования уранилацетатом).

Практически полное отсутствие накопления фуллерена С60 во внутренних органах, несмотря на значительную липофильность этого соединения и его выраженное влияние на ряд изучаемых показателей, было подтверждено в ряде токсикологических работ [17, 18, 20], в том числе при ежедневном 28- и 92-дневном пероральном введении. При естественном (пероральном) пути поступлении С60 возможна его биодеградация, или биотрансформация, что создает дополнительные сложности для точной оценки содержания С60 в том или ином органе живого организма. Тем не менее введение С60 в заведомо аггравированной дозе в изолированную петлю тонкой кишки крыс в обход воздействия ферментных систем желудка и поджелудочной железы, которые также могут служить причиной биоконверсии С60, не привело к обнаружению С60 во внутренних органах ни при помощи ВЭЖХ, ни ТЭМ. Возможной причиной этого является переход немодифицированной формы С60 в его гидрокисилированные или другие производные, точный состав которых до сих пор не установлен. Данный процесс, как показали результаты проведенных модельных тестов in vitro по изучению биодеградации С60 [14], является достаточно быстрым. По этим причинам выявить присутствие С60 в изученных органах не удалось. При этом биотрансформированные, включая гидроксилированные, производные фуллерена могут продолжать оказывать специфическое биологическое действие на организм, в том числе проявлять токсичность для клеток печени, несмотря на отсутствие видимых признаков наличия исходного C60 в ткани.
Помимо ковалентных и нековалентных модификаций поверхности фуллеренов, возможна их деградация в живых объектах. В [21] показана возможность биодеградации фуллеренов C60 миелопероксидазой через синтез гипохлорита натрия, являющегося сильным биологическим окислителем. Вероятно, модификация или деградация фуллеренов и их производных в зависимости от степени измененности может затруднять их выявление в органах и тканях с помощью спектрометрических методов [22] или электронной микроскопии.
Имеющиеся данные, как правило, описывают благоприятное воздействие С60 на печень и связывают его с антиоксидантными свойствами фуллерена С60. В [23, 24] показана роль С60 в качестве гепатопротектора, снижающего, в том числе, эффект ожирения. Вероятно, развитие жировой дистрофии может объясняться тем, что имеет место непрямое воздействие наночастиц. По-видимому, при высокой концентрации С60 в просвете кишечника клетки последнего могут запускать секрецию цитокинов, включая фактор некроза опухоли – α (TNF-α), интерлейкин-6 (IL-6) и интерлейкин-8 (IL-8). Усиленная продукция TNF-α вызывает развитие жировой дистрофии в печени [25, 26] и дальнейшую продукцию гепатоцитами провоспалительных цитокинов (IL-6, TGF-β). Кроме того, наблюдали патологию митохондрий, что может быть следствием их повреждения в результате воздействия TNF-α [27].
На основании имеющихся данных можно предположить следующую модель воздействия фуллерена С60 на гепатоциты: неалкогольный гепатостеатоз может быть вызван накоплением триглицеридов в печени, а также окислительным стрессом и провоспалительными цитокинами [28]. Вероятно, при взаимодействии суспензии фуллерена С60 с микрофлорой подвздошной кишки молекулы фуллерена могут подвергаться модификации. Согласно данным изучения процессов ферментативного окисления фуллерена in vitro его поверхность может гидроксилироваться [29]. Модифицированные в ходе пребывания в просвете кишки фуллерены, по всей видимости, могут взаимодействовать с М-клетками Пейеровых бляшек. Известно, что гидроксилированные C60 оказывают стимулирующее действие на клетки иммунной системы, усиливая выброс TNF-α [30, 31 ] . TNF-α относится к многофункциональным провоспалительным цитокинам, в [25] внутривенная инъекция данного цитокина приводила к развитию жировой дистрофии печени у крыс в течение 5 ч. По-видимому, контакт суспензии модифицированных С60 с тканями тонкого кишечника может вызывать усиление выброса TNF-α или других провоспалительных цитокинов с их последующим попаданием в кровоток и, соответственно, в печень, приводя таким образом к развитию жировой дистрофии в течение 3 ч после введения суспензии. Ввиду низких концентраций C60, достигаемых в биологических тканях, выявление и идентификация его предполагаемых метаболитов являются сложной задачей, которая в перспективе может быть решена с использованием метода меченых атомов, а также масс-спектрометрии и современных метаболомных технологий.
Авторы выражают благодарность Л.С. Василевской за помощь в проведении эксперимента на изолированной петле кишечника крыс.
Работа выполнена за счет средств субсидии на выполнение государственного задания в рамках Программы фундаментальных научных исследований (тема Минобрнауки России № 0529-2014-0053).
Работа выполнена за счет средств субсидии на выполнение государственного задания в рамках Программы фундаментальных научных исследований (тема Министерства науки и высшего образования Российской Федерации № 0529-2019-0057).
Список литературы
Bakry R., Najam-ul-haq M., Huck C.W. // Int. J. Nanomedicine. 2007. V. 2. № 4. P. 639.
Husen A., Siddiqi K.S. // J. Nanobiotechnology. 2014. V. 12. P. 16. https://doi.org/10.1186/1477-3155-12-16
Zaytseva O., Neumann G. // Chem. Biol. Technol. Agric. 2016. V. 3. P. 1. https://doi.org/10.1186/s40538-016-0070-8
Steffensen I., Alexander J., Binderup M. et al. // Norwegian Scientific Committee for Food Safety. 2010. P. 7.
Shipelin V.A., Gmoshinski I.V., Tutel’yan V.A. et al. // Nanotechnol Russia. 2013. V. 8. P. 810. https://doi.org/10.1134/S1995078013060141
Moussa F., Trivin F., Céolin R. et al. // Fullerene Sci Technol. 1996. V. 4. № 1. P. 21. https://doi.org/10.1080/10641229608001534
Rajagopalan P., Wudl F., Schinazi R.F., Boudinot F.D. // Antimicrob Agents Chemother. 1996. V. 40. № 10. P. 2262.
Shebanova A.S., Bogdanov A.G., Ismagulova T.T. et al. // Biofizika. 2014. V. 59. № 2. P. 284.
Griffiths G. // Encyclopedia of Molecular Cell Biology and Molecular Medicine. 2nd ed. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2006. P. 21.
Botton G., Prabhudev S. // Springer Handbooks. New York. 2019. P. 345.
Glaeser R.M., Thomas G. // Biophys. J. 1969. V. 9. № 9. P. 1073.
Onishchenko G.E., Erokhina M.V., Abramchuk S.S. et al. // Bull. Experimental Biology and Medicine. 2012. V. 154. № 2. P. 265.
Plascencia-Villa G., Starr C.R., Armstrong L.S. et al. // Integr. Biol. 2012. V. 4. № 11. P. 1358. https://doi.org/10.1039/c2ib20172k
Rhodes R.S., Karnovsky M.J. // Lab. Invest. United States. 1971. V. 25. № 3. P. 220.
Yamago S., Tokuyama H., Nakamura E. et al. // Chem. Biol. 1995. V. 2. № 6. P. 385. https://doi.org/10.1016/1074-5521(95)90219-8
Baati T., Bourasset F., Gharbi N. et al. // Biomaterials. 2012. V. 33. № 19. P. 4936. https://doi.org/10.1016/j.biomaterials.2012.03.036
Шипелин В.А., Арианова Е.А., Трушина Э.Н. и др. // Гигиена и санитария. 2012. Т. 2. С. 90.
Volkheimer G. // Adv. Pharmacol. Chemother. 1977. V. 14. P. 163. https://doi.org/10.1016/s1054-3589(08)60188-x
Шипелин В.А., Авреньева Л.И., Гусева Г.В. и др. // Вопросы питания. 2012. Т. 81. № 5. С. 20.
Litasova E.V., Iljin V.V., Sokolov A.V. et al. // Dokl. Biochem. Biophys. 2016. V. 471. № 3. P. 417. https://doi.org/10.1134/S1607672916060119
Pycke B.F., Chao T.C., Herckes P. et al. // Anal. Bioanal. Chem. 2012. V. 404. № 9. P. 2583. https://doi.org/10.1007/s00216-012-6090-8
Halenova T., Raksha N., Vovk T. et al. // Int. J. Obes. 2018. V. 42. № 12. P. 1987. https://doi.org/10.1038/s41366-018-0016-2
Halenova T.I., Vareniuk I.M., Roslova N.M. et al. // RSC Adv. The Royal Soc. Chem. 2016. V. 6. № 102. P. 100046.
Yachi R., Muto C., Ohtaka N. et al. // J. Clin. Biochem. Nutr. 2013. V. 52. № 2. P. 146. https://doi.org/10.3164/jcbn.12-101
Wandrer F., Liebig S., Marhenke S. et al. // Cell. Death. Dis. 2020. V. 11. № 212. https://doi.org/10.1038/s41419-020-2411-6
Mariappan N., Elks C.M., Fink B., Francis J. // Free Radic. Biol. Med. 2009. V. 46. № 4. P. 462. https://doi.org/10.1016/j.freeradbiomed.2008.10.049
Day C.P., James O.F. // Gastroenterology. 1998. V. 114. № 4. P. 842.
Gitsov I., Simonyan A., Wang L. et al. // J. Polymer Sci. A. 2012. № 50. P. 119. https://doi.org/10.1002/pola.24995
Liu Y., Jiao F., Qiu Y. et al. // Nanotechnology. 2009. V. 20. № 41. P. 415102. https://doi.org/10.1088/0957-4484/20/41/415102
Xiang K., Dou Z., Li Y. et al. // Nanosci Nanotechnol. 2012. V. 12. № 3. P. 2169. https://doi.org/10.1166/jnn.2012.5681
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


