Российские нанотехнологии, 2020, T. 15, № 4, стр. 523-531
ВЛИЯНИЕ БЕНТОНИТОВОЙ НАНОГЛИНЫ НА СОСТОЯНИЕ ЗАЩИТНОГО БАРЬЕРА ТОНКОЙ КИШКИ КРЫС В ЭКСПЕРИМЕНТЕ
В. А. Шипелин 1, 2, *, И. В. Гмошинский 1, В. А. Саркисян 1, С. А. Хотимченко 1, 3, Д. Б. Никитюк 1, 3
1 Федеральный исследовательский центр питания и биотехнологии
Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
3 Первый Московский государственный медицинский университет им. И.М. Сеченова
Москва, Россия
* E-mail: v.shipelin@yandex.ru
Поступила в редакцию 30.06.2020
После доработки 21.09.2020
Принята к публикации 21.09.2020
Аннотация
Бентонитовые наноглины широко используются в пищевой промышленности в качестве технологических вспомогательных средств – адсорбентов при очистке растительных масел и производстве напитков. В число разрешенных пищевых добавок входят алюмосиликаты натрия, калия и кальция (Е554–Е556), бентонит (Е558) и каолин (Е559). Данные о пероральной токсичности наноглин (НГ) немногочисленны и противоречивы. Известно, что in vitro нативные и органомодифицированные НГ обладают цитотоксичностью в отношении как нормальных, так и трансформированных клеток животных и человека. Из-за высокой ионообменной и адсорбционной способности НГ могут препятствовать всасыванию в желудочно-кишечном тракте микроэлементов, в частности цинка. Наноглины способны влиять на состав и активность кишечного микробиоценоза. В эксперименте по изучению подострой 92-суточной пероральной токсичности бентонитовой НГ для крыс линии Вистар показано, что НГ в дозе 100 мг/кг м. т. (масса тела) препятствует проникновению через стенку кишки макромолекул куриного овальбумина, который не был выявлен в крови ни у одной из 10 тестированных крыс через 3 ч после его внутрижелудочного введения в дозе 2000 мг/кг м. т. У этих же животных отмечалось достоверное возрастание абсолютной массы тела. Результаты микроскопического исследования слизистой оболочки тонкой кишки показали усиление секреции кишечной слизи с формированием плотного слизистого барьера при дозе НГ 10 мг/кг м. т. и более. В том числе при дозе 10 мг/кг м. т. образование этого барьера происходило с локализацией поверх щеточной каймы энтероцитов с возрастанием числа бокаловидных клеток. При дозе 100 мг/кг м. т. вместе с резким увеличением количества этих клеток образовывался слившийся слой плотной слизи, склеивающий ворсинки в апикальной части. При минимальной из изученных доз НГ (1 мг/кг м. т.) наблюдалось усиление десквамации энтероцитов в апикальной части ворсинок. Морфометрический анализ длины ворсинок и глубины крипт показал, что соотношение ворсинка/крипта при потреблении НГ снижается в сравнении с контролем в пределах 32–34% независимо от дозы наноматериала. Потребление НГ во всем диапазоне изученных доз оказывает негативное влияние на морфофункциональное состояние ворсинок и крипт подвздошной кишки крыс, причем избыточная секреция слизи при дозе НГ 100 мг/кг м. т. может нарушать пристеночное пищеварение и влиять на барьерную и иммунорегуляторную функции кишечника.
ВВЕДЕНИЕ
Слоистые филлосиликаты, в число которых входят бентонитовые наноглины (НГ), содержащие в наноформе минерал монтмориллонит (натриевый 2:1 алюмосиликат), широко используются в пищевой промышленности в качестве технологических вспомогательных средств и входят в состав полимерных композитных материалов для газобарьерной упаковки растительных масел, напитков и др. [1]. Благодаря особенностям своего строения НГ характеризуются высокими адсорбционными и катионообменными свойствами, гидрофильностью, способностью к набуханию в водных средах и особыми реологическими свойствами [2], из-за чего могут снижать в желудочно-кишечном тракте (ЖКТ) биодоступность некоторых микроэлементов, в частности цинка [3]. Бентонит (Е558), как и другие виды глинистых минералов, таких как алюмосиликаты натрия, калия и кальция (Е554–Е556), и каолин (Е559) входят в число разрешенных пищевых добавок11.
В настоящее время НГ являются актуальным объектом токсикологических исследований из-за наличия в их составе алюминия, обладающего общетоксическим и нейротоксическим действием [4, 5]. В исследовании [6] установлено, что содержание алюминия в крови крыс, потреблявших НГ в течение 28 дней, было выше по сравнению с контролем. Авторы сделали вывод, что НГ частично растворяются в просвете кишки с высвобождением алюминия, проникающего через кишечный барьер. Риски, связанные с миграцией алюминия в пищевые продукты из полимерных композиционных упаковочных материалов с НГ, на сегодняшний день недостаточно изучены ввиду отсутствия статистики их использования в пищевой промышленности и могут зависеть от состава композитов и модификации НГ [7, 8].
Существует ряд данных о цитотоксичности НГ in vitro в отношении линий нормальных и трансформированных клеток животных и человека, включая кишечные клеточные линии INT 407 [9], Caco2 [10, 11] и HCT116 [12]. В немногочисленных токсикологических in vivo-исследованиях НГ обладали низкой токсичностью [6, 9, 13–16]. В [13] НГ влияли на состав и соотношение субпопуляций микробиома кишечника крыс, многократно стимулируя рост дрожжевой флоры слепой кишки и снижая функциональную активность симбиотической бифидофлоры. Лишь в нескольких работах проводилась оценка гистопатологических изменений внутренних органов [6, 14–16], а в исследовании [6] под действием НГ наблюдали удлинение апикальных микроворсинок, усиление репликации митохондрий и значительное увеличение толщины кишечных ворсинок, вызванное большими вакуолями у основания энтероцитов.
Эффекты НГ in vivo недостаточно охарактеризованы в диапазонах низких доз, что не исключает наличия эффектов, отсутствующих в условиях высоких доз у большинства наноматериалов, склонных к агрегации в биологических средах. Таким образом, учитывая низкую биодоступность НГ, данные об их воздействии на кишечный микробиом наряду с их способностью связывать различные виды токсинов и препятствовать всасыванию микроэлементов, представляет интерес изучение гистопатологической характеристики слизистой оболочки тонкой кишки и состояния защитного барьера ЖКТ для макромолекул и антигенов энтеральной среды при воздействии НГ. В этой связи целью настоящего исследования являлась оценка проницаемости кишечной стенки для модельного белкового антигена в сочетании с морфофункциональной характеристикой тонкой кишки крыс, получавших НГ в дозах 1–100 мг/кг массы тела (м. т.) в условиях подострого токсикологического эксперимента в течение 92 дней.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика наноматериала. В эксперименте использовали химически модифицированную бентонитовую НГ марки “Монамет 1Н1®” (АО “МЕТАКЛЭЙ”, Россия). Согласно спецификации производителя гидрофильную НГ получали путем физико-химической обработки природного осадочного минерала бентонита и химической обработки специальным модификатором с полярными функциональными группами. Более 90% препарата НГ представлено монтмориллонитом и менее 1% – примесями (кремнезем, кварцевый песок и др.). Для приготовления дисперсий НГ использовали деионизованную воду из установки “Milli-Q” (“Merck”, Германия). Диспергирование НГ в воде осуществляли в течение 20 мин на погружном ультразвуковом (УЗ) процессоре с охлаждением при средней мощности 2 Вт/см3. Введение дисперсии в корм и исследования размеров частиц проводили в течение не более чем 30 мин после УЗ-обработки.
Методом сканирующей электронной микроскопии (СЭМ) проведены исследования структуры нативного препарата НГ и его 1%-ной дисперсии после УЗ-обработки. Образцы наносили тонким слоем на подложку из двухсторонней токопроводящей клейкой ленты. Микрофотографии получали в сканирующем электронном микроскопе AIS 1800C (Seron Technologies Inc, Корея) в режиме вторичных электронов в высоком вакууме. С помощью полученных микрофотографий были рассчитаны критерии размера и формы частиц согласно [17]: эквивалентный диаметр (характеризует средний размер частиц неправильной формы) и эллиптичность (характеризует степень отклонения формы частицы от сферической) по формулам:
эквивалентный диаметр:
эллиптичность: где l – длина частицы, b – ширина частицы.Методика биологического эксперимента. В исследовании использовали крыс линии Вистар, полученных из питомника “Столбовая” ФГБУН “Научный центр биомедицинских технологий ФМБА России”. Работу с животными выполняли в соответствии с правилами надлежащей лабораторной практики22. Методика биологического эксперимента была одобрена комитетом по этике ФГБУН “ФИЦ питания и биотехнологии”. Для эксперимента было сформировано четыре группы по 16 самцов крыс исходной массой 80 ± 10 г. После недельного карантина крысы групп с первой по четвертую получали в условиях неограниченного доступа в течение 92 сут полусинтетический сбалансированный рацион по AIN-93 с добавлением водной дисперсии НГ в расчетных дозах: 0 (контроль), 1, 10 и 100 мг/кг м. т. Количество потребленного корма регистрировали для коррекции дозы НГ в рационе. Массу тела животных измеряли еженедельно на электронных весах с точностью ±1 г. Доступ животных к воде, полученной в установке обратного осмоса “Milli-RO” (“Waters”, США), предоставлялся ad libitum. Животных выводили из эксперимента на 93-е сутки после 16-часового голодания путем обескровливания через нижнюю полую вену под глубокой эфирной анестезией.
Оценка барьерной функции ЖКТ. Барьерную функцию ЖКТ оценивали по величине всасывания макромолекул куриного белка овальбумина (ОВА). Для этого ОВА (пятикратно перекристаллизованный препарат) вводили крысам внутрижелудочно через зонд в виде 20%-ного раствора в 0.15 М NaCl в дозе 2 г/кг м. т. по белку за 3 ч до некропсии, после чего содержание ОВА в сыворотке крови определяли методом двухвалентного твердофазного иммуноферментного анализа [18]. Всасывание ОВА в кровь выражали в процентах от введенной дозы с учетом величины гематокрита, исходя из предположения, что масса крови крысы составляет в среднем 6% от м. т.33
Гистологические исследования. Во время некропсии на секции выделяли подвздошную кишку и немедленно после извлечения фиксировали в растворе 3.7%-ного формальдегида в 0.1 М натрий-фосфатном буфере, рН 7.00 ± 0.05, в течение трех суток, дегидратировали в спиртах восходящей концентрации, пропитывали ксилолом и заливали гомогенизированной парафиновой средой “Histomix”. Парафиновые срезы толщиной 3–4 мкм изготавливали на микротоме “Microm HM355s” (“Leica”, Германия), окрашивали гематоксилином и эозином по стандартной методике [19] и исследовали в микроскопе “AxioImager Zl” (“Zeiss”, Германия) с цифровой фотокамерой при увеличении ×400.
Статистический анализ данных. Статистическую обработку проводили с помощью пакета программы SPSS 22.0. Расчет включал в себя определение выборочного среднего, стандартной ошибки среднего и стандартного отклонения. Вероятность принятия нуль-гипотезы о совпадении распределений сравниваемых выборок устанавливали согласно критериям Манна–Уитни, Краскелла–Уоллиса и ANOVA. Достоверность различий принимали при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Расчет количеств НГ, потребляемых крысами с рационом, показал, что суточные дозы наноматериала 1, 10 и 100 мг/кг м. т. стабильно выдерживались в опытных группах со второй по четвертую соответственно в пределах не более ±15%. Подробно данные о количестве потребленной животными НГ представлены в [20].
Микрофотографии нативного препарата НГ и его 1%-ной водной суспензии, полученные методом СЭМ, представлены на рис. 1а, 1б соответственно. Проведенные гранулометрические расчеты частиц в нативном препарате НГ (рис. 1в) показали, что средний эквивалентный диаметр агрегатов составляет 25.6 мкм с распределением их размеров от 11 до 68 мкм. В результате обработки 1%-ного водного раствора НГ ультразвуком средний эквивалентный диаметр объектов уменьшился до 6.3 мкм (рис. 1г). Гранулометрический анализ показал, что в водной фазе также присутствуют агрегированные частицы эквивалентного диаметра от 2 до 15 мкм.
Рис. 1.
Микрофотографии образцов наноглины, полученные методом СЭМ в микроскопе AIS 1800C: а – нативный препарат, увеличение ×200; б – водный 1%-ный раствор препарата после УЗ-обработки, увеличение ×590; в – график распределения частиц нативного препарата по размерам в поле зрения микроскопа; г – график распределения частиц по размерам в 1%-ном растворе препарата после УЗ-обработки в поле зрения микроскопа.

Гистопатологическая оценка окрашенных гематоксилин-эозином срезов подвздошной кишки с использованием светооптической электронной микроскопии позволила выявить признаки нарушения функции и строения эпителиоцитов подвздошного кишечника крыс под действием НГ во всем диапазоне изученных доз (рис. 2). Во всех опытных группах в периваскулярной зоне собственной пластинки слизистой оболочки отмечалась значительная воспалительная инфильтрация полинуклеарными и мононуклеарными лейкоцитами с примесью эозинофилов. Уже при дозе НГ 1 мг/кг м. т. (рис. 2б) можно наблюдать (табл. 1) достоверное увеличение в сравнении с контролем на 65% количества каемчатых энтероцитов кишечных ворсинок с уплотнением клеточного ряда и изменением формы ядер. Десквамация щеточной каймы с ее последующим разрывом приводила к обнажению стромы кишечных ворсинок. В то же время у животных контрольной группы (рис. 2а) отсутствовали признаки воспаления и десквамации эпителиоцитов, межклеточные контакты не были нарушены, сохранялась нормальная морфология клеток, ворсинки были хорошо развиты и имели в основном правильное строение. В группе 3, получавшей НГ в дозе 10 мг/кг м. т., напротив, происходило формирование плотного слизистого барьера поверх щеточной каймы, в апикальной части ворсинок наблюдались увеличение количества (на 88% в сравнении с группой 1, p < 0.05) и уплотнение ряда каемчатых энтероцитов с уплощением их ядер; на 56% (табл. 1) достоверно возрастало число бокаловидных клеток, продуцирующих слизь (рис. 2в). В группе 4, где животные потребляли рацион, содержащий НГ в максимальной дозе 100 мг/кг м. т., эффекты, аналогичные наблюдаемым в группе 3, усиливались (рис. 2г): толщина надэпителиальных слизистых наложений видимым образом увеличивалась с образованием слившегося слоя слизи, склеивающего ворсинки в апикальной части; наблюдалось достоверное увеличение на 80% (табл. 1) числа бокаловидных клеток и на 136% каемчатых энтероцитов вместе с избыточным накоплением гематоксилина в ядрах каемчатых энтероцитов ближе к апикальной части ворсинок. При оценке состояния либеркюновых крипт (рис. 3) у их основания в группах 2 и 4 наблюдается повышение количества ацидофильных секреторных гранул внутри клеток Панета (рис. 3б, 3г). В опытных группах в сравнении с контролем отмечается лейкоцитарная инфильтрация с уменьшением количества бокаловидных клеток, наиболее выраженная в группе крыс, потреблявших НГ в дозе 100 мг/кг м. т. (рис. 3г). Морфометрический анализ (табл. 1) длины кишечных ворсинок крыс (рис. 4) показал, что их средняя длина в группах 1–4 составила 1230 ± 55, 840 ± 22, 791 ± 23 и 694 ± 12 мкм (M ± m) соответственно. Таким образом, длина ворсинок в опытных группах в среднем достоверно меньше, чем в контроле, на 32 и 36% у животных, получавших НГ в дозах 1 и 10 мг/кг м. т. (рис. 4б, 4в), и на 44% при дозе 100 мг/кг м. т. (рис. 4г). При измерении глубины крипт было установлено, что соотношение ворсинка/крипта при дозах НГ 1, 10 и 100 мг/кг м. т. в сравнении с контролем достоверно снижается в пределах 32–34%.
Рис. 2.
Репрезентативные световые оптические микрофотографии ворсинок подвздошной кишки крыс, окраска гематоксилином-эозином, увеличение ×400: а – группа 1 (контроль), б – группа 2 (доза НГ 1 мг/кг м. т.), в – группа 3 (доза НГ 10 мг/кг м. т.), г – группа 4 (доза НГ 100 мг/кг м. т.); Я – ядра, БК – бокаловидная клетка, ДЭ – десквамация эпителия, УК – уплотнение клеток эпителия, С – слизь.

Таблица 1.
Морфометрические показатели слизистой оболочки подвздошной кишки крыс, потреблявших НГ в течение 92 сут (М ± m)
| Показатель | Группа 1, контроль | Группа 2, доза НГ 1 мг/кг м. т. | Группа 3, доза НГ 10 мг/кг м. т. | Группа 4, доза НГ 100 мг/кг м. т. |
|---|---|---|---|---|
| Длина ворсинок, мкм* | 1230 ± 442,3,4 | 840 ± 221,4 | 791 ± 241,4 | 694 ± 551,2,3 |
| Глубина крипт, мкм* | 336 ± 94 | 351 ± 104 | 324 ± 84 | 283 ± 71,2,3 |
| Соотношение ворсинка/крипта* | 3.70 ± 0.712,3,4 | 2.45 ± 0.521 | 2.47 ± 0.501 | 2.49 ± 0.411 |
| Количество каемчатых энтероцитов на единицу длины ворсинки* | 17.8 ± 0.62,3,4 | 29.4 ± 1.91,4 | 33.5 ± 1.91,4 | 42.1 ± 2.41,2,3 |
| Количество бокаловидных клеток в продольном срезе ворсинки* | 20.8 ± 0.83,4 | 21.3 ± 0.93,4 | 32.5 ± 1.01,4 | 37.5 ± 1.91,2,3 |
Рис. 3.
Репрезентативные световые оптические микрофотографии крипт подвздошной кишки крыс, окраска гематоксилином-эозином, увеличение ×400: а – группа 1 (контроль), б – группа 2 (доза НГ 1 мг/кг м. т.), в – группа 3 (доза НГ 10 мг/кг м. т.), г – группа 4 (доза НГ 100 мг/кг м. т.); КП – клетки Панета, ЛИ – лейкоцитарная инфильтрация.
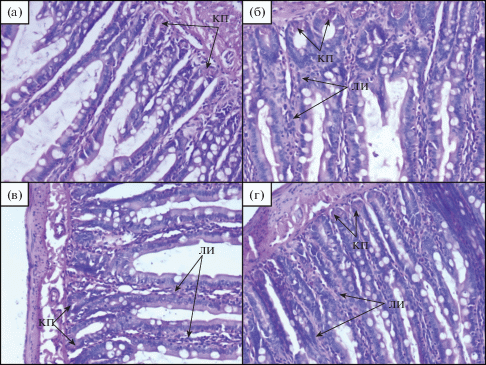
Рис. 4.
Репрезентативные световые оптические микрофотографии подвздошной кишки крыс, окраска гематоксилином-эозином, увеличение ×200: а – группа 1 (контроль), б – группа 2 (доза НГ 1 мг/кг м. т.), в – группа 3 (доза НГ 10 мг/кг м. т.), г – группа 4 (доза НГ 100 мг/кг м. т.); скобка – измеренное расстояние, мкм.

При исследовании влияния НГ на барьерную функцию ЖКТ в эксперименте по оценке проницаемости кишки для модельных белковых макромолекул ОВА в группе, получавшей НГ в максимальной дозе (100 мг/кг м. т.), антиген ОВА в крови не был выявлен ни у одной из 10 тестированных крыс (0%), тогда как в контрольной группе и группе, получавшей НГ в дозе 1 мг/кг м. т., всасывание ОВА было выявлено в пределах чувствительности метода анализа (500 пг/мл или 2 · 10–6% от введенной дозы) у всех 10 крыс (100%), а в группе, получавшей 10 мг/кг м. т., − у 7 из 10 крыс (70%). При дозе НГ 100 мг/кг м. т. у животных, получавших НГ в наибольшей дозе, в конце эксперимента отмечалась достоверно повышенная абсолютная масса тела (447 ± 21 г; M ± m) по сравнению с контролем (383 ± 14 г, p < 0.05, ANOVA). В других опытных группах достоверных изменений абсолютной массы тела в сравнении с контролем выявлено не было.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализируя данные по морфометрической характеристике как водной коллоидной дисперсии НГ, так и ее нативного препарата, следует отметить, что разрешающая способность метода СЭМ не позволила установить наличие более мелких фракций частиц, что, тем не менее, не исключает их наличия, как было показано ранее [20]. Исследования размеров частиц НГ методами трансмиссионной электронной микроскопии и динамического лазерного рассеяния света, имеющими более высокую разрешающую способность, продемонстрировали наличие структур сферической и стержневидной формы диаметром 50–100 нм, а также нанопластин размером от 10 до 100 нм и более. Таким образом, высокая способность к агрегации гидрофобных наночастиц в водных средах приводит к большой структурной гетерогенности наноматериалов, в частности НГ, что указывает на целесообразность использования нескольких методических подходов для оценки размеров частиц.
Как показали результаты гистопатологического исследования, употребление НГ на протяжении 92 дней в дозах от 1 до 100 мг/кг м. т. приводит к усилению секреции кишечной слизи с формированием плотного слизистого барьера в подвздошной кишке крыс вместе с увеличением количества бокаловидных клеток и каемчатых энтероцитов. Данный эффект максимально проявил себя в группе 4, где животные потребляли НГ в наибольшей из доз (100 мг/кг м. т.). Это согласуется с блокированием всасывания макромолекул белка у этих животных, выявленным с использованием антигенного ОВА, не обнаруженного в сыворотке крови крыс в сколько бы то ни было значимых количествах. Как известно, влияние на всасывание веществ различной природы в ЖКТ характерно для НГ [14, 21], в силу чего они широко используются в качестве энтеросорбентов. Эти свойства НГ, по-видимому, могут приводить также к замедлению всасывания витаминов, макро- и микроэлементов, в частности это может иметь отношение к витамину В12, рецепторы к которому значительно экспрессированы на микроворсинках слизистой оболочки подвздошной кишки [22], и, как уже было сказано ранее, к цинку [3]. Витамин В12, в свою очередь, является активным регулятором субпопуляций микробиома в тонкой кишке [23].
В [6] под действием НГ наблюдались удлинение апикальных микроворсинок, усиление репликации митохондрий и значительное увеличение толщины кишечных ворсинок, вызванное большими вакуолями у основания энтероцитов, что демонстрирует локальное влияние НГ на липогенез. В первой части настоящего эксперимента были также обнаружены изменения в профиле липопротеидов высокой и низкой плотности и наличие у животных гипертриглицеридемии [20]. Увеличение плотности ряда эпителиоцитов в апикальной части ворсинок, наблюдаемое во всех опытных группах, является следствием повышенной пролиферативной активности в криптах. Усиление пролиферативной активности эпителиоцитов на фоне выраженной лейкоцитарной инфильтрации может способствовать нарушению гистоархитектоники с последующей гиперплазией крипт и ворсинок. Увеличение количества бокаловидных клеток при дозах НГ 10 и 100 мг/кг м. т., образующихся из плюрипотентных стволовых клеток, присутствующих в основании крипт, сопровождается избыточной продукцией слизи, формирующей защитный барьер против микроорганизмов и химических воздействий [24]. Слизь содержит множество эндогенных белков и цинка, участвующих в межорганном обмене нутриентами, в том числе ферментных белков, необходимых для пристеночного и мембранного пищеварения [25]. С одной стороны, избыточное количество слизи может способствовать ускоренному ферментированию жировых мицелл и углеводных компонентов пищи в тонкой кишке, следствием чего, возможно, явилось повышение массы тела животных при максимальной дозе НГ. С другой стороны, вследствие формирования плотного слизистого барьера может замедляться всасывание некоторых веществ, микро- и макроэлементов и белков, в том числе эндогенных, которые гидролизуясь в составе химуса, реабсорбируются в просвете кишки. Последнее подтверждается данными о торможении катаболических процессов у этих животных, выраженное в снижении коэффициента де Ритиса (АСТ/АЛТ) и уровня азотистых метаболитов сыворотки крови [20]. Исходя из наблюдаемого эффекта торможения всасывания макромолекул белка ОВА под действием высокой дозы НГ, можно предположить, что образованная при этом слизь в тонкой кишке препятствует всасыванию продуктов частичного гидролиза экзогенных и эндогенных белков химуса, в том числе в форме биологически-активных пептидов, обладающих противоанаболическим, седативным и анорексигенным действием [26, 27]. Следствием этого может быть компенсаторное повышение аппетита крыс, приводящее к достоверному увеличению их массы тела на 20%. По аналогичному механизму при действии высоких доз НГ, возможно, снижается обеспеченность цинком [3], который совершает оборот между кровью и пищеварительной системой [25], где его эндогенная секреция максимально высока и находится в равновесии с его концентрацией в крови по принципу отрицательной обратной связи. Известно, что недостаточная обеспеченность цинком чаще всего развивается при некоторых патологических состояниях у человека, сопровождаемых кишечной мальабсорбцией [28], что приводит к увеличению экспрессии провоспалительного интерлейкина 1β и активации NLRP3-комплекса инфламмасом, приводя к развитию стерильного воспаления [29]. Учитывая наблюдаемые признаки повышенной секреции слизи и увеличение количества ацидофильных гранул в клетках Панета, в которых депонируется значительное количество цинка, можно предположить, что при действии высоких доз НГ помимо снижения самой биодоступности цинка происходит его повышенная эндогенная секреция, ухудшающая тем самым обеспеченность [25]. В первой части настоящего эксперимента одним из признаков мальабсорбции в группе 4 явился избыточный бактериальный рост, в частности энтерококков. У этих же животных имели место сдвиги в лейкоцитарной формуле: достоверно возрастало количество лимфоцитов, базофилов и снижалось – нейтрофилов, что свидетельствует о развитии иммунной реакции [20], которую также наблюдали в криптах и ворсинках подвздошной кишки. Тем не менее без изучения содержания микро- и макроэлементов в органах крыс в условиях данного эксперимента оценить степень влияния НГ на статус минеральных веществ не представляется возможным. Поэтому такие результаты вместе с данными специфической оценки уровней цитокинов, хемокинов и ростовых факторов в крови животных и степень их продукции культивируемыми клетками селезенки ex vivo будут опубликованы в следующем сообщении.
ЗАКЛЮЧЕНИЕ
Изучение влияния бентонитовых наноглин на состояние барьера слизистой оболочки тонкой кишки растущих крыс показало, что действие НГ в условиях ежедневного 92-суточного перорального поступления в диапазоне доз от 1 до 100 мг/кг м. т. вызывает различные нарушения в структуре ткани, сопровождающиеся признаками иммунной реакции в виде лейкоцитарной инфильтрации. Потребление крысами НГ в высокой дозе 100 мг/кг м. т. одновременно приводит к усиленному формированию плотного слоя слизистых наложений поверх щеточной каймы энтероцитов и подавлению всасывания белковых макромолекул. Таким образом, выявленные гистопатологические нарушения ворсинок, особенно при высоких дозах НГ, могут способствовать развитию токсической энтеропатии, гиперплазии ворсинок и крипт и, как следствие, приводить к синдрому мальабсорбции, что может повлечь за собой нарушение ассимиляции белка, витаминов, микро- и макроэлементов. Для понимания последствий нарушения барьерной функции целесообразным является оценка влияния НГ на статус микро- и макроэлементов. Однако уже сейчас можно заключить, что даже при дозе НГ 1 мг/кг постулируемая безопасность этого вещества требует более тщательной оценки, особенно в диапазоне низких доз. Ввиду этого актуальной представляется оценка содержания в пищевой продукции НГ вследствие их миграции из упаковочных материалов или поступления с пищевыми добавками и остаточными количествами технологических вспомогательных средств для оценки рисков, создаваемых при употреблении человеком конечной продукции.
Авторы выражают благодарность сотрудникам ФГБУН “ФИЦ питания и биотехнологии” М.О. Семину за помощь в проведении анализа образцов НГ на сканирующем электронном микроскопе и О.А. Прядко за подготовку препаратов для гистологических исследований.
Работа выполнена за счет средств субсидии на выполнение государственного задания в рамках Программы фундаментальных научных исследований (тема Министерства науки и высшего образования Российской Федерации № 0529-2019-0057).
Список литературы
Bumbudsanpharoke N., Ko S. // J. Nanomater. 2019. V. 2019. P. 8927167. https://doi.org/10.1155/2019/8927167
Awasthi A., Jadhao P., Kumari K. // SN Appl. Sci. 2019. V. 1. № 9. P. 1076. https://doi.org/10.1007/s42452-019-0858-9
Phillips T.D. // Toxicol. Sci. 1999. V. 52. № 2. Suppl. P. 118. https://doi.org/10.1093/toxsci/52.suppl_1.118
Kumar V., Gill K.D. // Arch. Toxicol. 2009. V. 83. № 11. P. 965. https://doi.org/10.1007/s00204-009-0455-6
Exley C. // Morphologie. 2016. V. 100. № 329. P. 51. https://doi.org/10.1016/j.morpho.2015.12.003
Reichardt F., Chaumande B., Haboldet C. et al. // Comp. Biochem. Physiol. Molecular Integr. A. Physiol. 2007. V. 146. P. S186. https://doi.org/10.1016/j.cbpa.2008.04.065
Багрянцева О.В., Шатров Г.Н., Хотимченко С.А. и др. // Анализ риска здоровью. 2016. № 1. С. 58.https://doi.org/10.21668/health.risk/2020.1.16.eng
Gmoshinskii I.V., Bagryantseva O.V., Arnautov S.A. et al. // Heal. Risk Anal. 2020. № 1. P. 142. https://doi.org/10.21668/health.risk/2020.1.16.eng
Baek M., Lee J.-A., Choi S.-J. // Mol. Cell. Toxicol. 2012. V. 8. № 1. P. 95. https://doi.org/10.1007/s13273-012-0012-x
Sharma A.K., Schmidt B., Frandsen H. et al. // Mutat. Res. 2010. V. 700. № 1. P. 18. https://doi.org/10.1016/j.mrgentox.2010.04.021
Houtman J., Maisanaba S., Puerto M. et al. // Appl. Clay Sci. 2014. V. 90. P. 150. https://doi.org/10.1016/j.clay.2014.01.009
Janer G., Fernández-Rosas E., Mas del Molino E. et al. // Nanotoxicology. 2014. V. 8. № 3. P. 279. https://doi.org/10.3109/17435390.2013.776123
Смирнова В.В., Тананова О.Н., Шумакова А.А. и др. // Гигиена и санитария. 2012. № 3. С. 76.
Afriyie-Gyawu E., Mackie J., Dash B. et al. // Food Addit. Contam. 2005. V. 22. № 3. P. 259. https://doi.org/10.1080/02652030500110758
Lee Y.-H., Kuo T.-F., Chen B.-Y. et al. // Biomed. Eng. Appl. Basis Commun. 2005. V. 17. № 02. P. 72. https://doi.org/10.4015/S1016237205000111
Maisanaba S., Gutiérrez-Praena D., Puerto M. et al. // Appl. Clay Sci. 2014. V. 95. P. 37. https://doi.org/10.1016/j.clay.2014.04.006
Гаврилова Н.Н., Назаров В.В., Яровая О.В. Микроскопические методы определения размеров частиц дисперсных материалов: учебное пособие. М.: РХТУ им. Д.И. Менделеева, 2012. 52 с.
Stuart C.A., Twistelton R., Nicholas M.K., Hide D.W. // Clin. Allergy. 1984. V. 14. № 6. P. 533.
Саркосов Д.Л., Перов Ю.Л. Микроскопическая техника: руководство. М.: Медицина, 1996. 544 с.
Шипелин В.А., Шумакова А.А., Мусаева А.Д. и др. // Вопросы питания. 2020. Т. 89. № 3. С. 52.
Afriyie-Gyawu E., Wang Z., Ankrah N.A. et al. // Food Addit. Contam. Part A. 2008. V. 25. № 7. P. 872. https://doi.org/10.1080/02652030701854758
Hagedorn C.H., Alpers D.H. // Gastroenterology. 1977. V. 73. № 5. P. 1019.
Degnan P.H., Taga M.E., Goodman A.L. // Cell Metab. 2014. V. 20. № 5. P. 769. https://doi.org/1010.1016/j.cmet.2014.10.002
Forstner J.F., Forstner G.G. // Physiology of the gastrointestinal tract. 3rd edition edited by Johnson L.R. New York: Raven Press, 1994. P. 1255.
Шлыгин Г.К. Роль пищеварительной системы в обмене веществ. М.: Синергия, 2001. 232 с.
Chakrabarti S., Guha S., Majumder K. // Nutrients. 2018. V. 10. № 11. P. 1738. https://doi.org/10.3390/nu10111738
Sánchez A., Vázquez A. // Food Quality and Safety. 2017. V. 1. № 1. P. 29. https://doi.org/10.1093/fqsafe/fyx006
Maxfield L., Crane J.S. Zinc Deficiency (Updated 2019 Nov 14) // StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK493231/
Summersgill H., England H., Lopez-Castejon G. et al. // Cell Death Dis. 2014. V. 5. № 1. P. e1040. https://doi.org/10.1038/cddis.2013.547
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


