Российские нанотехнологии, 2021, T. 16, № 2, стр. 253-260
НАСЫЩЕНИЕ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ ФЛАВОЛИГНАНАМИ СИЛИМАРИНА В СОСТАВЕ ЛИПИДНЫХ НАНОЧАСТИЦ
М. Р. Бахман 1, Н. Б. Фельдман 1, *, С. Н. Орехов 1, Н. Е. Седякина 1, Т. И. Громовых 1, С. В. Луценко 1
1 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Москва, Россия
* E-mail: n_feldman@mail.ru
Поступила в редакцию 07.07.2020
После доработки 16.11.2020
Принята к публикации 16.11.2020
Аннотация
Силимарин (СМ) из Silybum marianum (L.) представляет собой сумму флаволигнанов (силибинин, силикристин, силидианин и изосилибинин), проявляющих широкий спектр биологической активности и оказывающих противовоспалительное, противоопухолевое, гепатопротекторное, иммуномодулирующее действие. С помощью модифицированного эмульсионного метода с упариванием растворителя получены липидные наночастицы с силимарином (ЛНЧ-СМ), размер которых составил 257 ± 6 нм, ζ-потенциал –20.8 ± 1.6 мВ. Эффективность включения СМ в липидные наночастицы составила 89.8%, степень загрузки – 5.4%. Высвобождение СМ из состава полученных наночастиц носит пролонгированный характер; через 48 ч в диализную среду высвобождается лишь 68.3 ± ± 5.4% активного вещества. Исследована динамика включения/высвобождения СМ, входящего в состав ЛНЧ, в пленки бактериальной целлюлозы (БЦ), продуцируемые штаммом Gluconacetobacter hansenii GH-1/2008. Показано, что после 24 ч инкубации максимальное насыщение СМ пленки БЦ достигает 0.745 ± 0.038 мг/см2, максимальное высвобождение – 0.520 ± 0.041 мг/см2. Продемонстрировано, что и золи ЛНЧ-СМ, и образцы БЦ, насыщенной ЛНЧ-СМ, проявляют низкую гемолитическую активность, что свидетельствует о потенциальной биобезопасности этих препаратов. Препарат ЛНЧ-СМ в отличие от свободного СМ проявляет фунгистатическое действие в отношении грибов A. niger и C. albicans. Как свободный СМ, так и препарат ЛНЧ-СМ подавляют рост грамположительных бактерий, однако действие препарата ЛНЧ-СМ более эффективно. Минимальная подавляющая концентрация препарата ЛНЧ-СМ для B. subtilis и B. coagulans составляет 105 и 210 мкг/мл соответственно. Обсуждается возможность разработки биосовместимых покровных материалов на основе БЦ, насыщенной ЛНЧ-СМ.
ВВЕДЕНИЕ
Одними из наиболее перспективных и широко изучаемых биологически активных веществ природного происхождения являются флаволигнаны силимарина (СМ), содержащиеся в расторопше пятнистой Silybum marianum (L.). Сухие экстракты, получаемые из расторопши пятнистой, содержат около 60% СМ, основными действующими компонентами которого являются флаволигнаны силибинин, силикристин, силидианин и изосилибинин [1].
Силимарин проявляет широкий спектр биологической активности. Он обладает способностью к подавлению TNF-индуцируемой продукции реактивных форм кислорода, улавливанию свободных радикалов, препятствует перекисному окислению липидов [2, 3]. СМ также способствует снижению концентрации липопротеинов низкой плотности в сыворотке крови, способствует утилизации этих липопротеинов печенью и таким образом снижает уровень холестерола [4]. Продемонстрировано также противовоспалительное [5], противоопухолевое [6–9], гепатопротекторное [10, 11], кардиопротекторное [12], нейропротекторное [13] и иммуномодулирующее [14, 15] действие СМ. Описано антимикробное действие СМ в отношении грамположительных бактерий [16]. СМ проявляет крайне низкую токсичность для человека даже при ежедневной дозе приема, превышающей 1.5 г, однако максимальному проявлению его биологической активности препятствует низкая растворимость в воде (<50 мкг/мл) [17].
Повышения растворимости и биодоступности СМ можно добиться путем его инкапсулирования в липосомы или другие типы наночастиц. Так, СМ был инкапсулирован в липосомы [18, 19], включался в твердые дисперсии [20] и микрочастицы [21], амфифильные хитозановые мицеллы [22].
Одним из перспективных направлений увеличения биодоступности и повышения эффективности терапевтического действия является включение флаволигнанов СМ в состав липидных наночастиц, стабилизированных эмульгаторами и находящихся в твердом состоянии при температуре тела человека [23].
Ранее на основе сложного эфира глицерина и остатков жирных кислот (“Compritol”) и неионогенного поверхностно-активного вещества (ПАВ) (Твин 80) были получены липидные наночастицы, включающие СМ (ЛНЧ-СМ). Полученные нанодисперсии проявляли более высокую терапевтическую активность в отношении повреждений печени в сравнении со свободным флаволигнаном силибинином [24]. Также были получены включающие силибинин твердые ЛНЧ на основе стеариновой кислоты и неионного детергента Brij 78 (октодецилполиоксиэтилен-78) [25]. Такие наночастицы отличались крайне медленным высвобождением силибинина и обладали стелс-эффектом, т.е. способностью избегать захвата макрофагами ретикуло-эндотелиальной системы.
В настоящей работе ЛНЧ-СМ получены на основе глицеролмоностеарата и фосфатидилхолина; изучены их физико-химические свойства и антибактериальная активность. Бактериальная целлюлоза (БЦ), продуцируемая штаммом Glucon-acetobacter hansenii GH-1/2008, представляет собой эластичный, биосовместимый нанопористый материал, возможности медицинского применения которого активно изучаются [26]. В этом плане перспективное направление использования БЦ – получение на ее основе покровного материала с антимикробной активностью, в связи с чем поставлена задача изучить кинетику насыщения–высвобождения целлюлозой ЛНЧ-СМ, а также гемолитическую и антимикробную активность полученных пленок.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали полиэтиленгликоль PEG 400, Твин 80, додецилсульфат натрия (SDS), ЭДТА, изопропанол, этанол, фосфатно-солевой буфер (PBS), глицеролмоностеарат, L-α-фосфатидилхолин, силимарин, Сефадекс G50 (все реагенты от Sigma-Aldrich, США). Лимонная кислота, сахароза, Na2HPO4, NaOH имели квалификацию “ч.д.а.”.
ЛНЧ-СМ получали с помощью модифицированного эмульсионного метода с упариванием растворителя [27]. Компоненты частиц (глицеролмоностеарат, фосфатидилхолин, СМ) в массовом соотношении 10:1.5:1 растворяли в минимальном объеме абсолютного этилового спирта, нагретого до 70°С. Полученный раствор добавляли по каплям в нагретую до 70°С водную фазу, содержащую PEG 400 (1% мас./об.) и изопропанол (1% мас./об), при постоянном перемешивании со скоростью 1200 об./мин. Через 5 ч инкубации полученную дисперсию приливали при перемешивании (1000 об./мин) к равному объему охлажденного до 4°С водного раствора (гидратирующий раствор), содержащего Твин 80 (1% мас./об.) и PEG 400 (1% мас./об.), и инкубировали в течение 3 ч. Суспензию фильтровали через мембранный фильтр с размером пор 0.45 мкм и проводили дополнительную очистку липидных частиц с помощью гельфильтрации на колонке с носителем Сефадекс G50. 2 мл липидной дисперсии, включающей СМ, наносили на колонку, уравновешенную 40 мМ PBS, рН 7.4, и элюировали препарат тем же буфером при скорости потока 1.0 мл/мин. Процесс очистки контролировали с помощью детектора при λ 300 нм.
Для определения эффективности включения СМ в ЛНЧ к 1 мл дисперсии, полученной после очистки на колонке с Сефадекс G50, приливали 50 мл метанола, фильтровали через мембранный фильтр с размером пор 45 мкм, отбирали 100 мкл пробы для HPLC-анализа. Анализ проводили с помощью хроматографа Agilent Technologies 1260 Infinity (США) на обращеннофазовой колонке С 18. Подвижная фаза состояла из смеси ацетонитрила и воды (30:70 об./об.) при скорости потока 1 мл/мин. Элюат с колонки мониторировали при длине волны 300 нм. Концентрацию СМ определяли в пересчете на силибинин по калибровочному графику, построенному с помощью стандартного образца силибинина. Эффективность (E) включения СМ в ЛНЧ рассчитывали по формуле: E = [(масса СМ в ЛНЧ, мг)/(общая масса СМ, мг)] × 100%. Степень загрузки (DL) ЛНЧ силимарином определяли по формуле: DL = [(масса СМ в ЛНЧ, мг)/(масса липидов, мг)] × 100%.
Размер частиц и ζ-потенциал определяли методом динамического рассеяния света (ДРС) на анализаторе ζ-потенциала и размера частиц Zetasizer Nano ZS (Malvern Instruments Ltd, Великобритания). Формы и размеры ЛНЧ изучали с помощью сканирующего электронного микроскопа (СЭМ) JEOL JSM-6490LV (Япония) при увеличении ×10 000 и ×15 000. Исследуемые пробы напыляли (40 с при 40 мА) слоем 20 нм платины в автоматическом коутере JEOL JFC-1600.
Изучение динамики высвобождения СМ из ЛНЧ проводили с помощью метода диализа с некоторыми модификациями [28]. Перед использованием диализные мешки кипятили в воде в течение 10 мин с добавлением этилендиаминтетрауксусной кислоты, промывали и оставляли в деионизированной воде на 12 ч. 10 мл дисперсии ЛНЧ-СМ в диализном мешке диализировали в течение 48 ч при 37°С на шейкере VXR basic Vibrax (IKA) при перемешивании (50 об./мин) против 500 мл PBS, рН 7.4, содержащего 1% метанола. В качестве контроля использовали свободный СМ, который диализировали в аналогичных условиях. Аликвотные части опытных и контрольных образцов диализируемого раствора отбирали для анализа через определенные промежутки времени, добавляя к этому раствору тот же объем свежего буфера. Содержание СМ в диализате определяли с помощью HPLC.
В работе использовали штамм Gluconacetobacter hansenii GH-1/2008 ВКПМ B-10547. Для получения пленок БЦ штамм G. hansenii культивировали в стационарной культуре на среде, содержащей 2% сахарозы, 0.5% пептона, 0.5% дрожжевого экстракта, 0.27% Na2HPO4, 0.12% лимонной кислоты. Посевной материал G. hansenii выращивали на указанной среде при 30°C с использованием ротационного шейкера в течение 3 сут. Для получения пленок БЦ культивировали продуцент в стационарной культуре на среде в течение 15 сут при температуре 26 ± 2°С в кюветах размером 25 × 50 см. Толщина полученных пленок составляла ~150 мкм. После завершения культивирования пленки отделяли от культуральной жидкости, промывали дистиллированной водой для удаления компонентов среды и обрабатывали 1.0 М раствором NaOH при 80°C в течение 2 ч для удаления контаминаций и иммобилизованных на пленке клеток продуцента. На завершающем этапе пленки БЦ отмывали от щелочи дистиллированной водой. Отмывку прекращали, когда рН промывной жидкости достигала нейтральных значений.
Для изучения сорбции ЛНЧ-СМ на БЦ гидратированные пленки размером 4 см2 инкубировали в золе ЛНЧ-СМ в течение определенных промежутков времени (от 10 мин до 24 ч) при покачивании при комнатной температуре. Концентрация СМ в золе ЛНЧ-СМ составляла 0.842 мг/мл. По истечении времени инкубации пленки извлекали из инкубационной среды и определяли концентрацию СМ, оставшегося в инкубационной среде, с помощью HPLC, как это описано выше, при длине волны λ 300 нм после разрушения ЛНЧ путем добавления 96%-ного этанола. Количество СМ, сорбировавшегося на БЦ, вычисляли по разнице концентраций в исходной суспензии и в суспензии после извлечения пленки.
Далее изучали динамику высвобождения СМ из пленок бактериальной целлюлозы с сорбированными ЛНЧ-СМ. Влажные пленки БЦ с сорбированными на них ЛНЧ-СМ, полученные как описано выше, помещали в емкость с PBS, рН 7.4, и инкубировали при покачивании. Через определенные промежутки времени отбирали пробы инкубационной среды и оценивали в них концентрацию высвободившегося из пленок СМ с помощью HPLC. По результатам эксперимента строили график динамики высвобождения СМ из пленок БЦ.
Гемолитическую активность ЛНЧ-СМ определяли по методу [29] с некоторыми модификациями. В экспериментах использовали цельную кровь аутбредных половозрелых самок мышей ICR (CD-I), собранную посредством декапитации. Содержание животных и все манипуляции проводили в соответствии с требованиями законодательства Российской Федерации, положениями “Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей” (ETC 123), положениями Guide for the Care and Use of Laboratory Animals (Washington D.C., 2011) и другими нормами международного права, регламентирующими вопросы содержания и использования лабораторных (экспериментальных) животных. К 1 мл золя ЛНЧ-СМ в PBS (рН 7.4) добавляли 100 мкл мышиной крови и инкубировали смесь 1 ч при 37°С. Раствор центрифугировали 10 мин при 5000 об./мин. Высвободившийся в ходе лизиса гемоглобин регистрировали фотометрически в супернатантах при длине волны 540 нм. В качестве препарата отрицательного контроля (отсутствие гемолиза) использовали PBS, рН 7.4, в качестве препарата положительного контроля со 100%-ной гемолитической активностью – 1.5%-ный (мас./об.) раствор SDS. Контрольные препараты подвергали той же процедуре, что и опытные образцы. Гемолитическую активность (Н) ЛНЧ-СМ в процентах вычисляли по формуле: Н = [(АЛНЧ – АPBS)/ASDS] × 100%, где АЛНЧ – оптическая плотность супернатанта в препаратах, содержащих ЛНЧ-СМ, АPBS, ASDS – оптическая плотность супернатанта отрицательного и положительного контроля.
Для определения гемолитической активности фосфатидилхолина и Твин 80 готовили их растворы (1 и 0.625% соответственно) в PBS, рН 7.4. Перед определением гемолитической активности фосфатидилхолина его раствор подвергали ультразвуковой обработке. Для определения гемолитической активности свободного СМ готовили его суспензию (0.842 мг в 1 мл PBS, рН 7.4). Определение гемолитической активности БЦ проводили в PBS, содержащем фрагмент пленки (230 мг на 1 мл) (контрольный образец); опытный образец содержал в 1 мл PBS 230 мг целлюлозы, насыщенной ЛНЧ-СМ.
Оценку антимикробной активности ЛНЧ-СМ проводили методом диффузии в агар [30] с использованием тест-культур условно-патогенных грибов и бактерий: Aspergillus niger INA 00760, Candida albicans АТСС 2091, Bacillus subtilis АТСС 6633, B. coagulans 429, Escherichia coli ATCC 8739. На поверхность агара помещали вырезанные из пленки БЦ диски, на которые предварительно наносили по 420 мкг СМ, входящего в состав ЛНЧ; в качестве контрольных образцов использовали диски БЦ диаметром 6 мм, содержащие 420 мкг свободного СМ. Контролем чувствительности тест-организма служили стандартные диски с нистатином (“НИИ Пастера”, 40 мкг/мл) и амоксиклавом (“НИИ Пастера”, 10 мкг/мл).
Минимальную подавляющую концентрацию (МПК) ЛНЧ-СМ определяли методом последовательных разведений на штаммах грамположительных бактерий B. subtilis АТСС 6633, B. coagulans 429 и грамотрицательных бактерий E. coli ATCC 8739. Эксперименты проводили в жидких средах: мясо-пептонном бульоне с глюкозой (для Bacillus) или среде Кесслера (для E. coli). Суспензию инокулята тест-организмов разводили в стерильном физиологическом растворе, доводя до оптической плотности 0.5 по стандарту мутности МакФарланда, а затем разбавляли питательной средой в 100 раз. В стерильные пробирки, содержащие каждая по 1 мл разведения препарата на питательной среде, добавляли инокулят в объеме 1 мл. Конечные концентрации препарата в пробирках составляли от 420 до 26.25 мкг/мл. В контрольную пробирку добавляли по 1 мл чистой питательной среды и инокулята. Инкубировали пробирки 24 ч при 37°С, после чего определяли МПК как минимальную концентрацию препарата, полностью предотвращающую видимый рост тест-организма [30].
Обработку полученных данных проводили с помощью компьютерных программ Microsoft Excel 2010 и Microcal Origin 8.0 (OriginLab Corporation). Все данные представлены как средние арифметические значения (M) и стандартные отклонения (±SD). Для выявления статистической значимости различий применяли однофакторный дисперсионный анализ (ANOVA); различия считали достоверными при значениях р < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С помощью эмульсионного метода с упариванием растворителя при высокой температуре с последующим затвердеванием частиц при низкой температуре получен препарат ЛНЧ-СМ, средний размер которых по данным ДРС составил 257.0 ± 6.3 нм (рис. 1). ζ-потенциал представляет собой важный параметр, величина которого позволяет судить о стабильности коллоидных растворов [31]. В случае ЛНЧ ζ-потенциал зависит от природы частиц, состава буферной среды, характера расположения молекул липидов на поверхности частиц, природы и локализации молекул ПАВ на поверхности раздела фаз и других параметров. ζ-потенциал полученных ЛНЧ-СМ составил –20.8 ± 1.6 мВ, при этом золь оставался стабильным при 4°С в течение по крайней мере двух недель. В течение этого срока параметры, характеризующие стабильность золя (образование агрегатов, распределение частиц по размерам, эффективность включения СМ), практически не изменялись (данные не приводятся). Эффективность включения СМ в ЛНЧ была достаточно высока и составила 89.8%; степень загрузки – 5.4%.
Рис. 1.
СЭМ-изображение ЛНЧ-СМ и график их распределения по размерам, полученный с помощью анализатора Malvern Zetasizer Nano ZS.

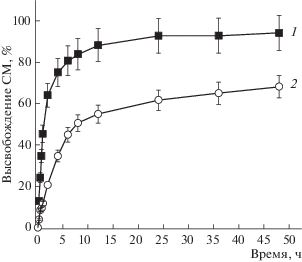
Исследование динамики высвобождения СМ из состава полученных ЛНЧ проводили при рН 7.4, что может имитировать высвобождение препарата при его попадании в плазму крови человека при внутривенном введении. Как видно на рис. 2, в первые часы инкубации свободный СМ довольно быстро высвобождается в диализную среду, практически достигая в ней полумаксимального (47.05%) накопления чуть больше чем за 1 ч. В дальнейшем скорость высвобождения постепенно снижалась; через 24 ч в диализной среде оказывалось 92.7 ± 8.34%, а через 48 ч – 94.1 ± ± 8.46% от общего количества свободного СМ. В то же время высвобождение СМ, находящегося в составе ЛНЧ, носит пролонгированный характер; через 1 ч инкубации высвобождается лишь 11.8 ± ± 0.94% СМ; через 24 ч – 61.8 ± 4.97%, а через 48 ч – 68.3 ± 5.44%. Таким образом, золи ЛНЧ-СМ можно рассматривать как терапевтическое транспортное средство, которое может найти применение для доставки и пролонгированного высвобождения СМ.
Описанное в литературе антиоксидантное, мембранопротекторное, противовоспалительное, противоопухолевое действие СМ [1] позволяет предполагать перспективность его применения в составе покровных материалов, предназначенных для лечения кожных и ожоговых травм, псориаза, аутоиммунных заболеваний и др. В связи с этим представляется важным поиск путей решения вопроса о возможностях применения ЛНЧ-СМ в составе покровных материалов и трансдермальных систем медицинского назначения. В настоящей работе исследована возможность получения подобного материала на основе пленок БЦ, продуцируемой штаммом Gluconacetobacter hansenii GH-1/2008. Бактериальная целлюлоза представляет собой биосовместимый нанопористый материал, области применения которого активно изучаются [26].
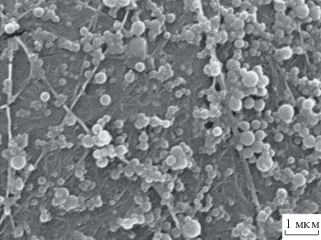
Результаты эксперимента по насыщению целлюлозы препаратом ЛНЧ-СМ приведены на рис. 3. Насыщение целлюлозы ЛНЧ-СМ носило экспоненциальный характер. Полумаксимальное насыщение пленки БЦ достигалось через 4 ч инкубации и составляло 0.579 ± 0.029 мг/см2; максимальное насыщение – через 24 ч и составляло 0.745 ± 0.038 мг/см2. Таким образом, 89.1% СМ, находящегося в составе ЛНЧ-СМ в инкубационной среде, включалось в БЦ, что может свидетельствовать о ее достаточно высокой пористости и емкости. Как видно на рис. 4, ЛНЧ-СМ активно взаимодействуют с фибриллами БЦ, создавая на ее поверхности довольно плотное нанопокрытие.
Результаты исследования высвобождения СМ из пленок БЦ, насыщенных ЛНЧ-СМ, представлены на рис. 5. Высвобождение СМ носило замедленный характер; через 1 ч инкубации высвобождалось 0.162 ± 0.013 мг/см2 СМ (21.6% от общей массы СМ, сорбированного на БЦ); через 2 ч – 0.248 ± 0.019 мг/см2 (33.1%). Максимальное высвобождение СМ из пленки БЦ отмечалось через 24 ч инкубации и составляло 0.520 ± 0.041 мг/см2 (69.3%). Таким образом, практическое применение ЛНЧ-СМ в составе лекарственных форм на основе пленок БЦ может иметь существенные преимущества в результате пролонгирования высвобождения СМ, обеспечиваемого как за счет замедленного высвобождения самих наночастиц из состава пленки, так и замедленного высвобождения СМ из состава наночастиц.
Ранее было показано, что СМ может быть использован при лечении экземы, псориаза, рака кожи и других заболеваний [32, 33]. Также был описан иммуносупрессивный эффект силибинина (основного флаволигнана СМ). Подавление пролиферации и индукция силибинином апоптоза T-лимфоцитов на фоне подавления экспрессии провоспалительных цитокинов приводили к снижению иммунной реакции организма на здоровые ткани, что может оказаться важным при лечении аутоиммунных заболеваний [34]. Таким образом, разработка биосовместимых покровных материалов на основе БЦ, насыщенной ЛНЧ-СМ, представляется актуальным направлением расширения арсенала средств терапии раневых и ожоговых травм, патологий кожных покровов и аутоиммунных заболеваний.
Для оценки уровня безопасности ЛНЧ-СМ, бактериальной целлюлозы, насыщенной наночастицами, а также ключевых компонентов ЛНЧ использовали тест на гемолитическую активность. Как видно на рис. 6, наиболее высокой гемолитической активностью (16.8 ± 1.4%) обладал гидратирующий раствор Твин 80, используемый при получении ЛНЧ-СМ. Очевидно, что после очистки ЛНЧ-СМ, проведенной с помощью гель-фильтрации, содержание Твин 80 в золе должно было значительно снижаться и не вносить существенного вклада в гемолитическую активность препарата. Действительно, очищенный золь ЛНЧ-СМ проявлял весьма низкую гемолитическую активность (8.7 ± 0.7%). При этом препарат свободного СМ практически не проявлял гемолитической активности (0.4 ± 0.1%), а фосфатидилхолин проявлял крайне низкую активность (0.8 ± 0.1%). Контрольный образец БЦ, не содержащей ЛНЧ-СМ, проявлял несколько более высокую гемолитическую активность (12.8 ± 1.0%) в сравнении с образцом БЦ, насыщенной ЛНЧ-СМ (10.1 ± 0.9%), что подтверждает данные об антигемолитическом действии СМ [35].
Рис. 6.
Оценка in vitro гемолитической активности полученных препаратов и их компонентов; ФХ – фосфатидилхолин; БЦ-ЛНЧ-СМ – бактериальная целлюлоза, насыщенная ЛНЧ-СМ.
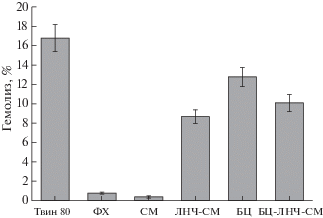
По данным [36] препараты, характеризующиеся значениями гемолиза, превышающими 25%, рассматриваются как факторы высокого риска; препараты, вызывающие гемолиз, не превышающий 10%, считаются негемолитическими. Таким образом, в соответствии с полученными в настоящей работе данными препарат ЛНЧ-СМ и образцы насыщенной им бактериальной целлюлозы могут рассматриваться в качестве достаточно безопасных с точки зрения проявления гемолитической активности.
Учитывая, что свободный СМ проявляет антимикробную активность [37], провели сравнительное исследование антимикробной активности свободного СМ и ЛНЧ-СМ в отношении штаммов условно-патогенного гриба A. niger, дрожжевого гриба C. albicans, грамположительных бактерий – B. subtilis, B. coagulans, а также грамотрицательной бактерии E. coli (табл. 1). Свободный СМ проявлял слабое подавляющее действие в отношении грамположительных бактерий, в то время как препарат ЛНЧ-СМ оказывал ингибирующее действие в отношении микроорганизмов всех исследуемых штаммов.
Таблица 1.
Антимикробная активность препаратов силимарина в отношении условно-патогенных грибов и бактерий (зона угнетения роста, мм)
| Тест-организм | СМ | ЛНЧ-СМ | Нистатин | Амоксиклав |
|---|---|---|---|---|
| Aspergillus niger INA 00760 | 0 | 9.1 ± 0.6 | 14.9 ± 0.3 | |
| Candida albicans АТСС 2091 | 0 | 13.4 ± 0.4 | 24.8 ± 0.6 | |
| Bacillus subtilis ATCC 6633 | 11.0 ± 0.3 | 20.2 ± 0.6 | 30.1 ± 0.3 | |
| Bacillus coagulans 429 | 8.0 ± 0.2 | 16.4 ± 0.7 | 24.8 ± 0.2 | |
| Escherichia coli ATCC 8739 | 0 | 7.3 ± 0.5 | 21.3 ± 0.3 |
Согласно [38] действие свободного силибинина (одного из флаволигнанов СМ) на C. albicans приводит к изменению проницаемости клеточных мембран, снижению метаболической активности клеток, подавлению формирования биопленок и индукции апоптоза. Как видно из табл. 1, препарат ЛНЧ-СМ в отличие от свободного СМ проявляет фунгистатическое действие в отношении A. niger и C. albicans, менее выраженное в сравнении с нистатином. В отличие от свободного СМ наличие антигрибкового эффекта у ЛНЧ-СМ может быть связано с эффективным взаимодействием ЛНЧ с поверхностью бактериальной клетки с последующим высвобождением флаволигнанов СМ непосредственно на поверхности клетки-мишени.
Как известно, свободный СМ не проявляет антибактериальной активности в отношении грамотрицательной бактерии E. coli. В данном случае отсутствие антибактериального эффекта может объясняться стимулирующим действием СМ на синтез ДНК в клетках E. coli, а также отсутствием его влияния на уровень синтеза клеточных белков и РНК [39]. В проведенном эксперименте в отличие от свободного СМ препарат ЛНЧ-СМ проявлял бактериостатическую активность, крайне низкую в сравнении с активностью амоксиклава (табл. 1).
Грамположительные бактерии более чувствительны к действию свободного СМ, поскольку он ингибирует внутриклеточный синтез белков и РНК [39]. Как видно из табл. 1, и свободный СМ, и препарат ЛНЧ-СМ подавляют рост бактерий B. subtilis и B. coagulans. При этом действие препарата ЛНЧ-СМ более эффективно – его МПК для B. subtilis и B. coagulans составляет 105 мкг/мл и 210 мкг/мл соответственно. Препарат свободного СМ оказывает слабый бактериостатический эффект (в диапазоне исследуемых концентраций от 420 до 26.25 мкг/мл МПК не достигалась).
Таким образом, препарат ЛНЧ-СМ проявляет более высокую антимикробную активность по сравнению со свободным СМ, что может быть обусловлено специфическим связыванием ЛНЧ-СМ с поверхностью микробных клеток. При этом наиболее высокая активность ЛНЧ-СМ отмечается в отношении грамположительных бактерий B. subtilis и B. coagulans; в отношении грибов A. niger и C. аlbicans препарат ЛНЧ-СМ проявляет фунгистатический эффект. По-видимому, широких перспектив для использования в качестве эффективных антимикробных средств ЛНЧ-СМ не имеют вследствие их низкой токсичности. Однако как свободный СМ, так и ЛНЧ-СМ могут рассматриваться в качестве перспективных средств, дополняющих действие антибиотиков [37].
ЗАКЛЮЧЕНИЕ
В отличие от плохо растворимого в биологических жидкостях свободного СМ ЛНЧ-СМ образуют устойчивые водные золи, наличие которых может значительно расширить спектр терапевтического применения СМ на основе разработки новых лекарственных форм. Кроме того, в составе липидной наночастицы флаволигнаны СМ оказываются надежно защищенными от агрессивной внешней среды. Пролонгированное высвобождение СМ из ЛНЧ создает дополнительные преимущества при рассмотрении путей введения и возможностей его терапевтического применения. Практическое отсутствие у ЛНЧ-СМ и их компонентов гемолитической активности наряду с литературными данными о крайне низкой токсичности СМ, его высокой антиоксидативной, противовирусной, противовоспалительной, антиангиогенной и противоопухолевой активности наглядно свидетельствует об актуальности разработки на основе этих наночастиц и биосовместимого материала БЦ новых противоожоговых и раневых повязок, а также систем трансдермальной доставки.
Работа выполнена при поддержке проекта повышения конкурентоспособности ведущих российских университетов среди ведущих мировых научно-образовательных центров.
Список литературы
Gazák R., Walterová D., Kren V. // Curr. Med. Chem. 2007. V. 14. № 3. P. 315. https://doi.org/10.2174/092986707779941159
Manna S.K., Mukhopadhyay A., Van N.T., Aggarwal B.B. // J. Immunol. 1999. V. 163. № 12. P. 6800.
Basaga H., Poli G., Tekkaya C., Aras I. // Cell Biochem. Funct. 1997. V. 15. № 1. P. 27. https://doi.org/10.1002/(SICI)1099-0844(199703)15:1<27::AID-CBF714>3.0.CO;2-W
Skottová N., Krecman V. // Acta Univ. Palacki. Olomuc. Fac. Med. 1998. V. 141. P. 39.
Wu C.H., Huang S.M., Yen G.C. // Antioxid. Redox Signal. 2011. V. 14. № 3. P. 353. https://doi.org/10.1089/ars.2010.3134
Wang Y.X., Cai H., Jiang G. et al. // Asian Pac. J. Cancer Prev. 2014. V. 15. № 16. P. 6791. https://doi.org/10.7314/apjcp.2014.15.16.6791
Woo S.M., Min K.J., Kim S. et al. // Chem.-Biol. Interact. 2014. V. 211. P. 36. https://doi.org/10.1016/j.cbi.2014.01.004
Pirouzpanah M.B., Sabzichi M., Pirouzpanah S. et al. // Asian Pac. J. Cancer Prev. 2015. V. 16. № 5. P. 2087. https://doi.org/10.7314/apjcp.2015.16.5.2087
Tyagi A., Agarwal C., Harrison G. et al. // Carcinogenesis. 2004. V. 25. № 9. P. 1711. https://doi.org/10.1093/carcin/bgh180
Féher J., Lengyel G. // Curr. Pharm. Biotechnol. 2012. V. 13. № 1. P. 210. https://doi.org/10.2174/138920112798868818
Vargas-Mendoza N., Madrigal-Santillán E., Morales-González A. et al. // World J. Hepatol. 2014. V. 6. № 3. P. 144. https://doi.org/10.4254/wjh.v6.i3.144
Rao P.R., Viswanath R.K. // Exp. Clin. Cardiol. 2007. V. 12. № 4. P. 179.
Borah A., Paul R., Choudhury S. et al. // CNS Neurosci. Ther. 2013. V. 19. № 11. P. 847. https://doi.org/10.1111/cns.12175
Gharagozloo M., Karimi M., Amirghofran Z. // Int. Immunopharmacol. 2013. V. 16. № 2. P. 243. https://doi.org/10.1016/j.intimp.2013.04.016
Esmaeil N., Anaraki S.B., Gharagozloo M., Moayedi B. // Int. Immunopharmacol. 2017. V. 50. P. 194. https://doi.org/10.1016/j.intimp.2017.06.030
Lee D.G., Kim H.K., Park Y. et al. // Arch. Pharm. Res. 2003. V. 26. № 8. P. 597. https://doi.org/10.1007/BF02976707
Di Costanzo A., Angelico R. // Molecules. 2019. V. 24. № 11. Art. 2155. https://doi.org/10.3390/molecules24112155
El-Samaligy M.S., Afifi N.N., Mahmoud E.A. // Int. J. Pharm. 2006. V. 308. № 1–2. P. 140. https://doi.org/10.1016/j.ijpharm.2005.11.006
Feldman N.B., Gromovykh T.I., Sedyakina N.E. et al. // BioNanoSci. 2018. V. 8. № 4. P. 971. https://doi.org/10.1007/s12668-018-0556-x
Sun N., Wei X., Wu B. et al. // Powder Technol. 2008. V. 182. P. 72. https://doi.org/10.1016/j.powtec.2007.05.029
Abrol S., Trehan A., Katare O.P. // Drug Deliv. 2004. V. 11. № 3. P. 185. https://doi.org/10.1080/10717540490433958
Wu Y.P., Huo M.R., Zhou J.P. // Yaoxue Xuebao. 2009. V. 44. P. 651.
Bhatt S., Sharma J., Singh M., Saini V. // Acta Pharm. Sci. 2018. V. 56. № 3. P. 27. https://doi.org/10.23893/1307-2080.APS.05616
Cengiz M., Kutlu H.M., Burukoglu D.D., Ayhancı A. // Food Chem. Toxicol. 2015. V. 77. P. 93. https://doi.org/10.1016/j.fct.2014.12.011
Zhang, J.Q., Liu J., Li X.L., Jasti B.R. // Drug Deliv. 2007. V. 14. P. 381. https://doi.org/10.1080/10717540701203034
Громовых Т.И., Садыкова В.С., Луценко С.В. и др. // Прикладная биохимия и микробиология. 2017. Т. 53. № 1. С. 69. https://doi.org/10.7868/S0555109917010093
Liu K., Sun J., Wang Y. et al. // Drug Dev. Ind. Pharm. 2008. V. 34. № 5. P. 465. https://doi.org/10.1080/03639040701662230
Zhang X., Lu S., Han J. et al. // Pharmazie. 2011. V. 66. P. 404. https://doi.org/10.1691/ph.2011.0350
Elmowafy M., Viitala T., Ibrahim H.M. et al. // Eur. J. Pharm. Sci. 2013. V. 50. № 2. P. 161. https://doi.org/10.1016/j.ejps.2013.06.012
Balouiri M., Sadiki M., Ibnsouda S.K. // J. Pharm. Anal. 2016. V. 6. № 2. P. 71. https://doi.org/10.1016/j.jpha.2015.11.005
Garcia R.L., Rondero A.G. // J. Chem. Dermatol. Sci. Appl. 2015. V. 5. № 2. P. 62. https://doi.org/10.4236/jcdsa.2015.52008
Corchete P. // Bioactive molecules and medicinal plants / Eds. Ramawat K., Merillon J. Berlin; Heidelberg: Springer, 2008. P. 123. https://doi.org/10.1007/978-3-540-74603-4_6
Khan A.Q., Khan R., Tahir M. et al. // Nutr. Cancer. 2014. V. 66. № 2. P. 249. https://doi.org/10.1080/01635581.2014.863365
Dupuis M.L., Conti F., Maselli A. et al. // Front. Immunol. 2018. V. 9. Art. 1903. https://doi.org/10.3389/fimmu.2018.01903
Valenzuela A., Barría T., Guerra R., Garrido A. // Biochem. Biophys. Res. Commun. 1985. V. 126. P. 712. https://doi.org/10.1016/0006-291x(85)90243-8
Amin K., Dannenfelser R.M. // J. Pharm. Sci. 2006. V. 95. P. 1173. https://doi.org/10.1002/jps.20627
de Oliveira D.R., Tintino S.R., Braga M.F. et al. // BioMed Res. Int. 2015. Art. 292797. https://doi.org/10.1155/2015/292797
Yun D.G., Lee D.G. // IUBMB Life. 2017. V. 69. № 8. P. 631. https://doi.org/10.1002/iub.1647
Lee D.G., Kim H.K., Park Y. // Arch. Pharm. Res. 2003. V. 26. № 8. P. 597. https://doi.org/10.1007/BF02976707
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии