Российские нанотехнологии, 2021, T. 16, № 2, стр. 244-252
ВЛИЯНИЕ НАНОЧАСТИЦ ОКСИДА МЕДИ И СЕРЕБРА НА РАЗВИТИЕ УСТОЙЧИВОСТИ К Alternaria alternata У in vitro-КЛОНОВ ТОПОЛЯ
Т. А. Гродецкая 1, *, О. А. Федорова 1, П. М. Евлаков 1, О. Ю. Баранов 2, О. В. Захарова 3, 4, 5, А. А. Гусев 1, 3, 4, 5
1 Воронежский государственный лесотехнический университет им. Г.Ф. Морозова
Воронеж, Россия
2 Институт леса НАН Беларуси
Гомель, Беларусь
3 Тамбовский государственный университет им. Г.Р. Державина
Тамбов, Россия
4 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
5 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: tatyana.pokusina@yandex.ru
Поступила в редакцию 03.07.2020
После доработки 20.11.2020
Принята к публикации 26.11.2020
Аннотация
Исследовано влияние наночастиц оксида меди (CuO) и серебра (Ag) на экспрессию генов asr3, icdh, PR-1, PR-10, DREB2, используемых в качестве маркеров развития стрессоустойчивости, у in vitro-клонов тополя сорта ПОК в условиях искусственного заражения нитевидным аскомицетом Alternaria alternata. Воздействие фитопатогена вызывает активацию генов asr3, icdh, PR-1, PR-10, DREB2 у микроклонов на среде без наночастиц, что свидетельствует о развитии у них механизмов адаптации. Показатели экспрессии маркерных генов стрессоустойчивости у in vitro-клонов на среде с наночастицами CuO и Ag были снижены или не превышали значения, полученного для растений на среде без наночастиц. Наблюдаемое подавление стрессового ответа в условиях культивирования с CuO и Ag может быть обусловлено ингибирующим воздействием наночастиц на развитие Alternaria alternata, а также их влиянием на процессы развития in vitro-клонов тополя сорта ПОК, что связано с особенностями генотипа растений и концентрацией наночастиц.
ВВЕДЕНИЕ
Растительные организмы постоянно сталкиваются с влиянием различных факторов, включая действие вредителей и патогенных микроорганизмов, токсичных агрохимикатов, климатических условий и т.д. Традиционные стратегии защиты растений часто оказываются недостаточными, а применение химических препаратов может оказывать негативное воздействие на живые организмы и вызывать снижение плодородия почвы [1]. Использование достижений нанотехнологий для защиты растительных культур является передовым подходом, работающим по принципу “минимальное использование с максимальным эффектом” [2].
Наночастицы (НЧ) являются перспективными противомикробными агентами и все чаще рассматриваются как альтернатива антибиотикам. Имеется значительное количество работ, подтверждающих противомикробное действие НЧ серебра [3–5]. Например, в [6] показана высокая противогрибковая активность наносеребра против 18 различных патогенов, включая представителей родов Alternaria, Fusarium, Cladosporium, Pythium и др. В [7] показано биоцидное действие НЧ Ag в концентрациях 30–200 мг/л по отношению к Penicillium brevicompactum, Aspergillus fumigatus, Cladosporium cladosporoides, Chaetomium globosum и Stachybotrys chartarum. НЧ Ag, полученные методом “зеленого” синтеза, проявили антимикробную активность в отношении Erwinia sp., Pseudomonas syringe, Bacillus megaterium, Fusarium graminearum, F. avenaceum и F. culmorum [8]. НЧ Ag генерируют активные формы кислорода (АФК), которые ответственны за окисление клеточных компонентов [9], при этом клетки становятся нестабильными на физиологическом и генетическом уровне, нарушаются обмен веществ и процесс деления. НЧ Ag также влияют на формирование биопленки, предотвращая ее рост, путем связывания с мембраной клеток они изменяют ее проницаемость и мембранный потенциал [10, 11].
Медь является важным микроэлементом, входящим в состав многих белков и металлоферментов, играет важную роль в здоровье и питании растений. Благодаря антимикробной активности НЧ Cu находят новые применения в сельском хозяйстве, здравоохранении и промышленности [12]. НЧ Cu и CuO продемонстрировали высокую эффективность против ряда фитопатогенных организмов [13, 14]. Результаты показали, что CuO в концентрации 250 мкг/мл вызывает гибель R. solanacearum. Установлено, что CuO могут взаимодействовать с бактериальными клетками, предотвращая образование биопленки, снижать подвижность и нарушать выработку аденозинтрифосфата. Методом просвечивающей электронной микроскопии (ПЭМ) показано наномеханическое повреждение цитомембраны, что сопровождалось поглощением множества НЧ. Кроме того, молекулярные исследования выявили подавление ряда генов, связанных с патогенезом и подвижностью [15]. Исследование противогрибковой активности биосинтезированных НЧ оксида против растительных патогенов показало значительное ингибирование Fusarium culmorum и Aspergillus niger при 100 мкг/мл [16]. Исследование влияния сферических НЧ Cu размером 20–50 нм на развитие Fusarium sp. показало, что при использовании концентрации 450 ч/млн после девятидневной инкубации подавление роста грибков составило 93.98% [17].
В [18] исследовали влияние НЧ Ag и Cu на патоген пшеницы (Pseudocercosporella herpotrichoides) и на растения пшеницы различных сортов и предположили, что влияние НЧ на фитопатоген происходит не напрямую, а опосредованно через формирование в организме растения свободных радикалов, которое было зафиксировано с помощью реакции тиобарбитуровой кислоты с маркерами перекисного окисления липидов.
При достаточно изученных механизмах влияния наноматериалов на микроорганизмы механизмы протекторного действия по отношению к растениям на данный момент известны не до конца. Возможно, имеет место стимуляция собственного иммунитета растений, а не только прямое действие на возбудителей. Кроме того, механизмы токсического воздействия на растения также до конца не изучены.
Формирование ответа растительного организма на стресс начинается на уровне экспрессии генов стрессоустойчивости. Воздействие стресса индуцирует в растениях ответную реакцию, проявляющуюся на физиологическом, биохимическом и молекулярно-генетическом уровнях, что ведет к изменению экспрессии генов стрессоустойчивости [19–21]. В ходе взаимодействия растительного организма с патогеном происходит активация или ингибирование различных семейств генов, например, ферментов фенилпропаноидного пути, антиоксидантных систем, связанных с патогенезом (pathogenesis-related, PR) белков [22, 23], при этом 2,6-дихлоризоникотиновая и салициловая кислоты являются мощными индукторами защитных механизмов, способствующих развитию повышенной устойчивости к болезням [24]. Открытие новых генов, определение паттернов их экспрессии в ответ на абиотический стресс и лучшее понимание их роли в адаптации к стрессу (полученной с помощью функциональной геномики) обеспечат основу эффективных стратегий, направленных на получение стрессоустойчивых форм [25]. Гены ферментов, индуцируемых в ответ на стрессовые воздействия, могут использоваться в качестве маркеров развития устойчивости для отбора перспективных генотипов, введения их в культуру in vitro и массового тиражирования с целью лесовосстановления.
Анализ экспрессии генов с использованием маркеров стрессоустойчивости при применении нанопрепаратов в условиях культивирования in vitro является актуальным для оценки эффективности использования НЧ для повышения адаптации растений к неблагоприятным условиям. Однако сведений о влиянии НЧ Ag и CuO на экспрессию генов растений мало [26–29], а тополя нет совсем.
В связи с этим для выяснения молекулярно-генетических механизмов формирования ответа растительного организма на воздействие НЧ было исследовано влияние НЧ CuO и Ag на экспрессию генов asr3, icdh, PR-1, PR-10, DREB2, используемых в качестве маркеров развития стрессоустойчивости, у in vitro-клонов тополя в условиях искусственного заражения нитевидным аскомицетом Alternaria alternata.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Наночастицы. В работе использовали НЧ оксида меди и серебра. НЧ CuO получали золь-гель-методом [30] с использованием реагентов фирмы Sigma-Aldrich (США). К водному раствору CuCl2 · 2H2O (0.2 М) добавляли 1 мл ледяной уксусной кислоты и нагревали до 100°C при постоянном перемешивании. При помощи NaOH (8 М) раствор доводили до pH = 7 ± 0.2, при этом цвет суспензии изменялся с зеленого на черный и наблюдалось выпадение осадка. Полученный осадок доосаждали центрифугированием при 6000 об./мин и промывали 4 раза дистиллированной водой. Осадок сушили на воздухе в течение 24 ч. Раствор НЧ готовили путем диспергирования в ультразвуковой ванне Ultrasonic Cleaner CD-4800 (Codyson, Китай) 20 мг порошка в 100 мл дистиллированной воды (pH = 7 ± 0.2) в течение 5 мин. Таким образом, получали суспензию с концентрацией НЧ 200 мг/л.
НЧ Ag получали методом химического восстановления [31]. Для этого к 50 мл водного раствора, содержащего 0.2 г натриевой соли сульфоэтоксилата додеканола (SLES, 70%-ный водный раствор Hansa), по каплям при интенсивном перемешивании добавляли 50 мл водного раствора, содержащего 0.062 г нитрата серебра (Sigma-Aldrich). Через 15 мин после смешения к реакционной системе также по каплям при интенсивном перемешивании добавляли 100 мл раствора, содержащего 0.028 г боргидрида натрия (Acros Organics). Концентрация наносеребра в полученной дисперсии составляла 200 мг/л.
Анализ морфологии частиц проводили методом ПЭМ на микроскопе Leo 912 AB Omega (Leo Ltd., Германия). Исследование размера НЧ и агрегатов в коллоидных системах проводили на анализаторе Zetasizer Nano ZS (Malvern Instruments ltd., Великобритания).
Постановка эксперимента по воздействию наночастиц на фитопатогены. В качестве объекта исследования использовали in vitro-клоны тополя сорта Пирамидально-осокоревый Камышинский (ПОК).
Предварительные исследования показали, что наилучшие результаты на стадии введения в культуру in vitro получены при концентрации НЧ CuO и Ag 5 мг/л. Данную концентрацию использовали на всех этапах отработки технологии. In vitro-клоны тополя выращивали на агаризованной питательной среде WPM [32], в которую добавляли растворы НЧ CuO и Ag. В качестве контроля использовали питательную среду без добавления НЧ. Условия климатического режима: 16-часовой фотопериод при освещенности 2–3 клк, температура 24–26°С.
Для искусственного заражения микроклонов тополя использовали культуру фитопатогенного гриба Alternaria alternata, возбудителя альтернариоза растений. Исследуемую культуру выращивали на косом питательном агаре Чапека следующего состава (г/л): сахароза – 30.0, NaNO3 – 2.0, K2HPO4 – 1.0, MgSO4 – 0.5, KCl – 0.5, FeSO4 – 0.01, агар – 16.0, вода дистиллированная – 1 л, рН – 7.0–7.3. Использовали заспорованную культуру гриба, которую смывали стерильной водой и доводили до титра 2 × 106 спор/мл. Титр спор подсчитывали в камере Горяева. Заражение микроклонов проводили путем опрыскивания растений суспензией спор, а также заражением питательной среды. Контрольная группа растений заражению не подвергалась. Микроклоны опытной и контрольной групп были отобраны через два дня после заражения и немедленно зафиксированы в низкотемпературной камере хранения при –80°С.
Качественное и количественное исследования РНК. Выделение РНК из образцов тополя проводили с использованием стандартного набора колонок NucleoSpin® RNA Plant (Macherey-Nagel, Германия). Полученные препараты РНК анализировали методом электрофореза в 1%-ном агарозном геле с использованием интеркалирующего красителя SYBR Green I (Lumiprobe, США), результат визуализировали с использованием гель-документирующей системы Infinity VX2 1126MX X-Press (Vilber Lourmat, Франция).
Концентрацию РНК определяли на флюориметре Qubit 2.0 (Thermo Fisher Scientific, США) с использованием набора реактивов Qubit RNA BR Assay Kit (Thermo Fisher Scientific, США).
Обратную транскрипцию проводили с помощью стандартного набора с MMLV-RH (Диаэм, Россия), используя 0.5–1 мкг суммарной РНК.
Подбор праймеров к генам устойчивости. Согласно [33–36] были выбраны гены-кандидаты для оценки стрессоустойчивости у образцов тополя. Подбор праймеров к генам устойчивости образцов осуществляли на основе нуклеотидных последовательностей, представленных в международной базе данных NCBI. Праймеры к последовательностям генов стрессоустойчивости подбирали в программе Primer3. Данные олигонуклеотидные последовательности представлены в табл. 1.
Таблица 1.
Последовательности праймеров к генам стрессоустойчивости тополя
| Ген | Последовательность, 5' → 3' |
|---|---|
| asr3 | F: CATGCATGAGAAGCACGAGT |
| R: GGTGGTGCTTCTTTCCGTTA | |
| icdh | F: ACTCGGCATTACAGGGTTCA |
| R: GACTCCACAGCTCCGATACA | |
| PR-1 | F: TTATGGCGAGAACCTTGCAT |
| R: CATTGCTGCACCTTGCTTTA | |
| DREB2 | F: TGTATGCTCGTATGCTCGT |
| R: TCCTCATACACGCAGACCTC | |
| PR-10 | F: GAAGCCAATGTTTGGAAGGA |
| R: TGGATTGGCCAAGAAGTAGG | |
| 18S | F: GGCTCTGCCCGTTGCTCT |
| R: CGTCACCCGTCACCACCA |
Полимеразную цепную реакцию проводили с помощью стандартного набора реагентов в присутствии красителя SYBR Green I (Синтол, Россия) с использованием CFX96 (Bio-Rad, США), детекция накопления продукта осуществлялась в реальном времени. Параметры реакции: 95°С – 3 мин, затем 45 циклов из стадий 95°С – 10 с, 60°С – 30 с, 72°С – 30 с, затем финальная элонгация 72°С – 2 мин. В качестве референсного использовался ген 18S. Относительный уровень транскриптов определяли с использованием 2-ΔΔCt-метода c помощью программного пакета CFX Manager (Bio-Rad, США).
Все эксперименты проводили в трехкратной биологической и аналитической повторности. Статистическую обработку данных осуществляли с использованием программы Microsoft Excel 2010 (пакет “Описательная статистика”) с применением однофакторного дисперсионного анализа (ANOVA) при 5%-ном уровне значимости.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеризация наночастиц. Электронно-микроскопическое исследование полученных НЧ CuO и Ag показало, что они имеют форму, близкую к сферической (рис. 1, 2). Согласно ПЭМ-изображениям средний размер НЧ CuO находится в диапазоне 5–25 нм, причем они склонны к агрегации (рис. 1). Анализ микрофотографий наносеребра показывает, что средний размер частиц Ag составляет ~10–30 нм (рис. 2).
В ходе анализа дисперсного состава методом динамического рассеяния света суспензий НЧ установлено, что коллоидный раствор НЧ CuO характеризуется более широким распределением частиц от 2 до 30 нм (рис. 3а), для НЧ Ag наблюдался более узкий размерный диапазон – 10–30 нм (рис. 3б) – с максимальным пиком в районе 15 нм. Таким образом, установлено, что средний размер НЧ CuO равен 5–30 нм, НЧ Ag – 10–30 нм.
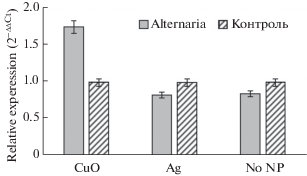
Исследование влияния наночастиц на экспрессию генов устойчивости. Для исследования влияния НЧ на микроклоны тополя проведен анализ экспрессии генов стрессоустойчивости. Выявлено, что у in vitro-клонов, содержащихся на среде с НЧ CuO, уровень транскриптов генов asr3, PR-10, DREB2 выше, чем в вариантах на среде без НЧ в 1.9–80.6 раза (рис. 4).
Рис. 4.
Относительная экспрессия генов стрессового ответа у in vitro-клонов тополя на среде с НЧ CuO и Ag; серые столбцы – экспрессия генов на среде с CuO, белые – на среде с Ag.

Сверхэкспрессия генов стрессового ответа (в 2–53 раза) наблюдалась также для образцов на среде с НЧ Ag (рис. 4). В то же время экспрессия PR-1 достоверно не изменялась при помещении клонов на среды с НЧ CuO и Ag. Для гена icdh на среде с НЧ Ag также не было выявлено изменения экспрессии.
Значительная активация генов стрессового ответа asr3, PR-10, DREB2 у микроклонов, помещенных на среду, содержащую НЧ CuO и Ag, свидетельствует о влиянии на метаболизм растений. При этом НЧ Ag не оказывают значительного влияния на гены PR-1 и icdh, а НЧ Cu – на ген PR-1. Высокое содержание в среде культивирования НЧ способно вызывать осмотический стресс, активируя механизмы активной защиты у in vitro-клонов тополя.
Изучение влияния Alternaria alternata на экспрессию генов устойчивости. Экспрессия генов стрессового ответа была проанализирована у in vitro-клонов тополя после заражения Alternaria alternata в течение двух дней. Этого времени достаточно для того, чтобы фитопатоген через корневую систему начал проникать в растение (рис. 5). Относительный уровень транскриптов PR-1 увеличивался у образцов тополя, помещенных на среду с НЧ CuO и Ag, в 3.5 и 27 раз соответственно относительно образцов на среде без НЧ (рис. 6).
Рис. 6.
Уровень экспрессии гена PR-1 у микроклонов тополя ПОК под воздействием Alternaria alternata. CuO – микроклоны на среде с НЧ оксида меди, Ag – микроклоны на среде с НЧ серебра, No NP – микроклоны на среде без НЧ.
Активация PR-белков происходит под воздействием патогенов, абиотического стресса, что обусловлено гиперчувствительным ответом (hypersensitive response, HR) и системной приобретенной резистентностью (systemic acquired resistance, SAR) [23]. PR-1 индуцируется патогенами или салициловой кислотой и используется в качестве SAR-маркера [23]. Ранее активация генов, кодирующих PR-1, сообщалась для гибридного тополя (Populus trichocarpa × P. deltoides) во время заражения листовой ржавчиной Melampsora medusae на протяжении всего периода воздействия патогена [37, 38].
PR-10 представляют мультигенное семейство, включающее в себя аллергены пыльцы деревьев, активность которого регулируется в ходе развития растений и при воздействии факторов окружающей среды [23]. Экспрессия гена PR-10 увеличивалась в 1.7 раза у микроколонов на среде с CuO, в то время как у растений на среде с Ag и контрольной группы достоверных изменений выявлено не было (рис. 7).
Индукция экспрессии PR-10 показана в иглах Pinus monticola при заражении Cronartium ribicola [39], а также индукция белка PR-10 была выявлена в тканях коры корней псевдотсуги (Pseudotsuga menziesii), зараженных грибковым патогеном Phellinus sulphurascens [40]. У гибридного тополя (P. trichocarpa × P. deltoides) взаимодействие с патогеном Melampsora laricipopulina вызывало активацию транскриптов PR-10 [41].
Ген PR-1 в ответ на воздействие НЧ Ag или Cu не активировался, в то же время экспрессия PR-10 значительно увеличивалась при воздействии обоих типов НЧ. Воздействие Alternaria alternata активировало PR-1, тогда как экспрессия PR-10, напротив, была снижена относительно вариантов, инкубированных на средах с НЧ без воздействия патогена. PR-белки в отличие от других использованных в исследовании являются специфическими факторами ответа на воздействие биотического стресса. Выявлено, что воздействие НЧ хитозана значительно активировало экспрессию генов PR-1, PR-2, PR-8 и PR-9 у растений томата, зараженных Fusarium andiyazi [42]. При этом НЧ хитозана обладали выраженным антифунгальным действием. Воздействие НЧ может усиливать защитный ответ растения на фитоинфекцию, с одной стороны, что проявляется в увеличении экспрессии генов стрессового ответа, и в то же время ингибировать активность патогена, с другой стороны, что снижает агрессивность воздействия и влечет уменьшение уровня транскриптов стрессовых генов.
PR-1 и PR-10 наряду с другими белками данного семейства играют важную роль в естественной защите от вредителей и патогенов, образуя точку пересечения для ответных метаболических сетей, реагируя с различными индукторами, такими как салициловая кислота, жасмоновая кислота, систерин и этилен [43].
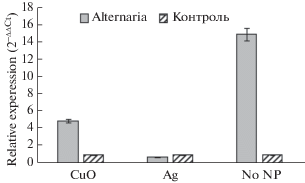
Выявлено, что уровень транскриптов гена asr3 увеличивается при воздействии Alternaria alternata у in vitro-клонов тополя на среде с НЧ СuO, а также на среде без НЧ в 4.5 и 14.5 раза соответственно. У микроклонов на среде с НЧ Ag экспрессия относительно контроля не изменяется (рис. 8).
Растительное семейство АБК-индуцируемых генов (ABA-stress-ripening, ASR) активируется в ответ на воздействие абиотического стресса в виде засухи, засоления, воздействия металлов (алюминия) [44, 45]. Сверхэкспрессия OsASR2 усиливала устойчивость к Xanthomonas oryzae pv. oryzae и Rhizoctonia solani и устойчивость к засухе у растений риса [46].
Транскрипционные факторы играют важную роль в реакции растений на биотический стресс, проявляя дифференциальную экспрессиию при заражении бактериальной, грибковой и вирусной инфекцией [47].
DREB2 относится к семействам генов транскрипционных факторов, выступающих в качестве главного регулятора реакции растений на стресс. Ранее было установлено, что DREB2 вовлечен в развитие толерантности к солевому стрессу у тополя евфратского [35].
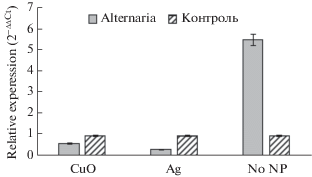
Экспрессия DREB2 у микроклонов тополя на средах с НЧ СuO и Ag, подверженных воздействию Alternaria alternata, была снижена, в то время как у микроклонов на среде без НЧ наблюдалась активация DREB2 в 5.6 раза относительно контрольных образцов (рис. 9)
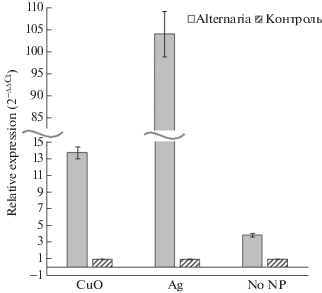
Для гена icdh выявлено увеличение экспрессии при воздействии фитопатогенов в 7.2–13.8 раза у всех анализируемых групп (рис. 10).
Ген icdh кодирует НАДФ-изоцитратдегидрогеназу (никотинамидадениндинуклеотидфосфат), поставляющую восстановленный НАДФ+ в ходе ферментативной реакции превращения изоцитрата в 2-оксоглутарат [48]. Процесс углеродной фиксации в ходе фотосинтеза обеспечивает поставку углеводных соединений (триозофосфатов), служащих углеродными скелетами для синтеза первичных метаболитов, таких как аминокислоты, жирные кислоты, фитогормоны (АБК, этилен, жасмоновая и салициловая кислоты), антимикробных соединений, таких как камалексин, и полимеров, усиливающих клеточную стенку (каллоза и лигнин), необходимых для защиты при патогенной атаке. Синтез этих первичных и специализированных метаболитов и полимеров часто требует потребления АТФ и НАДФН, а иногда и O2, трех конечных продуктов фотосинтетических световых реакций. При инвазии бактериальные патогены используют комбинацию различных факторов вирулентности, таких как эффекторные белки и фитотоксины, которые приводят к перепрограммированию фотосинтеза и разрушению хлорофилла [49]. Увеличение активности НАДФ-изоцитратдегидрогеназы способствует поставке восстановленных эквивалентов НАДФН и углеродных скелетов в виде 2-оксоглутарата для синтеза первичных метаболитов, участвующих в защите растения от инфекции, что служит компенсаторной реакцией при снижении фотосинтетического выхода данных продуктов.
Установлено, что НЧ оказывают значительное влияние на развитие фитопатогенов. Раствор НЧ СuO ингибировал развитие колоний Alternaria alternata, Fusarium oxysporum и Fusarium avenaceum. Для НЧ Ag также было выявлено антифунгальное действие по отношению к Alternaria alternata, значительное подавление роста колоний Fusarium avenaceum, однако наблюдалась индукция роста Fusarium oxysporum (данные не представлены). Антифунгальное воздействие ранее было выявлено для НЧ оксида цинка и диоксида титана [50].
В [51] показано, что НЧ CuO (20–40 нм) могут аккумулироваться в растениях кукурузы и подвергаться биотрансформации, восстанавливаясь из формы Cu(II) в Cu(I) в ходе перемещения по флоэме. Также было продемонстрировано подавление развития проростков кукурузы, вызванное воздействием НЧ CuO.
Полученные результаты показывают, что воздействие НЧ CuO и Ag может провоцировать стрессовый ответ у in vitro-клонов тополя, выражающийся в активации генов, индуцируемых воздействием осмотического стресса. В то же время интенсивность стрессового ответа снижается при заражении клонов Alternaria alternata, что может быть обусловлено подавлением активности патогена и/или снижением стрессоустойчивости растений тополя.
ЗАКЛЮЧЕНИЕ
Воздействие Alternaria alternata на in vitro-клоны тополя провоцирует развитие ответной реакции в виде значительной активации стрессовых генов (asr3, icdh, DREB2) на среде без наночастиц, что свидетельствует о развитии у них механизмов адаптации, в то время как стрессовый ответ у микроклонов на среде с наночастицами CuO и Ag снижен либо не отличается относительно контрольной группы на среде без наночастиц по четырем из пяти проанализированным генам устойчивости. Возникновение данного эффекта могло быть спровоцировано влиянием наночастиц на метаболизм, в значительной степени обусловленным особенностями исследуемого генотипа тополя, а также игибирующим воздействием наночастиц на развитие патогена, что вызывало снижение экспрессии генов стрессоустойчивости.
Таким образом, воздействие Alternaria alternata провоцирует стрессовый ответ у in vitro-клонов тополя, при этом данный эффект суммируется с влиянием наночастиц оксида меди и серебра, что приводит к активации генов стрессового ответа и способствует развитию устойчивости у растений. Развитие осмотического стресса может быть спровоцировано влиянием наночастиц в результате их аккумуляции в различных частях растения и включения в процессы метаболизма. Использование наночастиц в процессе культивирования in vitro требует тщательного подбора концентрации и типа наночастиц с учетом особенностей генотипа растения и вида патогена.
Список литературы
Mazzaglia A., Fortunati E., Kenny J.M. et al. // Nanotechnol. Agriculture Food Sci. 2017. V. 7. P. 113.
Ojha S., Singh D., Sett A. et al. // Ch. 16 – Nanotechnology in Crop Protection. Nanomaterials in Plants, Algae, and Microorganisms. Concepts and Controversies. V. 1. Guwahati: Academic press, 2018. P. 345.
Jung J.H., Kim S.W., Min J.S. et al. // Mycobiology. 2010. V. 38. № 1. P. 39.
Singh R., Shedbalkar U.U., Wadhwani S.A. et al. // Appl. Microbiol. Biotechnol. 2015. V. 99. № 11. P. 4579.
Mishra S., Singh H.B. // Appl. Microbiol. Biotechnol. 2015. V. 99. № 3. P. 1097.
Kim S.W., Jung J.H., Lamsal K. et al. // Mycobiology. 2012. V. 40. № 1. P. 53.
Ogar A., Tylko G., Turnau K. // Sci. Total. Environ. 2015. V. 521. P. 305.
Gautam N., Salaria N., Thakur K. et al. // Proc. Natl. Acad. Sci. India. B. 2020. V. 90. № 2. P. 439.
Chatzimitakos T.G., Stalikas C.D. // J. Proteome Res. 2016. V. 15. № 9. P. 3322.
Dakal T.C., Kumar A., Majumdar R.S., Yadav V. // Front. Microbiol. 2016. V. 7. P. 1831.
Singh A., Gautam P.K., Verma A. et al. // Biotechnol. Rep. (Amst). 2020. V. 25. P. e00427.
Kasana R.C., Panwar N., Kaul R., Kumar P. // Nanosci. Food Agriculture 3. 2017. V. 23. P. 129.
Malandrakis A.A., Kavroulakis N., Chrysikopoulos C.V. // Sci. Total Environ. 2019. V. 670. P. 292.
Giannousi K., Avramidis I., Dendrinou-Samara C. // RCS Adv. 2013. V. 3. P. 21743.
Chen J., Mao S., Xua Z., Ding W. // RSC Adv. 2019. V. 9. P. 3788.
Vanathi P., Rajiv P., Sivaraj R. // Bull. Mater. Sci. 2016. V. 39. P. 1165.
Viet P.V., Nguyen H.T., Cao T.M., Hieu L.V. // J. Nanomater. 2016. V. 2016. P. 1.
Belava V.N., Panyuta O.O., Yakovleva G.M. // Nanoscale Res Lett. 2017. V. 12. P. 250.
Chinnusamy V., Zhu J., Zhu J.K. // Trends Plant Sci. 2007. V. 12. № 10. P. 444.
Bartels D., Sunkar R. // Critical Rev. Plant Sci. 2005. V. 24. № 1. P. 23.
Shinozaki K., Yamaguchi-Shinozaki K. // J. Experimental Botany. 2007. V. 58. № 2. P. 221.
Boava L.P., Kuhn O.J., Pascholati S.F. et al. // Australasian Plant Pathology. 2009. V. 38. № 6. P. 594.
Veluthakkal R., Dasgupta M.G. // Trees. 2010. V. 24. № 6. P. 993.
Conrath U., Chen Z., Riciglianot J.R., Klessigt D.F. // Proc. National Acad. Sci. 1995. V. 92. № 16. P. 7143.
Cushman J.C., Bohnert H.J. // Curr. Opin. Plant Biol. 2000. V. 3. № 2. P. 117.
Deabes M.M., Khalil W.K.B., Attallah A.G. et al. // Open Access Maced. J. Med. Sci. 2018. V. 6. № 4. P. 600.
Ramezani M., Asghari S., Gerami M. et al. // Sugar Tech. 2020. V. 22. № 3. P. 518.
Kaveh R., Li Y.S., Ranjbar S. et al. // Sci. Technol. 2013. V. 47. № 18. P. 10637.
Mosa K.A., El-Naggar M., Ramamoorthy K. et al. // Front. Plant. Sci. 2018. V. 9. P. 872.
Kshirsagar J.M., Shrivastava R., Adwani P.S. // Thermal Sci. 2017. V. 21. № 1A. P. 233.
Iravani S., Korbekandi H., Mirmohammadi S.V., Zolfaghari B. // Res. Pharm. Sci. 2014. V. 9. № 6. P. 385.
Lloyd G., McCown B.H. // Comb. Proc. Int. Plant Prop. Soc. 1980. V. 30. P. 421.
Pääkkönen E., Seppänen S., Holopainen T. et al. // New Phytologist. 1998. V. 138. № 2. P. 295.
Kushiro T., Okamoto M., Nakabayashi K. et al. // EMBO J. 2004. V. 23. № 7. P. 1647.
Chen J., Xia X., Yin W. // Biochem. Biophys. Res. Commun. 2009. V. 378. № 3. P. 483.
Wu H.L. Li L., Cheng Z.C. et al. // Genetics Molecular Res. 2015. V. 14. № 3. P. 10206.
Miranda M., Ralph S.G., Mellway R. et al. // Molecular Plant-Microbe Interactions. 2007. V. 20. № 7. P. 816.
Duplessis S., Major I., Martin F. et al. // Critical Rev. Plant Sc. 2009. V. 28. № 5. P. 309.
Ekramoddoullah A.K.M. // J. Crop Improvement. 2004. V. 10. № 1–2. P. 261.
Sturrock R.N., Islam M.A., Ekramoddoullah A.K.M. // Phytopathology. 2007. V. 97. № 11. P. 1406.
Rinaldi C., Kohler A., Frey P. et al. // Plant Physiol. 2007. V. 144. № 1. P. 347.
Chun S.C., Chandrasekaran M. // Int. J. Biological Macromolecules. 2019. V. 125. P. 948.
Hernández I., Portieles R., Chacón O. et al. // Biotecnología Aplicada. 2005. V. 22. № 4. P. 256.
Li J., Li Y., Yin Z. et al. // Plant biotechnology journal. 2017. V. 15. № 2. P. 183.
Sade H., Meriga B., Surapu V. et al. // Biometals. 2016. V. 29. № 2. P. 187.
Li N., Wei S., Chen J. et al. // Plant Biotechnol. J. 2018. V. 16. № 3. P. 771.
Amorim A., da Fonseca dos Santos R., Pacifico Bezerra Neto J. et al. // Curr. Protein Peptide Sci. 2017. V. 18. № 4. P. 335.
Leterrier M., del Río L.A., Corpas F.J. // Free Radical Res. 2007. V. 41. № 2. P. 191.
Lu Y., Yao J. // Int. J. Molecular Sci. 2018. V. 19. № 12. P. 3900.
Захарова О.В., Гусев А.А. // Российские нанотехнологии. 2020. Т. 14. № 9–10. С. 3.
Wang Z., Xie X., Zhao J. et al. // Environ. Sci. Technol. 2012. V. 46. № 8. P. 4434.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии