Российские нанотехнологии, 2021, T. 16, № 2, стр. 261-268
НАНОРАЗМЕРНЫЙ ОКСИД АЛЮМИНИЯ – БИОНАКОПЛЕНИЕ И ТОКСИКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ПРИ АЛИМЕНТАРНОМ ПОСТУПЛЕНИИ
Н. В. Зайцева 1, М. А. Землянова 1, 2, 3, *, М. С. Степанков 1, 2, А. М. Игнатова 1, 3
1 Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения
Пермь, Россия
2 Пермский государственный национальный исследовательский университет
Пермь, Россия
3 Пермский национальный исследовательский политехнический университет
Пермь, Россия
* E-mail: zem@fcrisk.ru
Поступила в редакцию 31.08.2020
После доработки 09.10.2020
Принята к публикации 25.01.2021
Аннотация
Многократное пероральное поступление наночастиц оксида алюминия (Al2O3) в течение 10 сут в суммарной дозе 21 895 мг/кг массы тела вызывает гибель 50% особей экспонируемой группы, в то время как при экспозиции микрочастицами Al2O3 в аналогичной дозе гибель составляет 25%. Концентрации алюминия после экспозиции наноматериалом повышаются относительно контрольных уровней в головном мозге, печени и крови экспонированных животных в 4.40, 1.23 и 1.48 раза соответственно, после экспозиции микроматериалом – в головном мозге в 3.59 раза и крови в 1.82 раза. Концентрации алюминия при действии наноматериала выше, чем при действии микроматериала, в головном мозге в 1.23 раза и печени в 1.41 раза. При экспозиции нанодисперсным Al2O3 зафиксированы острое венозное полнокровие печени, эозинофильная инфильтрация слизистой желудка, гиперплазия лимфоидной ткани и увеличение объема белой пульпы селезенки до 70%. При экспозиции микрочастицами Al2O3 патоморфологические изменения отмечены только в тканях селезенки в виде гиперплазии лимфоидной ткани и увеличения объема белой пульпы до 50%. Интратрахеальная инстилляция нано- и микрочастиц Al2O3 вызывает повреждения альвеолярных макрофагов. При действии наночастиц степень повреждений и их количество выше в 2.50 и 8 раз соответственно, диаметр повреждений в 2.25 раза меньше. Высокий показатель гибели животных, особенности бионакопления, патоморфологических изменений тканей органов при пероральной экспозиции и повреждения альвеолярных макрофагов при интратрахеальной экспозиции наночастицами Al2O3 указывают на большую токсичность наноматериала при алиментарном поступлении в организм в сравнении с микродисперсным аналогом.
ВВЕДЕНИЕ
Пищевая промышленность является одной из перспективных отраслей применения нанотехнологий в хозяйственной деятельности человека [1]. Включение наноматериалов в состав продуктов питания и пищевых упаковок в качестве красителей, биоцидных компонентов, противослеживающих добавок обеспечивает эффективное повышение качества продукции, выпускаемой предприятиями данной отрасли. При всех своих положительных свойствах наноматериалы обладают высокой проникающей способностью через защитные барьеры организма и реакционной активностью, следствием чего может являться увеличение токсических свойств при поступлении в организм в процессе производства и потребления продукции, содержащей в своем составе наноматериалы [2].
Одним из активно применяющихся в пищевой промышленности материалов являются наночастицы (НЧ) оксида алюминия (Al2O3). Наноразмерный Al2O3 входит в состав консервантов, красителей, противослеживающих добавок, эмульгаторов, соевых детских смесей, защитных антибактериальных упаковок [3–5]. Поступление в организм человека НЧ Al2O3 возможно и через продукцию сельского хозяйства, для выращивания которой используют регуляторы роста растений, содержащие в своем составе соединения, образующиеся в процессе гидролиза НЧ оксида алюминия [6].
С помощью in vitro- и in vivo-исследований установлено, что НЧ Al2O3 способны генерировать активные формы кислорода [7], обладают цитотоксичностью [8], накапливаются в различных органах и тканях, вызывая патоморфологические изменения [7, 9], воздействуют на протеомный профиль [10], имеют такие отдаленные эффекты токсичности, как канцерогенность и генотоксичность [11, 12].
В связи с активным применением в пищевой промышленности НЧ Al2O3 возрастает риск алиментарного поступления в организм наноматериала, обладающего токсическими свойствами, что может привести к увеличению числа случаев заболеваний центральной нервной системы, желудочно-кишечного тракта и крови [13]. Исходя из сказанного выше, исследования, направленные на изучение токсиколого-гигиенических свойств НЧ Al2O3 при алиментарном поступлении в организм, приобретают особую актуальность.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве тестируемого образца использовали порошок нанодисперсного Al2O3 (CAS 1344-28-1, продукт № 718475) производства компании Sigma Aldrich (США). Для сравнительного анализа использовали порошок микродисперсного Al2O3 (CAS 1344-28-1, продукт № 265497) производства той же компании.
Оценка размера частиц Al2O3 выполнена в водных суспензиях методом динамического рассеяния света (ДРС) на анализаторах Horiba LB-550 (Horiba, Япония) и Microtrac S3500 (Microtrac, США), а также в виде нативных порошков методом сканирующей электронной микроскопии (СЭМ) на микроскопе высокого разрешения S-3400N (HITACHI, Япония). Исследование и оценка удельной площади поверхности частиц Al2O3 выполнены методом БЭТ (Брунауэра, Эммета и Теллера) на приборе ASAP 2020 (Micromeritics, США).
Исследования на животных проведены в соответствии с требованиями этического комитета ФНЦ медико-профилактических технологий управления рисками здоровью населения и Руководством по уходу и использованию лабораторных животных [14]. Исследование токсичности НЧ Al2O3 при алиментарном поступлении осуществляли в экспериментах по изучению действия тестируемого наноматериала при многократном пероральном и однократном интратрахеальном введении. Исследование токсического действия НЧ Al2O3 при многократной пероральной экспозиции проводили на половозрелых самцах крыс линии Wistar массой 250–300 г в соответствии с методикой, предложенной в [15]. Экспериментальных животных (n = 24) случайным образом распределили на опытную группу (n = 8) для исследования водной суспензии нанопорошка, группу сравнения (n = 8) – для исследования микропорошка, и контрольную группу (n = = 8), не экспонированную изучаемыми материалами. Начальная исследуемая доза как для нано-, так и для микровещества составила 1510 мг/кг массы тела, что соответствует 1/10 от среднелетальной дозы (LD50) Al2O3 [16]. Каждые четверо суток дозу увеличивали в 1.5 раза. Для проведения пероральных экспозиций порошки нано- и микродисперсного Al2O3 переводили в форму суспензий на основе бидистиллированной воды. Необходимые концентрации суспензий рассчитывали с учетом средней массы животных в экспериментальных группах и объемом введения 1.5 см3/крысу. Для равномерного распределения частиц полученные водные суспензии подвергали обработке ультразвуковым гомогенизатором Sonopuls Hd (Bandelin, Германия) при комнатной температуре в течение 15 мин в режиме непрерывной пульсации на 80%-ной мощности. Экспозицию осуществляли до достижения гибели 50% особей в одной из групп. По показателю гибели установлено значение LD50 при многократном введении.
Выживших животных (опытная группа – 4 особи, группа сравнения – 6, контрольная группа – 8) для изучения особенностей бионакопления и патоморфологических изменений выводили из опыта через 24 ч после последней экспозиции методом цервикальной дислокации. Для изучения бионакопления алюминия у экспериментальных животных отбирали печень, почки, головной мозг и кровь. Забор крови осуществляли до эвтаназии из подъязычной вены в объеме 3 см3. Каждый отобранный орган делили на три части примерно одинаковой массы, две из них использовали для определения концентрации алюминия, одну – для гистологического исследования. В целом с учетом образцов крови концентрацию исследуемого вещества определяли в 126 образцах (количество образцов опытной группы – 28, группы сравнения – 42, контрольной группы – 56). Для установления патоморфологических изменений тканей органов проводили гистологическое исследование печени, почек, головного мозга, желудка и селезенки на 90 образцах (количество образцов опытной группы – 20, группы сравнения – 30, контрольной группы – 40).
Для определения концентрации алюминия отобранные образцы подвергали термическому озолению в течение 9 ч в муфельной печи при температуре 450–500°С. Количественное определение содержания алюминия в образцах осуществляли методом масс-спектрометрии с индуктивно связанной плазмой на масс-спектрометре Agilent 7500cx (Agilent, США) с октопольной реакционной/столкновительной ячейкой. В качестве газа-реактанта использовали гелий.
Для установления патоморфологических изменений тканей органов экспериментальных животных проведено гистологическое исследование. Извлеченные образцы фиксировали в 10%-ном растворе нейтрального формалина с добавлением фосфатного буфера. Дегидратацию фиксированных кусочков тканей проводили в автоматическом гистологическом процессоре “Excelsior ES” (Thermo Scientific, Германия). Гистологические препараты изготавливали из парафиновых срезов толщиной 3–4 мкм, окрашивая по общепринятой методике гематоксилином и эозином в роботе-окрашивателе “Varistain Gemini ES” (Thermo Scientific, Германия). Микрофотографии сделаны с помощью камеры “Mikroskopkamera AxioCam ERc 5s” (Carl Zeiss, Германия).
При алиментарном поступлении в организм некоторая доля НЧ может проникнуть в легкие интратрахеальным путем. В связи с этим проведено исследование реакции альвеолярных макрофагов при интратрахеальной экспозиции НЧ Al2O3. В качестве биологической модели использовали крыс-самцов линии Wistar массой 250–300 г. Экспериментальных животных (n = 27) случайным образом распределили на три группы: опытная группа (n = 9) – животные, экспонированные суспензией нанодисперсного Al2O3, приготовленной на основе стерильного изотонического 0.9%-ного раствора хлорида натрия (0.9% NaCl), группа сравнения (n = 9) – животные, экспонированные суспензией микродисперсного аналога на той же основе, контрольная группа (n = 9) – животные, получавшие стерильный изотонический физиологический раствор без тестируемых веществ. Для инстилляции использовали суспензии в концентрации 0.013 г/см3, вводимые интратрахеально под эфирным масочным наркозом в объеме 0.4 см3 на крысу. Животные контрольной группы получали 0.9% NaCl в аналогичном объеме. Через 24 ч после введения суспензий экспериментальным животным проводили однократное промывание дыхательных путей стерильным изотоническим физиологическим раствором в объеме 10 см3. Полученные промывные воды центрифугировали в течение 4 мин при 1000 об./мин. Надосадочную жидкость декантировали, из клеточного осадка готовили мазки. Высушенные препараты фиксировали метиловым спиртом в течение 1 мин и окрашивали азур-эозином по Романовскому в течение 20 мин. Для определения количества и диаметра повреждений проводили анализ цифровых изображений мазков, полученных с помощью светового микроскопа DМ 1000 (Leica, Германия) с иммерсионной системой с использованием универсального программного обеспечения ImageJ-FiJi. Степень повреждения макрофагов оценивали как долю повреждений от общей удельной площади их поверхности, вычисляемой по величине среднего размера единичного повреждения и частоте расположения повреждений на поверхности.
Математическую обработку результатов исследования осуществляли с помощью параметрических методов статистики, предварительно оценивали соответствие полученных результатов закону нормального распределения, выполняли расчет выборочного среднего (М) и стандартной ошибки (m), проверку гипотезы о совпадении выборочных средних с использованием t-критерия Стьюдента. Различия полученных результатов считали статистически значимыми при р ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
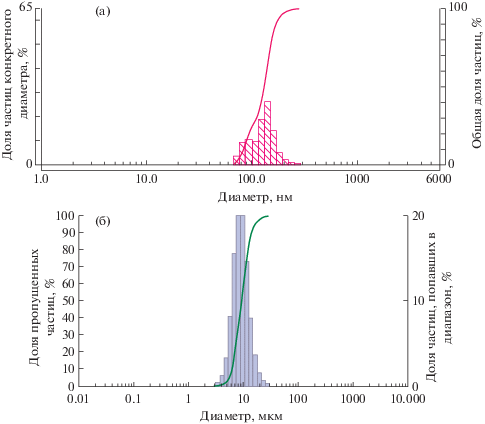
По результатам ДРС установлено, что средний размер частиц нанопорошка Al2O3 в водной среде составил 129.90 ± 11.46 нм, что в 103.62 раза меньше данного показателя частиц микродисперсного аналога (13.46 ± 3.14 мкм) (рис. 1). При верификации методом СЭМ средний размер частиц нанопорошка Al2O3 составил 40.48 ± 6.07 нм, что в 139.58 раза меньше данного показателя у микродисперсного аналога (5.65 ± 0.74 мкм) (рис. 2). Удельная площадь поверхности НЧ составила 113 м2/г, что в 161.43 раза больше значения у микрочастиц (0.70 м2/г).
Гибель 50% (n = 4) особей опытной группы при многократной пероральной экспозиции НЧ Al2O3 достигнута на 10-е сутки эксперимента, суммарная доза тестируемого вещества составила 21895 мг/кг массы тела. В группе сравнения гибель животных, экспонированных микроматериалом в той же дозе, составила 25% (n = 2).
После многократного перорального введения НЧ Al2O3 отмечено увеличение концентрации алюминия относительно контрольных значений в головном мозге, печени и крови экспонированных животных в 4.40 (р < 0.0001), 1.23 (р = 0.044) и 1.48 раза (р = 0.002) соответственно. После экспозиции микрочастицами Al2O3 повышение концентрации алюминия относительно контроля установлено в головном мозге в 3.59 раза (р = = 0.001) и крови в 1.82 раза (р = 0.007). Отмечено различие показателей бионакопления алюминия после экспозиций нано- и микрочастицами исследуемого химического соединения. При действии нанодисперсного вещества отмечено повышение концентрации алюминия в головном мозге в 1.23 раза (р = 0.036) и печени в 1.41 раза (р = = 0.020) относительно данного показателя при действии микродисперсного аналога. У животных экспонируемых групп статистически достоверных изменений по показателю концентрации алюминия в почках относительно контроля не установлено (табл. 1).
Таблица 1.
Результаты исследования бионакопления алюминия в органах и тканях крыс линии Wistar при многокртаной пероральной экспозиции водной суспензией нано- и микродисперсного Al2O3 (р ≤ 0.05)
| Группа животных |
Показатели | Концентрация алюминия в органе, мкг/г | ||||
|---|---|---|---|---|---|---|
| Мозг | Печень | Почки | Кровь | |||
| Контрольная группа | Среднее значение (M ± m) | 0.28 ± 0.002 | 0.62 ± 0.093 | 0.90 ± 0.202 | 0.06 ± 0.015 | |
| Группа сравнения | Среднее значение (M ± m) | 0.99 ± 0.180 | 0.54 ± 0.161 | 0.94 ± 0.111 | 0.11 ± 0.033 | |
| Межгрупповое различие с контролем (p) | 0.001 | 0.437 | 0.695 | 0.007 | ||
| Кратность различий с контролем | выше | 3.59 | 1.04 | 1.82 | ||
| ниже | 0.35 | |||||
| Опытная группа | Среднее значение (M ± m) | 1.21 ± 0.171 | 0.77 ± 0.114 | 0.97 ± 0.278 | 0.09 ± 0.009 | |
| Межгрупповое различие с контролем (p) | <0.0001 | 0.044 | 0.619 | 0.002 | ||
| Кратность различий с контролем | выше | 4.40 | 1.23 | 1.08 | 1.48 | |
| ниже | ||||||
| Межгрупповое различие группой сравнения (p) | 0.036 | 0.020 | 0.786 | 0.201 | ||
| Кратность различий с группой сравнения | выше | 1.23 | 1.41 | 1.04 | ||
| ниже | 1.23 | |||||
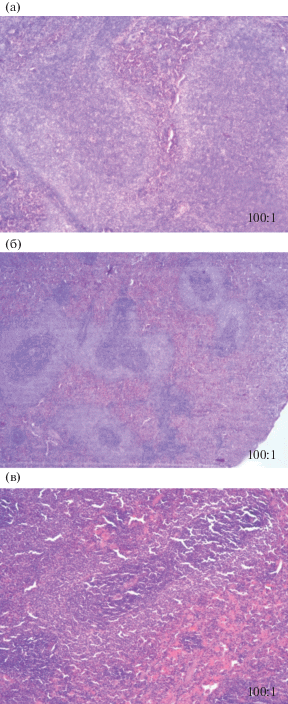
Гистологическими методами исследования у животных опытной группы зафиксированы патоморфологические изменения тканей органов в виде острого венозного полнокровия печени (рис. 3) и эозинофильной инфильтрации желудка (рис. 4), чего не отмечено у экспериментальных животных групп сравнения и контроля. Как в опытной группе, так и в группе сравнения установлены гиперплазия лимфоидной ткани и увеличение объема белой пульпы селезенки (рис. 5). Действие НЧ Al2O3 на селезенку более выражено и приводит к увеличению объема белой пульпы на 70%, что на 20% больше значения данного показателя при действии микроразмерного аналога (50%). У животных экспонируемых групп патоморфологических изменений тканей почек не установлено.
Рис. 3.
Микрофотографии гистологических препаратов тканей печени крыс линии Wistar (окраска гематоксилин-эозином, масштаб 400:1): а – опытная группа, б – группа сравнения, в – контрольная группа.
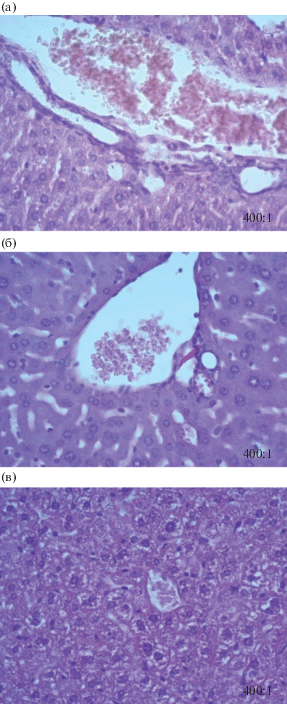
Рис. 4.
Микрофотографии гистологических препаратов тканей желудка крыс линии Wistar (окраска гематоксилин-эозином, масштаб 400:1): а – опытная группа, б – группа сравнения, в – контрольная группа.

Рис. 5.
Микрофотографии гистологических препаратов тканей селезенки крыс линии Wistar (окраска гематоксилин-эозином, масштаб 100:1): а – опытная группа, б – группа сравнения, в – контрольная группа.
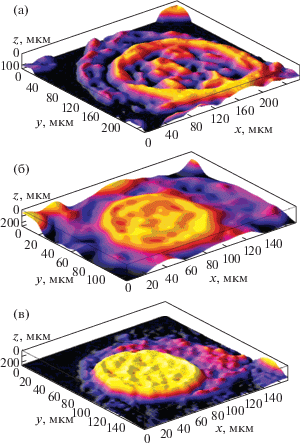
Результаты исследования жидкости бронхоальвеолярного лаважа, извлеченной через сутки после однократной интратрахеальной инстилляции нано- и микрочастиц Al2O3, позволили установить повреждение альвеолярных макрофагов у животных обеих экспонированных групп. При этом в опытной группе среднее число повреждений составило 2.40 ± 0.04 шт./мкм2, что в 8 раз больше, чем в группе сравнения (0.30 ± ± 0.06 шт./мкм2). Средний диаметр повреждений, вызываемых действием НЧ Al2O3, составил 0.40 ± 0.05 мкм, что в 2.25 раза меньше данного показателя при экспозиции микрочастицами (0.90 ± 0.08 мкм). Степень повреждения альвеолярных макрофагов у животных опытной группы достигает 18.00%, что в 2.50 раза больше значения в группе сравнения (7.20%) (рис. 6).
Рис. 6.
Трехмерная реконструкция морфологических параметров альвеолярных макрофагов крыс линии Wistar: а – опытная группа, б – группа сравнения, в – контрольная группа.
Обобщение полученных результатов показало, что исследованный образец Al2O3 является наноматериалом, так как содержит в своем составе частицы размером до 100 нм, обладающие высокой удельной площадью поверхности по сравнению с микрочастицами. Методом ДРС установлено, что средний размер частиц нанопорошка составляет 129.90 ± 11.46 нм, методом СЭМ – 40.48 ± 6.07 нм. Данную разницу можно объяснить вероятной агломерацией НЧ Al2O3 в связи с повышением ζ-потенциала в средах со значением pH, близких к 7 [17]. Несферическая форма НЧ Al2O3 может также являться одной из причин искажения результатов, полученных методом ДРС. Для НЧ Al2O3 при многократном пероральном введении установлен показатель LD50, равный 21 895 мг/кг массы тела, в то время как при действии микрочастиц в аналогичной дозе достигается лишь LD25. Многократная пероральная экспозиция нано- и микроразмерным Al2O3 вызывает увеличение концентрации алюминия в головном мозге и крови экспериментальных животных. Материальная кумуляция НЧ более выражена по сравнению с микрочастицами, на что указывают более высокие значения концентраций исследуемого вещества в перечисленных выше органах, а также увеличение данного показателя в тканях печени, что не зафиксировано при действии микрочастиц. Присутствие алюминия в организме неэкспонированных животных можно объяснить низкой степенью биофильности данного элемента. Примерная доля содержания алюминия в организме человека составляет около 10–5% от общего количества веществ, в том числе отмечено его наличие в крови (0.20 мг/дм3), печени (1–10 мг/кг), почках (0.40 мг/г), головном мозге (2.00 мкг/кг) [18]. В тканях печени животных опытной группы установлено острое венозное полнокровие, что указывает на затрудненное кровообращение, вызванное, вероятно, увеличением количества тромбоцитов в результате прямого действия НЧ Al2O3 [19, 20]. Эозинофильная инфильтрация желудка и гиперплазия тканей селезенки могут указывать на развитие воспалительного процесса в результате увеличения в крови уровня медиаторов воспаления, индуцированного действием активных форм кислорода, генерируемых наноразмерным Al2O3 [21–24]. Альвеолярные макрофаги животных опытной группы после интратрахеальной инстилляции НЧ Al2O3 обладают большим количеством повреждений меньшего диаметра, чем при инстилляции частиц микроразмерного аналога, что связано с размером частиц и разницей в их количестве в вводимых суспензиях, обусловленной разной насыпной плотностью нано- и микроматериала.
ЗАКЛЮЧЕНИЕ
В результате исследований установлено, что бионакопление наночастиц Al2O3 при многократной пероральной экспозиции более выражено, чем у микрочастиц, и происходит преимущественно в тканях головного мозга, печени и крови. Наноматериал более токсичен относительно микроразмерного аналога, на что указывают гибель большего числа животных опытной группы при одинаковой дозе пероральной экспозиции, более выраженные патоморфологические изменения тканей селезенки, наличие изменений тканей желудка и печени, не установленные у животных группы сравнения, а также более выраженная степень повреждения альвеолярных макрофагов при интратрахеальном поступлении исследуемого наноматериала. Полученные результаты необходимо учитывать для повышения эффективности обоснования мер профилактики для производителей и потребителей пищевой продукции, содержащей в своем составе наночастицы Al2O3.
Список литературы
Singh T., Shukla S., Kumar P. // Front. Microbiol. 2017. V. 8. P. 7. https://doi.org/10.3389/fmicb.2017.01501
Sukhanova A., Bozrova S., Sokolov P. et al. // Nanoscale Res. Lett. 2018. V. 13. № 44. P. 21. https://doi.org/10.1186/s11671-018-2457-x
Batt C., Tortorello M. Encyclopedia of food microbiology. Second edition. San Diego: Academic Press Elsevier, 2014. 1014 p.
Krewski D., Yokel R., Nieboer E. et al. // J. Toxicol. Environ. Health. B. 2007. V. 10. P. 1. https://doi.org/10.1080/10937400701597766
Alshatwi A.A., Subbarayan P.V., Ramesh E. // Food Addit. Contam. A. Chem. 2013. V. 30. № 1. P. 1. https://doi.org/10.1080/19440049.2012.729160
Единая компьютерная база данных по наноматериалам и нанотехнологиям, используемым в Российской Федерации (реестр) // Информационно-аналитический центр по проблеме безопасности нанотехнологий и наноматериалов. http://web.ion.ru/GM_1/GM.aspx
Balasubramanyam A., Sailaja N., Mahboob M. et al. // Mutagenesis. 2009. V. 24. № 3. P. 245. https://doi.org/10.1093/mutage/gep003
Arul Prakash F., Dushendra Babu G.J., Lavanya M. et al. // Int. J. Nanotechnol. Applications. 2011. V. 5. № 2. P. 99.
Park E-J., Sim J., Kim Y. // Arch. Toxicol. 2015. V. 89. № 3. P. 371. https://doi.org/10.1007/s00204-014-1256-0
El-Hussainy el-H.M., Hussein A.M., Abdel-Aziz A. et al. // Can. J. Physiol. Pharmacol. 2016. V. 94. № 8. P. 868. https://doi.org/10.1139/cjpp-2015-0446
Di Virgilio A.L., Reigosa M., Arnal P. M. et al. // J. Hazard Mater. 2010. V. 177. № 1–3. P. 711. https://doi.org/10.1016/j.jhazmat.2009.12.089
International Agency for Research on Cancer. http://monographs.iarc.fr/ENG/Classification/index.php
Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду. М.: Федеральный центр госсанэпиднадзора Минздрава России. 2004. 143 с.
Руководство по уходу и использованию лабораторных животных (Guide for the care and use of laboratory animals) // National Research Council of the national academies. Washington: The national academies press, 2011. 248 p.
Lim R.K., Rink K.G., Glass H.G et al. // Arch. Int. Pharmacodyn. Ther. 1961. V. 130. P. 336.
Morsy G., El-Ala K., Ali A. // Toxicol. Ind. Health. 2016. V. 32. № 2. P. 344. https://doi.org/10.1177/0748233713498449
Mui J., Ngo J., Kim B. // Nanomaterials (Basel). 2016. V. 6. № 5. P. 1. https://doi.org/10.3390/nano6050090
Токсикологическая химия. Метаболизм и анализ токсикантов: учебное пособие / Под. ред. проф. Калетиной Н.И. М.: ГЭОТАР-Медиа, 2008. 1016 с.
Макарова В.Г., Макарова М.Н. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных: Справочник. СПб: Лема, 2013. 116 с.
Park E-J., Kim H., Kim Y. et al. // Toxicol. Environ. Chem. 2011. V. 93. № 1. P. 120. https://doi.org/10.1080/02772248.2010.495191
Gleich G.J. // J. Allergy Clin. Immunol. 2000. V. 105. № 4. P. 651. https://doi.org/10.1067/mai.2000.105712
Pease C., Rucker T., Birk T. // Chem. Res. Toxicol. 2016. V. 29. № 3. P. 237. https://doi.org/10.1021/acs.chemrestox.5b00448
Park E.-J., Kim S.N., Kang M.-S. et al. // J. Immunotoxicol. 2016. V. 13. № 4. P. 439. https://doi.org/10.3109/1547691X.2015.1122116
Mittal M., Siddiqui M.R., Tran K. et al. // Antioxid. Redox Signal. 2014. V. 20. № 7. P. 1126. https://doi.org/10.1089/ars.2012.5149
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии