Российские нанотехнологии, 2021, T. 16, № 2, стр. 222-231
СИНТЕЗ НАНОЧАСТИЦ СУЛЬФИДА СЕЛЕНА В ПОЛИСАХАРИДНЫХ МАТРИЦАХ АРАБИНОГАЛАКТАНА И КРАХМАЛА
М. В. Лесничая 1, *, Б. Г. Сухов 1
1 Иркутский институт химии им. А.Е. Фаворского СО РАН
Иркутск, Россия
* E-mail: mlesnichaya@mail.ru
Поступила в редакцию 05.05.2020
После доработки 17.08.2020
Принята к публикации 11.12.2020
Аннотация
Новые водорастворимые SeS2-содержащие нанокомпозиты получены в результате ионообменного взаимодействия селенистой кислоты с сульфидом аммония в водной среде с использованием природных полисахаридов арабиногалактана и крахмала в качестве стабилизаторов наночастиц. С помощью комплекса физико-химических методов (просвечивающая электронная микроскопия, рентгеноструктурный анализ, динамическое рассеяние света) установлено, что нанокомпозиты формируются в виде сферических наночастиц кристаллического SeS2 размером 5–140 нм, диспергированных в полисахаридных матрицах. Установлено определяющее влияние типа стабилизирующей матрицы и соотношения реагирующих веществ на наноморфологические характеристики получаемых материалов.
ВВЕДЕНИЕ
На протяжении последнего десятилетия наблюдается неослабевающий интерес исследователей к разработке эффективных методов синтеза новых перспективных наноматериалов и поиску потенциальных областей их применения [1–3]. Основной причиной данного явления можно назвать проявление качественно новых или многократное усиление известных свойств материалов при их структурном переходе из объемного bulk-состояния в наноразмерное [4, 5].
Задача создания новых эффективных материалов наиболее остро поставлена в области биомедицины [6] и оптоэлектроники [7]. Одними из наиболее исследуемых объектов, имеющих высокий потенциал применения в данных областях, являются наночастицы селена [8] и серы [9]. Так, согласно [10–13] наночастицы селена (НЧSe0) обладают наименьшей токсичностью среди всех органических и неорганических соединений селена наряду с сохранением широкого профиля биологической активности, в частности антиоксидантной, противоопухолевой, антимикробной, противовоспалительной и другими. Характер проявления той или иной биологической активности, а также токсичность НЧSe0 являются размер-зависимыми. Это позволяет регулировать их действие посредством варьирования размера НЧ [14].
Аналогичные результаты получены для наночастиц серы (НЧS0), нашедших свое применение в качестве антибактериальных и химиотерапевтических агентов [9, 15]. Отметим успешное использование данных НЧ в оптоэлектронике в качестве материалов катода высокопроизводительных литий-ионных батарей [16–18].
Сульфид селена является веществом, потенциально сочетающим в себе биологические и электронные свойства селена и серы. Обширное применение сульфида селена в биомедицине, а именно в дерматологии, основано на его фунгицидном и цитостатическом (антимитотическом) эффекте [19]. Он является противогрибковым агентом в отношении Malassezia furfur, Microsporum sp., включая Microsporum audouinii и Microsporum canis, Pityrosporon sp., Trichophyton sp., включая Trichophyton schoenleinii и Trichophyton tonurans. Кроме того, сульфид селена замедляет рост гиперпролиферативных клеток при себорее и уменьшает выработку эпидермального и фолликулярного эпителиальных корнеоцитов [20]. Наночастицы SeS2 сохраняют весь профиль противогрибковой активности bulk/SeS2, а также в отличие от НЧSe0 или НЧS0 обладают более высокой проводимостью. Это позволяет получать на их основе аккумуляторы с высокой пропускной способностью, чрезвычайно стабильным циклом (до 2000 циклов) и превосходной емкостью [21, 22].
Среди существующих методов синтеза SeS2 особо следует отметить группу химических методов. В их основе лежит взаимодействие прекурсоров Se и S в присутствии стабилизатора. Основными преимуществами данной группы методов являются отсутствие специального дорогостоящего аппаратурного оформления, доступность используемых реагентов, легкость стандартизации, высокая воспроизводимость и отсутствие необходимости дополнительной очистки получаемых наноматериалов от непрореагировавших остатков и побочных продуктов микробиологического происхождения (как в случае генерирования НЧSeS2 с использованием растительных экстрактов или микроорганизмов) [23–25].
В данной работе для синтеза НЧSeS2 использовали подход, в основе которого лежит способность природных полисахаридов арабиногалактана (АГ) и крахмала (Кр) стабилизировать поверхность НЧ различной природы. При этом формируется единая гибридная водорастворимая органо-неорганическая система “ядро (НЧSeS2)/оболочка (полисахаридная матрица)”. В частности, на основе данного подхода в [26–31] были получены водорастворимые агрегативно устойчивые нанокомпозиты, представляющие собой наночастицы Ag0, Au0, Fe3O4, Pd0, Se0 и др., стабилизированные АГ и Кр.
Использованные стабилизирующие агенты – АГ и Кр – являются доступными природными водорастворимыми полисахаридами. Они широко применяются в пищевой и фармацевтической промышленности и обладают комплексом собственной биологической активности (иммуномодулирующая, мембранотропная, противовоспалительная, гиполипидемическая, детоксикационная) [32]. Включение НЧSeS2 в полисахаридные матрицы АГ и Кр позволит получить материалы, сочетающие в себе как все перечисленные выше свойства полисахаридов, так и ценные биологические и оптические свойства SeS2.
Вследствие определяющего влияния размера НЧ на их физико-химические и биологические свойства получение частиц в требуемом размерном диапазоне становится основным критерием оценки возможности их дальнейшего применения. Размер формирующихся частиц находится в зависимости от условий их получения. Поэтому его контроль возможен посредством варьирования условий синтеза, в том числе типа стабилизатора и количественного соотношения реагентов.
Целью данной работы является разработка оптимальных условий синтеза наночастиц сульфида селена в стабилизирующих матрицах арабиногалактана и крахмала с оценкой степени их влияния на наноморфологические характеристики получаемых материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали АГ лиственницы Сибирской (Larix Sibirica). Извлечение и очистку АГ проводили согласно методике, представленной в [33]. Молекулярная масса АГ, определенная ранее методом высокоэффективной жидкостной хроматографии [27], составила 42.3 кДа. Водный 20%-ный раствор (NH4)2S (Sigma Aldrich), H2SeO3 (Вектон), водорастворимый крахмал (Реахим), этанол (Реахим) использовали без дополнительной очистки. Средневязкостная молекулярная масса крахмала, определенная вискозиметрическим методом с использованием его 0.005%-ного водного раствора по методике, подробно описанной в [34], составила 326 кДа.
ИК-спектры снимали в KBr в диапазоне частот 4000–400 см–1 на приборе Varian Resolutions Pro. Перед измерением навеску KBr массой 800 мг измельчали и тщательно смешивали с навеской анализируемого образца массой 4 мг, после чего проводили прессование смеси в таблетку толщиной 0.93–0.94 мм на прессе “Dezimalpresse DP 36” при давлении 170 кгс·см–2.
Рентгеноструктурный анализ проводили на дифрактометре “Bruker D8 ADVANCE”, оснащенном зеркалом Геббеля, в Cu-излучении в режиме locked Coupled с экспозицией 1 с для фазового анализа и 3 с для расчета параметра ячейки и размера области когерентного рассеяния.
Спектры поглощения 0.2%-ных водных растворов SeS2-содержащих нанокомпозитов на основе АГ и Кр регистрировали относительно дистиллированной воды в 1 см кварцевой кювете в интервале длин волн 190–1000 нм на спектрофотометре UNICO 2800 UV/VIS.
Микрофотографии образцов получали на просвечивающем электронном микроскопе “Leo 906 Е”. Для микроскопического исследования навеску анализируемого образца массой 2–3 мг растворяли в воде. Разбавление проводили до оптической плотности конечного раствора 0.1. Каплю полученного раствора нанокомпозита помещали на формваровую пленку-подложку с последующим высушиванием на воздухе и микроскопическим исследованием. Для измерения размера частиц использовали программу IPWin45. Распределение НЧ получали с помощью статистической обработки не менее семи микрофотографий разных полей анализируемой подложки для получения данных о размере 900–1000 частиц.
Элементный анализ (ЭА) составa проведен методом рентгеновского энергодисперсионного микроанализа на электронном сканирующем микроскопе Hitachi ТМ 3000 с X-ray детектором SDD XFlash 430-4 и на CHNS-анализаторе Flash 2000 фирмы Thermo Scientific.
Гидродинамические радиусы (Rh) НЧSeS2 и макромолекул исходных АГ и Кр определяли методом динамического рассеяния света (ДРС) на корреляционном спектрометре Photocor Compасt-Z (источник света – термостабилизированный полупроводниковый лазер мощностью 20 мВт с длиной волны λ = 638 нм) под углом 90°. Анализ автокорреляционной функции проводили с помощью программы обработки данных ДРС Dynals. Величины Rh рассчитывали из значений коэффициентов диффузии (D) по уравнению Эйнштейна–Стокса Rh = kT/6πη0D* (η0 – вязкость растворителя, k – константа Больцмана, T – температура). Растворы для анализа готовили разбавлением 0.5 мл реакционной смеси в 2 мл дистиллированной воды, предварительно отфильтрованной через шприцевой фильтр, после чего полученный разбавленный раствор еще раз очищали фильтрованием через шприцевой фильтр (0.22 мкм). Время измерения составляло не менее 200 с. Измерение повторяли трижды.
МЕТОДИКА СИНТЕЗА SeS2-СОДЕРЖАЩИХ НАНОКОМПОЗИТОВ
К раствору АГ или Кр (1.0 г в 50 мл H2O) при комнатной температуре и интенсивном перемешивании добавляли 5 мл водного раствора, содержащего 0.16–0.82 ммоль H2SeO3. После этого смесь нагревали до 40°С и перемешивали в течение 15 мин. Далее в реакционную смесь по каплям добавляли раствор (NH4)2S в количестве 51–254 мкл. Раствор приобрел желто-оранжевую окраску. Время синтеза нанокомпозитов составило 30 мин при постоянном перемешивании и температуре 45°С. Выделение и очистку SeS2-содержащих нанокомпозитов осуществляли высаживанием охлажденной до комнатной температуры реакционной смеси в четырехкратный избыток этанола. Осадок многократно промывали этанолом на фильтре, отфильтровывали и высушивали на воздухе. Полученные нанокомпозиты представляли собой водорастворимые порошки красно-оранжевого цвета с выходом 92–95% и содержанием сульфида селена 2.05–12.0%. ЭА, найдено (%): АГ: H – 6.1, C – 41.5; SeS2/АГ (2.05% SeS2): H – 5.7, C – 42.0, Se – 1.2, S – 0.85; SeS2/АГ (6.0% SeS2): H – 5.14, C – 40.0, Se – 3.3, S – 2.67; SeS2/АГ (12.0% SeS2): H – 5.35, C – 41.97, Se – 6.6, S – 5.35; крахмал: H – 6.4, C – 42.7; SeS2/Кр (2.07% SeS2): H – 5.57, C – 41.87, Se – 1.23, S – 0.87; SeS2/Кр (12.0% SeS2): H – 5.79, C – 41.4, Se – 6.5, S – 5.4. ИК, KBr (ν-1), АГ: 3422 см–1 (O–H), 2920 см–1 (C–H), 1642 см–1 (O–H адсорбированной воды), 886‒1216 см–1 (C–O антисимметричные колебания С–O–H- и C–O–C-групп); крахмал: 3433 см–1 (O–H), 2928 см–1 (C–H), 1637 см–1 (O–H адсорбированной воды), 1080, 1021, 931 см–1 (С–Н-, С–О-, С–С-колебания связей D-глюкопиранозного кольца.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
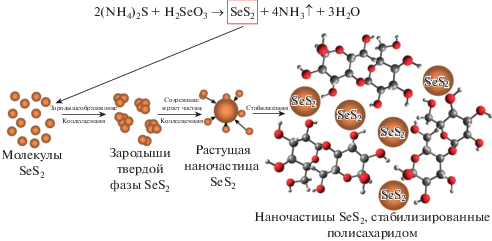
Синтез наночастиц SeS2 осуществлен в результате ионообменного взаимодействия водных растворов сульфида аммония и селенистой кислоты в среде водного раствора полисахаридных матриц Кр и АГ (рис. 1).
Результатом данной реакции является формирование молекул сульфида селена с последующим их объединением и кристаллизацией в НЧ. Процесс формирования НЧ проходит множество стадий, первой из которых является образование молекул SeS2 [35]. Вследствие высоких скоростей протекания реакций ионного обмена образование SeS2 в реакционной среде теоретически полностью завершается к окончанию первой стадии процесса. При достижении критической концентрации молекул SeS2 в реакционной среде запускается процесс их коалесценции с образованием зародышей новой (неорганической твердой) фазы с последующим их ростом и созреванием до НЧSeS2. Основным фактором, определяющим скорость данных процессов, является диффузия сформированных молекул SeS2 к поверхности растущей НЧ. Диффузия зависит от молекулярно-массовых и вязкостных характеристик полисахаридов, присутствующих в составе реакционной среды.
Пассивация энергонасыщенной поверхности НЧSeS2 и обеспечение их агрегативной устойчивости происходит вследствие адсорбции на их поверхности полисахаридных макромолекул АГ и Кр (стерическая стабилизация), а также вследствие электростатической стабилизации поверхности НЧ высокополярными функциональными группами макромолекул полисахаридов АГ и Кр (гидроксильными, терминальными карбонильными). При этом формируется единая гибридная устойчивая водорастворимая система наноядро (НЧSeS2)/полисахаридная матрица.
Согласно данным рентгенодифракционного анализа (РДА) все полученные нанокомпозиты являются аморфно-кристаллическими веществами. Их дифрактограммы характеризуются наличием гало аморфной фазы биополимерной матрицы АГ и Кр и набором уширенных рефлексов различной интенсивности в области 2θ = 14°–29°, принадлежащих нанокристаллическим частицам SeS2 (рис. 2а). Средние размеры кристаллитов SeS2, вычисленные по формуле Дебая–Шеррера, в зависимости от типа стабилизатора и их количества в композите варьируют в интервале 9.2–69.4 нм (табл. 1).
Рис. 2.
Рентгенограммы SeS2-содержащих нанокомпозитов на основе крахмала (а) и арабиногалактана (б) с различным содержанием наночастиц SeS2 в составе.

Таблица 1.
Средние значения диаметра (d) наночастиц SeS2 в матрицах арабиногалактана (АГ) и крахмала (Кр), полученные методами ПЭМ, РДА и ДРС
| Образец | d, нм ПЭМ | d, нм РДА | d (2Rh), нм ДРС |
|---|---|---|---|
| SeS2/АГ (2.05%) | 26 | 24.7 | 123.9 |
| SeS2/АГ (12.0%) | 39 | 43.6 | 146.5 |
| SeS2/Кр (2.07%) | 8 | 9.2 | 104.7 |
| SeS2/Кр (12.0%) | 65 | 69.4 | 205.0 |
Значительное снижение интенсивности рефлексов, а также их уширение по сравнению с интенсивными узкими рефлексами порошкового образца SeS2, синтезированного для сравнения, вероятно, свидетельствуют о малом размере формирующихся частиц сульфида селена в нанокомпозите. Кроме того, на интенсивность рефлексов НЧSeS2 может влиять факт их локализации в области 2θ расположения гало аморфной фазы полисахарида.
С использованием просвечивающей электронной микроскопии (ПЭМ) установлено, что SeS2-содержащие нанокомпозиты формируются в виде диспергированных в матрицах АГ и Кр наночастиц сульфида селена, размер которых варьирует в интервале 5–140 нм, а форма близка к сферической (рис. 3, 4). Их средний размер и степень полидисперсности находятся в зависимости от условий синтеза нанокомпозитов.
Рис. 3.
Микрофотографии и дисперсное распределение наночастиц SeS2 в полисахаридной матрице крахмала при их содержании 2.07 (а, в) и 12.0% (б, г).
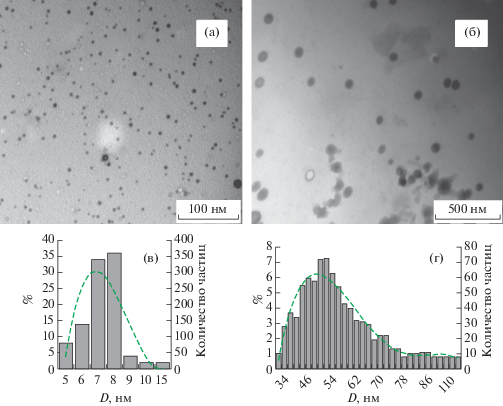
Рис. 4.
Микрофотографии и дисперсное распределение наночастиц SeS2 в полисахаридной матрице арабиногалактана при их содержании 2.05 (а, в) и 12.0% (б, г).

Установлено, что частицы с наименьшими размерами (5–15 нм) сформированы при использовании в качестве стабилизирующей матрицы Кр в случае включения небольшого (2.05%) количества НЧSeS2. Средний размер НЧSeS2 в данном случае составил 8 нм. Повышение количественного содержания SeS2 в составе матрицы крахмала до 12.0% сопровождается уширением полидисперсности частиц сульфида селена (34–140 нм) и увеличением их среднего размера до 65 нм. Использование в качестве стабилизатора макромолекул АГ приводит к формированию в нанокомпозитах НЧSeS2 со средним размером 26 и 39 нм, содержащих 2.07 и 12.0% SeS2 соответственно. Тенденция к увеличению полидисперсности и среднего размера НЧSeS2 при использовании АГ также сохраняется, однако менее выражена, чем в случае использования в качестве стабилизатора крахмала (табл. 1).
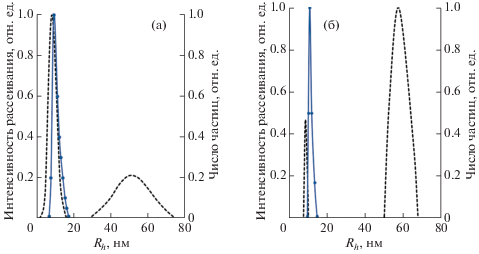
С помощью метода ДРС исследована динамика синтеза НЧSeS2 в полисахаридных матрицах АГ и Кр. Данное исследование проведено с целью определения влияния типа полисахаридной матрицы, продолжительности синтеза и соотношения прекурсоров на размерные характеристики получаемых НЧ. Согласно полученным данным исходный раствор АГ характеризуется бимодальным распределением интенсивностей рассеяния с максимумами, соответствующими значениям Rh 8.3 и 50.1 нм. Тогда как выражение распределения частиц не по интенсивности, а по их числу характеризуется мономодальным типом с максимумом, соответствующим Rh 9.6 нм (рис. 5а). Согласно [36, 37] характер распределения интенсивности рассеяния света сильно зависит от степени полидисперсности образца, размера и формы частиц, а также наличия случайных крупных частиц в объеме анализируемого образца [36, 38]. С учетом этих данных максимум в области значений Rh 8.3 нм (9.6 нм в случае распределения частиц по их числу) предположительно соответствует гидратированным индивидуальным макромолекулам АГ. Отсутствие максимума в области значений Rh 50.1 нм в случае распределения по числу частиц, вероятно, указывает на присутствие в водном растворе небольшого количества агрегатов макромолекул АГ, которые вносят существенный вклад в общую интенсивность рассеяния образца, однако их количество ничтожно мало по сравнению с индивидуальными плохо рассеивающими макромолекулами АГ. Подобная закономерность наблюдается в случае исследования водного раствора крахмала. В распределении интенсивности рассеяния его исходный раствор характеризуется наличием двух максимумов соответствующих Rh частиц 17.7 и 126.3 нм, принадлежащим, вероятно, как и в случае АГ, индивидуальным макромолекулам и агрегированным формам крахмала соответственно. Тогда как в случае распределения по числу частиц второй максимум исчезает и остается только один, соответствующий Rh 22.6 нм (рис. 5б). Наблюдаемое выраженное различие положения и количества максимумов, характеризующих дисперсность частиц в исследуемых образцах, при переходе выражения распределения дисперсности по интенсивности рассеяния к распределению по числу частиц свидетельствует в пользу дальнейшей характеристики распределения частиц и их Rh по числу частиц. Это позволит минимизировать влияние случайных высокорассеивающих крупных частиц (или агрегатов) на получаемые данные.
Рис. 5.
Распределение по интенсивности рассеяния (пунктирная линия) и числу рассеивающих частиц (сплошная линия) арабиногалактана (а) и крахмала (б).
Введение в АГ или Кр водного раствора селенистой кислоты сдвигает рН реакционной среды в кислую область. Увеличение массового соотношения полисахарид:H2SeO3 с 1:47 до 1:10 обусловливает более интенсивное снижение рН с 4.5 до 3.0. С другой стороны, добавление H2SeO3 к АГ и Кр сопровождается увеличением ионной силы раствора. Анионные добавки с учетом полиэлектролитной природы используемых полисахаридов могут оказывать влияние на интенсивность межмолекулярных взаимодействий [39, 40], что в данном случае подтвердилось незначительным снижением величины Rh крахмала до 19.1 нм и АГ до 8.4 нм, вероятно, вследствие частичного конформационного перехода распрямленных в нейтральной среде макромолекул АГ и Кр в более компактную форму клубка за счет ионизации их полярных групп [40]. Наблюдаемое незначительное снижение Rh частиц при закислении среды хорошо согласуется с данными, представленными в литературе, и является характерным для интервала рН 2.3–7.0 в отличие от резкого снижения Rh с ростом рН [40–42]. Добавление к полученной смеси полисахарида и селенистой кислоты сульфида аммония по мере увеличения времени синтеза с 0 до 30 мин характеризуется сохранением мономодального типа дисперсного распределения по числу частиц, а также ростом Rh. Так, непосредственно сразу после введения в смесь крахмала и селенистой кислоты сульфида аммония в концентрации 0.000022 моль в реакционной среде происходит незначительное увеличение Rh частиц до 22.6 нм. По мере увеличения продолжительности синтеза среднее значение Rh частиц также возросло до 31.6, 37.3, 44.2 и 52.3 нм на 3-, 7-, 20-й и 30-й минуте синтеза соответственно (рис. 6а). Увеличение концентрации H2SeO3 и (NH4)2S до 0.000032 и 0.000065 моль соответственно во время синтеза нанокомпозита также сопровождалось ростом Rh частиц с 28.4 до 37.2, 58.7, 86.7 и 102.5 нм на 0-, 3-, 7-, 20-й и 30-й минуте синтеза соответственно (рис. 6б). При увеличении продолжительности синтеза до 40 мин значимого изменения величины Rh не наблюдалось, что вероятно свидетельствует о завершении процесса стабилизации НЧSeS2 и формирования нанокомпозита.
Рис. 6.
Динамика изменения величины гидродинамического радиуса частиц в процессе синтеза SeS2-содержащих нанокомпозитов на основе крахмала (верхний ряд) и арабиногалактана (нижний ряд) в условиях различного количественного содержания прекурсоров: 0.000011 моль H2SeO3 и 0.000022 моль (NH4)2S (а, в) или 0.000032 моль H2SeO3 и 0.000065 моль (NH4)2S (б, г).
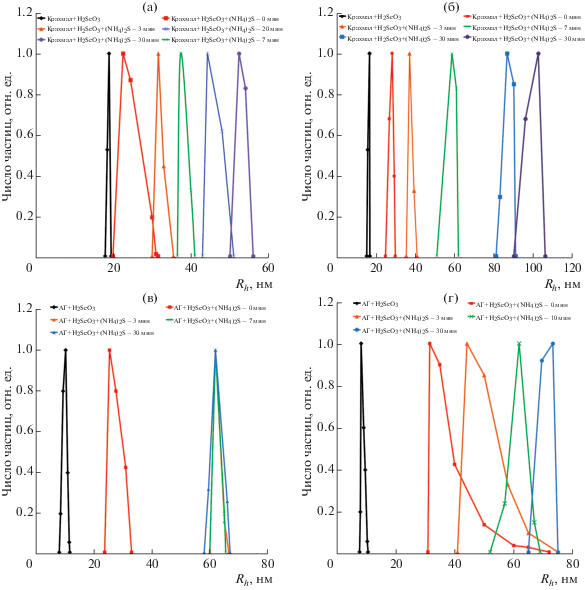
В случае использования в качестве стабилизатора АГ добавление сульфида аммония в концентрации 0.000022 или 0.000065 моль в реакционную смесь сопровождалось увеличением Rh частиц до 25.4 и 31.6 нм соответственно. Увеличение времени синтеза до 3, 10 и 30 мин приводило к плавному росту Rh частиц (в случае использования повышенных концентраций прекурсоров) до 44.2, 61.9 и 73.2 нм соответственно (рис. 6г). Тогда как в условиях низкой концентрации селенистой кислоты и сульфида аммония, начиная с третьей минуты синтеза, изменение величины Rh отсутствовало. Полученные значения составили 61.9, 61.9 и 61.9 нм на 3-, 7-й и 30-й минуте синтеза (рис. 6в). Это позволяет предположить возможное завершение процесса стабилизации и формирования НЧSeS2 макромолекулами АГ к третьей минуте синтеза при их небольшом (2.05%) содержании в объеме полисахаридной матрицы. В случае высоких концентраций прекурсоров наряду с процессами формирования НЧSeS2 (химическая реакция ионного обмена между селенистой кислотой и сульфидом аммония, образование зародышей твердой фазы, коалесценция и стабилизация поверхности), вероятно, протекают процессы агрегации НЧSeS2, возможно, с последующим растворением части образовавшихся агрегатов. При этом в условиях повышенной ионной силы подвижность макромолекул АГ в водном растворе может быть снижена, что в совокупности приводит к увеличению требуемого времени для завершения синтеза нанокомпозита SeS2/АГ.
Отметим, что наблюдаемое значение Rh соответствует гидродинамическому радиусу частиц, находящихся в объеме исследуемого раствора, и характеризует размер не только НЧSeS2, но и размер покрывающей поверхность НЧ оболочки из гидратированных макромолекул полисахаридов. Огромное влияние на величину Rh оказывает способность полисахарида к сольватации, зависящей от структуры макромолекулы, степени полимеризации, молекулярной массы, температуры и присутствующих в растворе ионов. Учитывая размер НЧSeS2, определенный с помощью ПЭМ, а также допуская сферическую форму всех НЧ и отсутствие массированной агрегации НЧ на микрофотографиях в совокупности с наиболее узким распределением дисперсности (к моменту окончания синтеза), можно предположить, что определенное методом ДРС значение Rh скорее всего относится к полисахарид-стабилизированным НЧSeS2, а не их агрегатам. При этом размер гидратированной оболочки АГ и Кр, покрывающей поверхность НЧ, является разностью между величиной 2Rh (определенной методом ДРС) и диаметром НЧSeS2 из данных ПЭМ. Полученная величина варьирует в интервале 98.0–107.5 нм для нанокомпозитов на основе АГ и 96.7–140.0 нм для нанокомпозитов на основе крахмала. Полученные расчетные данные хорошо согласуются с известным фактом высокой влагоудерживающей способности крахмала и его гигроскопичности.
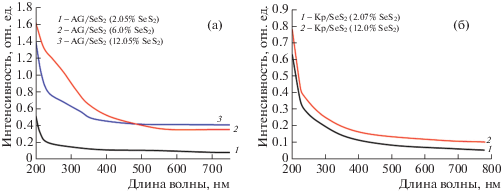
Спектры поглощения водных растворов SeS2-содержащих нанокомпозитов на основе АГ и Кр в УФ- и видимой области спектра имеют невыразительный характер (рис. 6). Достаточно высокое фоновое поглощение, наблюдаемое в спектрах нанокомпозитов на основе АГ, подтверждает данные ПЭМ, согласно которым в этой матрице формируются довольно крупные частицы SeS2. Спектры нанокомпозитов SeS2/Кр также характеризуются наличием фонового поглощения, однако его выраженность менее интенсивная по сравнению с нанокомпозитами SeS2/АГ. В целом полученная картина электронных спектров поглощения SeS2-содержащих нанокомпозитов хорошо согласуется с данными [23–25]. Это в совокупности с полученными данными РДА, ПЭМ и ДРС, а также элементного анализа свидетельствует об успешности генерирования НЧSeS2 в матрицах природных биополимеров АГ и Кр, стабилизирующих их поверхность и обеспечивающих водорастворимость и стабильность получаемых нанокомпозитов.
ЗАКЛЮЧЕНИЕ
Впервые осуществлен синтез гибридных органо-неорганических водорастворимых нанокомпозитов на основе арабиногалактана и крахмала, содержащих в качестве неорганической фазы наночастицы SeS2 в количестве от 2.05 до 12.0%. Установлено определяющее влияние количественного соотношения реагирующих веществ и стабилизатора на размерные характеристики формирующихся наночастиц сульфида селена. Обнаружено, что степень выраженности стабилизирующей способности полисахаридов АГ и Кр находится в зависимости от количественного содержания вводимого в их состав сульфида селена вследствие влияния на конформацию их макромолекул в растворе реакционной среды таких факторов, как рН и ионная сила раствора. Установлено, что высокая насыщенность реакционной среды ионами прекурсоров и побочных продуктов реакции в процессе синтеза нанокомпозитов приводит к увеличению полидисперсности получаемых нанокомпозитов и росту размеров формирующихся НЧSeS2.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-316-20017 мол_а_вед) (синтез SeS2-содержащих нанокомпозитов и исследование их структуры) и проектом Госзадания НИР ИрИХ СО РАН АААА-А16-116112510011-8 (исследование динамики синтеза нанокомпозитов).
Использовано оборудование ЦКП Лимнологического института СО РАН, а также оборудование Байкальского аналитического центра коллективного пользования Иркутского института химии им. А.Е. Фаворского СО РАН.
Список литературы
Mauricio M.D., Guerra-Ojeda S., Marchio P. et al. // Oxid. Med. Cell. Longev. 2018. V. 2018. P. 1. https://doi.org/10.1155/2018/6231482
Salman Z., Irshad U., Ali K. et al. // Nanoscale Rep. 2019. V. 2. P. 32. https://doi.org/10.26524/nr1924
Kolahalam L.A., Viswanat I.V.K., Diwakar B.S. et al. // Mater. Today: Proc. 2019. V. 18. P. 2182. https://doi.org/10.1016/j.matpr.2019.07.371
Taloni A., Vodret M., Costantini G., Zapperi S. // Nat. Rev. Mater. 2018. V. 3. P. 211. https://doi.org/10.1038/s41578-018-0029-4
Rodriguez-Lopez J.L., Montejano-Carrizales J.M., Palomares-Baez J.P. et al. // Key Eng. Mater. 2010. V. 444. P. 47. https://doi.org/10.4028/www.scientific.net/KEM.444.47
Ramos A.P., Cruz M.A.E., Tovani C.B., Ciancaglini P. // Biophys. Rev. 2017. V. 9. P. 79. https://dx.doi.org/10.1007%2Fs12551-016-0246-2.
Glebska S., Szczecinska A., Znajdek N. et al. // Acta Innovations. 2019. V. 30. P. 5. http://dx.doi.org/10.32933%2FActaInnovations.30.1.
Соседова Л.М., Рукавишников В.С., Сухов Б.Г. и др. // Российские нанотехнологии. 2018. Т. 13. С. 76.
Suleiman M., Ali A.A., Hussein A. et al. // J. Mater. Environ. Sci. 2013. V. 5. P. 1029.
Boroumand S., Safari M., Shaabani E. et al. // Mater. Res. Express. 2019. V. 6. P. 211. https://doi.org/10.1088/2053-1591/ab2558
Vahdati M., Moghadam T.T. // Sci. Rep. 2020. V. 10. P. 510. https://doi.org/10.1038/s41598-019-57333-7
Hosnedlova B., Kepinska M., Skalickova S. et al. // Int. J. Nanomed. 2018. V. 13. P 2107. https://dx.doi.org/10.2147%2FIJN.S157541
Amini S.M., Mahabadi V.P. // Nanomed. Res. J. 2018. V. 3. P. 117. https://doi.org/10.22034/nmrj.2018.03.001
Сергеев Г.Б. // Рос. хим. журн. 2002. Т. 46. С. 22.
Tripathia R.M., Rao P.R., Tsuzuki T. // RSC Adv. 2018. V. 8. P. 36345. https://doi.org/10.1039/C8RA07845A
Risse S., Hark E., Kent B., Ballauff M. // ACS Nano. 2019. V. 13. P. 10233. https://doi.org/10.1021/acsnano.9b03453
Chen H., Wang C., Dong W. et al. // Nano Lett. 2015. V. 15. P. 798. https://doi.org/10.1021/nl504963e
Mo R., Lei Z., Rooney D., Sun K. // Energy Storage Mater. 2019. V. 23. P. 284. https://doi.org/10.1016/j.ensm.2019.04.046
Cohen P.R., Anderson C.A. // Dermatol. Ther. (Heidelb). 2018. https://doi.org/10.1007/s13555-018-0259-9
Mavandadnejad F., Rafii F., Faghfuri E. et al. // Am. Res. J. Dermatol. 2013. V. 1. P. 22.
Li Z., Zhang J., Lu Y., Lou W.X. // Sci. Adv. 2018. V. 4. P. 1. https://doi.org/10.1126/sciadv.aat1687
He J., Lv W., Chen Y. // J. Mater. Chem. A. 2018. V. 22. P. 1. https://doi.org/10.1039/c8ta02434k
Asghari-Paskiabi F., Imani M., Rafii-Tabar H., Razzaghi-Abyaneh M. // Biochem. Biophys. Res. Commun. 2019. V. 516. P. 1078. https://doi.org/10.1016/j.bbrc.2019.07.007
Raksha K.R., Ananda S., Narayanaswamy R. // J. Sulfur Chem. 2015. V. 12. P. 471. https://doi.org/10.1080/17415993.2015.1057511
Kariper I.A., Ozden S., Tezel F.M. // Opt. Quantum Electron. 2018. V. 50. P. 441. https://doi.org/10.1007/s11082-018-1693-8
Фадеева Т.В., Шурыгина И.А., Сухов Б.Г. и др. // Изв. РАН. Сер. физ. 2015. Т. 79. С. 297.
Александрова Г.П., Боймирзаев А.С., Лесничая М.В. и др. // Журн. общей химии. 2015. Т. 85. С. 317.
Александрова Г.П., Грищенко Л.А., Богомяков А.С. и др. // Изв. РАН. Сер. хим. 2010. Т. 12 С. 2261.
Феоктистова Л.П., Александрова Г.П., Грищенко Л.А. и др. // Нанотехника. 2009. Т. 20. С. 31.
Лесничая М.В., Малышева С.Ф., Белогорлова Н.А. и др. // Изв. РАН. Сер. хим. 2019. Т. 12. С. 2245.
Wongmanee K., Khuanamkam S., Chairam S. // J. King Saud University Sci. 2017. V. 29. P. 547. https://doi.org/10.1016/j.jksus.2017.08.007
Медведева Е.Н., Бабкин В.А., Остроухова Л.А. // Химия растительного сырья. 2003. Т. 1. С. 27.
Антонова Г.Ф., Тюкавкина Н.А. // Химия древесины. 1983. № 2. С. 89.
Dokic P., Dokic L., Dapcevic T., Krstonosic V. // Prog. Colloid Polym. Sci. 2008. V. 135. P. 48.
Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2011. Т. 80. С. 635.
Хлебцов Б.Н., Хлебцов Н.Г. // Коллоидный журнал. 2011. Т. 73. С. 106.
Sadeghi R., Daniella Z., Uzun S., Kokini J. // J. Cereal Sci. 2017. V. 76. P. 127.
Gasilova E.R., Toropova A.A., Bushin S.V. et al. // J. Phys. Chem. B. 2010. V. 114. P. 4204.
Pecora R. Dynamic Light Scattering: Applications of Photon Correlation Spectroscopy. New York: Plenum Press, 1985.
Romdhane A., Aurousseau M., Guillet A., Mauret E. // Starch. 2015. V. 67. P. 319.
Russell P.L., Oliver G. // J. Cereal Sci. 1989. V. 10. P. 123. https://doi.org/10.1016/S0733-5210(89)80041-4
Hosseini E., Mozafari H.R., Hojjatoleslamy M., Rousta E. // Food Sci. Technol. 2017. V. 37. P. 1. https://doi.org/10.1590/1678-457x.18116
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии