Российские нанотехнологии, 2021, T. 16, № 4, стр. 494-518
ПРИМЕНЕНИЕ НАНОТЕХНОЛОГИЙ В ИЗУЧЕНИИ СТРУКТУРЫ ДРОЖЖЕЙ Candida
Н. А. Савин 1, *, В. С. Колмогоров 1, Р. В. Тимошенко 1, Н. Л. Клячко 2, Ю. Н. Пархоменко 1, С. В. Салихов 1, А. Г. Мажуга 1, 2, А. С. Ерофеев 1, 2, П. В. Горелкин 1
1 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: nsavin99@mail.ru
Поступила в редакцию 11.12.2020
После доработки 11.12.2020
Принята к публикации 16.12.2020
Аннотация
В обзоре рассмотрены методы зондовой, электронной и конфокальной микроскопии для изучения структуры дрожжей Candida. Приведены последние достижения в области исследования противомикробных эффектов методами микроскопии высокого разрешения. Представлены преимущества и недостатки каждого метода, а также границы их применения. Описаны такие процессы, как лизис клеточной стенки и разрушение цитоплазматической мембраны, вызванные противогрибковыми препаратами, а также их воздействие на наноструктурные или механические свойства дрожжей Candida. Особое внимание уделено пробоподготовке Candida и протоколам сканирования.
ОГЛАВЛЕНИЕ
Введение
1. Применение зондовых методов микроскопии в изучении клеток Candida
2. Применение методов электронной микроскопии в изучении клеток Candida
3. Применение конфокальной микроскопии в исследовании дрожжей Candida
4. Сравнение методов
Заключение
ВВЕДЕНИЕ
Инвазивные инфекции, вызванные дрожжами разных видов рода Candida, в основном поражают пожилых людей или пациентов с иммунодефицитом и трудно поддаются лечению [1, 2]. Высокий показатель смертности связывают с ограниченным резервом противогрибковых препаратов и появлением большого количества резистентных штаммов [3, 4]. На сегодня самыми распространенными группами противогрибковых препаратов являются: азолы, блокирующие синтез эргостерола; полиены, связывающиеся с эргостеролом в плазматической мембране, что приводит к нарушению проницаемости клетки; фторированные пиримидины, препятствующие синтезу белка и репликации ДНК; эхинокандины, блокирующие β-1,3-глюкансинтазу, которая участвует в биосинтезе клеточной стенки дрожжей [3, 5–9]. Как правило, воздействие данных препаратов исследуется при помощи методов флуоресцентной микроскопии, однако подобные методы не позволяют получать данные о наноразмерной структуре поверхности дрожжей.
Современные методы высокоразрешающей микроскопии активно используются для исследования морфологических и функциональных свойств единичных дрожжевых клеток и действия на них лекарственных препаратов. Широко применяются методы зондовой микроскопии для визуализации оболочки и измерения жесткости клеточной стенки дрожжей. Атомно-силовая микроскопия (АСМ) является наиболее используемым методом для изучения морфологии и механических свойств клеток дрожжей в физиологических условиях [10–12]. Другим методом для визуализации является сканирующая электронная микроскопия, позволяющая получать изображения клеток и биопленок в высоком разрешении. Метод просвечивающей электронной микроскопии дает возможность визуализировать клетку в разрезе для обнаружения разрушения мембраны. Однако у перечисленных методов есть один существенный недостаток. В процессе пробоподготовки образца гибнут сами дрожжи, что не позволяет определить, какие морфологические изменения вызывает терапевтический препарат, а какие высушивание клеток или их фиксация. Такой метод пробоподготовки не позволяет изучить динамику морфологических изменений и кинетику воздействия противогрибковых препаратов. При этом наименее инвазивные методы, такие как быстрая криофиксация/витрификация клеток [13–15], криозамещение воды [16, 17], весьма дорогостоящие и трудоемкие.
Методы АСМ широко используются в клеточной биологии [18–20] для визуализации и изучения функциональных свойств живых клеток. Пространственное разрешение изображений зависит от радиуса острия зонда. Более того, нанозонды способны измерять силы в широком диапазоне (приблизительно от 0.1 до 100 нН), которые действуют на отдельные молекулы, что позволяет определять силы небольших межмолекулярных, межклеточных и сильных ковалентных взаимодействий [21–23]. Возможность наблюдать структуру поверхности или локализацию адгезии единичных молекул и механических свойств клетки позволяет проводить оценку воздействия противомикробных препаратов на штаммы бактерий и грибков или выявлять их резистентность [24, 25].
В свою очередь, методы растровой и просвечивающей электронной микроскопии (РЭМ и ПЭМ) позволяют получать снимки клеточной стенки и биопленки дрожжей с более высоким пространственным разрешением ~5–100 нм для РЭМ и 1–30 нм для ПЭМ. Метод дает информацию не только о структуре поверхности (РЭМ), но и о внутриклеточной структуре срезов (ПЭМ). Отметим, что большинство экспериментов проводится in vitro, однако имеются сообщения об опытах по изучению Candida на моделях in vivo [26–29].
Отличительным преимуществом методов зондовой, электронной и конфокальной микроскопии от классических оптических методов является возможность исследования наноструктуры биологических объектов. К примеру, изменения, возникающие в ходе лизиса клеточной стенки дрожжей, толщина которой составляет ~100–250 нм, невозможно зафиксировать с помощью оптического микроскопа, то же справедливо для образования биопленок на клетках. Изучение таких процессов, их динамики и причины возникновения вносит существенный вклад в понимание принципа действия, качественного и количественного анализа эффективности противогрибковых препаратов, что способствует разработке более эффективных препаратов. В данном обзоре рассмотрены последние достижения в области исследования дрожжей Candida, полученные благодаря микроскопии высокого разрешения и демонстрирующие, как технология расширила понимание о процессах, протекающих на клеточной поверхности, механике и структуре клеток.
1. ПРИМЕНЕНИЕ ЗОНДОВЫХ МЕТОДОВ МИКРОСКОПИИ В ИЗУЧЕНИИ КЛЕТОК Candida
Атомно-силовая микроскопия [30] является передовым методом визуализации сверхвысокого разрешения, позволяющим решать фундаментальные и практические задачи в области клеточной биологии. Метод АСМ способен визуализировать клетки в физиологическом растворе в режиме реального времени для последующего анализа топографии и механических свойств. Поскольку при визуализации поверхности методом АСМ на образец оказывается механическое воздействие, необходима фиксация образца на поверхности подложки химическими методами [31].
Основной принцип работы АСМ заключается в регистрации силового взаимодействия между зондом и поверхностью образца [32]. При сканировании образец фиксируют на пьезоэлектрическом сканере, способном претенциозно перемещаться в трех измерениях. Такой режим известен как сканирование образцом, также возможно сканировать, перемещая в пространстве острие, сканирование острием, однако такая конструкция дорогостоящая. Острие установлено на гибкий кантилевер, на который светят лазерным лучом, и при механическом отклонении острия от образца фотодиодом фиксируется отклонение лазерного пучка. Величина такого отклонения зависит от сил взаимодействия между острием и образцом.
Существуют два режима сканирования АСМ для визуализации биологических объектов – контактный и динамический. При контактном режиме зонд находится в непосредственном контакте с поверхностью образца. Преимуществами такого режима являются высокая скорость сканирования, возможность измерения распределения латеральных сил по поверхности образца и высокое качество изображений поверхности с развитым рельефом. Тем не менее немаловажным недостатком является проблематичность при сканировании мягких и незакрепленных биологических образцов, по этой причине режим почти не используется при изучении дрожжей Candida. В динамическом режиме, включающем в себя полуконтактный и бесконтактный режимы, кантилевер колеблется таким образом, что зонд находится вблизи или немного выше поверхности образца [33, 34]. В таком режиме воздействие на образец минимально, следовательно, повреждение мягких образцов менее вероятно, а разрешающая способность для мягких образцов выше, хотя скорость такого сканирования меньше, чем у контактного режима.
Несмотря на различные режимы сканирования, зонд АСМ прилагает силу к образцу, что приводит к дрейфу незафиксированных клеток. Сканирование высушенных образцов позволяет добиться физической фиксации клеток на субстрат и избежать их дрейфа при сканировании методом АСМ. Однако данное преимущество нивелируется невозможностью исследования живых клеток, что не позволяет изучать динамику изменения структуры поверхности и кинетику воздействия противогрибковых препаратов. Так как информация, полученная с дегидратированных клеток ограничена, самым распространенным применением АСМ в изучении дрожжей является анализ терапевтических свойств противогрибковых препаратов, основанный на данных о топографии грибка.
В [35] различными методами, включая АСМ, изучали терапевтические свойства 1,4-нафтохинона по отношению к Candida albicans. Замечено, что некоторые группы нафтохинонов, обладающие высокой фармакологической активностью, связанной с окислительно-восстановительными и кислотно-основными свойствами [36], проявляют противогрибковый эффект [37, 38].
В настоящей работе исследовали высушенные клетки. Анализ клеток C. albicans (рис. 1) демонстрирует, что дрожжи из контрольной группы (рис. 1а) обладают гладкой поверхностью и имеют правильную форму, в то время как обработанные нафтохиноном клетки имеют шероховатую поверхность (рис. 1б). Согласно фазово-контрастной визуализации клетки, обработанные нафтохиноном (рис. 1г), мягче, чем клетки контрольной группы (рис. 1в). Выявлено, что у обработанных нафтохиноном клеток C. albicans сила адгезии меньше, чем у контрольной группы (рис. 1д, 1е). Данное исследование демонстрирует возможность не только проводить профилирование с наноразрешением и силой адгезии, но и оценивать противогрибковую активность 1,4-нафтохинонов в отношении штаммов C. albicans методом АСМ.
Рис. 1.
АСМ-изображение клеток Candida albicans: а – контрольные клетки (высота); б – клетки, обработанные нафтохиноном (высота); в – контрольные клетки (фазовый контраст); г – клетки, обработанные нафтохиноном (фазовый контраст); д – контрольные клетки (адгезия); е – клетки, обработанные нафтохиноном (адгезия) [35].

Метод АСМ позволяет выявлять эффекты незначительных изменений в составе клеточной поверхности и ее отклик на добавление биоматериалов, при этом АСМ дает информацию о поверхности относительно экзополисахаридов, которыми покрыты биопленки клетки Candida. Известно [39, 40], что мед обладает противомикробными свойствами, которые опосредованы содержащимися в нем перекисью водорода и ингибином. Также мед эффективен при лечении различных бактериальных заболеваний [41–43]. В [44] изучено влияние меда на образование биопленок C. albicans и его разрушающее воздействие на биопленки C. albicans.
В представленной работе биопленки иммобилизировали на субстрат глутаровым альдегидом. Такая модификация жестче фиксирует биологический микрообъект, нежели поли-L-лизин [31], что позволяет добиться лучшей адгезии между клеткой и субстратом. Однако исследования проводили на высушенной в газовой фазе биопленке, что негативно сказалось на ее структуре. Изображения получали в динамическом полуконтактном режиме с использованием острия радиусом в 10.0 ± 0.8 нм и угла схождения 22°. Такой режим позволяет проводить визуализацию с высоким разрешением и минимальным воздействием на образец, что весьма важно при сканировании хрупкого объекта с развитым рельефом.
АСМ-изображения биопленок C. albicans демонстрируют, что в контрольной группе Candida (рис. 2а) грибок встроен в слой экзополисахаридов, равномерно распределенных по поверхности. Данный слой отсутствует у групп клеток, обработанных медом (рис. 2б, 2в), и их значение высоты выше, чем у контрольной группы.
Рис. 2.
АСМ-изображение C. albicans: а – биопленка контрольных клеток спустя 48 ч инкубации (высота 200 нм); б, в – биопленка клеток, инкубированных с медом (40 мас. %) в течение 48 ч (высота 90, 14 нм соответственно) [44].
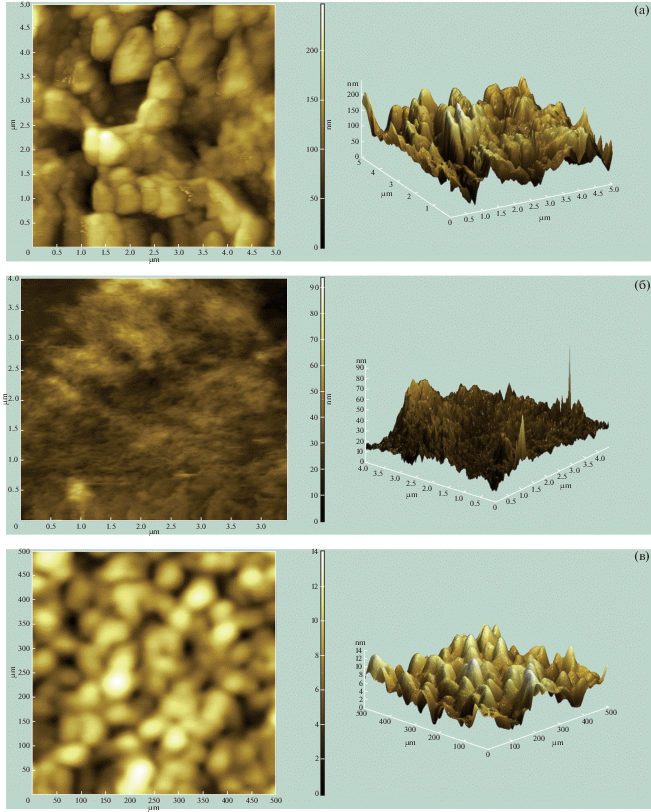
Таким образом, после обработки медом толщина биопленки C. albicans уменьшается более чем вдвое. При этом значительно увеличивается шероховатость биопленки C. albicans, что связано с удалением экзополисахаридного слоя, покрывающего биопленку C. albicans. Данный слой препятствует проникновению противогрибковых препаратов в биопленку и поддерживает ее гладкую текстуру. Это согласуется с данными [45], демонстрирующими, что биопленки C. albicans выделяют толстый слой экзополисахаридов, в котором клетки прикрепляются друг к другу, что защищает их от внешней среды.
Оценка противогрибковых препаратов классическими методами клеточной биологии может быть весьма затруднительна. К примеру, масло цимбопогона (LGO) способно проявлять противогрибковую активность, которую возможно наблюдать на наноструктурном уровне [46]. Для корректной оценки таких свойств требуются методы микроскопии сверхвысокого разрешения. В [47] методом АСМ оценили воздействие на морфологию C. albicans масел LGO в жидкой и газообразной фазах. Изображения высушенных клеток получали на АСМ, работающем в динамическом полуконтактном режиме.
АСМ-изображения демонстрируют признаки противогрибковой активности обработанной раствором или парами LGO биопленки C. albicans. Методом АСМ выявлено уменьшение размера и высоты клеток (контрольная группа на рис. 3а), обработанных LGO (рис. 3б) и парами LGO (рис. 3в), что еще раз подтверждает возможность использования АСМ в изучении воздействия противогрибковых препаратов на грибке Candida.
Рис. 3.
АСМ-изображения, демонстрирующие изменение высоты необработанных и обработанных (24 ч) клеток Candida от поверхности стекла: а – необработанные (h – 2000 нм), б – обработанные LGO (h – 700 нм), в – обработанные паром LGO (h – 100 нм) [47].

Отличительной особенностью АСМ от прочих методов микроскопии сверхвысокого разрешения является возможность сканирования поверхности живых клеток. Такой подход позволяет изучать быстропротекающие процессы в дрожжах in vitro. В [48] изучена чувствительность био-пленок C. albicans к обработке холодной плазмой в течение минуты с короткими интервалами по времени. С помощью АСМ было расширено понимание морфологических изменений клеток после обработки биопленки плазмой. Благодаря АСМ-методу визуализации определено, что для клеток, обработанных плазмой, характерны более сферическая форма, нарушение целостности структуры клетки, а также меньшее количество клеток по сравнению с контрольными клетками. Определение жизнеспособности клеток после плазменной терапии рассмотренным методом возможно применять в пищевой промышленности, где удаление биопленок представляет большой интерес.
В [49] исследованы белки SMI1, участвующие в регуляции синтеза клеточной стенки C. albicans. Исследование проводилось на дрожжах, находящихся в физиологическом растворе, с максимально прилагаемой к образцу силой в 1 нН, что благоприятно влияет на чистоту полученных результатов. Методами АСМ выявлены структурообразующая роль белка SMI1 у C. albicans и нарушение целостности клеточной стенки у мутантных штаммов без SMI1. Более того, при помощи записи механических сил дрожжей определено воздействие белка SMI1 на модуль Юнга клеток и адгезию клеток друг к другу. Полученные данные возможно использовать при разработке противогрибковых препаратов, направленных на SMI1. Несомненно, возможность визуализировать поверхностную структуру Candida на не обезвоженных образцах является перспективной в разработке медикаментов и изучении механизмов, протекающих на поверхности. Однако большинство работ по изучению живых дрожжей направлено на изучение механических свойств клеток.
Изучение адгезивных свойств клеток расширяет понимание процессов, проходящих на их поверхности, дает представление о поверхностном составе и белках адгезии. Метод АСМ позволяет исследовать механические свойства биологических объектов, что находит применение в различных сферах и актуально на данный момент. В [50] с помощью атомно-силового микроскопа оценили адгезию клеток C. albicans к поверхностям из полиметилметакрилата (ПММА), поскольку это основной материал [51] для изготовления зубных протезов. Чтобы получить контакт между дрожжами и зондом без механического отталкивания друг от друга, образец иммобилизировали на предметные стекла, покрытые поли-L-лизином либо дофамин гидрохлоридом (более предпочтительное покрытие для гифальных форм грибка) (рис. 4).
Рис. 4.
Схема установки для изучения адгезии между ППМА и C. albicans, единичных клеток и гифов (а); оптические изображения зонда над клетками C. albicans, прорастающими дрожжевыми тубами и гифом соответственно (б–г) [50].

Установлено, что силы адгезии между C. albicans C1 и ПММА возрастают с увеличением времени контакта, аналогичная ситуация и с силами адгезии между ПММА и гифальными трубками (рис. 5). Однако силы адгезии между ПММА и гифами в 20 раз выше, чем между ПММА и клеткой при максимальном времени контакта 30 с. Такой результат указывает на пластичность экспрессии адгезина клеток C. albicans. Схожая морфологически зависимая адгезия обнаружена между ПММА и C. albicans штамма ATCC 10231; тем не менее сила адгезии между ПММА и гифами лишь в 4 раза выше, чем между ПММА и клетками (рис. 5). Разница в силах адгезии между ПММА и клетками или гифом свидетельствует о наличии большого количества поверхностных адгезинов, позволяющих взаимодействовать с биоматериалом. Таким образом, методом АСМ можно проводить измерения не только на стандартных субстратах для культивирования дрожжей, но и на поверхностях, где повышенная концентрация патогенного штамма Candida может приводить к инфекционным заболеваниям.
Рис. 5.
Сравнение сил адгезии между C. albicans штамма 10231, C. albicans штамма C1 и ПММА при разном времени контакта (0–30 с) [50].

Еще одним применением АСМ при определении сил адгезии является изучение маннанов. Биопленка C. albicans содержит обширное количество внеклеточных α-глюканов, продуцируемых экзоферментом (GtfB), который секретирует S. mutans. В [46] исследованы находящиеся на клеточной стенке C. albicans маннаны, обеспечивающие связывание экзофермента GtfB, тем самым усиливая продуцирование глюкан-матрикса, а также модуляцию в биопленках бактериально-грибковых объединений.
В данном примере микробные клетки были иммобилизованы на предметном стекле, покрытом поли-L-лизином [46]. Такое покрытие позволяет сканировать клетки различного размера, но при этом сила иммобилизации клеток ниже, чем у механического захвата в мембраны. Для исследования зонд АСМ был функционализирован экзоферментом GtfB [47]. Измерения живых клеток также проводились в физиологическом растворе по протоколу [46], при котором минимизируется воздействие зонда на образец.
Обнаруженные высокоадгезивные контакты между экзоферментом GtfB и клетками C. albicans (рис. 6а) и низкоадгезивные взаимодействия между O-маннозилированными мутантами C. albicans могут использоваться для практического определения в колониях диких и мутантных штаммов. Сшивание острия АСМ с GtfB для исследования сил адгезии между GtfB–Candida позволяет выявить различия между контактом адгезии GtfB и C. albicans дикого типа и мутировавших штаммов C. albicans (рис. 6б). В дополнение проведенный иммуноферментный анализ отмытых после инкубации с GtfB клеток C. albicans подтвердил результаты о слабой силе адгезии между GtfB и мутировавшими штаммами грибка (рис. 6в). Представленная работа дополняет общее представление о возможностях метода АСМ по изучению сил адгезии.
Рис. 6.
Гистограмма силы адгезии (а); АСМ-изображения и топография сил адгезии для штаммов дикого типа WT и штаммов мутантных штаммов pmt4ΔΔ и och1ΔΔ (б); количество GtfB, связанного на (и оторванного от) поверхности C. albicans (в) [89].

Уникальной особенностью метода АСМ в изучении сил адгезии является возможность определять не только силы большого количества адгезинов или маннанов, но и проводить анализ механических сил единичных белков. В [52] проанализированы отдельные белки Als5p на клетках дрожжей. Для этого N-концы полноразмерных белков Als5p модифицировали эпитопной меткой V5 (рис. 7а), обеспечивающей специфическое обнаружение с антителом анти-V5, прикрепленной к острию АСМ (рис. 7б) по протоколу [53]. Измерения АСМ проводились в физиологических условиях, а клетки C. albicans иммобилизовались путем фиксации в пористые поликарбонатные мембраны (Millipore), размер пор которых сопоставим с размером клеток. Данный метод иммобилизации клеток Candida весьма распространен [5, 54, 55], так как позволяет жестко закреплять образец, однако выборка по размеру клеток ограничена.
Рис. 7.
Гистограмма силы адгезии, полученная путем записи кривых силы между острием анти-V5 и поверхностью, модифицированной эпитопами V5 (а); тот же эксперимент, но в присутствии свободных эпитопов V5 концентрацией 0.2 мг/мл (б) [52].

Первоначально измеряли аналогичные силы между острием, функционализированным анти-V5, и смоделированной поверхностью, функционализированной эпитопами V5 (рис. 7а). Специфичность измеренного взаимодействия подтвердилась снижением частоты адгезии при введении свободных эпитопов как на поверхности модели (рис. 7в), так и на живых клетках (рис. 8). Затем сопоставили пространственные расположения белков Als5p, которые показали, что у клеток дикого типа (рис. 9а), на которые не воздействовали механически, белки распределены равномерно без каких-либо явных проявлений кластеризации (рис. 8б). У клеток, на которые воздействовали механически (рис. 9в), замечено увеличение общей плотности белков на поверхности (рис. 9г), более того, белки не распределены равномерно и образуют кластеры (рис. 6б, 6в). Как показано на рис. 9г, доля кластерных молекул увеличена.
Рис. 8.
Гистограмма силы адгезии, полученная путем записи кривых силы между острием анти-V5 и клетками, экспрессирующими меченные V5 белки Als5p (а); тот же эксперимент в присутствии 0.2 мг/мл свободных эпитопов V5 (б) [52].
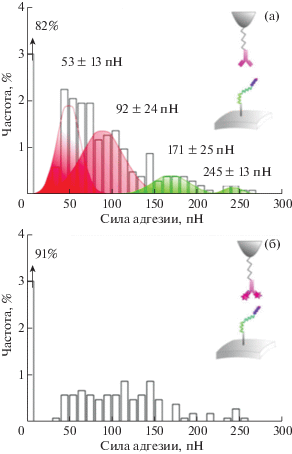
Рис. 9.
АСМ-топография S. cerevisiae дикого типа, экспрессирующих меченные V5 белки Als5p (а). Картирование силы адгезии клеток, не подверженных механическому воздействию (б). Картирование силы адгезии (в). Гистограммы количества белков Als на мкм2, измеренные для клеток дикого типа (WT), убитых нагревом клеток дикого типа (WTk), мутантных клеток V326N (г) [52].
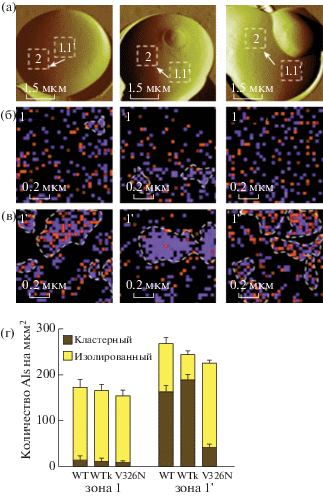
Локальное воздействие сил величиной в пиконьютон на живые дрожжевые клетки вызывает образование и распространение адгезивных контактов. Принудительная активация клеточной адгезии является распространенным биологическим явлением [56, 57]. Наблюдения [52] показывают, что силозависимая кластеризация адгезина служит общим механизмом активации клеточной адгезии. На начальной стадии растяжение и развертывание Als5p с помощью острия АСМ увеличили количество конформаций, в которых предпочтительны гомологичные гидрофобные взаимодействия. Гидрофобные взаимодействия между повторяющимися фрагментами ДНК способствуют самоассоциации Als5p и привлечению других соседних белков [58]. Возможность определять силы адгезии единичных белков позволяет проводить количественную оценку адгезинов при контакте клетка–клетка, что является одним из важных факторов при изучении процессов, проходящих на поверхности дрожжей.
Помимо визуализации морфологии и определения сил адгезии АСМ может использоваться для определения силы взаимодействия между острием и образцом для картирования распределения сила–расстояние в режиме силовой спектроскопии. С помощью этой уникальной способности возможно исследовать механические свойства биологических образцов.
Использование метода АСМ-сверхразрешения совместно с определением механических свойств дрожжей позволяет решать задачи, связанные с улучшением противогрибковой терапии. В исследовании [55] рассмотрено воздействие противогрибкового препарата каспофунгина, который, ингибируя β-1,3-глюкансинтазу, действует как блокирующий агент синтеза клеточной стенки. С помощью метода АСМ было изучено влияние каспофунгина на состав, морфологию и механические свойства клеточной стенки двух штаммов Candida, один из которых WT (дикий тип) восприимчив к данному препарату, а другой CaspR обладает резистентностью.
В данном эксперименте клетки фиксировались в пористых мембранах и находились в физиологическом растворе и нормальных условиях по протоколу [59]. Картирование механических свойств проводилось на поверхности отдельных клеток с приложением минимальных сил (3 нН) острием без модификаций, при таких условиях на клетку практически не оказывается никакого воздействия.
Выявлено, что в отличие от грибка контрольной группы, имеющей однородную клеточную форму (рис. 10а, 10г), в группах, инкубированных с каспофунгином, среди грибка WT наблюдаются клетки с искривленной неправильной формой (рис. 10б). На снимках при более высоком разрешении у одиночных клеток наблюдается шероховатая поверхность (рис. 10б). У всей группы из штамма WT выявлены повреждения мембраны при увеличенной концентрации каспофунгина (рис. 10в). Схожие изменения обнаружены на грибке мутантных штаммов C. albicans в аналогичном исследовании, в котором также проявляется разрушение клеточной стенки [60]. Предполагается, что при низкой концентрации каспофунгина у клеток CaspR возникают мутации, приводящие к возникновению резистентности к противогрибковому препарату, полностью предохраняющие клетку от эффектов лекарственного средства (рис. 10д). Однако при высокой концентрации для резистентного штамма CaspR некоторые клетки приобретали более рыхлую форму (рис. 10е). Эти данные свидетельствуют о том, что терапия каспофунгином влияет на штаммы, которые ранее считались устойчивыми к препарату и что ответ на противогрибковый препарат является гетерогенным.
Рис. 10.
АСМ-изображения (полученные на воздухе) восприимчивых WT (а, б, в) и резистентных СaspR (г, д, е) к каспофунгину клеток. Образцы контрольной группы (а, г), обработанные каспофунгином с концентрацией в 0.5 и 50 МИК (б, д, и в, е соответственно). На вставках снимки отдельных клеток в высоком разрешении, под каждым снимком трехмерные изображения [55].

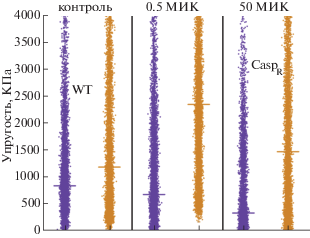
По кривым сил возможно изучать механические изменения в клетках, вызванные активностью препарата в отношении синтеза β-1,3-D-глюкана. По картированию силы деформации поверхности клеток дрожжей (рис. 11а) можно напрямую судить о ее механической прочности. Полученный результат модулей упругости в контрольной группе клеток WT и CaspR (рис. 11в, 11е, 9) согласуется со значениями, полученными при измерении других штаммов дрожжей [61]. При добавлении небольших доз каспофунгина значительного изменения модуля упругости не происходит, однако некоторые клетки становятся более мягкими (рис. 11г, 11ж). Такая стабильность модуля упругости объясняется переориентировкой синтеза клеточной стенки для сохранения прочности, что также согласуется с другими исследованиями ответных реакций грибка на воздействие каспофунгина [62, 63]. Однако при обработке высокими дозами каспофунгина у клеток WT модуль упругости снижается в 6 раз (рис. 11д, 12), что указывает на неспособность грибка адаптироваться к повышенным дозам препарата.
Рис. 11.
АСМ-измерение механических свойств клеток, восприимчивых и резистентных к каспофунгину (а). Кривые зависимости силы от глубины вдавливания индентора, полученные на клетках WT или СaspR с препаратом и без него (кружки – WT, треугольники – СaspR, линии – теоретические модели) (б). Гистограммы эластичности клеток WT (в–д) и СaspR (е–з); контрольные группы (в, е); после обработки каспофунгином ex situ при 0.5 (г, ж), 50 МИК (д, з) [55].

При низкой концентрации каспофунгина клетки CaspR имеют более жесткую клеточную стенку, чем у клеток контрольной группы (рис. 11е, 11ж соответственно, рис. 12). Такое повышение модуля упругости свидетельствует о том, что в присутствии малых доз препарата возникают изменения в составе клеточной стенки. При высокой концентрации каспофунгина модуль упругости клеток CaspR повышается двукратно (рис. 11з, 12), однако у некоторых грибков эффект воздействия препарата не выявлен, что согласуется с топографией (рис. 10е). Каспофунгин не только ответственен за изменение β-1,3-D-глюканов, но и опосредует перестройку клеточной стенки, за счет чего компенсируется негативный эффект лекарственного препарата. Из данной работы можно судить о мультизадачности метода АСМ, способного единовременно предоставлять информацию о структуре и механических свойствах дрожжей. На такой основе возможно проводить анализ противогрибковых препаратов в доклинических исследованиях.
Рис. 12.
График распределения модулей упругости у клеток штаммов WT и СaspR контрольных групп и с добавлением каспофунгина в 0.5 и 50 МИК [55].
В [64] исследовали живые дрожжи, используя неинвазивный метод сканирующей ион-проводящей микроскопии (СИПМ) [65]. Одновременно получены топография поверхности и нормированный ток, демонстрирующие резкий контраст между подложкой и образцом. На поверхности дрожжей замечен высокий рост тока, что говорит о наличии отрицательного заряда. Таким образом, показана возможность метода СИПМ получать мультифункциональную информацию за одно сканирование с использованием одноканального зонда.
Согласно рассмотренным работам АСМ позволяет визуализировать наноразмерную структуру клеточных поверхностей, а также локализовать их отдельные составляющие. Несмотря на то что данный метод позволяет решать основные вопросы области биофизики, в частности процесс лизиса клеточной стенки, развитие биопленки или адгезию клеток, у него имеются некоторые ограничения. Во-первых, работа с живыми клетками весьма трудозатратна, а протоколы пробоподготовки требуют значительного опыта работы как с биообразцом, так и с установкой. Качество полученного образца и острия, контроль их целостности и правильная интерпретация данных являются показательными факторами проведения экспериментов. Поэтому так важна разработка более простых протоколов сканирования живых образцов или методов прикрепления биомолекул к кантилеверам.
Во-вторых, зонд с малым радиусом острия (10 ± 0.8 нм) способен механически повредить мембрану клетки. В связи с этим, как правило, используется острие радиусом 50 ± 4 нм, что негативно сказывается на пространственном разрешении изображения. При этом даже малые механические воздействия зонда на биологический образец (<50 пН) вызывают у последнего отклик, что также может влиять на результаты эксперимента. Отметим, что при контактном или полуконтактном режиме острие загрязняется слабосвязанными макромолекулами на поверхности клетки.
Метод визуализации клеток АСМ ограничен их внешней поверхностью, в связи с чем получение информации о внутренних структурах живого образца не представляется возможным.
2. ПРИМЕНЕНИЕ МЕТОДОВ ЭЛЕКТРОННОЙ МИКРОСКОПИИ В ИЗУЧЕНИИ КЛЕТОК Candida
Методы электронной микроскопии (ЭМ) стали применять для изучения поверхностных структур дрожжей в восьмидесятых годах прошлого столетия [66, 67]. В [68] представлена поверхностная структура дрожжей Candida tropicalis, исследованная при помощи методов РЭМ и ПЭМ. Пробоподготовка образцов основана на быстрой криофиксации [69] без добавления криопротекторов. Типичной подготовкой клеток для ПЭМ являются изготовление тонких срезов из сублимированных образцов и осаждение углерода и PtC.
С помощью методов РЭМ и ПЭМ проводилось сравнение грибков, выращенных на углеводородах и глюкозе. Метод позволил отчетливо различить полосу нитеподобных структур, которая покрывает тонкую клеточную стенку (рис. 13а). Такие же структуры наблюдались при пробоподготовке клеток посредством замораживания (рис. 13б). Согласно анализу РЭМ-изображений капсульный покров у протеолитически переваренных клеток, выращенных на углеводородах, в разы хуже по сравнению с клетками, выращенными на глюкозе (рис. 13в).
Рис. 13.
РЭМ-изображение Candida tropical, выращенной в культуре с углеводородами и глюкозой. Сравнительно тонкий слой клеточной стенки, покрытый “волосянистой” капсулой (а); ПЭМ-изображение среза C. tropical, выращенной с н-алканами в качестве субстрата. Хорошо различимa капсула, стрелки указывают на области, возникающие при инкубации клеток с гексадеканом (б); РЭМ-изображение C. tropical, подвергшейся протеолитическому расщеплению перед заморозкой. После обработки протеазой капсула разрушается, и обнажается тонкий слой клеточной стенки, которая местами разрушается (CW), обнажая поверхность плазматической мембраны (PF) и поверхность экзоплазматической оболочки (EF) (в); РЭМ-изображение C. tropical. Клеточная стенка более развита по сравнению с клетками, инкубированными на углеводородах, капсула слабо выражена (г); ПЭМ-изображение замороженного среза C. tropical, выращенного на глюкозе. Толщина капсулы меньше, чем у клеток, выращенных на углеводородах (д) [68].
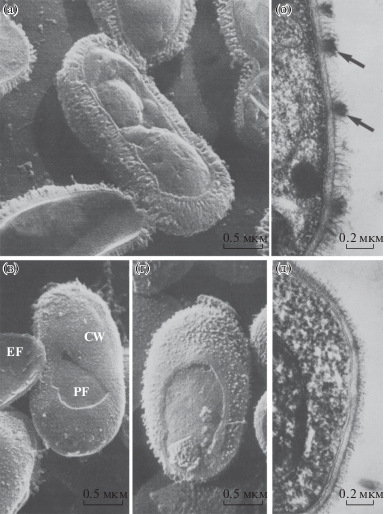
В отличие от ПЭМ- на РЭМ-снимках поверхностный слой капсулы менее выражен, при этом утолщена клеточная стенка (рис. 13г). На ПЭМ-снимке (тонкий срез, позитивное контрастирование) наблюдаются укороченные “волосатые наросты” (рис. 13д), толщина компактного слоя клеточной стенки существенно не отличается от толщины. Наилучшая адсорбция гексадекана на клетках при сравнении поверхностных структур заметна при выращивании дрожжей на углеводородах. Для процесса адсорбции подходит более развитая поверхность, которую возможно получить, выращивая клетки только на глюкозе. Исследования адсорбции, проведенные в [70], подтверждают эти выводы.
Исследования методами ЭМ позволили выявить, что для адсорбции углеводородов протеолитически расщепленные клетки проявляют наименьшую активность при контакте (рис. 13в). Однако клетки при обработке протеазой лишаются капсулы, что визуально делает их более гладкими, следовательно, и адсорбция углеводородов на таких клетках затруднена. В [71] выявлено, что содержание жирных кислот оказывает наибольшее влияние на гидрофобность клеточной стенки, что также подтверждено в [70] посредством РЭМ- и ПЭМ-методов визуализации.
Использование методов ЭМ широко распространено в изучении противогрибкового эффекта терапевтических препаратов в отношении грибков. В связи с тем что медицинские изделия, такие как катетеры, искусственные суставы, шунты и имплантаты, представляют собой хороший субстрат для формирования биопленок Candida, обладающих резистентностью к большинству противогрибковых препаратов [72, 73], в [74] оценили влияние флуконазола и вориконазола на морфологию клеток и образование биопленки у штамма C. glabrata, обладающего резистентностью к флуконазолу, и у штаммов C. rugosa и C. parapsilosis, восприимчивых к флуконазолу.
В [74] клетки Candida иммобилизовали с помощью глутарового альдегида и фиксировали в тетраоксиде осмия, затем подвергали сушке. Такая пробопоготовка может приводить к структурному изменению поверхности дрожжей. Исследование, аналогичное работе [68], проводилось на срезах клеток. При такой обработке изучаются уже дегидратированные дрожжи.
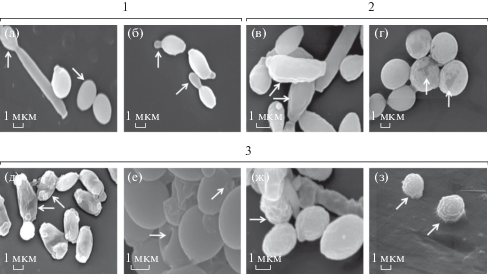
В [74] выделили три класса морфологии клеток для анализа воздействия на них препаратов. Интактные клетки без морфологических изменений относятся к классу 1 (рис. 14а, 14б). К такому классу отнесли контрольные клетки овальной формы, неповрежденные, с гладкой поверхностью (рис. 14а). В некоторых случаях замечено почкование клеток (рис. 14б). К классу 2 отнесли клетки с незначительными изменениями (рис. 14в, 14г). У клеток, обработанных флуконазолом (19 МИК), на поверхности присутствуют небольшие “морщины” (рис. 14в), а их клеточная стенка деградировала (рис. 14г). К классу 3 относятся клетки с явными изменениями (рис. 14д, 14е). Обработка флуконазолом (109 МИК) приводит к усадке клеток и образованию ямокоподобных структур на клеточной стенке (рис. 14д). У C. glabrata, обработанной флуконазолом (109 МИК), обнаружено повреждение клеточной стенки и мембраны, так как их рельеф неровный (рис. 14ж). На рис. 14з представлены клетки с поврежденной мембраной (обработка вориконазолом (МИК 19)).
Рис. 14.
РЭМ-изображение клеток Candida: а, б – морфология 1-го класса – нормальные овальные клетки; д, е – морфология 2-го класса – морщинистые клетки с деградирующей клеточной стенкой; ж, з – морфология 3-го класса – морщинистые клетки с разорванной мембраной [74].
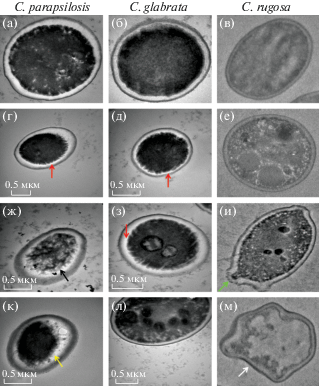
ПЭМ-анализ показал, что клетки контрольной группы не повреждены, их клеточная стенка одинаковой толщины (рис. 15а–15в). Обнаружены утолщение клеточной стенки и увеличение лакуны. При высоких концентрациях препаратов мембраны разрушены, что привело к впячиванию клеточной стенки внутрь (рис. 15г, 15д). В клетках C. rugosa отмечены образование вакуолей (рис. 15е) и прерывание почкования (рис. 15и). Также при обработке флуконазолом (МИК 109) отмечено разрушение клеточных компонентов, а у C. parapsilosis образование фибриллярно-подобных структур (рис. 15ж). Мембрана C. glabrata, обработанных флуконазолом, также впячена внутрь (рис. 15з), а при обработке клеток вориконазолом (МИК 19) замечена цитоплазматическая усадка (рис. 15к). Более того, обработка вориконазолом приводит к образованию вакуолей (рис. 15л) и искажению C. rugosa (рис. 15м). Представленные данные демонстрируют, что обработка биопленок Candida вориконазолом и флуконазолом приводит к существенному нарушению целостности клеток и снижению их жизнеспособности.
Рис. 15.
ПЭМ-изображения: а–в – контрольные клетки C. parapsilosis, C. glabrata и C. rugosa соответственно; г–е – обработанные флуконазолом (МИК 19) клетки C. parapsilosis, C. glabrata, C. rugosa; ж–и – обработанные флуконазолом (МИК 109) клетки C. parapsilosis, C. glabrata, C. rugosa; к–м – обработанные вориконазолом (МИК 19) клетки C. parapsilosis, C. glabrata, C. rugosa [74].
В [75] изучено воздействие наночастиц (НЧ) серебра (AgNPs) на биопленку C. auris методом СЭМ. Сравнительно недавно открытый штамм C. auris [76] способен вызывать инфекции кровотока, не поддающиеся лечению [77]. Отличительной особенностью C. auris является способность выживать в течение нескольких недель на различных поверхностях [78]. Наночастицы серебра способны проявлять противомикробную активность [79], что делает их претендентом в борьбе с инфекциями, вызванными Candida.
Биопленки, обработанные НЧ AgNP, фиксировали формальдегидом и глутаровым альдегидом и окрашивали тетроксидом осмия. Анализ контрольных клеток C. auris показал гладкую поверхность дрожжей правильной овальной формы с окружающим их внеклеточным полимерным веществом (рис. 16а, 16в, 16д). Наноструктурный РЭМ-анализ обработанных AgNP биопленок C. auris демонстрирует уменьшение количества клеток (рис. 16б) со значительным изменением формы и поверхности (рельеф более шероховатый) дрожжей, причинами чего служaт повреждение клеточной стенки, ее деформация и разрушение (рис. 16б, 16г, 16е соответственно). Представленные результаты демонстрируют сильную ингибирующую активность в отношении образования биопленки и предварительно образованных биопленок C. auris.
Рис. 16.
РЭМ-изображения контрольных клеток C. auris (а, в, д) и обработанных наночастицами AgNPs (б, г, е) [75].

Применимость методов ЭМ не ограничена изучением воздействия противогрибковых веществ, они могут использоваться и в отношении описания влияния комплексной терапии. К примеру, в онкологии используется фотодинамическая терапия (ФДТ), в основе метода заложена индукция фототоксической реакции посредством света соответствующей длины волны в сочетании с фотосенсибилизатором и молекулярным кислородом, приводящей к гибели клеток, в том числе микробных [62]. В [80] оценили способность гипокреллина B опосредовать фотодинамическую инактивацию восприимчивых и резистентных к классическим противогрибковым препаратам штаммов C. albicans методами ЭМ.
Пробоподготовка образцов для ПЭМ- и РЭМ-методов схожа с ранее рассмотренной работой [74]. После инкубации C. albicans с гипокреллином B и облучения светом клетки фиксировали в растворе глутарового альдегида, промывали раствором тетраоксида осмия, проводили дегидратацию этаном и высушивали. Для РЭМ клетки напыляли золотом, для ПЭМ грибок погружали в эпоксидную смолу и готовили срезы, окрашивая цитратом свинца.
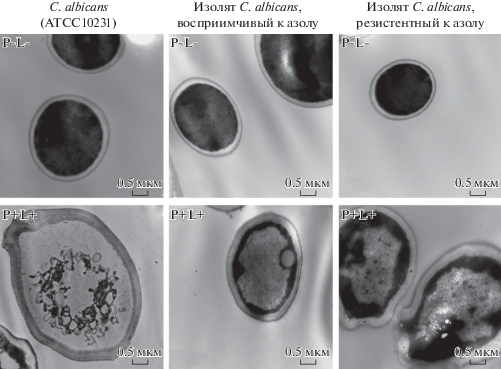
РЭМ-анализ показал, что контрольные клетки C. albicans (трех штаммов) имеют нормальную округлую форму с гладкой поверхностью (рис. 17). При инкубации с 10 мкМ гипокреллина В и облучением светом в 72 Дж/см2 поверхность клеток становится “извилистой”, а при концентрации гипокреллина B в 100 мкМ на поверхности появляются трещины. ПЭМ-анализ показал, что у контрольных клеткок C. albicans (трех штаммов) клеточная стенка и мембрана не повреждены и имеют правильную форму, видны ядра (рис. 18). У обработанных 100 мкМ гипокреллином B клеток обнаружено повреждение клеточной стенки, мембраны и цитоплазмы, ядра не видны. Таким образом, методом ЭМ доказана высокая эффективность гипокреллина B, опосредованного ФДТ, как противогрибкового препарата нового поколения.
Рис. 17.
РЭМ-изображения C. albicans контрольной группы (P-L-) и клеток, инкубированных с гипокреллином В в течение 30 мин, облученных светом (λ = 400–780 нм) в течение 15 мин (72 Дж/см2) (P + L +) [80].

Рис. 18.
ПЭМ-изображения C. albicans контрольной группы (P-L-) и клеток, инкубированных с гипокреллином В в течение 30 мин, облученных светом (λ = 400–780 нм) в течение 15 мин (72 Дж/см2) (P + L +) [80].
Несмотря на возможность получения изображений высокого разрешения методами ЭМ, пробоподготовка образцов более трудоемкая и включает в себя больше стадий по сравнению с АСМ. Процедуры подготовки требуют использования опасных химических веществ или дорогостоящего оборудования. Биологические образцы должны быть обезвожены, а их поверхность следует покрывать металлом или углеродом, что тоже негативно сказывается на структуре образца. РЭМ-анализ позволяет получить информацию только о внешнем виде клеток, тогда как АСМ дает информацию еще и о механических свойствах образца. При этом послойное сканирование в ПЭМ требует большого количества времени и расходного материала для сбора статистически значимой информации, что экономически невыгодно.
3. ПРИМЕНЕНИЕ КОНФОКАЛЬНОЙ МИКРОСКОПИИ В ИССЛЕДОВАНИИ ДРОЖЖЕЙ Candida
Конфокальный микроскоп – прибор, позволяющий неинвазивным образом визуализировать поверхностную и внутреннюю структуры клеток in vivo и in vitro. Основными типами конфокальной микроскопии (КМ) являются: микроскопия на основе тандем-сканирующего микроскопа [81], имеющего простую конструкцию, однако интенсивность его излучения мала для построения изображения в высоком разрешении; сканирующая щелевая КМ [82], скорость которой значительно выше, контрастность системы низкая; лазерная сканирующая КМ [83] позволяет получать изображения высокой контрастности и разрешения по глубине.
Применение КМ способно решить задачи, связанные с изучением различных форм дрожжей в режиме реального времени, что весьма важно при описании процессов, протекающих при росте грибка. C. albicans может находиться в нескольких состояниях роста, а именно: дрожжах, псевдогифах и гифах [84]. При каждом из этих состояний на клеточной стенке C. albicans образуются определенные присущие только одной из стадий белки [85], влияющие на гидрофобность клеточной стенки и ее поверхностный заряд [86]. В [87] с помощью лазерной сканирующей КМ изучено, как взаимодействуют с клетками флуоресцентные НЧ полистирола при различных стадиях роста C. albicans.
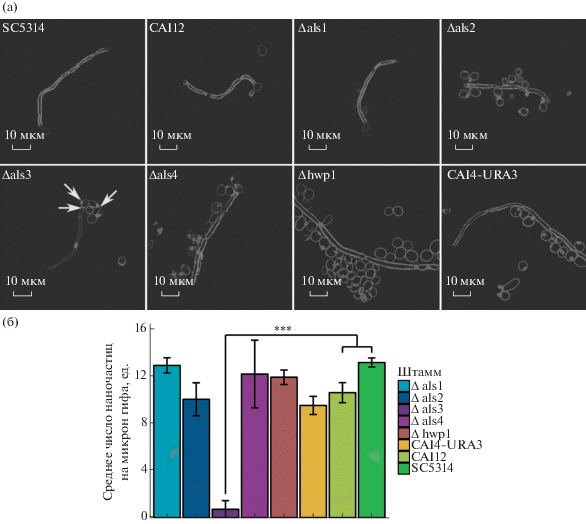
Известно, что белки Als и Hwp нужны для адгезии и агрегации C. albicans к абиотическим поверхностям или клеточным тканям [88]. Изображения, полученные посредством КМ, показали, что удаление белков ALS1, ALS2, ALS4 или HWP1 не оказывает влияния на адгезию НЧ к штаммам дикого типа (SC5314 и CAI12) (рис. 19а). Однако с удалением белка ALS3 НЧ переставали связываться с гафальными формами дрожжей (рис. 19а, Δals3). Обнаружена локальная агрегация клеток близ материнской клетки, на стыке клетки и гифа, а также на некоторых дрожжевых клетках (рис. 19а, Δals3, стрелки). Измеренную интенсивность НЧ преобразовали в их число на микрон путем нормализации с интенсивностью отдельной частицы (рис. 19б). Между контрольными штаммами (SC5314, Δals1, Δals2, Δals4, Δhwp1, CAI4-URA3 и CAI12) статистически значимой разницы не обнаружено, но между Δals3, CAI12 и SC5314 заметно снижение агрегации. Представленные результаты подтверждают ключевую роль ALS3 в адгезии отрицательно заряженных НЧ к поверхности Candida.
Рис. 19.
Конфокальные изображения мутантных штаммов дикого типа и Als, окрашенных CFW с наночастицами карбоксилата (а). Среднее количество наночастиц (200 нм) на микрон гифов штаммов C. albicans (б) [87].
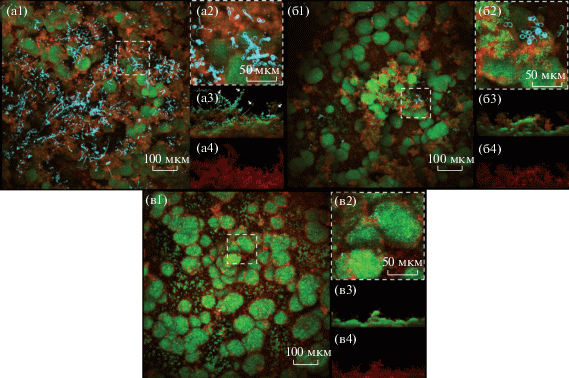
В [89] изучено воздействие фермента GtfB на дрожжи C. albicans методом КМ. Трехмерную структуру и пространственное распределение полученных из Gtf EPS-глюканов исследовали, помечая глюканы путем внедрения декстранового конъюгата Alexa Fluor 647. Развитие биопленок оценивалось по протоколам [90].
На конфокальных снимках наблюдается разрушение биопленок, образованных S.m.-C.a. (S. mutans и C. albicans), штаммов дикого типа (WT) и мутантных штаммов (och1ΔΔ и pmt4ΔΔ), скоплений C. albicans и матрицы α-глюкана (рис. 20 А1, Б1, В1 и А4, Б4, В4 соответственно). Биопленка S.m-C.a WT представляет собой как многочисленные гифы, так и дрожжевую форму C. albicans с обширным количеством бактерий S. mutans и плотно упакованными EPS-глюканами. С другой стороны, S.m-C.a штамма pmt4ΔΔ и S.m-C.a штамма och1ΔΔ представляют лишь малое количество клеток C. albicans при существенном уменьшении клеток бактерий и разрушении EPS-глюкан-матрикса; результаты согласуются с микробиологическими и биохимическими данными. На формирование биопленки может влиять образование поврежденных гифов или снижение скорости роста штамма och1ΔΔ.
Рис. 20.
КМ-изображения биопленок грибков смешанных видов: а – S.m-C.a штамма WT; б – S.m-C.a штамма pmt4ΔΔ; в – S.m-C.a штамма och1ΔΔ; 1 – биопленки, вид сверху; 2 – увеличенные снимки выделенных на 1 областей; 3 – биопленка, ортогональный вид; 4 – EPS-глюкан-матрица, ортогональный вид [89].
Ранее была рассмотрена антимикробная ФДТ. В [91] изучен противогрибковый эффект ФДТ на биопленках Candida dubliniensis, опосредованный куркумином (Cur), способным проявлять противовоспалительные, противоопухолевые, противомикробные свойства [92, 93]. Использовалась конфокальная лазерная сканирующая микроскопия для оценки поглощения Cur клетками дрожжей и его проникновения сквозь биопленку. Изображения получали на живых клетках методом дифференциальной интерференционной контрастности. Чтобы проиллюстрировать нахождение и поглощение Cur клетками, флуоресцентные и просвечивающие изображения накладывали друг на друга.
На рис. 21, 22 представлены конфокальные снимки клеток Candida dubliniensis после инкубации с Cur (20 мкМ) и биопленок, инкубированных с Cur (40 мкМ) соответственно. Обнаружено, что клетки культуры C. dubliniensis проявляли ярко-зеленую флуоресценцию спустя 5 и 20 мин после инкубации с одинаковым поглощением в обоих случаях. В случае с биопленкой C. dubliniensis после 5 мин инкубации только в небольших фрагментах биопленки отмечалась светло-зеленая флуоресценция Cur, но спустя 20 мин инкубации Cur сенсибилизировало большее количество клеток в биопленке, излучая более интенсивную флуоресценцию. Данные результаты представляют не только высокую проникающую способность куркумина относительно биопленок, но и динамику восприятия биопленок к проникновению Cur в их матрицу и инактивации клеток.
Рис. 21.
CLSM-визуализация отдельных клеток C. dubliniensis спустя 5 (а) и 20 мин (б) инкубации с Cur 20 мкМ [91].
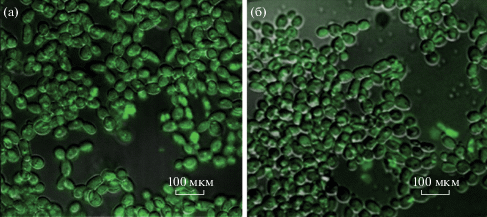
Рис. 22.
CLSM-визуализация биопленок C. dubliniensis спустя 5 (а) и 20 мин (б) инкубации с Cur 40 мкМ [91].

Конфокальный микроскоп является универсальным инструментом для анализа in vivo структуры и морфологии биопленок Candida. Неинвазивная пробоподготовка образца позволяет получать снимки живых клеток в их физиологическом растворе с возможностью исследования динамических процессов в грибке. При этом сам процесс подготовки образцов более прост, а использующиеся реактивы менее токсичны по сравнению с использующимися при подготовке образцов к РЭМ. А при использовании лазерных импульсов длительностью порядка десятой пикосекунды используемая мощность составляет порядка милливатт, что позволяет получать субмикронные изображения.
4. СРАВНЕНИЕ МЕТОДОВ
Одной из важных характеристик описанных методов при изучении структуры поверхности дрожжей является латеральная разрешающая способность. При изучении биологоческих образцов достигается следующая разрешающая способность: 1–100 нм у АСМ, 200–50 нм у КМ [94–96], у РЭМ и ПЭМ разрешение составляет 5–100 и 1–0 нм соответственно [97–100]. Отметим, что эти значения не являются предельными для данных методов. Например, с помощью АСМ можно получать изображения атомарного разрешения, что достигается за счет уменьшения радиуса острия. Однако при этом повышается сила воздействия на образец, что негативно сказывается на целостности структуры поверхности биологических образцов. Немаловажным фактором в изучении внутренней структуры дрожжей является максимальная толщина образца, при которой возможно проводить сканирование. Так, для метода ПЭМ биологические образцы должны быть тоньше 100 нм [101], для методов КМ – до 20 нм [102].
Другим важным фактором при исследовании дрожжей является изучение образцов в физиологических растворах. Имеются данные о получении методом АСМ топографии и поверхностных свойств дрожжей в физиологическом растворе [11, 34, 47, 48, 50, 55], а также проведено исследование топографии поверхности и механических свойств дрожжей в жидкой фазе одновременно [103]. Все упомянутые в настоящем обзоре работы по изучению дрожжей методами КМ проводились в физиологическом растворе. Во всех описанных работах, в которых методами РЭМ и ПЭМ исследовались дрожжи, эксперименты проводились на обезвоженных образцах. Существует метод ESEM (Environmental Scanning Electron Microscopy), позволяющий получать снимки живых биологических образцов [104, 105], который потенциально применим и на дрожжах.
В большинстве рассмотренных работ дрожжи изучались преимущественно одним методом. Таким образом, данные были ограничены анализом либо поверхностной структуры Candida (АСМ-, СИПМ- и РЭМ-методы), либо внутренней (ПЭМ и КМ). Хотя в [47, 89] проведен комплексный анализ поверхностной и внутренней структуры Candida множеством указанных методов, что дает более обширное понимание структуры клеток и процессов, протекающих в дрожжах. Несомненным преимуществом КМ в изучении структуры дрожжей является специфическое окрашивание различных участков клетки. В отличие от ПЭМ методы КМ позволяют избирательно сканировать структуру дрожжей [102], а именно при помощи красителей отдельно визуализировать клеточную стенку, цитоплазматическую мембрану, ядро, вакуоли, митохондрии, процесс эндоцитоза и ионов Ca2+.
Кроме широкого спектра применений КМ является наименее инвазивным методом микроскопии наноразмерного разрешения. Так, АСМ оказывает механическое воздействие на образец даже в полуконтактном режиме, при этом сила, прилагаемая зондом на клетки, равна 0.1 нН [106]. В методе СИПМ зонд вовсе не соприкасается с образцом, что позволяет избежать реакции клетки на сканирование [107]. Также данный метод позволяет проводить более длительную по времени сьемку, чем АСМ, что весьма важно в изучении фармакокинетики противогрибковых препаратов. Как ранее отмечалось, с помощью электронной микроскопии (РЭМ и ТЭМ) изучают только дегидратированные образцы, в связи с чем эти методы наиболее инвазивны для Candida и по этой же причине они не позволяют исследовать динамические процессы, протекающие в клетке и на ее поверхности.
Для изучения динамики процессов также важна скорость сканирования образцов. Наилучшими показателями обладает КМ. Изображения в высоком разрешении получают в течение 1–2 с, возможна и видеосъемка образца (30 кадров/мс), но с низким пространственным разрешением [108]. В случае зондовой микроскопии скорость сканирования образцов на порядки ниже. Так, для АСМ максимально допустимая скорость, при которой зонд не будет негативно воздействовать на клетку, составляет 20 мкм/с, а для СИПМ максимальная скорость сканирования без потери разрешения достигает 50 мкм/с [106, 109].
Немаловажным фактором сравнения методик является необходимость в пробоподготовке, предусматривающей фиксацию клеток или иммобилизацию их на субстрат. Пробоподготовка биологических образцов для методов ЭМ включает в себя обязательную фиксацию для сохранения и стабилизации структуры клетки [74, 75]. Для сканирования клеток методами зондовой микроскопии требуется иммобилизация образца на модифицированный субстрат или механической захват клеток, чтобы избежать дрейфа микроорганизмов в растворе или отталкивания зондом образца, находящегося в жидкой или газовой фазах [31]. В рассмотренных ранее работах сканирование дрожжей Candida или их биопленок методами КМ не требовало иммобилизации образца. Все описанные выше факторы сравнения представлены в табл. 1.
Таблица 1.
Сравнение методов микроскопии
| Факторы сравнения | Методы изучения дрожжей | |||||
|---|---|---|---|---|---|---|
| АСМ | СИПМ | РЭМ | ESEM | ПЭМ | КМ | |
| Латеральное разрешение, нм | 1–100 [94–96] |
3–100 | 5–100 [97–100] |
1–30 [99, 100] |
200–450 [94–96] | |
| Максимальная толщина образца, нм | до 100 [101] | 20 [102] | ||||
| Изучение дрожжей в физ. растворе | Данные
изучения
Candida [11, 34, 47, 48, 50, 55] |
Данные изучения клеток | Данные
изучения клеток [104, 105] |
Данные изучения Candida | ||
| Изучение поверхностной структуры дрожжей | Данные изучения Candida | Данные изучения Candida | Данные изучения Candida | Данные изучения клеток | Данные изучения Candida | |
| Изучение внутренней структуры дрожжей | Данные изучения Candida | Данные изучения дрожжей | ||||
| Изучение механических свойств | Данные
изучения
Candida [11, 50, 84] |
Данные изучения клеток [107] | ||||
| Изучение динамических процессов | Данные изучения клеток [86] | Невозможно | Данные изучения дрожжей [102] | |||
| Скорость сканирования | 20 мкм/с [106] | 50 мкм/с [109] | Один снимок/с [108] | |||
| Инвазивность метода | Механическое воздействие зондом на образец [106] |
Инвазивен [107] | Дегидра-тирование клеток | Возможно использование флюорофоров Для прижизненного сканирования клеток | ||
| Необходимость фиксации клеток | Не требуется | Следует фиксировать [74, 75] | ||||
| Необходимость иммобилизации клеток | Следует иммобили- зировать [31] | Отсутствует | ||||
ЗАКЛЮЧЕНИЕ
Существует острая нехватка противогрибковых препаратов широкого спектра применения, которые бы воздействовали на большинство известных видов Candida. Ситуация усугубляется появлением мутировавших штаммов, обладающих полной резистентностью. В связи с этим исследование новых препаратов, способных проявлять противогрибковое действие на резистентные виды Candida, и применение электронных и зондовых методов для изучения влияния медикаментов являются особо актуальными.
Методы электронной микроскопии требуют обезвоживания образца, что исключает возможность изучения динамических процессов, протекающих в клетке. Улучшение методов покрытия металлом поверхности образцов или фиксации дрожжей позволило удешевить эксперименты и облегчить пробоподготовку материала.
Атомно-силовая микроскопия хорошо проявляет себя как инструмент для визуализации наноразмерных объектов и анализа их механических свойств. Тем не менее на объекты исследования оказывается механическое давление, что может играть ключевую роль при изучении хрупких биологических материалов. Данную проблему возможно решить, используя метод СИПМ, позволяющий получать топографию и картирование по жесткости биологических образцов, находящихся в жидкости, исключая непосредственный контакт между биоматериалом и зондом. Таким образом, значительно упрощается пробоподготовка и минимизируется механическое воздействие на образец. Более того, данным методом возможно проводить измерения клеточных процессов в живых клетках.
Работа выполнена при поддержке Российского научного фонда (грант № 19-19-00626).
Список литературы
Pfaller M.A., Diekema D.J. // Clin. Microbiol. Rev. 2007. V. 20. № 1. P. 133. https://doi.org/10.1128/CMR.00029-06
Janbon G., Quintin J., Lanternier F. et al. // Genes Immun. 2019. V. 20. № 5. P. 403. https://doi.org/10.1038/s41435-019-0071-2
Wu S., Wang Y., Liu N. et al. // J. Med. Chem. 2017. V. 60. № 6. P. 2193. https://doi.org/10.1021/acs.jmedchem.6b01203
Denning D.W., Hope W.W. // Trends Microbiol. 2010. V. 18. № 5. P. 195. https://doi.org/10.1016/j.tim.2010.02.004
El-Kirat-Chatel S., Beaussart A., Alsteens D. et al. // Nanoscale. 2013. V. 5. № 3. P. 1105. https://doi.org/10.1039/c2nr33215a
Kurtz M.B., Douglas C.M. // Med. Mycol. 1997. V. 35. № 2. P. 79. https://doi.org/10.1080/02681219780000961
Pappas P.G., Kauffman C.A., Andes D. et al. // Clin. Infect. Dis. 2009. V. 48. № 5. P. 503. https://doi.org/10.1086/596757
Odds F.C., Brown A.J.P., Gow N.A.R. // Trends Microbiol. 2003. V. 11. № 6. P. 272. https://doi.org/10.1016/s0966-842x(03)00117-3
Vermes A. // J. Antimicrob. Chemother. 2000. V. 46. № 2. P. 171. https://doi.org/10.1093/jac/46.2.171
Dufrêne Y.F., Ando T., Garcia R. et al. // Nat. Nanotechnol. 2017. V. 12. № 4. P. 295. https://doi.org/10.1038/nnano.2017.45
Alsteens D., Beaussart A., El-Kirat-Chatel S. et al. // PLoS Pathog. 2013. V. 9. № 9. P. 1. https://doi.org/10.1371/journal.ppat.1003516
Deryabin D.G., Vasilchenko A.S., Aleshina E.S. et al. // Nanotechnologies in Russia. 2010. V. 5. № 11. P. 857. https://doi.org/10.1134/s1995078010110169
Vila T., Fonseca B.B., da Cunha M.M.L. et al. // J. Microsc. 2017. V. 267. № 3. P. 409. https://doi.org/10.1111/jmi.12580
Guo J., Wang G., Tang W. et al. // J. Struct. Biol. 2020. V. 212. P. 107600. https://doi.org/10.1016/j.jsb.2020.107600
Bhakta G., Lee K.H., Magalhães R. et al. // Biomaterials. 2009. V. 30. № 3. P. 336. https://doi.org/10.1016/j.biomaterials.2008.09.030
Bertin A., McMurray M.A., Pierson J. et al. // Mol. Biol. Cell. 2012. V. 23. № 3. P. 423. https://doi.org/10.1091/mbc.e11-10-0850
Giddings T.H., O’Toole E.T., Morphew M. et al. // Methods Cell Biol. 2001. V. 67. P. 27. https://doi.org/10.1016/s0091-679x(01)67003-1
Müller D.J., Dufrêne Y.F. // Trends Cell Biol. 2011. V. 21. № 8. P. 461. https://doi.org/10.1016/j.tcb.2011.04.008
Kaminskyj S.G.W., Dahms T.E.S. // Micron. 2008. V. 39. № 4. P. 349. https://doi.org/10.1016/j.micron.2007.10.023
Liu S., Wang Y. // Scanning. 2010. V. 32. № 2. P. 61. https://doi.org/10.1002/sca.20173
Puchner E.M., Gaub H.E. // Curr. Opin. Struct. Biol. 2009. V. 19. № 5. P. 605. https://doi.org/10.1016/j.sbi.2009.09.005
Dufrêne Y.F., Evans E., Engel A. et al. // Nat. Methods. 2011. V. 8. № 2. P. 123. https://doi.org/10.1038/nmeth0211-123
Neuman K.C., Nagy A. // Nat. Methods. 2008. V. 5. № 6. P. 491. https://doi.org/10.1038/nmeth.1218
Formosa C., Grare M., Duval R.E. et al. // Nanomed. Nanotechnol. Biol. Med. 2012. V. 8. № 1. P. 12. https://doi.org/10.1016/j.nano.2011.09.009
Formosa C., Grare M., Jauvert E. et al. // Sci. Rep. 2012. V. 2. P. 1. https://doi.org/10.1038/srep00575
Tian J., Ban X., Zeng H. et al. // Food Control. 2011. V. 22. № 12. P. 1992. https://doi.org/10.1016/j.foodcont.2011.05.018
Chandra J., Long L., Isham N. et al. // Antimicrob. Agents Chemother. 2018. V. 62. № 8. https://doi.org/10.1128/aac.00722-18
Sen B.H., Piskin B., Demirci T. // Dent. Traumatol. 1995. V. 11. № 1. P. 6. https://doi.org/10.1111/j.1600-9657.1995.tb00671.x
De Boer P., Hoogenboom J.P., Giepmans B.N.G. // Nature Methods. 2015. V. 12. № 6. P. 503. https://doi.org/10.1038/nmeth.3400
Binnig G., Quate C.F., Gerber C. // Phys. Rev. Lett. 1986. V. 56. № 9. P. 930. https://doi.org/10.1103/physrevlett.56.930
Louise Meyer R., Zhou X., Tang L. et al. // Ultramicroscopy. 2010. V. 110. № 11. P. 1349. https://doi.org/10.1016/j.ultramic.2010.06.010
Dufrêne Y.F. // Analyst. 2008. V. 133. № 3. P. 297. https://doi.org/10.1039/b716646j
Zhong Q., Inniss D., Kjoller K. et al. // Surf. Sci. 1993. V. 290. № 1. P. L688. https://doi.org/10.1016/0167-2584(93)90906-y
Martin Y., Williams C.C., Wickramasinghe H.K. // J. Appl. Phys. 1987. V. 61. № 10. P. 4723. https://doi.org/10.1063/1.338807
Janeczko M., Kubiński K., Martyna A. et al. // J. Med. Microbiol. 2018. V. 67. № 4. P. 598. https://doi.org/10.1099/jmm.0.000700
Kumagai Y., Shinkai Y., Miura T. et al. // Annu. Rev. Pharmacol. Toxicol. 2012. V. 52. № 1. P 221. https://doi.org/10.1146/annurev-pharmtox-010611-134517
Ibis C., Tuyun A.F., Bahar H. et al. // Med. Chem. Res. 2014. V. 23. № 4. P. 2140. https://doi.org/10.1007/s00044-013-0806-y
Nittayananta W., Pangsomboon K., Panichayupakaranant P. et al. // J. Oral Pathol. Med. 2013. V. 42. № 9. P. 698. https://doi.org/10.1111/jop.12060
Motallebnejad M., Akram S., Moghadamnia A. et al. // J. Contemp. Dent. Pract. 2008. V. 9. № 3. P. 1. https://doi.org/10.5005/jcdp-9-3-40
Al-Waili N.S., Salom K., Butler G. et al. // J. Med. Food. 2011. V. 14. № 10. P. 1079. https://doi.org/10.1089/jmf.2010.0161
Cooper R.A., Lindsay E., Molan P.C. // J. ApiProduct ApiMedical Sci. 2011. V. 3. № 3. P. 117. https://doi.org/10.3896/IBRA.4.03.3.02
Maddocks S.E., Lopez M.S., Rowlands R.S. et al. // Microbiology. 2012. V. 158. P. 781. https://doi.org/10.1099/mic.0.053959-0
Alandejani T., Marsan J., Ferris W. et al. // Otolaryngol. Head Neck Surg. 2009. V. 141. № 1. P. 114. https://doi.org/10.1016/j.otohns.2009.01.005
Ansari M.J., Al-Ghamdi A., Usmani S. et al. // Arch. Med. Res. 2013. V. 44. № 5. P. 352. https://doi.org/10.1016/j.arcmed.2013.06.003
Lal P., Sharma D., Pruthi P. et al. // J. Appl. Microbiol. 2010. V. 109. № 1. P. 128. https://doi.org/10.1111/j.1365-2672.2009.04634.x
Helal G.E.D.A., Sarhan M.M., Abu Shahla A.N.K. et al. // J. Basic Microbiol. 2007. V. 47. № 1. P. 5. https://doi.org/10.1002/jobm.200610137
Tyagi A.K., Malik A. // Micron. 2010. V. 41. № 7. P. 797. https://doi.org/10.1016/j.micron.2010.05.007
Handorf O., Schnabel U., Bösel A. et al. // Microb. Biotechnol. 2019. V. 12. № 5. P. 1034. https://doi.org/10.1111/1751-7915.13459
Martin-Yken H., Bedekovic T., Brand A.C. et al. // Cell Surf. 2018. V. 4. P. 10. https://doi.org/10.1016/j.tcsw.2018.10.002
Aguayo S., Marshall H., Pratten J. et al. // J. Dent. Res. 2017. V. 96. № 8. P. 917. https://doi.org/10.1177/0022034517706354
Uzunoglu E., Bicer A.Z.Y., Dolapci I. et al. // J. Adv. Prosthodont. 2014. V. 6. № 1. P. 30. https://doi.org/10.4047/jap.2014.6.1.30
Alsteens D., Garcia M.C., Lipke P.N. et al. // Proc. Natl. Acad. Sci. U. S. A. 2010. V. 107. № 48. P. 20744. https://doi.org/10.1073/pnas.1013893107
Ebner A., Wildling L., Kamruzzahan A.S.M. et al. // Bioconjug. Chem. 2007. V. 18. № 4. P. 1176. https://doi.org/10.1021/bc070030s
Formosa C., Schiavone M., Martin-Yken H. et al. // Antimicrob. Agents Chemother. 2013. V. 57. № 8. P. 3498. https://doi.org/10.1128/aac.00105-13
Quilès F., Accoceberry I., Couzigou C. et al. // Nanoscale. 2017. V. 9. № 36. P. 13731. https://doi.org/10.1039/c7nr02170d
Smith A.S., Sengupta K., Goennenwein S. et al. // Proc. Natl. Acad. Sci. U. S. A. 2008. V. 105. № 19. P. 6906. https://doi.org/10.1073/pnas.0801706105
Bershadsky A., Kozlov M., Geiger B. // Curr. Opin. Cell Biol. 2006. V. 18. № 5. P. 472. https://doi.org/10.1016/j.ceb.2006.08.012
Frank A.T., Ramsook C.B., Otoo H.N. et al. // Eukaryot. Cell. 2010. V. 9. № 3. P. 405. https://doi.org/10.1128/ec.00235-09
Kasas S., Ikai A. // Biophys. J. 1995. V. 68. № 5. P. 1678. https://doi.org/10.1016/s0006-3495(95)80344-9
Hasim S., Allison D.P. // Infect. Immun. 2017. V. 85. № 1. https://doi.org/10.1128/iai.00601-16
Dague E., Bitar R., Ranchon H. et al. // Yeast. 2010. V. 27. № 8. P. 673. https://doi.org/10.1002/yea.1801
Perlin D.S. // Clin. Infect. Dis. 2015. V. 61. № 6. P. S612. https://doi.org/10.1093/cid/civ791
Walker L.A., Munro C.A., De Bruijn I. et al. // PLoS Pathog. 2008. V. 4. № 4. P. e1000040. https://doi.org/10.1371/journal.ppat.1000040
Page A., Perry D., Unwin P.R. // Proc. R. Soc. A. 2017. V. 473. P. 20160889. https://doi.org/10.1098/rspa.2016.0889
Krochev Y.E., Bashford C.L., Milovanovic M. et al. // Biophys. J. 1997. V. 73. № 2. P. 653. https://doi.org/10.1016/s0006-3495(97)78100-1
Kappeli O., Muller M., Fiechter A. // J. Bacteriol. 1978. V. 133. № 2. P. 952. https://doi.org/10.1128/JB.133.2.952-958.1978
Walther P., Müller M., Schweingruber M.E. // Arch. Microbiol. 1984. V. 137. № 2. P. 128. https://doi.org/10.1007/bf00414453
Käppeli O., Walther P., Mueller M. et al. // Arch. Microbiol. 1984. V. 138. № 4. P. 279. https://doi.org/10.1007/bf00410890
Mueller M., Meister N., Moor H. // Mikroskopie. 1980. V. 36. P. 129.
Kappeli O., Fiechter A. // J. Bacteriol. 1977. V. 131. № 3. P. 917. https://doi.org/10.1128/JB.131.3.917-921.1977
Iimura Y., Hara S., Otsuka K.I. // Agric. Biol. Chem. 1981. V. 45. № 5. P. 1113. https://doi.org/10.1080/00021369.1981.10864679
Desai J.V., Mitchell A.P., Andes D.R. // Cold Spring Harb. Perspect. Med. 2014. V. 4. № 10. P. a019729. https://doi.org/10.1101/cshperspect.a019729
Deorukhkar S.C., Saini S. // Interdiscip. Perspect. Infect. Dis. 2016. V. 2016. P. 1. https://doi.org/10.1155/2016/1854673
Madhavan P., Jamal F., Pei C.P. et al. // Mycopathologia. 2018. V. 183. № 3. P. 499. https://doi.org/10.1007/s11046-018-0243-z
Lara H.H., Ixtepan-Turrent L., Jose Yacaman M. et al. // ACS Appl. Mater. Interfaces. 2020. V. 12. № 19. P. 21183. https://doi.org/10.1021/acsami.9b20708
Satoh K., Makimura K., Hasumi Y. et al. // Microbiol. Immunol. 2009. V. 53. № 1. P. 41. https://doi.org/10.1111/j.1348-0421.2008.00083.x
Sarma S., Upadhyay S. // Infect. Drug Resist. 2017. V. 10. P. 155. https://doi.org/10.2147/idr.s116229
Short B., Brown J., Delaney C. et al. // J. Hosp. Infect. 2019. V. 103. P. 92. https://doi.org/10.1016/j.jhin.2019.06.006
Nadtochenko V.A., Radtsig M.A., Khmel I.A. // Nanotechnologies in Russia. 2010. V. 5. № 5. P. 277. https://doi.org/10.1134/s1995078010050010
Jan A., Liu C., Deng H. et al. // Photodiagnosis Photodyn. Ther. 2019. V. 27. P. 419. https://doi.org/10.1016/j.pdpdt.2019.07.014
Bohnke M., Masters B.R. // Ophthalmology. 1997. V. 104. № 11. P. 1887. https://doi.org/10.1016/s0161-6420(97)30011-6
Masters B.R. // CIS Selected Papers: Coherence-Domain Methods in Biomedical Optics. 1996. V. 2732. P. 155. https://doi.org/10.1117/12.231674
Webb R.H., Hughes G.W., Pomerantzeff O. // Appl. Opt. 1980. V. 19. № 17. P. 2991. https://doi.org/10.1364/ao.19.002991
Sudbery P., Gow N., Berman J. // Trends Microbiol. 2004. V. 12. № 7. P. 317. https://doi.org/10.1016/j.tim.2004.05.008
Beaussart A., Alsteens D., El-Kirat-Chatel S. et al. // ACS Nano. 2012. V. 6. № 12. P. 10950. https://doi.org/10.1021/nn304505s
Hazen B.W., Hazen K.C. // Infect. Immun. 1988. V. 56. № 9. P. 2521. https://doi.org/10.1128/IAI.56.9.2521-2525.1988
Lyden A., Lombardi L., Sire W. et al. // Nanoscale. 2017. V. 9. № 41. P. 15911. https://doi.org/10.1039/c7nr04724j
Zhao X., Oh S.H., Cheng G. et al. // Microbiology. 2004. V. 150. № 7. P. 2415. https://doi.org/10.1099/mic.0.26943-0
Hwang G., Liu Y., Kim D. et al. // PLoS Pathog. 2017. V. 13. № 6. P. e1006407. https://doi.org/10.1371/journal.ppat.1006407
Klein M.I., Xiao J., Heydorn A. et al. // J. Vis. Exp. 2010. № 47. P. 2512. https://doi.org/10.3791/2512
Sanitá P.V., Pavarina A.C., Dovigo L.N. et al. // Lasers Med. Sci. 2018. V. 33. № 4. P. 709. https://doi.org/10.1007/s10103-017-2382-8
Ribeiro A.P.D., Pavarina A.C., Dovigo L.N. et al. // Lasers Med. Sci. 2013. V. 28. № 2. P. 391. https://doi.org/10.1007/s10103-012-1064-9
Quishida C.C.C., De Oliveira Mima E.G., Jorge J.H. et al. // Lasers Med. Sci. 2016. V. 31. № 5. P. 997. https://doi.org/10.1007/s10103-016-1942-7
Vicinanza M., Korolchuk V.I., Ashkenazi A. et al. // Mol. Cell. 2015. V. 57. № 2. P. 219. https://doi.org/10.1016/j.molcel.2014.12.007
Chi K.R. // Nat. Methods. 2009. V. 6. № 1. P. 15. https://doi.org/10.1038/nmeth.f.234
Hell S.W. // Science. 2007. V. 316. № 5828. P. 1153. https://doi.org/10.1126/science.1137395
Melling M., Karimian-Teherani D., Mostler S. et al. // Microsc. Res. Tech. 2004. V. 64. № 1. P. 1. https://doi.org/10.1002/jemt.20045
Bergmans L., Moisiadis P., Van Meerbeek B. et al. // Int. Endod. J. 2005. V. 38. № 11. P. 775. https://doi.org/10.1111/j.1365-2591.2005.00999.x
McKeown T.A., Moss S.T., Jones E.B.G. // Mycol. Res. 1996. V. 100. № 7. P. 821. https://doi.org/10.1016/s0953-7562(96)80028-1
Protasoni M., De Eguileor M., Congiu T. et al. // Tissue Cell. 2003. V. 35. № 4. P. 306. https://doi.org/10.1016/s0040-8166(03)00052-1
Cheville N.F., Stasko J. // Vet. Pathol. 2014. V. 51. № 1. P. 28. https://doi.org/10.1177/0300985813505114
Hickey P.C., Swift S.R., Roca M.G. et al. // Method. Microbiol. 2004. V. 34. P. 63. https://doi.org/10.1016/s0580-9517(04)34003-1
Chopinet L., Formosa C., Rols M.P. et al. // Micron. 2013. V. 48. P. 26. https://doi.org/10.1016/j.micron.2013.02.003
Collins S.P., Pope R.K., Scheetz R.W. et al. // Microsc. Res. Tech. 1993. V. 25. № 5. P. 398. https://doi.org/10.1002/jemt.1070250508
Sánchez C., Moore D., Díaz-Godínez G. // Mycologia. 2006. V. 98. № 5. P. 682. https://doi.org/10.1080/15572536.2006.11832640
Takeyasu K. // Atomic Force Microscopy in Nanobiology. 2014. P. 458. https://doi.org/10.1201/b15671
Seifert J., Rheinlaender J., Novak P. et al. // Langmuir. 2015. V. 31. № 24. P. 6807. https://doi.org/10.1021/acs.langmuir.5b01124
Tanaami T., Otsuki S., Tomosada N. et al. // Appl. Opt. 2002. V. 41. № 22. P. 4704. https://doi.org/10.1364/ao.41.004704
Ossola D., Dorwling-Carter L., Dermutz H. et al. // Phys. Rev. Lett. 2015. V. 115. № 23. P. 238103. https://doi.org/10.1103/physrevlett.115.238103
Clarke R.W., Novak P., Zhukov A. et al. // Soft Matter. 2016. V. 12. № 38. P. 7953. https://doi.org/10.1039/c6sm01106c
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


