Российские нанотехнологии, 2021, T. 16, № 4, стр. 564-571
ВЛИЯНИЕ НАНОКОМПОЗИТОВ СЕРЕБРА НА ОСНОВЕ ГУМИНОВЫХ ВЕЩЕСТВ НА ЖИЗНЕСПОСОБНОСТЬ РИЗОСФЕРНЫХ МИКРООРГАНИЗМОВ
А. И. Перфильева 1, *, О. А. Ножкина 1, Г. П. Александрова 2, М. С. Карепова 1, Н. С. Забанова 1, И. А. Граскова 1, Б. Г. Сухов 3, Б. А. Трофимов 2
1 Сибирский институт физиологии и биохимии растений СО РАН
Иркутск, Россия
2 Иркутский институт химии им. А.Е. Фаворского СО РАН
Иркутск, Россия
3 Институт химической кинетики и горения им. В.В. Воеводского СО РАН
Новосибирск, Россия
* E-mail: alla.light@mail.ru
Поступила в редакцию 27.11.2020
После доработки 06.12.2020
Принята к публикации 06.12.2020
Аннотация
Исследовано влияние нанокомпозитов (НК) серебра, синтезированных на основе гуминовых веществ (ГВ): углей (ГВ-уг), сланцев (ГВ-сл), грязей (ГВ-гр), выделенных на территории Монголии на жизнеспособность ризосферных бактерий Rhodococcus erythropolis (грам+) и Pseudomonas oryzihabitans (грам–) с применением методов измерения оптической плотности бактериальной суспензии, диффузии в агар, а также исследования интенсивности образования биопленок. Показано, что воздействие ГВ и нанокомпозитов ГВ на бактерии в динамике различается у R. erythropolis и P. oryzihabitans. Так, ГВ-сл стимулировали рост родококка в первые сутки наблюдения, а у P. oryzihabitans этот эффект отмечен позже, на вторые сутки эксперимента. Несмотря на отсутствие у ГВ бактериостатических эффектов, выявлено снижение биопленкообразования бактерий под их влиянием. ГВ-уг и ГВ-гр снижали биопленкообразование R. erythropolis, а ГВ-сл – P. oryzihabitans. Введение ГВ в состав НК приводит к сохранению бактерицидного эффекта НК ГВ-уг/Ag и НК ГВ-гр/Ag по отношению к R. erythropolis. Отмечено снижение биопленкообразования грамотрицательных бактерий – P. oryzihabitans под влиянием НК ГВ-гр/Ag. НК ГВ-уг/Ag, наоборот, усиливал размножение P. oryzihabitans в течение всего периода наблюдений. Таким образом, реакция микроорганизмов на воздействие ГВ в составе НК зависит как от морфологии самих бактерий, так и от химической структуры и функционального состава действующих веществ. Полученные данные и ранее опубликованные результаты, подтверждающие положительное влияние НК серебра и ГВ на растения, открывают перспективы дальнейшего исследования эффектов использования НК ГВ при внесении в почву в комплексе с ризосферными бактериями для повышения устойчивости культурных растений к стрессовым факторам.
ВВЕДЕНИЕ
Гуминовые вещества (ГВ) представляют собой комплексы органических соединений с высокой молекулярной массой, образующиеся в процессе минерализации растительных остатков в живой природе [1]. Доля ГВ в торфе, углях, донных отложениях и органической части почвенных и водных экосистем составляет от половины до 90%. По химическому строению ГВ представляют собой супрамолекулярные структуры гетерогенных молекул, включающих в себя углеводы, жирные кислоты, полипептиды, алифатические цепи и ароматические кольца [2, 3]. К ГВ относят гумусовые кислоты, гумин (негидролизуемый остаток) и фульвокислоты [4, 5].
ГВ проявляют свое влияние на растения посредством влияния на сигнальные системы, которые запускают различные биохимические и физиологические процессы в растительной клетке [3]. ГВ способствуют улучшению усвоения растениями полезных элементов из почвы, повышают активность ферментов, в результате чего усиливается интенсивность фотосинтеза и дыхания, а также белковый и фосфорный обмены в растениях [6]. Кроме того, ГВ обладают гормоноподобной активностью, благодаря которой стимулируется образование корневой системы у растений вследствие разрастания боковых корней [7].
ГВ способны оказывать влияние на почвенную микрофлору, как правило, активизируя ее [3]. Одними из важнейших представителей почвенной микрофлоры являются ризосферные микроорганизмы. Они обитают в ризосфере, тонком слое почвы, окружающем корневые волоски растений [8, 9]. Этот слой почвы богат корневыми экссудатами, которые выделяют растения. Известно, что ГВ усиливают корневую экссудацию и приводят к модификации состава экссудатов [3]: изменяется синтез органических кислот корнями растений, например в 2 раза увеличивается синтез щавелевой, лимонной, винной кислот и значительно уменьшается синтез малеиновой и фумаровой кислот [7].
На основе ГВ существует множество коммерческих гуминовых препаратов (ГП), применяемых в сельском хозяйстве. Они различаются по своим свойствам, технологиям производства, а также по сырью, из которого они произведены. В большинстве случаев удобрения на основе ГВ создают из торфа, сапропеля, бурого угля и сланцев [7]. Использование ГП повышает продуктивность растений до 30%, а также способствует повышению их устойчивости к абиотическим и биотическим стрессовым факторам. Кроме того, ГП применяются при фиторемедиации почв [10]. Показано, что ГП, созданный на основе гуминовых кислот торфа, усиливает фиторемедиационные свойства пшеницы [11]. Однако имеются сведения о неоднозначных и даже негативных последствиях применения ГП в реальных условиях возделывания растений. Полученные отрицательные результаты применения ГП исследователи объясняют ухудшением поглощения корнем необходимых элементов вследствие большого количества ГВ, а также высоким содержанием кальция в почве [12]. Поскольку имеющиеся в литературе сведения о роли ГП для растений неоднозначны, существует необходимость дополнительных исследований их влияния на растения. В последние десятилетия нанотехнологии активно внедряются в различные аспекты жизни человека, в том числе в сельское хозяйство. Создаются и исследуются препараты на основе наночастиц (НЧ) [13–20]. Ранее нами были начаты исследования биологической активности НК серебра на основе ГВ (НК ГВ/Ag). Показано их стимулирующее влияние на картофель in vitro и губительное воздействие на бактерию, вызывающую кольцевую гниль [15, 21], обусловленное наличием НЧ Ag в составе НК. Учитывая, что ГВ оказывают комплексное воздействие на растения и ризосферные микроорганизмы, необходимо исследовать воздействие НК ГВ/Ag на окружающую среду, в частности на микрофлору почвы.
Цель работы – изучить влияние НК ГВ/Ag на жизнеспособность ризосферных бактерии в процессе обработки нанокомпозитами культурных растений для повышения их устойчивости к фитопатогенам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нанокомпозиты. Три типа гуминовых веществ извлечены щелочной экстракцией из природных веществ, выделенных на территории Монголии, – лечебных грязей (ГВ-гр), сланцев (ГВ-сл) и углей (ГВ-уг) по методике [22]. Серебросодержащие НК гуминовых веществ (НК Ag/ГВ) получены восстановлением AgNO3 в присутствии ГВ в водно-щелочной среде по методике [23]. К раствору 1 г ГВ грязей, сланцев или углей в 10 мл 1 н NaOH приливали водный раствор, содержащий 170–210 мг AgNO3, и нагревали на кипящей водяной бане в течение 30 мин. Образование НК ГВ фиксировали по появлению в спектрах максимумов в области 410–430 нм, характерных для плазмонного резонанса НЧ серебра Ag(0). Выделение НК проводили высаживанием реакционной смеси в 10-кратный избыток этанола. Содержание серебра в НК определяли атомно-адсорбционным методом на спектрометре Perkin Elmer Analyst 200. НК обладают длительной агрегативной устойчивостью в растворе и могут быть выделены в сухом порошкообразном виде, сохраняя при этом способность к повторному растворению, что весьма важно для их дальнейшего практического использования.
В работе синтезированы следующие НК гуминовых веществ:
– нанокомпозит серебра в матрице ГВ лечебных грязей с содержанием Ag 9.8%;
– нанокомпозит серебра в матрице ГВ сланцев с содержанием Ag 10.5%;
– нанокомпозит серебра в матрице ГВ углей с содержанием Ag 12.0%.
Для экспериментов использовали водный раствор НК в конечной концентрации Ag 0.000625%, подобранной ранее экспериментальным путем.
Электронная микроскопия. НК растворяли в воде и наносили на сетки с формваровыми подложками. Подготовленные пробы исследовали с помощью просвечивающего электронного микроскопа (ПЭМ) LEO 906E (“Carl Zeiss”, Германия) при ускоряющем напряжении 80 кВ.
Штаммы бактерий. В качестве почвенных микроорганизмов использовали грамположительные и грамотрицательные бактерии, выделенные из ризосферы растений, произрастающих на нефтезагрязненной территории Заларинского района Иркутской области (п. Тыреть, Россия). После выделения бактерий изучили их морфологические, культуральные и физиолого-биохимические свойства, также провели секвенирование гена 16S рРНК с целью определения видовой принадлежности [24].
Штамм Rhodococcus erythropolis получен из ризосферы пырея ползучего Elytrígia repens. Культура на ранней стадии развития представляет собой рудиментарный мицелий, который распадается на фрагменты, далее превращающиеся в палочки, а затем в кокки. Бактерии по Граму окрашиваются положительно. Колонии средние, размером около 1.5–2.5 мм, кремового цвета, матовые, пастообразные, выпуклые, с ризоидным краем, шероховатой структуры. Аэробы. Оксидазоотрицательные, обладают каталазной активностью.
Штамм Pseudomonas oryzihabitans выделен из ризосферы осоки острой Carex acuta. Клетки имеют вид прямых палочек, одиночных или попарно соединенных, по Граму окрашиваются отрицательно. При культивировании на твердых средах образуют желтые, гладкие, блестящие, круглой формы, с ровными краями, выпуклые, однородной структуры, мягкой консистенции слизистые колонии. Аэробы. Способны к пигментации. Каталазо- и оксидазоположительные [25].
Для уточнения видовой принадлежности чистых культур проводили анализ нуклеотидной последовательности гена 16S рРНК, которая показала следующие нуклеотидные последовательности (п. н.): у штамма R. erythropolis размером 1136 п. н. (98%), у штамма P. oryzihabitans – 1429 п. н. (99%), которые выявили родовую принадлежность к Rhodococcus и Pseudomonas.
Почвенные бактерии культивировали в темноте в течение двух суток на твердой среде, состоящей из агара, ферментативного гидролизата говяжьего мяса, и на жидкой питательной среде аналогичного состава.
Методы изучения антибактериальной активности. Выявление бактерицидного эффекта НК осуществляли с применением метода кругов (метода диффузии в агар) [26]. Для исследования бактериостатической активности НК в отношении бактерий жидкую культуру микроорганизмов выращивали в темноте при 26°С на качалке (80 об./мин) в колбах, содержащих питательную среду. После внесения НК проводили измерение оптической плотности суспензии при 595 нм на планшетном спектрофотометре “BIO-RAD” (США) сразу и через 2, 4, 24, 28, 48, 48, 52 и 72 ч коинкубации. Влияние НК на биопленкообразование бактерий исследовали с применением планшетного метода [27].
Полученные данные подвергали статистической обработке с использованием программы MS Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ГВ были выбраны в качестве полимерной матрицы НК в связи с тем, что они представляют собой основной органический почвенный компонент, который также является первичным метаболитом для большинства микробов, находящихся в почве. Используемые в работе три различных типа ГВ, извлеченных из лечебных грязей, сланцев и углей, ранее подробно были изучены [22, 28, 29]. Серебросодержащие НК лечебных грязей, сланцев и углей синтезированы гидротермальным восстановлением AgNO3 в присутствии соответствующих ГВ в водно-щелочной среде.
Размерные и геометрические характеристики НЧ в серебросодержащих НК исследованы с помощью ПЭМ. Установлено, что НЧ Ag формируются в виде частиц округлой формы, равномерно распределенных в матрицах ГВ (рис. 1). Размеры НЧ, сформированных в матрицах, варьируются в узком интервале от 2 до 16 нм, что хорошо согласуется с данными рентгенофазового анализа. Полученные результаты свидетельствуют о высокой восстанавливающей и стабилизирующей способности данных ГВ.
Рис. 1.
ПЭМ-изображения НК ГВ: а – НК ГВ-сл/Ag 10.5% Ag, б – НК ГВ-гр/Ag 9.8% Ag, в – НК ГВ-уг/Ag 12.0% Ag.

Формирование НЧ Ag0 идентифицировали по появлению интенсивного плазмонного поглощения в видимой области спектра (410 нм), обусловленного коллективным возбуждением электронов проводимости серебра. Данные рентгенодифракционного анализа НК ГВ-гр/Ag, НК ГВ-уг/Ag также показали присутствие нуль-валентного серебра Ag0 и подтвердили их двухфазную аморфно-кристаллическую структуру. Экспериментально полученные значения межплоскостных расстояний (а = 0.4086 нм) кристаллической фазы хорошо согласуются со стандартными значениями нуль-валентного серебра (a = 0.4078 нм). Средние размеры области когерентного рассеяния (L, нм) НЧ Ag, являющиеся важнейшей характеристикой металлической фазы наноразмерного ядра, в полученных образцах варьируют в интервале 6.6–14.3 нм.
При изучении биологической активности НК ГВ были проведены исследования на возбудителе кольцевой гнили картофеля Clavibacter michiganensis (Cms) и на растениях картофеля in vitro [15, 21, 30]. Обнаружено, что НК ГВ-гр/Ag и НК ГВ-уг/Ag обладают бактериостатическим эффектом на фитопатогенные бактерии Cms, в течение 48 ч наблюдения они оказывали негативное влияние на рост бактерий [21]. Под влиянием НК ГВ изменялась морфология бактериальной клетки, бактерии укорачивались и утолщались [30]. Кроме того, было показано, что НК ГВ-сл/Ag и НК ГВ-гр/Ag снижают способность образования бактериями биопленок в 2 раза по сравнению с контролем. Помимо антибактериального эффекта НК ГВ выявлено положительное влияние на вегетацию и продуктивность растений картофеля [21]. Показано, что НК ГВ-уг/Ag оказывают стимулирующее влияние на активность пероксидазы картофеля. Обработка растений НК ГВ-гр/Ag приводит к увеличению прироста растений по сравнению с контролем [15]. Таким образом, получены результаты, свидетельствующие об отсутствии негативного эффекта НК ГВ/Ag на растения, а в некоторых случаях даже стимуляции, и выраженном антибактериальном действии на фитопатогенную бактерию Cms.
Важным аспектом применения агентов, используемых в сельском хозяйстве, является минимизация их влияния на окружающую среду и ее обитателей. Часто используемые пестициды оказывают негативное влияние на обитателей почвы и подземных вод. В связи с этим в настоящей работе изучено воздействие ГВ и НК ГВ на жизнеспособность ризосферных микроорганизмов. Для более полной картины влияния ГВ и НК ГВ на почвенную микрофлору в качестве объектов для исследования были выбраны две ризосферные бактерии R. erythropolis и P. oryzihabitans, обладающие различной морфологией (размер, взаимное расположение клеток, строение клеточной стенки, наличие поверхностных структур, наличие жгутиков, капсулы, способность к спорообразованию, окраска) и физиолого-биохимическими свойствами. Бактерии р. Pseudomonas встречаются в филлосфере, эктосфере и эндосфере растений и изучаются в качестве эпифитной микрофлоры, повышающей иммунную защиту растений [31, 32]. Бактерии R. erythropolis способны осуществлять в почве полезные функции – выполнять биодеструкцию углеводородов и биоремедиацию почвы [33, 34]. Показано, что R. erythropolis обладают также фитостимулирующей активностью [35]. Повышение жизнеспособности исследуемых микроорганизмов благодаря внесению в почву ГВ и НК ГВ могло бы стать важным дополнением при их применении на практике.
На первом этапе изучения влияния НК Ag на ризосферные бактерии была исследована бактериостатическая активность НК (рис. 2). Показано, что в контрольных образцах наблюдаются типичные логарифмические кривые роста микроорганизмов. Обнаружено, что водный раствор нитрата серебра (серебросодержащий прекурсор изучаемых НК) оказывает ингибирующее на рост воздействие на обе исследуемые бактерии уже в первые сутки наблюдения, значительно снижая прирост бактериальной биомассы (рис. 2). Наблюдаемый эффект сохранялся у родококка до 48 ч инкубации. У псевдомонад ингибирование прироста по сравнению с контролем отмечено до 52 ч. В конце эксперимента оптическая плотность бактерий, инкубируемых с нитратом серебра, достигала уровня контроля. Аналогичный эффект наблюдался в [15] при инкубации Clavibacter sepedonicus с нитратом серебра. Вероятно, в начале эксперимента бактерии активно поглощали нитрат серебра, что приводило к их гибели вследствие нарушения трасмембранного потенциала, транспорта ионов через мембрану, а также подавления механизмов деления клеток. При этом фрагменты погибших клеток также на протяжении всего эксперимента продолжали быть резервуаром связывания ионов серебра. По-видимому, после двух суток инкубации псевдомонад и уже в первые сутки инкубации родококка все ионы серебра были поглощены микробными клетками, а оставшиеся бактерии начали активное размножение благодаря наличию питательных веществ в среде культивирования.
Рис. 2.
Влияние обработки НК ГВ/Ag на динамику роста ризосферных бактерий R. erythropolis (а) и P. oryzihabitans (б).
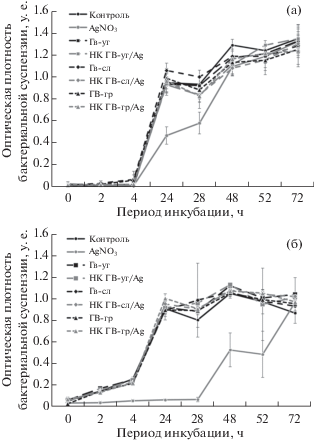
Для ГВ-сл отмечалась стимуляция прироста бактерий родококка в первые сутки инкубации по сравнению с контролем. У псевдомонад наблюдается аналогичный эффект, но чуть позже, в точке наблюдения 28 ч инкубации. НК ГВ-уг/Ag усиливал размножение псевдомонад в течение всего периода наблюдений. Обработка остальными агентами исследуемых ризосферных бактерий не оказывала влияния на их размножение (рис. 3). Запаздывание эффектов воздействия ГВ и НК ГВ на бактерии в динамике у P. oryzihabitans в сравнении с R. erythropolis, по-видимому, связано с морфологией клеточной стенки бактерий, а также с различной скоростью физиологических процессов в клетках исследуемых микроорганизмов.
Рис. 3.
Влияние обработки НК ГВ/Ag на биопленкообразование ризосферных бактерий R. erythropolis (а) и P. oryzihabitans (б).
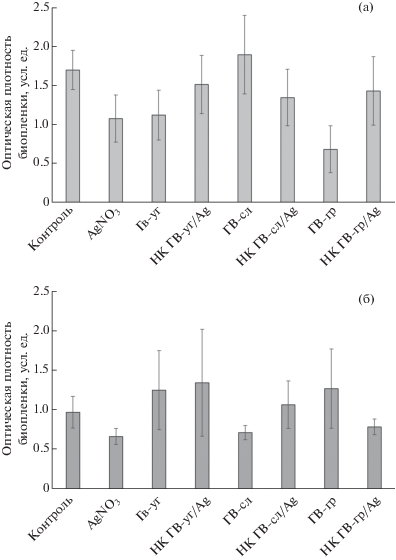
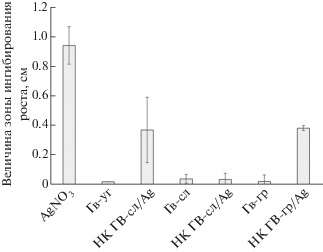
Значимой характеристикой успешного существования большинства важных для сельского хозяйства бактерий и биоремедиации является их способность к биопленкообразованию [36, 37]. В составе биопленок микроорганизмы проявляют большую устойчивость к стрессам [38]. Проведенные исследования показали, что водный раствор нитрата серебра достоверно снижает биопленкообразование ризосферных бактерий (рис. 3). Подобным эффектом обладают ГВ-уг и ГВ-гр в отношении биопленкообразования родококков. В составе негативный эффект этих ГВ нивелируется. ГВ-сл и НК на их основе не оказывают воздействия на исследуемый показатель (рис. 3а). Воздействие ГВ и НК ГВ на биопленкообразование псевдомонад отличается от аналогичных результатов, полученных на родококке. Снижение показателя отмечено под влиянием ГВ-сл и НК ГВ-гр/Ag (рис. 3а). Известно, что грамположительные (например, Rhodococcus) бактерии способны сорбировать гумусовые кислоты в бóльших количествах, чем грамотрицательные (например, Pseudomonas) [39]. Из литературы известно, что внесение в почву ГП способствует росту микробиологической активности, повышению потребления органических и минеральных субстратов, усилению минерализации органических веществ. В результате таких процессов повышается общая численность микроорганизмов и их отдельных групп [6]. Наибольшее воздействие ГП оказывают на микроорганизмы, относящиеся к группе азотфиксаторов, аммонификаторов и нитрификаторов, целлюлозоразлагающие и маслянокислые бактерии, почвенные микромицеты [7, 39]. Большинство ГП проявляет определенную биологическую активность по отношению к бактериям, причем в зависимости от состава и происхождения гуматов наблюдается селективность откликов микроорганизмов [40]. ГВ из бурого угля оказывают токсическое действие, подавляя на 25–35% рост тест-культуры Escherichia coli, а ГВ из торфа, наоборот, стимулируют рост этой культуры на 10–33% относительно контроля [41]. Также имеются данные о том, что ГВ в концентрациях, рекомендованных для промышленного применения (200 мг/л × 10–2, 10–3), ингибируют рост бактерий Pseudomonas spр. и Bacillus subtilis в 1.5–2 раза [42]. Механизм ингибирующего влияния ГВ на микроорганизмы может быть связан с изменением ферментативной активности бактериальной клетки и изменением проницаемости микробных мембран [7]. Кроме того, потенциальная токсичность ГВ может быть обусловлена их специфической молекулярной структурой и высокой адсорбционной активностью [5]. ГВ как природные структуры, обладающие высокими сорбционными свойствами [29], потенциально могут обладать способностью концентрировать экотоксиканты физической, химической и биологической природы.
Наличие бактерицидного эффекта у НК определяли по ширине зоны ингибирования вокруг лунок в чашке с питательной средой. ГВ и НК на их основе не обладали бактерицидным эффектом в отношении P. oryzihabitans. Зона ингибирования роста наблюдалась только вокруг лунки с нитратом серебра. У R. erythropolis обнаружен ярко выраженный участок отсутствия роста под влиянием нитрата серебра, а также НК на основе углей и грязей. Величина зоны ингибирования достигала 4 ± 0.05 мм. Во всех остальных вариантах эксперимента обнаружено незначительное ингибирование роста бактерий (рис. 4).
Несмотря на одинаковое содержание серебра в вариантах обработки бактерий нитратом серебра и НК ГВ/Ag, нитрат серебра оказывал значительно большее антибактериальное воздействие на ризосферные бактерии (рис. 4). Различия между исследуемыми микроорганизмами по наличию бактерицидных свойств ГВ и НК ГВ, вероятно, связаны с различным строением клеточной стенки изучаемых бактерий. Известно, что грамотрицательные бактерии более устойчивы к стрессовым факторам благодаря наличию непроницаемой клеточной стенки, состоящей из пептидогликанового и липополисахаридного слоев, а также наружной мембраны [43]. Большинство патогенных микроорганизмов, устойчивых к антибиотикам, являются грамотрицательными бактериями, к которым также относятся сапрофитные, условно-патогенные и патогенные бактерии р. Pseudomonas, вызывающие заболевания растений, животных и человека.
Таким образом, при исследовании трех различных типов ГВ, выделенных из углей, грязей и сланцев, и ряда НК ГВ/Ag эффекты воздействия изучаемых агентов на жизнеспособность бактерий в динамике различались у R. erythropolis и P. oryzihabitans. Так, ГВ-сл стимулируют рост родококка в первые сутки наблюдения, а у псевдомонад этот эффект отмечен позже, на вторые сутки эксперимента. Вероятно, это связано со строением клеточной стенки, а также с физиолого-биохимическими особенностями исследуемых микроорганизмов. Несмотря на отсутствие у ГВ бактериостатических эффектов, выявлено снижение биопленкообразования бактерий под их влиянием. ГВ-уг и ГВ-гр снижают биопленкообразование родококков, а ГВ-сл – псевдомонад. Подтверждено, что водный раствор нитрата серебра (предшественника НЧ серебра), содержащий диффузионно-подвижные и потому токсичные ионы серебра, обладает выраженным антибактериальным эффектом на ризосферные микроорганизмы. Он оказывает ингибирующее влияние на рост микроорганизмов и образование бактериями биопленок. Внесение ГВ в состав НК приводит к сохранению бактерицидного эффекта НК ГВ-уг/Ag и НК ГВ-гр/Ag по отношению к родококкам. Отмечено снижение биопленкообразования грамотрицательных бактерий – псевдомонад – только под влиянием НК ГВ-гр/Ag. НК ГВ-уг/Ag, наоборот, усиливает размножение псевдомонад в течение всего периода наблюдений.
Ранее было выявлено существенное положительное влияние ГВ и НК ГВ/Ag на вегетацию и продуктивность растений картофеля. Показано наличие яркого антибактериального эффекта НК ГВ/Ag в отношении фитопатогена Clavibacter michiganensis, вызывающего кольцевую гниль. Происхождение ГВ в составе НК (их различная химическая структура и функциональный состав) оказывает воздействие на селективность откликов микроорганизмов: зафиксировано разнонаправленное действие ГВ на исследуемые микроорганизмы, по-видимому, связанное с различной морфологией этих бактерий и принадлежностью к разным семействам. Негативные эффекты исследуемых веществ в большей степени выражены у грамположительных бактерий R. erythropolis. При этом в первые двое суток роста ризосферных бактерий наблюдалась стимуляция размножения микроорганизмов под влиянием ГВ-сл, а НК на его основе стимулировал даже прирост P. oryzihabitans. Выявлено, что НК ГВ/Ag подавляют жизнеспособность фитопатогенных бактерий, не оказывая подобного воздействия на микроорганизмы, обитающие в почве.
Работа выполнена с использованием коллекций ЦКП “Биоресурсный центр” Сибирского института физиологии и биохимии растений СО РАН.
Список литературы
Горовая А.И., Орлов Д.С., Щербенко О.В. Гуминовые вещества. Киев: Наукова думка, 1995. 304 с.
Попов А.И., Зеленков В.Н., Теплякова Т.В. // Вестн. РАЕН. 2016. Т. 16. № 5. С. 9.
Shah Z.H., Rehman H.M., Akhtar T. et al. // Front. Plant Sci. 2018. V. 9. Art. 263. https://doi.org/10.3389/fpls.2018.00263
Попов И.А. Гуминовые вещества: свойства, строение, образование. СПб.: Изд-во СПбГУ, 2004. 248 с.
Савченко И.А., Корнеева И.Н., Лукша Е.А. и др. // Журнал МедиАль. 2019. № 1. С. 54. https://doi.org/10.21145/2225-0026-2019-1-54-60
Безуглова О.С., Полиенко Е.А., Говорцов А.В. // Изв. Оренбург. гос. аграр. ун-та. 2016. № 4 (60). С. 11.
Пищик В.Н., Бойцова Л.В., Воробьев Н.И. // Агрохимия. 2019. № 3. С. 85. https://doi.org/10.1134/S0002188119030116
Bulgarelli D., Schlaeppi K., Spaepen S. et al. // Annu. Rev. Plant Biol. 2013. V. 64. P. 807. https://doi.org/10.1146/annurev-arplant-050312-120106
Феоктистова Н.В., Марданова А.М., Хадиева Г.Ф. и др. // Ученые записки Казанского университета. Серия: Естественные науки. 2016. № 2. С. 207.
Степанов А.А., Шульга П.С., Госсе Д.Д. и др. // Вестн. МГУ. Сер. 17: Почвоведение. 2018. № 2. С. 30.
Кирдей Т.А. // Изв. вузов. Прикладная химия и биотехнология. 2017. Т. 7. № 4. С. 102. https://doi.org/10.21285/2227-2925-2017-7-4-110-115
Leventoglu H., Erdal I. // J. Plant Nutr. 2014. V. 37. P. 2074. https://doi.org/10.1080/01904167.2014.920373
Романова А.П., Титова В.В., Макаева А.М. // Животноводство и кормопроизводство. 2018. Т. 101. № 2. С. 327.
Жемчужин С.Г., Спиридонов Ю.Я., Клейменова И.Ю. и др. // Агрохимия. 2019. № 5. С. 89. https://doi.org/10.1134/S0002188119050120
Perfileva A.I., Graskova I.A., Nozhkina O.A. et al. // Nanotechnologies in Russia. 2019. V. 14. № 9–10. P. 489. https://doi.org/10.1134/S1995078019050112
Camara M.C., Campos E.V.R., Monteiro R.A. et al. // J. Nanobiotechnology. 2019. V. 17. Art. 100. https://doi.org/10.1186/s12951-019-0533-8
Kumar S., Nehra M., Dilbaghi N. et al. // J. Control. Release. 2019. V. 294. P. 131. https://doi.org/10.1016/j.jconrel.2018.12.012
He X., Deng H., Hwang H.M. // J. Food. Drug. Anal. 2019. V. 27. № 1. P. 1. https://doi.org/10.1016/j.jfda.2018.12.002
Федотов М.А., Фолманис Г.Э., Гифер П.К. и др. // VII Всероссийская конференция по наноматериалам: сб. мат. М., 2020. С. 281.
Sampathkumar K., Tan K.X., Loo S.C.J. // Science. 2020. V. 23. № 5. P. 101055. https://doi.org/10.1016/j.isci.2020.101055
Graskova I.A., Perfilieva A.I., Nozhkina O.A. et al. // Doklady Biochemistry and Biophysics. 2018. V. 483. P. 321. https://doi.org/10.31857/S086956520003459-7
Dolmaa G., Aleksandrova G.P., Lesnichaya M.V. et al. // Mongolian J. Chem. 2013. V. 14. P. 51. https://doi.org/10.5564/mjc.v14i0.199
Александрова Г.П., Лесничая М.В., Долмаа Г. и др. // Изв. РАН. Сер. хим. 2017. № 1. С. 143.
Третьякова М.С. Перспективы использования эндо- и ризосферных микроорганизмов для восстановления загрязненных нефтью почв: автореф. дис. … канд. биол. наук. Иркутск, 2018. 22 с.
Silva F. // Rev. Chilena Infectol. 2015. V. 32. № 4. P. 445. https://doi.org/10.4067/S0716-10182015000500011
Sagdic O., Aksoy A., Ozkan G. // Acta Alimentaria. 2006. V. 35. № 4. P. 487. https://doi.org/10.1556/aalim.35.2006.4.12
Шагинян И.А., Алексеева Г.В., Чернуха М.Ю. и др. // Журнал микробиологии, эпидемиологии и иммунобиологии. 2007. № 1. С. 3.
Александрова Г.П., Лесничая М.В., Долмаа Г. и др. // География и природные ресурсы. 2016. № 6. С. 70. https://doi.org/10.21782/GIPR0206-1619-2016-6(70-75)
Долмаа Г., Александрова Г.П. Биологическая активность гуминовых веществ и их нанокомпозитов. Saarbrücken: LAP Lambert, 2017. 244 с.
Perfileva A.I., Nozhkina O.A., Graskova I.A. et al. // Russian Chemical Bulletin. 2018. V. 67. P. 157. https://doi.org/10.1007/s11172-018-2052-4
Заикина И.А. Эпифитная микрофлора здоровых растений. Пенза: РИО ПГСХА, 2007. Ч. 2. С. 40.
Бороздина И.Б. // Вестн. ВГУ. Cер.: Химия. Биология. Фармация. 2010. № 2. С. 67.
Fatahi A., Sadeghi S. // Lett. Appl. Microbiol. 2017. V. 64. P. 370. https://doi.org/10.1111/lam.12729
Cheng Y., Zang H., Wang H. et al. // Ecotoxicol. Environ. Saf. 2018. V. 157. P. 111. https://doi.org/10.1016/j.ecoenv.2018.03.074
Третьякова М.С., Беловежец Л.А., Маркова Ю.А. и др. // Агрохимия. 2017. № 12. С. 46. https://doi.org/10.7868/S0002188117120079
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. // Microbiology. 2015. V. 84. № 6. P. 731. https://doi.org/10.1134/s0026261715060107
Velmourougane K., Prasanna R., Saxena A.K. // J. Basic Microbiol. 2017. V. 57. № 7. P. 548. https://doi.org/10.1002/jobm.201700046
Yin W., Wang Y., Liu L. et al. // Int. J. Mol. Sci. 2019. V. 20. № 14. P. 3423. https://doi.org/10.3390/ijms20143423
Тихонов В.В., Якушев А.В., Завгородняя Ю.А. и др. // Почвоведение. 2010. № 3. С. 333. https://doi.org/10.1134/S1064229310030087
Lipsa F.D., Ulea E., Morari E.C. et al. // LucrăriŞtiinţifice. Seria Agronomie. 2012. V. 55. № 2. P. 253.
Каниськин М.А., Изосимов А.А., Терехова В.А. и др. // Теоретическая и прикладная экология. 2011. № 1. С. 87.
Pishchik V.N., Vorobyov N.I., Walsh O.S. et al. // Plant Nutr. 2016. V. 39. № 8. P. 1074. https://doi.org/10.1080/01904167.2015.1061551
Емцев В.Т., Мишустин Е.Н. Основы микробиологии. М.: Юрайт, 2019. 253 с.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии