Российские нанотехнологии, 2022, T. 17, № 1, стр. 65-78
РАЗРАБОТКА БЕЗРЕАГЕНТНЫХ ПРОВОДЯЩИХ НАНОКОМПОЗИТНЫХ СИСТЕМ ДЛЯ МОДИФИКАЦИИ ПЕЧАТНЫХ ЭЛЕКТРОДОВ ПРИ СОЗДАНИИ ГЛЮКОЗНЫХ БИОСЕНСОРОВ
В. А. Арляпов 1, Л. С. Кузнецова 1, А. С. Харькова 1, Д. В. Провоторова 1, Е. Д. Ненарочкина 1, О. А. Каманина 1, А. В. Мачулин 2, О. Н. Понаморева 1, В. А. Алферов 1, А. Н. Решетилов 1, 2, *
1 Тульский государственный университет
Тула, Россия
2 ФИЦ “Пущинский научный центр биологических исследований РАН”,
Институт биохимии и физиологии микроорганизмов РАН
Пущино, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 17.03.2021
После доработки 02.06.2021
Принята к публикации 21.06.2021
Аннотация
Исследована возможность использования редокс-активных полимеров на основе бычьего сывороточного альбумина (БСА) и хитозана, ковалентно связанных с медиаторами нейтральным красным, тионином и ферроценом и содержащих углеродные нанотрубки (УНТ) для иммобилизации глюкозооксидазы. Структуру полученных полимеров исследовали методом ИК-спектроскопии, спектрофотометрии, атомно-абсорбционной спектроскопии и сканирующей электронной микроскопии. Методом циклической вольтамперометрии найдены электрохимические характеристики исследуемых проводящих нанокомпозитных систем: гетерогенная константа скорости переноса электронов и константа скорости взаимодействия с глюкозооксидазой. Наиболее перспективными оказались системы, содержащие редокс-активный полимер на основе БСА, модифицированного медиатором ферроценом. Сформированные с использованием нанокомпозитных матриц биосенсоры имели высокую чувствительность с нижней границей определяемых концентраций глюкозы, составляющей 0.1 мМ, и характеризовались высокой корреляцией (R2 = 0.9827) с результатами определения содержания глюкозы в крови человека стандартным методом.
ВВЕДЕНИЕ
При решении ряда практических задач биосенсорный метод анализа показывает себя как один из наиболее перспективных методов аналитической химии. В частности, биосенсоры для определения глюкозы нашли широкое применение в сфере клинической диагностики и давно стали привычным, удобным и практически полностью замещающим альтернативные методы анализа портативным устройством [1]. Наибольшее значение среди биосенсоров имеют устройства, в которых перенос электронов с активного центра фермента на электрод осуществляется с помощью низкомолекулярных переносчиков (медиаторный биоэлектрокатализ) и наноматериалов (прямой биоэлектрокатализ). Современным и эффективным подходом к созданию медиаторных биосенсоров является использование редокс-активных полимеров, полученных на основе сшивки медиатора с полимерами, применяющимися для иммобилизации ферментов [2]. Такие полимеры могут обеспечивать высокую долговременную стабильность, а сам рецепторный элемент не будет требовать дополнительных реагентов [3, 4]. Акцент современных научных исследований в этой области смещен на улучшение базовых характеристик биосенсорных анализаторов, и в первую очередь за счет использования наноматериалов [2, 5].
Полимеры, способные к образованию редокс-активных гидрогелей, представляют собой сложную структуру, состоящую из молекул электроактивных соединений, ковалентно связанных с полимерной основой, которая может обладать или не обладать электропроводностью. Молекулы редокс-активных полимеров характеризуются большой молекулярной массой, а использование гидрогеля на их основе при создании биокатализатора позволяет им одновременно контактировать с поверхностью электрода и биологическим материалом; таким образом, отпадает необходимость передвижения медиатора в системе [6]. Полимерная система сама по себе инертна и является местом крепления электроактивных структур, вступающих в электрохимическое взаимодействие с активными центрами ферментов и поверхностью электродов. В качестве основы для создания проводящих гелей наиболее подходящими являются органические полимеры, поскольку они обладают высокой биосовместимостью, нетоксичны и биоразлагаемы. Хитозан как природный полисахарид обладает многими полезными характеристиками, такими как высокая проницаемость и механическая прочность, доступность и низкая стоимость. Благодаря наличию амино- и гидроксильных групп хитозан может легко сшиваться с различными молекулами и наноматериалами [7]. Благодаря доступности исходного материала, стабильным методикам выделения и, как результат, относительно невысокой цене и хорошей изученности свойств бычий сывороточный альбумин (БСА) также широко применяется в лабораторной практике [8]. В гидрогелях на основе БСА происходит эффективная иммобилизация биоматериала, она проводится в мягких условиях с применением нетоксичных реагентов и обеспечивает хорошие диффузионные свойства получаемой матрицы [9].
Одним из возможных путей получения редокс-активных полимеров является ковалентное связывание медиатора c полимером через основания Шиффа с последующим восстановлением иминных связей для придания медиатору подвижности. Данный метод использовали в [10], где получали проводящий гель на основе хитозана и ферроцена (ФЦ). Показано, что ФЦ в матрице хитозана сохраняет свою электрокаталитическую активность и не диффундирует из матрицы. Редокс-активный полимер был использован в качестве носителя для иммобилизации глюкозооксидазы (ГО) и целых клеток Gluconobacter oxydans на стеклоуглеродном электроде. Полученные биосенсоры обладали относительно быстрым временем отклика, хорошей воспроизводимостью и стабильностью. Бычий сывороточный альбумин, ковалентно связанный с медиатором ФЦ через основания Шиффа, успешно использовали в составе биосенсора на базе бактериальных клеток Gluconobacter oxydans и Paracoccus yeei [11, 12].
Особый интерес при создании биосенсоров на основе редокс-активных полимеров представляют наноматериалы. Наиболее часто используемыми среди них являются углеродные: одностенные [13–15] и многостенные [16, 17] нанотрубки (ОСУНТ, МУНТ). Их сходство с металлами по электронным свойствам, высокая электроактивная поверхность и стабильность делают их важной областью исследования биосенсоров [18]. Введение наноматериалов в структуру редокс-активных полимеров, как правило, приводит к улучшению характеристик формируемых биосенсоров, поэтому актуальными представляются получение гибридных нанокомпозитных проводящих гелей на основе редокс-активных полимеров и наноматериалов и изучение их свойств. Так, в [19] представлен иммуносенсор на основе ОСУНТ/хитозана. По сравнению с традиционными методами установленный иммуносенсор был более чувствительным. В [20] сформировали биосенсор для определения глюкозы, в котором конъюгат БСА и ферроценкарбоновой кислоты с добавлением МУНТ использовали в качестве проводящего полимера. Ферроценил-функционализированные ОСУНТ в полипиррольной матрице, связанной с ГО, использовали для определения глюкозы в [21]. Показано, что ферроценил-функционализированные ОСУНТ обеспечивают преимущественные пути для электронного транспорта от фермента через ферроценил-группы, таким образом иллюстрируя потенциальную возможность редокс-активных полимеров с УНТ для разработки биосенсоров. Описана матрица на основе хитозана, ковалентно-связанного с конъюгатом ферроценовых монокарбоновых кислот, аминированными наночастицами кремния и МУНТ [22]. Полученный конъюгат показывал хорошие окислительно-восстановительные свойства, а присутствие нанотрубок улучшало проводимость композитной пленки. Эта матрица обеспечила биосовместимую микросреду для сохранения активности ГО и обеспечивала доступ субстрата к активному участку фермента. Еще одним примером подобных разработок является биосенсор на основе иммобилизации трех компонентов: полимерной хитозановой сети, предварительно модифицированной окислительно-восстановительным медиатором ФЦ, фермента глюкозооксидазы и УНТ на твердом стеклоуглеродном электроде [23].
Таким образом, современные научные исследования в области создания эффективных глюкометров направлены на сочетание углеродных наноматериалов и редокс-активных полимеров. Гибридные проводящие гели для иммобилизации биоматериала имеют большой потенциал, способны сочетать медиаторный перенос электронов в системе с прямым биоэлектрокатализом. Однако они нуждаются в тщательном изучении электрохимических свойств, которое в большинстве описанных работ отсутствует. В [24] было проведено изучение электрохимических процессов переноса электронов с редокс-активных матриц на основе хитозана и БСА на графито-пастовый электрод. Данная работа направлена на создание гибридных проводящих гидрогелей на основе биосовместимых редокс-активных полимеров и УНТ для иммобилизации фермента ГО и комплексное исследование его электрохимических характеристик. Полученный безреагентный биосенсор для определения содержания глюкозы в крови можно использовать при создании глюкометров для многоразового анализа или для постоянного мониторинга концентрации анализируемого соединения.
МЕТОДЫ
Используемые реактивы и материалы
Биосенсорные измерения проводили с использованием фермента глюкозооксидазы (Sigma-Aldrich, США) (удельная активность 15 Е/мл). В качестве медиаторов электронного транспорта использовали ферроценкарбоксальдегид (Sigma-Aldrich, Германия), нейтральный красный (Диаэм, Россия) и тионин (Диаэм, Россия). В качестве основы редокс-полимера использовали непроводящие матрицы на основе низкомолекулярного хитозана со средней молекулярной массой 50–190 кДа (Sigma-Aldrich, Германия) и БСА (Sigma-Aldrich, Германия). Для формирования редокс-активных полимеров и проведения биосенсорных измерений использовали натрий-калий фосфатный буферный раствор с рН 6.8 (33 мМ KH2PO4 + + 33 мМ Na2HPO4, ООО “Диаэм”, Россия).
Синтез редокс-активных полимеров с использованием медиатора ферроценкарбоксальдегида
Модификацию хитозана ферроценкарбоксальдегидом проводили по методике [24]. Для формирования проводящей матрицы 0.1 г хитозана растворяли в 10 мл 3%-ной уксусной кислоты, смешивали с раствором 0.01 г ферроценкарбоксальдегида в 7 мл ацетона. Смесь перемешивали в течение суток при комнатной температуре. Затем при перемешивании добавляли 53.0 мг NaBH4. Реакционную смесь перемешивали еще в течение суток. Модифицированный полимер осаждали добавлением раствора 5.0 мМ NaOH до значения pH = 10.0. Осажденный полимер центрифугировали и очищали диализом, после чего сушили в сушильном шкафу в течение двух часов. Для формирования электрода 2.5 мг полученного полимера растворяли в 250 мкл 1%-ной уксусной кислоты. К 50 мкл полученного раствора добавляли 7.5 мкл глутарового альдегида, на поверхность печатного электрода наносили 10 мкл полученного полимера и оставляли до полного высыхания.
Модификацию БСА ферроценкарбоксальдегидом проводили по методике [24]. Для формирования проводящей матрицы 0.5 г БСА растворяли в 5 мл фосфатного буферного раствора (рН = 6.8), смешивали с раствором 0.05 г ферроценкарбоксальдегида в 5 мл ацетона. Полученный раствор доводили до рН = 9.3 путем добавления 5% K2CO3. Смесь перемешивали в течение часа при комнатной температуре, после чего добавляли 10 мг NaBH4. Полученную смесь перемешивали с использованием магнитной мешалки в течение 10 мин и выдерживали при комнатной температуре в течение 6 ч. Модифицированный полимер осаждали добавлением раствора 5.0 мМ NaOH до значения pH = 8.5. Осажденный полимер центрифугировали и очищали диализом, после чего сушили в сушильном шкафу в течение двух часов. Для формирования электрода редокс-активный полимер массой 3.5 мг растворяли в 50 мкл фосфатного буфера (рН = 6.8), затем добавляли 7.5 мкл глутарового альдегида. На печатный электрод наносили 10 мкл полученной смеси и оставляли до полного высыхания.
Синтез редокс-активных полимеров с использованием медиаторов нейтрального красного и тионина
Модификацию хитозана нейтральным красным (НК) и тионином (ТН) проводили по методике [24]. К 500 мкл 1%-ного раствора хитозана в 1%-ной уксусной кислоте добавляли 5 мкл 0.6 М раствора НК (или 6 мкл 0.5 М раствора ТН) и 50 мкл фосфатного буферного раствора с рН 6.8. Полученную смесь встряхивали в течение 5 мин. Затем к раствору добавляли 7.5 мкл глутарового альдегида и встряхивали в течение 30 с.
Модификацию БСА нейтральным красным и ТН проводили по методике [24]. К 3.5 мкг БСА добавляли 5 мкл 0.6 М раствора НК (или 5 мкл 0.5 М раствора ТН) и 50 мкл фосфатного буфера с рН 6.8. Далее формирование матрицы проходило аналогично формированию матрицы на основе хитозана.
Формирование редокс-активных полимеров на основе углеродных нанотрубок
Для создания гибридных полимеров использовали 0.5%-ную суспензию ОСУНТ (ООО “Углерод Чг”, Россия). Длина УНТ составляла 1–10 мкм, средний диаметр 1.5 нм, внешняя удельная поверхность была равна 450 м2/г. Для создания электрода использовали матрицу, содержащую 10 мкл 0.5%-ной суспензии УНТ, 10 мкл раствора ГО и 5 мкл редокс-активного гидрогеля БСА или хитозана.
Модификация углеродных нанотрубок карбоксильными группами
0.1 г УНТ суспендировали в 10 мл смеси концентрированных кислот HNO3 и H2SO4 (1 : 3 по объему). Смесь кислот с ОСУНТ обрабатывали ультразвуком (частота 22 кГц, мощность 50 Вт) в течение 3 ч при комнатной температуре, затем разбавляли водой и нейтрализовали 1 М раствором NaOH до рН 7. Окисленные ОСУНТ осаждали центрифугированием в течение 10 мин в деионизированной воде на центрифуге VORTEX ELMI (×10 000 g). Затем карбоксилированные ОСУНТ высушивали на воздухе и использовали для формирования рабочего электрода и для получения аминированных нанотрубок.
Модификация углеродных нанотрубок аминогруппами
0.02 г карбоксилированных ОСУНТ смешивали с 2 мл водного раствора аммиака при 25°С. Суспензию высушивали в сушильном шкафу при 100°С, затем сухой остаток прокаливали при 200°С в течение 15 мин. В результате получили амидированные нанотрубки. Аминирование проводили следующим образом: к суспензии амидированных ОСУНТ добавляли гипобромит натрия в избытке гидроксида натрия при перемешивании при 25°С. Модифицированные ОСУНТ осаждали центрифугированием в течение 10 мин в деионизированной воде на центрифуге VORTEX ELMI (×10 000 g). Высушивали на воздухе и использовали для формирования рабочего электрода.
Электрохимические измерения
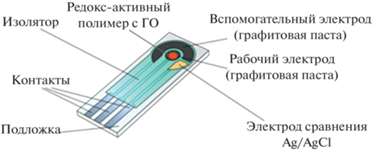
Для электрохимических измерений использовали потенциостат EmStat (“PalmSens”, Нидерланды). В работе использовали графитовые печатные электроды (ГПЭ) (ООО “Русенс”, Россия), выполненные по трехэлектродной схеме (рис. 1).
Измерения проводили в калий-натрий-фосфатном буферном растворе с рН 6.8 при 22°С. Объем ячейки составлял 4 мл. Перемешивание осуществляли магнитной мешалкой (ЗАО “Экрос”, Россия) со скоростью 200 об./мин. Циклические вольтамперограммы регистрировали при скорости развертки потенциала 20–200 мВ/с. Измеряемым параметром (откликом биосенсора) являлась амплитуда выходного сигнала биосенсора при добавлении субстрата. После каждого измерения электрод трехкратно промывали буферным раствором.
Определение содержания ферроцена в полученных образцах редокс-активных гидрогелей методом атомно-абсорбционной спектроскопии
Полученные образцы проводящих матриц высушивали; навеску сухого вещества массой 1.2 мг растворяли в 10 мл деионизованной воды с добавлением 3 мл концентрированной азотной кислоты и 2.5 мл пероксида водорода. Полученный раствор упаривали в течение двух часов до объема ~2–3 мл, после чего разбавляли 50 мл деионизованной воды. Для проведения анализа раствор разбавляли в 1000 раз; в измерительную кювету вносили 30 мкл разбавленного раствора. Для регистрации атомно-адсорбционных спектров использовали спектрофотометр МГА-915М (Люмекс, Россия).
Определение содержания нейтрального красного и тионина в полученных образцах редокс-активных гидрогелей методом фотометрии
Определение содержания НК в образцах спектрофотометрическим методом. К 500 мкл 1%-ного раствора хитозана в 1%-ной уксусной кислоте добавляли 5 мкл 0.6 М раствора НК, 50 мкл фосфатного буфера (pH 6.8) и 7.5 мкл глутаральдегида. Непрореагировавший НК отделяли диализом и определяли на спектрофотометре СФ-104 (“Аквилон”, Россия).
К 3.5 мг БСА добавляли 5 мкл 0.6 М раствора НК и 50 мкл фосфатного буфера, pH 6.8. Смесь встряхивали 5 мин. Затем в раствор приливали 7.5 мкл глутаральдегида. Непрореагировавший НК отделяли диализом и определяли на спектрофотометре СФ-104 (“Аквилон”, Россия).
Определение содержания ТН в образцах спектрофотометрическим методом. К 500 мкл 1%-ного раствора хитозана в 1%-ной уксусной кислоте добавляли 6 мкл 0.5 М раствора ТН, 50 мкл фосфатного буфера (pH 6.8) и 7.5 мкл глутаральдегида. Непрореагировавший ТН отделяли диализом и определяли на спектрофотометре СФ-104 (“Аквилон”, Россия).
К 3.5 мг БСА добавляли 5 мкл 0.5 М раствора ТН и 50 мкл фосфатного буфера, pH 6.8. Смесь встряхивали 5 мин. Затем в раствор приливали 6.0 мкл глутаральдегида. Непрореагировавший ТН отделяли диализом и определяли на спектрофотометре СФ-104 (“Аквилон”, Россия).
ИК-спектроскопия
Для получения ИК-спектров использовали ИК-фурье-спектрометр ФМС 1201 (ООО “Мониторинг”, Россия). Спектры снимали в таблетке KBr (ООО “Диаэм”, Россия) в области 4000–500 см–1 при отношении массы образца проводящей матрицы к массе бромида калия 2 : 300 (мг).
Сканирующая электронная микроскопия (СЭМ)
На образцы печатных электродов (на различных этапах формирования, для немодифицированного и модифицированного состояний) напыляли тонкий слой платиново-углеродной смеси в вакуумно-напылительной установке JEE-4X (JEOL, Япония). Электронно-микроскопический анализ образцов проводили с помощью сканирующего электронного микроскопа JSM-6510 LV (JEOL, Япония) в режиме высокого вакуума при регистрации вторичных электронов.
РЕЗУЛЬТАТЫ
Создание редокс-активных полимеров и нанокомпозитов на их основе
В [24] были созданы редокс-активные гидрогели на основе матриц хитозана и БСА, ковалентно связанных с медиаторами ФЦ, нейтральным красным или ТН, которые были использованы в качестве основы амперометрического биосенсора для определения глюкозы. В настоящей работе предложено использовать широкий спектр нанокомпозитных проводящих гидрогелей, получаемых за счет модификации полученных ранее редокс-активных полимеров ОСУНТ с различными привитыми химическими группами. В качестве надежных датчиков для проведения биосенсорных измерений использовали печатные электроды. Печатные электроды отличаются миниатюрностью, многофункциональностью, а современные разработки позволяют создавать одноразовые электроды с низкой себестоимостью в промышленных масштабах [25]. Важно отметить, что печатные электроды в отличие от графитовых и графито-пастовых характеризуются высокой воспроизводимостью и однородностью поверхности.
Выбор БСА и хитозана для синтеза редокс-активных полимеров обусловлен их высокой биосовместимостью и нетоксичностью. Данные свойства необходимы при использовании разработанных редокс-активных полимеров в качестве матриц для иммобилизации фермента при создании биосенсоров. В качестве медиаторов для получения проводящих систем за счет наличия необходимых функциональных групп и медиаторных свойств использовали НК, тионин и ферроценкарбоксальдегид. Структуры полученных матриц, модифицированных медиатором, изучали с помощью ИК-спектроскопии. На рис. 2 представлен ИК-спектр матрицы хитозана, ковалентно связанного с ТН.
Рис. 2.
ИК-спектры полученных редокс-активных полимеров: а – хитозана, ковалентно связанного с тионином (1) и чистых тионина (2) и хитозана (3), б – хитозана, ковалентно связанного с ферроценом (1) и чистых ферроценкарбоксальдегида (2) и хитозана (3), в – БСА, ковалентно связанного с тионином (1) и чистых тионина (2) и БСА (3), г – БСА, ковалентно связанного с ферроценом (1) и чистых ферроценкарбоксальдегида (2) и БСА (3).
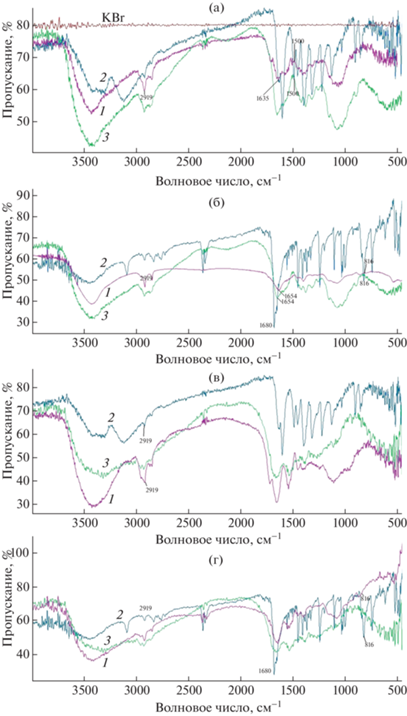
На ИК-спектре хитозана, модифицированного ФЦ, отчетливо видна полоса поглощения при волновом числе (ВЧ), равном 1654 см–1, являющаяся характерной для амидной полосы хитозана. Полоса поглощения валентных колебаний группы С=О (ВЧ 1680 см–1) ферроценкарбоксальдегида в модифицированном полимере исчезает. Присутствие ферроценилов в полученной матрице определяли по наличию полосы поглощения деформационных колебаний С–Н при ВЧ 816 см–1, полученные результаты согласуются с работой, в которой исследован ИК-спектр редокс-активного полимера хитозана, модифицированного ФЦ [10]. Аналогичные данные получены для матрицы на основе БСА и ферроцена. Сшивку тионина и НК с хитозаном и БСА проводили без восстановления имидной связи основания Шиффа, поэтому во всех спектрах для ВЧ, равного 1635 см–1, появляется полоса поглощения, соответствующая валентным колебаниям С=N иминной связи основания Шиффа. Наличие связи НК или тионина с матрицей хитозана также определяли по появлению полосы поглощения при ВЧ 1500 см–1, характерного валентным колебаниям “–С=С–бензольное кольцо”. Данная полоса отсутствует в исходной матрице хитозана, что подтверждает сшивку НК с матрицей. Следует отметить увеличение интенсивности полосы при ВЧ 2919 см–1 в модифицированном хитозане; данная полоса соответствует симметричным валентным колебаниям CH3-групп, что также может объясняться введением метильных групп НК или тионина в структуру хитозана. Синтез матрицы, образованной за счет сшивки БСА с медиаторами тионином и НК, достаточно сложно подтвердить по появлению новых ароматических пиков. Сложность обусловлена тем, что в структуре БСА содержится большое количество ароматических аминокислот, маскирующих этот эффект. Отметим, что в матрицах БСА–НК и БСА–ТН прослеживается аналогичная тенденция формирования связей, что и в матрицах с хитозаном: увеличение полосы валентных колебаний СН3-групп (полоса поглощения при ВЧ 2919 см–1) косвенно подтверждает сшивку медиатора с матрицей.
Результаты определения содержания железа в синтезированных матрицах на основе ФЦ, полученные методом атомно-абсорбционной спектроскопии, показали, что доля ФЦ в матрице БСА–ФЦ составила 14.1 мас. %, а в матрице хитозан–ФЦ – 6.2 мас. %. Таким образом, несмотря на меньшее содержание свободных аминогрупп в белке, БСА более эффективно подвергается модификации, чем хитозан. Скорее всего это связано с тем, что сшивка БСА с ферроценом протекает в щелочной среде, что существенно облегчает реакцию нуклеофильного присоединения. Сшивка хитозана в щелочной среде трудноосуществима из-за его малой растворимости.
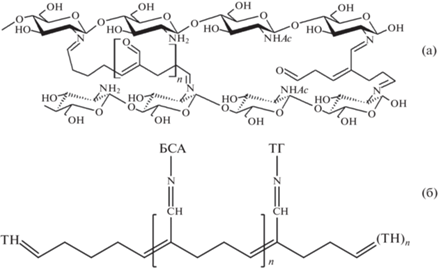
Массовые доли НК и тионина в созданных редокс-активных полимерах определены методом спектрофотометрии. В редокс-активных полимерах на основе хитозана доля НК составила 3, ТН – 12.5 мас. %; в редокс-активных полимерах на основе БСА доля НК – 23.7, ТН – 14.2 мас. %. Таким образом, более вероятно, что в структуре матриц с БСА образуется больше димерных фрагментов НК–НК–БСА (ТН–ТН–БСА), фрагментов БСА–НК (БСА–ТН) и незначительное количество димеров тионина и НК, которые удаляются при диализе. Обратная ситуация наблюдается при модификации хитозана: меньше сшивок медиаторов с матрицей и образование большего числа фрагментов сшивок медиаторов друг с другом, которые вымываются в результате диализа. С учетом различных форм глутарового альдегида, присутствующего в растворе [26], и на основе содержания тионина и НК предложен примерный вид структуры созданных редокс-активных полимеров (рис. 3).
Рис. 3.
Предполагаемая структура получаемых редокс-активных полимеров: а – редокс-активный полимер на основе хитозана, модифицированного тионином, б – редокс-активный полимер на основе БСА, модифицированного тионином.
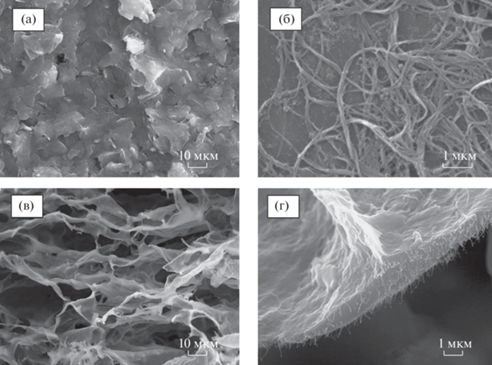
Физическая структура исследуемых проводящих гидрогелей была изучена методом СЭМ. Полученные изображения представлены на рис. 4. Видно, что используемый печатный электрод имеет высокоразвитую поверхность (рис. 4а), что обеспечивает большую площадь контакта фермента и проводящей матрицы и позволяет добиться высокой чувствительности биосенсоров на основе разработанных электродов. На рис. 4в, 4г можно видеть пористую структуру редокс-активных полимеров. Полученные гидрогели имеют размер пор ~10–15 мкм. Таким образом, при нанесении полученного геля на электрод существенно увеличивается площадь рабочей поверхности, пористая структура позволяет ГО встраиваться в данный полимер и обеспечивает легкую диффузию субстрата. При использовании УНТ (рис. 4б–4г) происходит их равномерное распределение в структуре синтезированных матриц, что способствует значительному облегчению переноса электронов от фермента на электрод.
Рис. 4.
СЭМ-изображение рабочего электрода на разных этапах модификации: а – поверхность немодифицированного печатного электрода; б – используемые для создания композитной проводящей матрицы УНТ; в – редокс-активный полимер на основе БСА, модифицированного НК; г – нанокомпозитная матрица на основе редокс-активного полимера БСА, модифицированного НК и УНТ.
Определение электрохимических свойств полученных редокс-активных полимеров и нанокомпозитных материалов
В исследуемой электрохимической системе в отсутствие УНТ можно выделить две стадии: “прыжковый механизм” (ПМ) – процесс переноса электронов между ковалентно связанными молекулами медиатора, поверхностную реакцию – перенос электронов от медиатора на электрод (рис. 5).
Рис. 5.
Перенос электронов на электрод в редокс-активном полимере на основе хитозана, модифицированного ферроценом: а – в отсутствие УНТ; б – в присутствии УНТ.

В случае, если расстояние между ковалентно связанными медиаторами большое, то скорость прыжковой составляющей переноса электронов может снижаться. За счет внедрения УНТ в структуру редокс-активного полимера эффективное расстояние между молекулами медиаторов уменьшается (рис. 5б); УНТ играют роль мостиков, по которым электроны переносятся по редокс-активному полимеру на электрод. Кроме того, введение нанотрубок увеличивает площадь контакта проводящей матрицы с поверхностью электрода.
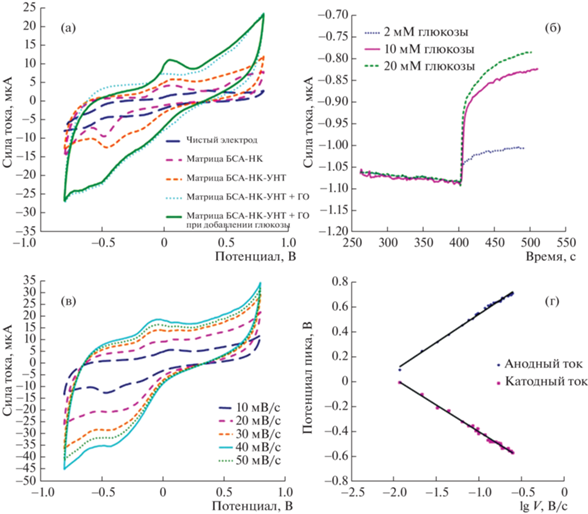
Электрохимические свойства полученных проводящих гелей исследовали методом циклической вольтамперометрии. Данный метод удобен для нахождения лимитирующих стадий электрохимических процессов, так как в случае медленного ПМ предельный анодный ток прямо пропорционален квадратному корню из скорости развертки. В случае, если ПМ осуществляется достаточно быстро и процесс лимитируется поверхностной реакцией на электроде, ток пропорционален скорости развертки [27]. Типичные виды изучаемых циклических зависимостей представлены на рис. 6.
Рис. 6.
Электрохимические исследования печатного электрода с разработанными проводящими нанокомпозитными системами: а – циклическая вольтамперограмма (ЦВА) на разных этапах модификации электрода; б – ответ биосенсора с нанокомпозитным материалом БСА–НК–УНТ на добавление разных концентраций глюкозы; в – ЦВА с нанокомпозитной системой БСА–НК–УНТ при разных скоростях развертки потенциала; г – зависимость для определения коэффициентов переноса (α) в исследуемой системе БСА–НК–УНТ.
Выявление лимитирующей стадии позволило применить модель Николсона (уравнение (1)) [27] и модель Лавирона [28] (уравнение (2)) для нахождения гетерогенных констант скорости переноса электронов на электрод (табл. 1). Использование моделей Николсона и Лавирона при определении электрохимических свойств редокс-активных полимеров можно найти в [29] и [30] соответственно:
(2)
$\begin{gathered} \log ({{k}_{S}}) = \alpha \log \left( {1 - \alpha } \right) + \left( {1 - \alpha } \right)\log \alpha - \\ \, - \log \left( {\frac{{RT}}{{n{\text{F}}{v}}}} \right) - \frac{{\alpha \left( {1 - \alpha } \right)n{\text{F}}\Delta E}}{{2.3RT}}, \\ \end{gathered} $Таблица 1.
Гетерогенные константы скорости переноса электронов и константы скорости взаимодействия ковалентно связанных материалов с ГО для разработанных редокс-активных полимеров и их нанокомпозитов
| Редокс матрица | Константа | Значения констант скорости | |||
|---|---|---|---|---|---|
| Без УНТ | УНТ | УНТ–NH2 | УНТ–COOH | ||
| БСА–ФЦ | ks, с–1 · см | 0.78 ± 0.04 | 0.82 ± 0.04 | 1.7 ± 0.1 | 0.87 ± 0.04 |
| kвзаим, см3/(моль · с) | 500 ± 30 | 0.21 ± 0.01 | 0.9 ± 0.4 | 0.9 ± 0.3 | |
| БСА–НК | ks, с–1 · см | 0.0119 ± 0.0006 | 0.0004 ± 0.0001 | 0.23 ± 0.01 | 0.012 ± 0.001 |
| kвзаим, см3/(моль · с) | 580 ± 30 | 6.1 ± 0.3 | 4.2 ± 0.4 | 3.9 ± 0.5 | |
| БСА–ТИО | ks, с–1 · см | 0.113 ± 0.006 | 0.0010 ± 0.0001 | 0.34 ± 0.02 | 0.035 ± 0.002 |
| kвзаим, см3/(моль · с) | 150 ± 10 | 11.2 ± 0.5 | 10.1 ± 0.5 | 12.0 ± 0.7 | |
| Хитозан–ФЦ | ks, с–1 · см | 0.0125 ± 0.0006 | 0.23 ± 0.01 | 1.6 ± 0.1 | 0.76 ± 0.04 |
| kвзаим, см3/(моль · с) | 20 ± 1 | 1.4 ± 0.2 | 2.8 ± 0.4 | 3.9 ± 0.2 | |
| Хитозан–НК | ks, с–1 · см | 0.063 ± 0.003 | 0.23 ± 0.01 | 0.0013 ± 0.0001 | 0.0020 ± 0.0001 |
| kвзаим, см3/(моль · с) | 30 ± 2 | 0.48 ± 0.02 | 0.24 ± 0.05 | 0.3 ± 0.1 | |
| Хитозан–ТИО | ks, с–1 · см | 0.38 ± 0.02 | 0.020 ± 0.001 | 0.019 ± 0.001 | 0.0013 ± 0.0001 |
| kвзаим, см3/(моль · с) | 80 ± 4 | 22 ± 1 | 12.1 ± 0.6 | 15.5 ± 0.4 | |
Кроме того, для практического использования проводящих систем в глюкометрах важно изучить не только электрохимические аспекты переноса электронов на электрод, но и особенности взаимодействия редокс-активных полимеров с используемым ферментом ГО. Для исследования возможности применения редокс-активных полимеров для иммобилизации ГО были найдены константы взаимодействия фермента с ковалентно связанными медиаторами электронного транспорта с использованием моделирования Николсона–Шайна [31], которое широко используется для анализа константы скорости взаимодействия медиаторов, в том числе в составе редокс-активных полимеров, с различными ферментами [12, 32–34]. В данной модели рассматривается изменение предельного анодного тока до и после введения в систему окисляемого субстрата. При избытке концентрации субстрата и низкой концентрации медиатора скорость биохимической стадии взаимодействия медиатора с биоматериалом имеет псевдопервый порядок, а константа взаимодействия связана с изменением предельного анодного тока уравнением Николсона и Шайна:
(3)
$\frac{{{{I}_{k}}}}{{{{I}_{d}}}} = \sqrt {\frac{{{{k}_{{{\text{взаим}}}}}\left[ E \right]RT}}{{n{\text{F}}{v}}}} ,$Наибольшую гетерогенную константу скорости переноса электронов имеет матрица БСА–ФЦ–УНТ–NH2. Такое высокое значение константы может быть связано с образованием прочной сшивки между БСА и ферроценкарбальдегидом, где ферроценилы равномерно распределены по гидрогелю, обеспечивая высокую скорость переноса электронов. Помимо этого, большое влияние оказывает присутствие в матрице УНТ–NH2, так как они сшиваются с матрицей посредством взаимодействия аминогруппы глутарового альдегида с образованием основания Шиффа. Благодаря этому предотвращается вымывание и десорбирование нанотрубок, а также обеспечивается близкий контакт УНТ с редокс-активной матрицей в нанокомпозите. Положительное влияние аминированных УНТ можно наблюдать на примере любой исследуемой матрицы, если сравнивать общее влияние УНТ на эффективность переноса.
С точки зрения взаимодействия полученных нанокомпозитных матриц с ГО наблюдается противоположная ситуация. Несмотря на повышение константы скорости взаимодействия аналогичных редокс-активных полимеров с бактериями [12, 35]. По полученным в настоящей работе результатам можно увидеть, что наличие нанотрубок оказывает негативное влияние на процесс взаимодействия ГО с ковалентно связанным медиатором. В [36] показано, что ГО может подвергаться массивной структурной перестройке при адсорбции на поверхности графена, что сокращает расстояние от флавинадениндинуклеотида до графена и приводит в свою очередь к инактивации фермента. В то время как активный фермент способен осуществлять реакцию, но из-за большого расстояния между активным центром и поверхностью графена не способен передавать электроны. Вероятно, в данном случае происходят аналогичные процессы изменения нативной конформации ГО под влиянием УНТ.
Исходя из значений полученных констант взаимодействия медиатора с биоматериалом можно увидеть, что наиболее высокую константу скорости имеет система на основе модифицированного нейтральным красным БСА в отсутствие УНТ. Высокое значение константы скорости взаимодействия в данном случае связано с эффективностью НК в системах с глюкозооксидазой [37] и его высоким содержанием в матрице на основе БСА.
Создание биосенсоров на основе полученных редокс-активных гидрогелей и нанокомпозитов
Для нахождения диапазона определяемых концентраций глюкозы строили градуировочные зависимости отклика биосенсоров на основе созданных редокс-активных гелей с лучшими электрохимическими характеристиками от концентрации стандартного раствора глюкозы (рис. 7). Зависимость отклика биосенсора от концентрации субстрата описывается уравнением Михаэлиса–Ментен:
где V – отклик биосенсора, мкА; Vmax – максимальный отклик биосенсора, при котором все молекулы фермента участвуют в образовании фермент-субстратного комплекса, мкА; КM – эффективная константа Михаэлиса, численно равная концентрации субстрата – глюкозы, при которой величина отклика биосенсора составляет половину от максимального значения, М; [S] – концентрация субстрата, М.Рис. 7.
Градуировочные зависимости биосенсоров на основе используемых редокс-активных матриц и их нанокомпозита.
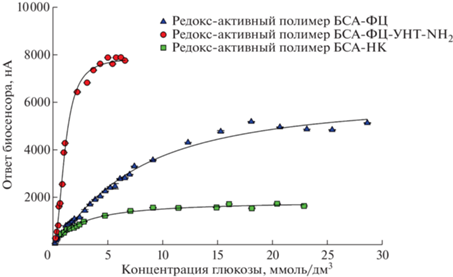
Из (4) следует, что при низких концентрациях субстрата аналитический сигнал пропорционален концентрации глюкозы, что позволяет выделить линейный участок градуировочной кривой, ограниченный сверху значением КM. Результаты по определению линейного участка градуировочной зависимости представлены в табл. 2.
Таблица 2.
Аналитические и метрологические характеристики разработанных биосенсоров и их аналогов
| ГО в редокс-активном геле | ГО в конъюгате восстановленного оксида графена и наночастиц Fe3O4 [38] | ГО в метал-лоорганическом каркасе на нано-волокнах ацетата целлюлозы [39] | |||
|---|---|---|---|---|---|
| БСА–ФЦ | БСА–ФЦ–УНТ–NH2 | БСА–НК | |||
| Диапазон определяемых концентраций, ммоль/дм3 | 0.25–5.3 | 0.1–1.8 | 0.6–2.7 | 0.05–1.0 | 1–10 |
| Коэффициент чувствительности, нА · мМ–1 | 290 ± 10 | 330 ± 10 | 250 ± 10 | 5900 | – |
| Относительное стандартное отклонение последовательных измерений, % | 5.32 | 5.08 | 1.6 | 3.98 | – |
| Долговременная стабильность, сут | 19 | 16 | 12 | более 30 сут | – |
| Время единичного измерения, мин | 1–3 | 1–3 | 1–3 | – | – |
Для биосенсора длительность единичного измерения складывается из времени отклика и времени регенерации активности рецепторного элемента (промывки сенсора). Время отклика биосенсора занимает менее 30 с. Регенерацию биосенсора после контакта с глюкозой проводили промыванием измерительной ячейки новой порцией буферного раствора. В среднем данная операция занимает 2 мин. Таким образом, время единичного анализа составляет не более 3 мин (табл. 2).
Среднюю продолжительность работы одного ферментного электрода определяли путем ежедневной фиксации величины отклика биосенсора на одну и ту же концентрацию раствора глюкозы. Между измерениями электрод хранили в буферном растворе при +4°С. За долговременную стабильность биосенсора принимали время, в течение которого величина сигнала составляла не менее 75% от начальной. Как видно из табл. 2, все созданные биосенсорные системы стабильно функционировали более 10 сут.
ОБСУЖДЕНИЕ
Отметим, что разработанные биосенсоры характеризуются высокой чувствительностью к глюкозе. Нижняя граница определяемых концентраций глюкозы биосенсором на основе композитного проводящего гидрогеля с УНТ–NH2 достаточно низка по сравнению со многими известными аналогами [10, 14, 39, 40]. Например, биосенсора на основе ГО в металлоорганическом каркасе на мембране из нановолокон ацетата целлюлозы (1 мМ) [39], биосенсора с ГО в матрице ферроцена, ковалентно-связанного с хитозаном (2 мМ) [10], и биосенсора на основе ГО, ферроцена и терморасширенного графита (0.87 мМ) [14].
Значения нижних границ определяемых концентраций глюкозы в целом коррелируют с результатами определения констант скорости взаимодействия медиатора с ГО и электродом (табл. 1). При этом гетерогенная константа скорости переноса электронов на электрод оказывает более сильное влияние на характеристики биосенсора, что, вероятно, связано с тем, что в созданных системах лимитирует процесс взаимодействия редокс-активных матриц с поверхностью рабочего электрода.
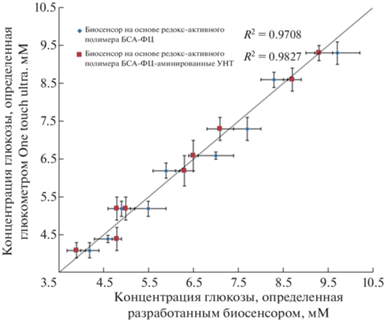
Проведены сравнительные испытания определения содержания глюкозы в крови человека с использованием биосенсоров на основе проводящих гидрогелей БСА–ФЦ и БСА–ФЦ–УНТ–NH2. В качестве референтного метода применяли аттестованный глюкометр One Touch Select (LifeSkan Inc. (Johnson and Johnson), США). Образцы крови отбирали в разное время до и после приема пищи, результаты приведены на рис. 8.
ЗАКЛЮЧЕНИЕ
Статистическая обработка (Модифицированный тест Стьюдента) результатов показала, что данные, полученные обоими методами, различаются незначительно. Важно отметить, что биосенсор на основе композитного проводящего гидрогеля БСА–ФЦ–УНТ–NH2 обладает более высоким коэффициентом корреляции с референтным методом, чем биосенсор на основе редокс-активного полимера БСА–ФЦ. Таким образом, разработанный биосенсор можно использовать в качестве альтернативы стандартному методу анализа и как прототип для создания чувствительных и точных глюкометров.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках Государственного задания (№ FEWG-2020-0008). Определение химической структуры редокс-полимеров проведено за счет гранта ректора ТулГУ для поддержки молодых ученых, договор № 8878 ГРР.
Список литературы
Mehrotra P. // J. Oral. Biol. Craniofac Res. 2016. V. 6. P. 153.
Zaman F.G., Moulahoum H., Ak M. et al. // Trends Anal. Chem. 2019. V. 118. P. 264.
Yang N., Chen X., Ren T. et al. // Sens. Actuators B. 2015. V. 207. P. 690. https://doi.org/10.1016/j snb.2014.10.040
Ansari S.A., Qayyum H. // Biotechnol. Adv. 2012. V. 30. P. 512.
Мельников П.В., Наумова А.О., Александровская А.Ю. и др. // Российские нанотехнологии. 2018. Т. 13. № 11–12. С. 47.
Yuan M., Minteer S.D. // Curr. Opin. Electrochem. 2019. V. 15. P. 1.
Jiang Y., Wu J. // Electrophoresis. 2019. V. 40. P. 2084. https://doi.org/10.1002/elps.201900066
Liang R.P., Fan L.X., Wang R. et al. // Electroanalysis. 2009. V. 21. P. 1685.
Qiu J-D., Deng M-Q., Liang R.-P. et al. // Sens. Actuators B. 2008. V. 135. P. 181.
Yılmaz Ö., Demirkol D.O., Gülcemal S. et al. // Colloids Surf. B. 2012. V. 100 P. 62.
Каманин С.С., Арляпов В.А., Понаморева О.Н. // Сенсорные системы. 2017. Т. 31. С. 161.
Arlyapov V.A., Kharkova A.S., Kurbanaliyeva S.K. et al. // Enzyme Microb. Technol. 2021. V. 143. № 109706. https://doi.org/10.1016/j.enzmictec.2020.109706
Chen J., Munje R., Godman N.P. et al. // Langmuir. 2017. V. 33. P. 7591.
Арляпов В.А., Каманин С.С., Каманина О.А. и др. // Российские нанотехнологии. 2017. Т. 12. С. 76.
Kamanina O.A., Kamanin S.S., Kharkova A.S. et al. // 3 Biotech. 2019. V. 9. P. 2.
Benjamin S.R., Vilela R.S., de Camargo H.S. et al. // Int. J. Electrochem. Sci. 2018. V. 13. P. 563.
Singh C., Srivastava S., Ali A. et al. // Sens. Actuators B. 2013. V. 185. P. 258.
Le Goff A., Moggia F., Debou N. et al. // J. Electroanal. Chem. 2010. V. 641. P. 57.
Zhang X., Li C.-R., Wang W.-C. et al. // Food Chem. 2016. V. 192. P. 197. https://doi.org/10.1016/j.foodchem.2015.06.044
Kandimalla V.B., Tripathi V.S., Ju H.A. // Biomater. 2006. V. 27. P. 1167.
Callegari A.S., Cosnier M., Marcaccio D. // J. Mater. Chem. 2004. V. 14. P. 807.
Qiu J.-D., Guo J., Liang R.-P., Xiong M. // Electroanalysis. 2007. V. 19. P. 2335.
Parra-Alfambra A.M., Casero E., Ruiz M.A. et al. // Anal. Bioanal. Chem. 2011. V. 401. P. 883. https://doi.org/10.1007/s00216-011-5128-7
Арляпов В.А., Харькова А.С., Абрамова Т.Н. и др. // Журн. аналит. химии. 2020. № 9. С. 820.
Justino C.I.L., Freitas A.C., Pereira R. at al. // TrAC Trends Anal. Chem. 2015. V. 68. P. 2.
Кильдеева Н.Р., Перминов П.А., Владимиров Л.В. и др. // Биоорган. химия. 2009. Т. 35. С. 360.
Nicholson R.S. // Anal. Chem. 1965. V. 37. P. 1351.
Laviron E. // J. Electroanal. Chem. Interfacial Electrochem. 1979. V. 101. P. 19.
Ribau I., Fortunato E. // J. Pharm. Pharmacol. 2018. V. 6. P. 175.
Giarola J., Mano V., Pereira A.C. // Electroanalysis. 2018. V. 30. № 1. P. 119.
Nicholson R.S., Shain I. // Analyt. Chem. 1964. V. 36. P. 706.
Ramírez-Delgado V., Cruz-Ramirez M., Hernández-Ayala L.F. et al. // J. Mexican Chem. Soc. 2015. V. 59. P. 282.
Sekretaryova A.N., Vagin M.Yu., Beni V. et al. // Biosens. Bioelectron. 2014. V. 53. P. 275.
Kharkova A.S., Arlyapov V.A., Turovskaya A.D. et al. // Enzyme Microb. Technol. 2020. V. 132. № 109435. https://doi.org/10.1016/j.enzmictec.2019.109435
Zaitseva A.S., Arlyapov V.A., Yudina N.Yu. et al. // Enzyme Microb. Technol. 2017. V. 98. P. 43.
Liang B., Guo X., Fang L. et al. // Electrochem. Commun. 2015. V. 50. P. 1.
Mazar F.M., Alijanianzadeh M., Molaeirad A. et al. // Process Biochem. 2017. V. 56. P 71.
Pakapongpan S., Poo-arporn R.P. // Mater. Sci. Eng. 2017. V. 76. P. 398.
Li X., Feng Q., Lu K., Huang J. // Biosens. Bioelectron. 2021. V. 171. P. 112690.
Каманин С.С., Арляпов В.А., Мачулин А.В. и др. // Журн. прикл. химии. 2015. Т. 88. Вып. 3. С. 458.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии