Российские нанотехнологии, 2022, T. 17, № 1, стр. 46-56
ВЛИЯНИЕ ТЕРМООБРАБОТКИ НА МИКРОСТРУКТУРУ И ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ PtCu/C-КАТАЛИЗАТОРОВ
А. К. Невельская 1, *, С. В. Беленов 1, В. Е. Гутерман 1, А. Ю. Никулин 1, Н. В. Топорков 1
1 Южный федеральный университет
Ростов-на-Дону, Россия
* E-mail: alina_nevelskaya@mail.ru
Поступила в редакцию 11.08.2021
После доработки 11.08.2021
Принята к публикации 16.10.2021
Аннотация
PtCu/C-электрокатализаторы с различным составом, полученные методом совместного восстановления прекурсоров металлов, термообработаны при температуре 350°C в атмосфере аргона. Исследование методами рентгеновской порошковой дифракции и просвечивающей электронной микроскопии показало увеличение среднего размера наночастиц после термической обработки, что объясняет снижение величины электрохимически активной площади поверхности катализаторов. Показано увеличение удельной активности катализаторов в реакции электровосстановления кислорода после термообработки. Исследование методом стресс-тестирования в диапазоне потенциалов 0.6–1.4 В показывает увеличение стабильности термообработанного катализатора по сравнению с материалом в состоянии “как получено”. Показано снижение количества растворяющейся меди из наночастиц катализатора после термической обработки в ходе электрохимической активации, что также указывает на увеличение стабильности катализатора.
ВВЕДЕНИЕ
Низкотемпературные топливные элементы (ТЭ) являются перспективным источником энергии как для стационарных установок, так и для различных портативных устройств, транспорта и т.д. [1–3]. На сегодня для эффективной работы ТЭ широко применяются электрокатализаторы, представляющие собой платиносодержащие наночастицы (НЧ), закрепленные на углеродном носителе [4–6]. К таким катализаторам предъявляют ряд требований, в числе которых высокая каталитическая активность, стабильность в процессе эксплуатации ТЭ, а также приемлемая стоимость. Поэтому все больше исследований проводится в направлении уменьшения загрузки платины в катализаторе, что может быть достигнуто путем частичной замены (легирования) платины некоторыми другими металлами. Известно, что в ряде случаев PtM/C (M = Co, Ni, Fe, Cu и др.) катализаторы обладают большей активностью и стабильностью, чем Pt/C-катализаторы [7–10]. К сожалению, при работе ТЭ может происходить растворение легирующего компонента, что отрицательно сказывается на проводимости протонпроводящей мембраны, а следовательно, и сроках эксплуатации ТЭ.
Для минимизации негативных последствий растворения неблагородного компонента, а также повышения активности и стабильности катализаторов используют различные подходы, в том числе термическую [11, 12] и предобработку в кислотах [13, 14]. Кроме того, предобработка катализаторов используется для удаления нежелательных примесей, остающихся в катализаторах после синтеза [15].
Известно, что в процессе термообработки происходит укрупнение НЧ [11, 12, 16, 17]. Этот процесс связывают с двумя основными причинами: миграция и коалесценция частиц; созревание по Оствальду. В рамках первого механизма перемещение металлических частиц на поверхности носителя происходит посредством миграции НЧ Pt или PtM, второй включает в себя обмен атомами, при этом более крупные частицы растут, а более мелкие непрерывно уменьшаются в размерах. Такой процесс аналогичен Оствальдовскому созреванию кристаллов в растворе [18]. При этом степень укрупнения НЧ зависит от начального размера и состава НЧ, характера их распределения по размеру и по поверхности углеродного носителя [19], типа носителя. Согласно [12, 17] рост НЧ оказывает негативное влияние на величину площади электрохимически активной поверхности (ЭХАП) катализаторов. Однако есть данные и об обратном эффекте термической обработки. Например, в [15] в качестве причин увеличения ЭХАП после термообработки указаны перекристаллизация НЧ, удаление остаточных органических групп с поверхности углерода и более прочное закрепление НЧ на поверхности графена, улучшающее электрический контакт.
Высокая стабильность является важным критерием отбора Pt-содержащих катализаторов. Положительное влияние термообработки на стабильность катализаторов в процессе стресс-тестирования отмечено в [11, 12, 17, 20, 21]. В [22] утверждают, что Pt/C коммерческий катализатор TEC10E50E-HT после термообработки показывает большую стабильность после 5000 циклов вольтамперометрических стресс-тестов в различных диапазонах потенциалов, в том числе 0.4–1.0 В. Это связывают с увеличением размера НЧ (с 2–3 нм до 5 нм), а также с повышением стабильности самого углеродного носителя. Таким образом, возможность контролируемого роста НЧ в процессе термической обработки позволяет получать более стабильные и более активные катализаторы.
Как правило, в процессе термической обработки катализаторов нагрев осуществляется в инертной атмосфере, что предотвращает окисление углеродного носителя. По-видимому, оптимальные условия термообработки (температура, скорость нагрева и охлаждения, длительность, состав атмосферы) зависят от состава и структуры металлических НЧ катализатора, типа используемого носителя. Например, в зависимости от условий термообработка биметаллических катализаторов может способствовать как разрушению НЧ со структурой оболочка–ядро [23], так и к образованию более совершенной оболочки [24]. Поэтому подбор оптимальных условий термообработки для каждого типа катализаторов очень важен.
В настоящее время сведения о возможных преобразованиях Pt-содержащих катализаторов в процессе термической обработки носят фрагментарный характер [21]. Результаты таких исследований важны как для разработки способов повышения функциональных характеристик биметаллических систем, так и для поиска оптимальных составов и структур катализаторов, характеризуемых высокой стабильностью к внешним воздействиям.
Целью настоящего исследования является изучение влияния термической обработки на структурные характеристики PtCu/С-катализаторов различного состава, их активность в реакции электровосстановления кислорода и стабильность по результатам стресс-тестирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез PtCu/C-материалов разного состава проводили методом совместного восстановления прекурсоров платины и меди [25]. К водно-этиленгликолевой суспензии углеродного носителя Vulcan XC72 при комнатной температуре добавляли количество прекурсоров металлов, рассчитанное таким образом, чтобы при их полном восстановлении атомное соотношение Pt : Cu составило 1 : 1, 1 : 1.5 и 1 : 2, а доля Pt в материале – 30 мас. %. К полученной суспензии при интенсивном перемешивании добавляли пятикратный избыток свежеприготовленного водного раствора 0.5 М NaBH4. Через 30 мин суспензию фильтровали на воронке Бюхнера, многократно промывали водой и этанолом, после чего сушили над P2O5.
Соотношение металлов Pt : Cu в PtCu/C-образцах определяли методом рентгеновского флуоресцентного анализа (РФлА) на спектрометре с полным внешним отражением рентгеновского излучения RFS-001 (Научно-исследовательский институт физики Южного федерального университета, г. Ростов-на-Дону). Время выдержки образца – 300 с. Регистрацию и обработку спектров рентгеновской флуоресценции проводили в программе UniveRS (Южный федеральный университет, Ростов-на-Дону). Полученные материалы с составами PtCu0.68, PtCu0.97 и PtCu1.26 маркировали как PC1, PC2 и PC3 соответственно. Массовую долю металлов в образцах определяли по массе несгоревшего остатка, предположительно состоящего из Pt и CuO, оставшегося после прокаливания образцов при 800°C. Массовая доля Pt составила 28.2, 30.5 и 31 мас. % для PC1, PC2 и PC3 соответственно.
Температурную обработку образцов проводили с использованием печи ПТК-1.2-40 (НПП “Теплоприбор”) в атмосфере аргона при 350°C в соответствии со следующей схемой: быстрое нагревание до заданной температуры (~15 мин), выдержка установленной температуры в течение 1 ч, медленное самопроизвольное охлаждение до комнатной температуры в течение 4–5 ч после выключения нагрева. При обозначении материалов, прошедших термическую обработку, к названию добавили индексы, соответствующие температуре обработки.
Рентгеновские дифрактограммы порошковых PtCu/C-материалов регистрировали на дифрактометре ARL X´TRA (CuKα-излучение), интервал углов 2θ от 15° до 95° с шагом 0.04° и скоростью регистрации 2° в минуту. Средний размер кристаллитов определяли по формуле Шеррера [26]:
где K = 0.98 – постоянная Шеррера, λ – длина волны монохроматического излучения в Å, FWHM – полная ширина пика на половине высоты (в радианах), D – средний размер кристаллитов, нм, θ – угол отражения в радианах.Исследование образцов методами просвечивающей электронной микроскопии (ПЭМ) и просвечивающей растровой электронной микроскопии (ПРЭМ) проводили с помощью микроскопа FEI Tecnai G2 F20 S-TWIN TMP с ЭДС-приставкой EDAX, работающим при ускоряющем напряжении 200 кВ. Порошки электрокатализатора диспергировали в этиловом спирте в течение 2–3 мин, затем одну каплю суспензии наносили на медную сетку, покрытую тонким слоем аморфного углерода. Было обработано 1150 НЧ каждого катализатора.
Электрохимическое поведение электрокатализаторов изучали в трехэлектродной ячейке на вращающемся дисковом электроде. Катализатор наносили на электрод, используя каталитические чернила – суспензию PtCu/C-материала в водно-изопропанольном растворе. Для приготовления каталитических чернил к 0.004 г исследуемого материала добавляли 100 мкл деионизированной воды, 100 мкл 1%-ного водного раствора Nafion и 1800 мкл изопропилового спирта. Суспензию диспергировали ультразвуком в течение 20 мин. При постоянном перемешивании отбирали аликвоту объемом 3 мкл и наносили на предварительно отполированный и очищенный торец стеклографитового дискового электрода, каждый раз регистрируя массу капли. После ее высыхания наносили следующую аликвоту объемом 3 мкл. Капли суспензии сушили при комнатной температуре в течение 10 мин при вращении электрода со скоростью 700 об./мин. Подобная методика нанесения обеспечивала формирование равномерного и однородного каталитического слоя.
Перед измерениями проводили стандартизацию поверхности катализатора. Для этого в 0.1 М растворе HClO4, который продувался Ar не менее 30 мин, методом циклической вольтамперометрии (ЦВА) проводили 100 циклов развертки потенциала в диапазоне значений от 0.04 до 1.0 В со скоростью развертки 200 мВ/с. В процессе пред-обработки происходит стандартизация поверхности катализатора, а также очищение этой поверхности от возможных органических примесей. Далее в аналогичных условиях, но при скорости развертки потенциала 20 мВ/с, регистрировали две ЦВА, которые использовали для определения площади ЭХАП. Величину ЭХАП рассчитывали по среднему значению количества электричества, пошедшего на электрохимическую адсорбцию и десорбцию атомарного водорода с учетом вклада тока для заряда двойного электрического слоя, как это описано в [25].
Активность катализаторов в реакции электровосстановления кислорода (РВК) определяли, регистрируя вольтамперограммы в 0.1 М растворе HClO4, насыщенным кислородом в течение 1 ч, на вращающемся дисковом электроде при скорости развертки потенциала 20 мВ/с. Вольтамперограммы регистрировали при скоростях вращения дискового электрода 400, 900, 1600 и 2500 об./мин. Расчет кинетического тока при потенциале 0.90 В относительно обратимого водородного электрода (ОВЭ) проводили по уравнению Коутецкого–Левича:
где j – экспериментально измеренный ток, jd – диффузионный ток, jk – кинетический ток.Разделив кинетический ток на массу Pt на электроде или ЭХАП катализатора, рассчитывали значения масс-активности (А/г (Pt)) или удельной (A/м2 (Pt)) активности катализатора в РВК. Также проводили корректировку потенциодинамических кривых вычитанием из вольтамперограммы аналогичной кривой, полученной на том же электроде в атмосфере Ar: I (O2) –I (Ar), как описано в [27].
Все кривые были предварительно нормализованы для учета вклада омического падения напряжения согласно формуле E = Eизм – I · R, где Eизм – заданное значение потенциала, I · R – омическое падение потенциала, равное произведению силы тока на сопротивление слоя раствора между электродом сравнения и исследуемым электродом.
Стабильность катализаторов оценивали методом стресс-тестирования, основанным на наложении 2000 вольтамперометрических циклов изменения потенциала со скоростью 100 мВ/с в диапазоне потенциалов 0.6–1.4 В. Измерения проводили в 0.1 М растворе HClO4, насыщенном аргоном, при 25°С. После 2000 циклов снова проводили стандартизацию поверхности методом ЦВА в диапазоне потенциалов 0.04–1.0 В при скорости развертки потенциала 200 мВ/с, после чего регистрировали две ЦВА при скорости развертки потенциала 20 мВ/с. ЭХАП рассчитывали с использованием второй ЦВА. Активность после стресс-тестирования определяли при потенциале 0.85 В.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На порошковых рентгенограммах синтезированных PtCu/C-материалов (рис. 1) отчетливо видны отражения, соответствующие ГЦК-ячейке (пр. гр. Fm3m) платины. Расчет среднего размера кристаллитов по полной ширине отражения на половине высоты (FWHM) показал, что размер частиц для полученных материалов слабо зависит от содержания меди в образцах и составляет от 2.3 до 2.6 нм. Максимумы отражений (111) и (200) смещены в область больших углов 2θ по сравнению с отражениями для фазы платины [28]. Расположение пиков в области углов 2θ между отражениями фаз платины и меди подтверждает гипотезу об образовании твердого раствора PtCu. Параметр кристаллической решетки (a) (табл. 1), рассчитанный для всех синтезированных образцов, находится в диапазоне между параметром кристаллической решетки платины 3.920 Å и меди 3.615 Å и уменьшается по мере увеличения массовой доли меди в катализаторах (3.824, 3.817, 3.811 Å для PC1, PC2 и PC3 соответственно), что подтверждает постепенное увеличение содержания меди в НЧ от образца к образцу. В то же время содержание меди в твердом растворе Pt–Cu, рассчитанное по закону Вегарда (табл. 1), для всех полученных образцов систематически ниже по сравнению с составом металлической компоненты катализаторов, определенным по данным РФлА. Для таких расчетов использовали наиболее интенсивный пик, соответствующий грани 111. По-видимому, несоответствие между составами, определенными по результатам рентгеновской дифрактометрии и РФлА, связано с неполным вхождением меди в состав твердого раствора. Поскольку на рентгенограммах не наблюдается отражений фаз меди или ее оксидов, можно предположить, что часть меди в материалах содержится в виде рентгеноаморфного оксида. На возможность образования таких оксидов указано в [24].
Рис. 1.
Рентгеновские дифрактограммы образцов PC2 (а), PC1 (б), PC2 (в) и PC3 (г) до (1) и после термообработки при 350°С (2).

Таблица 1.
Структурные характеристики PtCu/C-катализаторов
| Образец | ω (Pt), % | Состав | Средний размер кристаллитов Dср, нм | а, Å | |
|---|---|---|---|---|---|
| Расчет по РФлА | Расчет по РФА | ||||
| PC1 | 28.1 | PtCu0.68 | PtCu0.46 | 2.8 | 3.824 |
| PC1_350 | PtCu0.56 | 17.9 | 3.810 | ||
| PC2 | 30.5 | PtCu0.97 | PtCu0.51 | 2.3 | 3.817 |
| PC2_350 | PtCu0.78 | 14.9 | 3.788 | ||
| PC3 | 31.0 | PtCu1.26 | PtCu0.56 | 2.4 | 3.811 |
| PC3_350 | PtCu0.88 | 7.8 | 3.777 | ||
После термической обработки при 350°С на рентгенограммах всех полученных материалов наблюдаются сужение пиков, увеличение их интенсивности (рис. 1) и сдвиг максимумов отражений в область больших углов 2θ, что свидетельствует об увеличении среднего размера кристаллитов и уменьшении параметров кристаллической решетки вследствие термической обработки. Отметим, что средний размер кристаллитов, рассчитанный по формуле Шеррера, после термической обработки зависит от содержания меди в образце: при увеличении содержания меди средний размер уменьшается (табл. 1). Уменьшение параметра кристаллической решетки твердого раствора Pt–Cu после термической обработки материалов также зависит от исходного состава образцов. При увеличении содержания меди уменьшение величины a происходит в большей степени, а именно на 0.4, 0.8 и 0.9% от исходного значения для образцов PC1_350, PC2_350 и PC3_350 соответственно. Это указывает на досплавление металлических компонентов, происходящее в ходе термической обработки.
Согласно данным рентгенофазового анализа (РФА) для катализаторов после термической обработки (рис. 1а) также характерно образование сверхструктур типа PtCu [29], максимумы отражений которых ориентировочно расположены на 21°, 39°, 53°, 64° и 74° 2θ. Известно, что при температуре ниже 816°C в системе Pt–Cu формируется интерметаллид состава PtCu со структурой (пр. гр. R3m) хонгшиита в соответствии с диаграммой состояния системы платина–медь.
Для более подробного изучения явлений, происходящих в процессе термической обработки, был выбран катализатор PC3, для которого характерны наименьшая степень укрупнения НЧ и наибольшая степень досплавления компонентов в результате термообработки.
Результаты ПЭМ и ПРЭМ образца PC3 (рис. 2а) показали, что металлические НЧ равномерно распределены по поверхности углеродного носителя. ПЭМ-изображения материала PC3_350 (рис. 2б) выявили наличие агломератов, образующихся после термообработки, а также относительно небольшое увеличение среднего размера НЧ (с 2.6 до 4.1 нм).
Рис. 2.
ПЭМ- (а, б) и ПРЭМ-изображения (в, г) катализаторов PC3 и PC3_350 соответственно, а также гистограммы (д) распределения наночастиц по размерам с указанием среднего размера наночастиц.

Результат расчета среднего размера НЧ, полученный с помощью ПЭМ, отличается от среднего размера кристаллитов по данным рентгеновской порошковой дифракции, что отчасти обусловлено наличием крупных агломератов, учет размера которых при обработке ПЭМ-изображений не проводился. Сравнение гистограмм распределения размеров НЧ в исходном и термообработанном материалах (рис. 2в) показывает, что для катализатора, прошедшего термообработку при 350°С, характерно более широкое распределение НЧ по размерам, чем для материала в состоянии “как получено”. Это обусловлено спеканием части мелких НЧ в более крупные.
Циклические вольтамперограммы всех полученных PtCu/C-образцов на стадии стандартизации (рис. 3) имеют типичный вид, характерный для Pt-содержащих катализаторов [8–14, 17], и включают в себя водородную, двуслойную и кислородную области. На ЦВА исходных PtCu/C-материалов не наблюдается пиков, соответствующих растворению меди из отдельной фазы и из твердого раствора [30]. Однако на ЦВА всех термически обработанных образцов заметен анодный пик при потенциале ~0.75 В, связанный с растворением меди из фазы твердого раствора. В процессе повторения циклов развертки потенциала интенсивность этого пика снижается (рис. 3б, 3г, 3е). В ходе предобработки катализаторов PC2_350 и PC3_350 с бóльшим содержанием меди в первом цикле развертки потенциала на ЦВА также наблюдается пик при 0.35 В, соответствующий растворению меди из собственной фазы. Наличие двух этих пиков на ЦВА термообработанных материалов обусловлено изменением структуры НЧ под действием температуры. Атомы меди, изначально входящие в состав НЧ, могут диффундировать на поверхность, с которой растворяются в ходе электрохимической обработки. Кроме того, часть атомов меди, образующихся при карботермическом восстановлении аморфизированных оксидов меди, преимущественно локализованы в поверхностных слоях НЧ. Отсутствие пика в области 0.3–0.4 В на ЦВА образца PC1 объясняется меньшим содержанием меди в этом катализаторе, как это было изначально заложено при синтезе.
Рис. 3.
ЦВА (1 – первый цикл, 2 – 100 цикл) катализаторов PC1, PC2 и PC3 до и после термообработки при 350°С.

Результаты сравнения состава катализаторов PC3 и PC3_350 после электрохимической активации показали, что количество меди, растворяющейся в процессе циклирования, уменьшается после термообработки катализатора. Так, в случае катализатора PC3 растворяется 81% меди (состав меняется от PtCu1.26 до PtCu0.25), в то время как в случае термообработанного образца PC3_350 – всего лишь 32% (изменение состава от PtCu1.26 до PtCu0.89). Данный факт может быть связан с увеличением содержания меди в твердом растворе, упорядочением твердого раствора PtCu или ростом размера металлических НЧ после термической обработки. Согласно [31–33] высокое содержание меди в стандартизированном PtCu/C-катализаторе может оказывать положительное влияние на активность и стабильность катализатора в РВК, срок службы ТЭ в целом.
Величину ЭХАП катализаторов рассчитывали по водородной области ЦВА (рис. 4а, 4в, 4д), определяя количество электричества, затраченное на электрохимическую адсорбцию/десорбцию атомарного водорода в диапазоне потенциалов 0.04–0.40 В. Установлено, что после термической обработки происходит снижение величины ЭХАП всех полученных катализаторов. В наибольшей степени снижение выражено у образца PC1. Этот факт хорошо коррелирует с влиянием термообработки на средний размер кристаллитов (табл. 2): для материала с наименьшим содержанием меди средний размер частиц после термообработки увеличивается наиболее существенно.
Рис. 4.
ЦВА (атмосфера Ar) (а, в, д) и потенциодинамические кривые (атмосфера O2) (б, г, е) катализаторов PC1, PC2 и PC3 до (1) и после термообработки (2) соответственно. Электролит – 0.1 M HClO4.
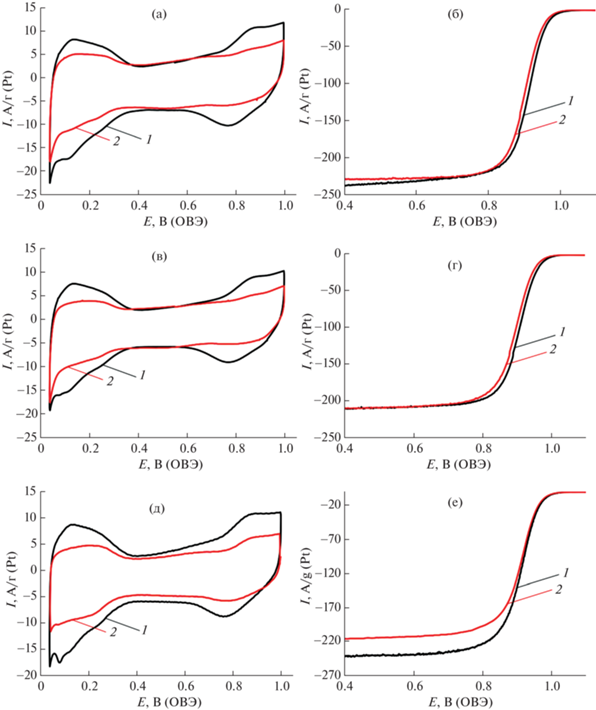
Таблица 2.
Некоторые характеристики PtCu/C-катализаторов до и после термообработки при 350°С
| Образец | ω (Pt), % | ЭХАП, м2/г (Pt) | Ik, A/г (Pt) | Ik, A/м2 (Pt) | E1/2, В |
|---|---|---|---|---|---|
| PC1 | 28.1 | 34 | 352 | 10.4 | 0.91 |
| PC1_350 | 18 | 231 | 12.8 | 0.90 | |
| PC2 | 30.5 | 33 | 287 | 8.7 | 0.91 |
| PC2_350 | 13 | 188 | 14.5 | 0.90 | |
| PC3 | 31.0 | 37 | 345 | 9.3 | 0.91 |
| PC3_350 | 20 | 318 | 15.9 | 0.91 | |
| HiSPEC 4000 | 40.0 | 59 | 160 | 2.1 | 0.90 |
После термической обработки для всех изученных образцов наблюдается снижение масс-активности в РВК (рис. 4б, 4г, 4е), также снижаются значения потенциалов полуволны электровосстановления кислорода (табл. 2), хотя для образца с наибольшим содержанием меди PC3 снижение активности выражено в значительно меньшей степени. В то же время для всех изученных катализаторов удельная активность (в расчете на единицу площади активной поверхности) увеличивается после термообработки при 350°С.
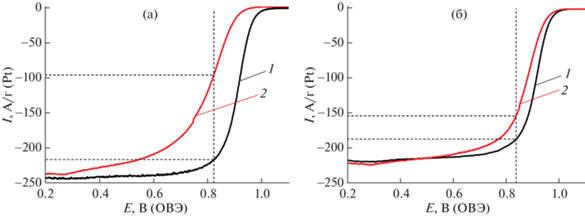
Для катализаторов PC3 и PC3_350, продемонстрировавших наиболее высокую активность в РВК, была проведена оценка стабильности. Для этого проводили многократное циклирование потенциала в диапазоне 0.6–1.4 В, после чего определяли величину ЭХАП и активность в РВК (рис. 5). Катализатор PC3_350 обладает большей остаточной активностью после 2000 циклов (83% от первоначальной) по сравнению с катализатором PC3, демонстрирующим после 2000 циклов только 30% от начального значения активности. Также расчет значения потенциала полуволны показал, что для материала PC3 после стабильности это значение уменьшается с 0.91 до 0.80 В, в то время как для катализатора PC3_350 всего лишь с 0.91 до 0.88 В. Полученные результаты подтверждают предположение о том, что термообработка приводит к увеличению стабильности биметаллических катализаторов.
Рис. 5.
Потенциодинамические кривые катализаторов PC3 (а) и PC3_350 (б) до (1) и после (2) 2000 циклов стресс-теста в диапазоне потенциалов 0.6–1.4 В (пунктирные линии соответствуют потенциалу 0.85 В, при котором сравнивали активность катализаторов).
Причиной более высокой стабильности термообработанного катализатора по сравнению с образцом в состоянии “как получено”, по-видимому, является больший размер биметаллических НЧ и, возможно, их более прочная адгезия к поверхности носителя. Кроме того, увеличение стабильности материалов после термической обработки может быть связано с образованием упорядоченного твердого раствора PtCu, который по данным [34, 35] более стабилен, по сравнению с неупорядоченным твердым раствором.
ЗАКЛЮЧЕНИЕ
Методом химического восстановления платины и меди из растворов их соединений получены PtCu/C-катализаторы PC1, PC2 и PC3, содержащие в состоянии “как получено” 28–31 мас. % Pt. Рентгеновская дифрактометрия и ПЭМ подтвердили формирование на поверхности углеродного носителя НЧ биметаллической фазы, представляющей собой твердый раствор Pt–Cu. Средний размер кристаллитов PtCu составил от 2.3 до 2.8 нм. Относительное содержание платины в металлической фазе, приближенно рассчитанное по закону Вегарда, слабо зависит от состава материалов, определенного РФлА, и составило PtCu0.46–PtCu0.56. По-видимому, общее увеличение количества меди в материалах при переходе PC1 → PC3 сопровождается, в первую очередь, увеличением количества поверхностных рентгеноаморфных оксидов меди, а не обогащением атомами меди НЧ твердого раствора PtCu.
Термическая обработка PtCu/C-материалов (1 ч при 350°С) приводит к росту среднего размера кристаллитов (Dср, а также сопровождается обогащением НЧ твердого раствора медью. Последний эффект может быть связан с карботермическим восстановлением меди из рентгеноаморфных оксидов. В результате термической обработки Dср растет тем сильнее, чем меньше общее содержание меди в материале.
Результаты электронно-микроскопического изучения микроструктуры образцов PC3 и PC3_350 подтвердили рост среднего размера и уширение дисперсии распределения размеров НЧ в результате термообработки. В то же время сравнение среднего размера НЧ, рассчитанного по результатам ПЭМ-исследования, и среднего размера кристаллитов Dср показало, что расчет по уравнению Шеррера дает сильно завышенные значения Dср. По-видимому, в значительной степени это обусловлено формированием крупных кристаллитов в результате слияния маленьких кристаллитов в изначально существующих агрегатах. Процесс коалесценции обусловливает и увеличение доли крупных НЧ в образце PC3_350, как это наблюдается при сравнении результатов электронно-микроскопического исследования образцов PC3 и PC3_350.
Электрохимическая активация (стандартизация поверхности) биметаллических катализаторов приводит к селективному растворению значительной части меди. При этом предшествующая термическая обработка способствует повышению содержания в катализаторе остаточной меди: состав PC3 меняется после активации от PtCu1.26 до PtCu0.25, в то время как состав термообработанного образца PC3_350 – всего до PtCu0.89. Такое влияние термообработки может быть связано как с увеличением содержания меди в металлической компоненте катализаторов, так и с увеличением доли крупных НЧ, из внутренних слоев которых растворение меди затруднено, а также с упорядочением твердого раствора PtCu.
Все исследованные PtCu/C-катализаторы проявляют бóльшую масс-активность в РВК по сравнению с коммерческим Pt/C-катализатором HiSPEC 4000. Термическая обработка катализаторов приводит к снижению их масс-активности в РВК. В наибольшей степени этот эффект проявляется для PC2, в наименьшей – для PC3. При этом удельная активность (в расчете на единицу площади активной поверхности катализатора) после термической обработки увеличивается. Таким образом, ключевым фактором, обусловливающим снижение масс-активности катализаторов вследствие термообработки, является снижение ЭХАП. На примере катализатора PC3 показано, что термообработка увеличивает стабильность биметаллических катализаторов в условиях многократного вольтамперометрического стресс-тестирования, что, вероятно, обусловлено формированием интерметаллида состава PtCu и увеличением среднего размера НЧ в результате термообработки.
В целом исследование показало, что изучение влияния термической обработки на состав, микроструктуру и электрохимическое поведение PtM/C-катализаторов может дать дополнительную информацию об их исходной микроструктуре в состоянии “как получено”. Полезными эффектами термообработки являются обогащение состава металлической компоненты катализатора легирующим компонентом, а также повышение удельной активности катализатора в РВК. Увеличение размера НЧ в процессе термообработки приводит к снижению масс-активности катализаторов в РВК, однако может повышать их коррозионно-морфологическую стабильность.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (проект № 20-33-90225).
Список литературы
Blal M., Benatiallah A., NeÇaibia A. et al. // Energy. 2019. V. 168 (C). P. 182. https://doi.org/10.1016/j.energy.2018.11.095
Seh Z.W., Kibsgaard J., Dickens C.F. et al. // Science. 2017. V. 355. № 6321. P. 1. https://doi.org/10.1126/science.aad4998
Chen J., Ou Z., Chen H. et al. // Chinese J. Catal. 2021. V. 42. № 8. P. 1297. https://doi.org/10.1016/S1872-2067(20)63736-6
Raciti D., Liu Z., Chi M. et al. // Nan. Sci. Tec. 2016. P. 253.https://doi.org/10.1007/978-3-319-29930-3_6
Jung N., Chung D.Y., Ryu J. et al. // Nano Today. 2014. V. 9. № 4. P. 433. https://doi.org/10.1016/j.nantod.2014.06.006
Yu W., Porosoff M.D., Chen J.G. // Chem. Rev. 2012. V. 112. № 11. P. 5780. https://doi.org/10.1021/cr300096b
Zhu H., Li X.W., Wang F.H. // Int. J. Hydrogen Energ. 2011. V. 36. № 15. P. 9151. https://doi.org/10.1016/j.ijhydene.2011.04.224
Tang X., Fang D., Qu L. // Chinese J. Catal. 2019. V. 40. № 4. P. 504. https://doi.org/10.1016/S1872-2067(19)63304-8
Oezaslan M., Strasser P. // J. Power Sources. 2011. V. 196. № 12. P. 5240. https://doi.org/10.1016/j.jpowsour.2010.11.016
Yan W., Zhang D., Zhang Q. et al. // J. Energy Chem. 2022. V. 64. P. 583. https://doi.org/10.1016/j.jechem.2021.05.003
Beermann V., Gocyla M., Kuehl S. et al. // J. Am. Chem. Soc. 2017. V. 139. P. 16536. https://doi.org/10.1021/jacs.7b06846
Kaewsai D., Yeamdee S., Supajaroon S. et al. // Int. J. Hydrogen Energ. 2018. V. 43. № 10. P. 5133. https://doi.org/10.1016/j.ijhydene.2018.01.101
Sohn Y., Park J.H., Kim P. // Curr. Appl. Phys. 2015. V. 15. № 9. P. 993. https://doi.org/10.1016/j.cap.2015.05.013
Menshchikov V.S., Alekseenko A.A., Guterman V.E. // Nanomaterials. 2020. V. 10. № 4. P. 742. https://doi.org/10.3390/nano10040742
Tamilarasan P., Alazmi A., Batra N.M. et al. // Mat. Sci. Eng. B-Solid. 2021. V. 272. P. 115370. https://doi.org/10.1016/j.mseb.2021.115370
Bezerra C.W.B., Zhang L., Liu H. et al. // J. Power Sources. 2007. V. 173. № 2. P. 891. https://doi.org/10.1016/j.jpowsour.2007.08.028
Lin R., Zhao T., Shang M. et al. // J. Power Sources. 2015. V. 293. P. 274. https://doi.org/10.1016/j.jpowsour.2015.05.067
Chen H., Yu Y., Xin H.L. et al. // Chem. Mater. 2013. V. 25. № 8. P. 1436. https://doi.org/10.1021/cm303489z
Han K., Moon Y., Han O. et al. // Electrochem. Commun. 2007. V. 9. № 2. P. 317. https://doi.org/10.1016/j.elecom.2006.09.027
Kalyva M., Sunding M.F., Gunnæs A.E. et al. // Appl. Surf. Sci. 2020. V. 532. P. 147369. https://doi.org/10.1016/j.apsusc.2020.147369
Moriau L., Hrnjić A., Pavlišič A. et al. // iScience. 2021. V. 24. № 2. P. 102102. https://doi.org/10.1016/j.isci.2021.102102
Maselj N., Gatalo M., Ruiz-Zepeda F. et al. // J. Am. Chem. Soc. 2020. V. 167. № 11. https://doi.org/10.1149/1945-7111/aba4e6
Беленов С.В., Волочаев В.А., Прядченко В.В. и др. // Российские нанотехнологии. 2017. Т. 12. № 3–4. С. 147. https://doi.org/10.1134/S1995078017020033
Tsypkin M., de la Fuente J.L.G., García Rodríguez S. et al. // J. Electroanal. Chem. 2013. V. 704. P. 57. https://doi.org/10.1016/j.jelechem.2013.06.007
Guterman V.E., Belenov S.V., Pakharev A.Yu. et al. // Int. J. Hydrogen Energy. 2016. V. 41. № 3. P. 1609. https://doi.org/10.1016/j.ijhydene.2015.11.002
Langford J.I., Wilson A.J.C. // J. Appl. Cryst. 1978. V. 11. P. 10. https://doi.org/10.1107/S0021889878012601
Shinozaki K., Zack J.W., Pylypenko S. et al. // J. Electrochem. Soc. 2015. V. 162. P. 1384. https://doi.org/10.1149/2.0551512jes
El-Deeb H., Bron M. // Electrochim. Acta. 2015. V. 164. P. 315. https://doi.org/10.1016/j.electacta.2015.02.137
Oezaslan M., Hasche F., Strasser P. // J. Electrochem. Soc. 2012. V. 159. № 4. https://doi.org/10.1149/2.106204jes
Pryadchenko V.V., Belenov S.V., Shemet D.B. et al. // J. Phys. Chem. C. 2018. V. 122. № 30. P. 17199. https://doi.org/10.1021/acs.jpcc.8b03696
Okonkwo P.C., Ige O.O., Manaa Barhoumi E. et al. // Int. J. Hydrogen Energy. 2021. V. 46. № 29. P. 15850. https://doi.org/10.1016/j.ijhydene.2021.02.078
Colón-Mercado H.R., Popov B.N. // J. Power Sources. 2006. V. 155. № 2. P. 253. https://doi.org/10.1016/j.jpowsour.2005.05.011
Xiong L., Manthiram A. // J. Electrochem. Soc. A. 2005. V. 152. № 4. P. 697. https://doi.org/10.1149/1.1862256
Wang D., Xin H.L., Hovden R. et al. // Nat. Mater. 2012. V. 12. № 1. P. 81. https://doi.org/10.1038/NMAT3458
Antolini E. // Appl. Catal. B-Environ. 2017. V. 217. P. 201. https://doi.org/10.1016/j.apcatb.2017.05.081
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


