Российские нанотехнологии, 2022, T. 17, № 2, стр. 206-215
Антибактериальное и цитотоксическое действие многостенных углеродных нанотрубок, функционализированных йодом
В. В. Белова 1, *, О. В. Захарова 1, 2, 3, Р. А. Столяров 4, А. А. Гусев 1, 2, 3, И. А. Васюкова 1, П. А. Баранчиков 1, А. Е. Меметова 4, Н. А. Чапаксов 4
1 Тамбовский государственный университет им. Г.Р. Державина
Тамбов, Россия
2 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
3 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
4 Тамбовский государственный технический университет
Тамбов, Россия
* E-mail: vuz.lera@yandex.ru
Поступила в редакцию 05.08.2021
После доработки 10.09.2021
Принята к публикации 14.09.2021
Аннотация
Исследовано влияние многостенных углеродных нанотрубок (МУНТ), функционализированных йодом (15, 10 и 5 мас. %), на бактерии Escherichia coli и опухолевые клетки аденокарциномы молочной железы MCF-7. Получено значительное увеличение противомикробной активности МУНТ при их модификации 15 и 10 мас. % йода – при концентрациях 0.1 и 0.01 г/л выживаемость бактерий составила менее 2%, в то время как для МУНТ без йода показатель составил 7 и 30% соответственно. Модификация МУНТ 5 мас. % йода также усилила антибактериальные свойства нанотрубок, но менее существенно. На клетки MCF-7 также наибольшее цитотоксическое действие оказали МУНТ, функционализированные 15 и 10 мас. % йода, однако в отличие от бактерий разница показателей выживаемости между композитами и по сравнению с чистыми МУНТ была не более 3%. Сравнение влияния йода в составе МУНТ и чистого йода показало, что для бактерий большей токсичностью обладали функционализированные МУНТ в концентрациях выше 0.001 г/л, тогда как для клеток растворы чистого йода обладали большей цитотоксичностью.
ВВЕДЕНИЕ
Углеродные нанотрубки (УНТ) – класс промышленно производимых аллотропных модификаций углерода, представляющих собой наномасштабные нитевидные конструкции из свернутых одного, двух или нескольких листов графена с внутренним каналом. По прогнозам рынок УНТ вырастет с 876 до 1714 млн дол. США при среднегодовом темпе роста 14.4% в период с 2021 по 2026 г. [1]. Благодаря уникальным физико-химическим свойствам сферы применения УНТ крайне разнообразны и включают в себя авиакосмическую и оборонную промышленности, медицину и сельское хозяйство, создание электроники и новых композитных материалов и т.д. Однако за счет действия ван-дер-ваальсовых сил в исходном состоянии УНТ являются плохо диспергируемыми в водных и органических растворителях, что приводит к высокой степени агрегации и ухудшению их свойств. Для решения этой проблемы, а также для придания новых характеристик материалам нередко прибегают к функционализации поверхности [2].
Вместе со значительным улучшением свойств и расширением области применения при функционализации поверхности УНТ, как правило, меняются и их токсические свойства [2]. Например, нефункционализованные многостенные УНТ (МУНТ) и МУНТ, функционализованные полиэтиленгликолем (МУНТ–ПЭГ), не оказывали токсического действия на мезенхимальные стволовые клетки человека hMSCs [3] в отличие от карбоксилированных МУНТ (МУНТ–COOH), при действии которых достоверно снижалась выживаемость клеток [3, 4]. В экспериментах на клетках HEK 293 обнаружен более сильный цитотоксический эффект при одинаковых условиях экспозиции у нефункционализованных МУНТ по сравнению с МУНТ–СООН и МУНТ–NH2, при этом в экспериментах in vivo на рыбах Danio rerio токсического эффекта не было обнаружено ни в одной группе [5]. При сравнении влияния типа функционализации однослойных УНТ (ОУНТ) на дрожжевые клетки Saccharomyces cerevisiae было показано, что ОУНТ–СООН и гидроксилированные ОУНТ (ОУНТ–ОН) приводили к развитию окислительного стресса и повреждению белков, оказывая при этом генотоксическое действие. В [6] также отмечается что ОУНТ–СООН были более токсичны, чем ОУНТ–ОН. Исследование показало, что ОУНТ–СООН проявляют более высокую генотоксичность на фибробласты китайского хомячка V79, клетки A549 человека [7], а также эндотелиальные клетки человека HUVEC [8], чем нефункционализованные ОУНТ.
Помимо описанных типов функционализации УНТ регулярно появляются новые. Сравнительно недавно были синтезированы МУНТ, функционализированные йодом (I-МУНТ), характеризующиеся значительным увеличением показателей электропроводности и заметными изменениями микроструктуры и состава [9, 10]. Однако токсикологические исследования МУНТ с подобной функционализацией отсутствуют.
Поэтому целью исследования стала оценка биобезопасности I-МУНТ в отношении микроорганизмов на примере Escherichia coli и клеток млекопитающих на примере клеточной линии аденокарциномы молочной железы MCF-7.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовали МУНТ, полученные методом CVD (ООО “НаноТехЦентр”, Тамбов, Россия), функционализированные йодом (I2 ЧДА, ГОСТ 4159-79 (ООО “Компонент реактив”)). Для функционализации йодом навески МУНТ, содержащие 5, 10 и 15 мас. % йода, помещали в герметичную стеклянную тару, устанавливали в термо-шкаф и выдерживали 2 ч при температуре 120°С.
Исследование исходного образца МУНТ проводили методами сканирующей (СЭМ) и просвечивающей (ПЭМ) электронной микроскопии. Модифицированные образцы МУНТ исследовали с использованием рентгеноструктурного анализа на дифрактометре ARL Equinox 1000 (Thermo Fisher Scientific, США) с длиной волны излучения 1.5406 Å, время съемки – 600 с. Спектры комбинационного рассеяния света (КРС) были получены на приборе DXR Raman Microscope (Thermo Fisher Scientific, США) c длиной волны возбуждающего лазера 532 нм.
В качестве тест-объектов использовали биосенсор “Эколюм” – лиофилизированная культура люминесцентного штамма E. coli (ЗАО “НВО Иммунотех”, Россия) [5, 7], клеточную линию MCF-7 (Michigan Cancer Foundation-7) – клетки аденокарциномы молочной железы человека.
Суспензии наночастиц. Суспензии I-МУНТ готовили на основе стерильной дистиллированной воды (рН = 7.1 ± 0.2). Навески нанопорошков (10 мг) взвешивали при помощи аналитических весов ViBRA HT (Shinko Denshi, Japan (точность ±0.0001 г)), переносили в лабораторный стакан, при помощи дозатора вносили небольшое количество воды и перемешивали стеклянной палочкой до полного смачивания наночастиц. После перемешивания доводили количество воды до 100 мл и обрабатывали суспензии в ультразвуковой ванне Ultrasonic Cleaner CD-4800 (Codyson, Китай) в течение 10 мин (70 Вт, 44 Гц, объем – 1.4 л). После обработки в дисперсию вносили Твин 20 (1%) (VWR Life Science AMRESCO, США) и вновь обрабатывали ультразвуком 15 мин. Исходная концентрация МУНТ во всех растворах составляла 0.1 г/л, из нее путем разбавления дистиллированной водой готовили суспензии концентрацией 0.01, 0.001 и 0.0001 г/л.
Растворы сравнения. Для сравнения вызываемых эффектов использовали дисперсии МУНТ без йода в тех же концентрациях и приготовленных согласно методике, описанной выше. Для сравнительной оценки влияния йода в составе растворов функционализированных МУНТ на бактерии и клетки использовали водные суспензии йода в концентрациях, содержащихся в суспензиях МУНТ: 0.00005, 0.0001, 0.00015, 0.0005, 0.001, 0.0015, 0.005, 0.01, 0.015 г/л.
Положительный контроль. В качестве положительного контроля брали растворы натриевой соли дихлоризоциануровой кислоты (sodium dichloroisocyanurate C3Cl2N3NaO3, SDC) (ООО НПФ “Практика”, Россия), которые также готовили на основе дистиллированной воды. Данный препарат применяется в качестве дезинфицирующего средства, обладающего антимикробным действием в отношении грамотрицательных и грамположительных бактерий, вирусов и грибов рода Кандида и дерматофитов.
Методы исследования. Для оценки антибактериального действия растворов МУНТ использовали широко распространенную биолюминесцентную методику [11–13].
Метод основан на определении изменения интенсивности биолюминесценции генно-инженерного штамма E. coli при воздействии наночастиц, присутствующих в анализируемой пробе, по сравнению с контролем. Критерием токсического действия является изменение интенсивности биолюминесценции тест-объекта в исследуемой пробе по сравнению с контрольной, не содержащей токсических веществ. Уменьшение интенсивности биолюминесценции пропорционально токсическому эффекту.
Токсическое действие исследуемой пробы наноматериала на бактерии определяли по ингибированию их биолюминесценции за 30-минутный период экспозиции. Количественная оценка параметра тест-реакции выражается в виде индекса токсичности: Т = 100 (Iо – I)/Iо, где I и Iо – интенсивность свечения контроля и опыта соответственно.
Цитотоксическое действие МУНТ оценивали с использованием МТТ-колориметрического теста, основанного на способности бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ) восстанавливаться до окрашенного формазана в присутствии митохондриальных ферментов живых клеток [14, 15].
Клетки MCF-7 культивировали в среде DMEM (Dulbecco’s Modified Eagle Medium) (Thermo Fisher Scientific, Великобритания) с добавлением 10% фетальной телячьей сыворотки (Sigma, Великобритания) при 37°C и 5% CO2.
В ходе проведения исследования в лунки 24-луночного планшета помещали по 1.5 мл суспензии клеток (1 × 105) и 0.5 мл растворов наночастиц (йода, SDC) и инкубировали в СО2-инкубаторе при 5% СО2 и температуре 37°С в течение суток. После инкубации к содержимому всех лунок добавляли 5%-ный раствор МТТ в физиологическом растворе (по 100 мкл на лунку) и инкубировали планшеты при 37°С, 5% СО2. Через 4 ч среду с МТТ осторожно удаляли пипеткой, не захватывая осевшие клетки. В каждую добавляли по 500 мкл диметилсульфида. Планшеты инкубировали в течение 30 мин на орбитальном шейкере при комнатной температуре при 350 об./мин. После чего содержимое лунок переносили в центрифужные пробирки, центрифугировали 5 мин при 300 g. Полученный супернант распределяли в триплеты лунок 96-луночного планшета по 100 мкл. Оптическую плотность оценивали на спектрофотометре Multiskan Sky (Thermo Scientific, США) при длине волны 540 нм. Жизнеспособность (выживаемость) клеток рассчитывали по формуле
Статистическая обработка. Все расчеты проводили с помощью компьютерной программы Microsoft Excel 2010 (пакет “Описательная статистика”). На графиках и гистограммах показаны средние арифметические значения и стандартные отклонения. В ходе обработки данных использовали однофакторный дисперсионный анализ (ANOVA) с расчетом достоверности различий с помощью F-критерия Фишера при 5%-ном уровне значимости. На гистограммах знаком “*” отмечали достоверности различия между растворами I-МУНТ и МУНТ в тех же концентрациях, знак “**” соответствует достоверности различия между образцами I-МУНТ с разным содержанием йода.
РЕЗУЛЬТАТЫ
Результаты исследования МУНТ. Методами электронной микроскопии установлено, что используемый в исследовании наноматериал представляет собой МУНТ диаметром от 10 до 30 нм и длиной больше 2 мкм (рис. 1).
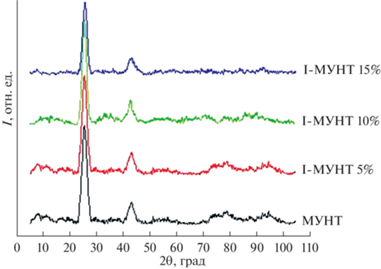
По данным рентгеновской дифракции заметна общая идентичность кривых с различием в базовой интенсивности (рис. 2).
Однако при ближайшем рассмотрении наблюдаются определенные расхождения в данных. Так, после использования йода в 15%-ной концентрации значительно увеличивается межслоевое расстояние между графеновыми слоями (примерно на 1 Å) в отличие от исходного образца и образцов, обработанных йодом в меньших концентрациях. Возможно, это связано с реакцией атомов йода с функциональными группами на поверхности внешнего слоя нанотрубок либо с группами, присоединенными к внутренним слоям, через дефекты внешнего слоя. Также вероятно увеличение межслоевого расстояния из-за деструкции внутренних слоев и попадания аморфного углерода в межслоевое расстояние. Проникновение атомов йода в межслоевое расстояние исключается из-за большого радиуса атома (атомный радиус йода – 140 пм или 1.40 Å). Также деструктивное действие йода высокой концентрации подтверждается сдвигом пика (002) в сторону большего угла 2θ, отражающего меньшую структурированность и бóльшую концентрацию углеродных несистемных включений, попадающих в межслоевое пространство.
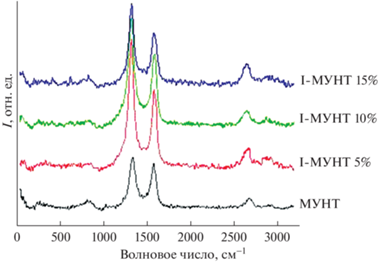
По данным спектроскопии КРС видно, что при обработке йодом значительно повышается степень дефектности материала, на 35% (рис. 3).
Данный показатель практически не зависит от концентрации йода при обработке, что говорит, с одной стороны, об отсутствии привязки между МУНТ и йодом, а с другой, само наличие в атмосфере паров йода провоцирует деструкцию графеновых слоев по активным центрам и образование новых активных центров. Это подтверждается небольшими изменениями пика 2D до и после обработки йодом различной концентрации. Пик становится больше и смещается в сторону меньшей длины волны, что может свидетельствовать о структурных изменениях вследствие разрушения графеновых слоев. Заметны небольшие несистематические изменения основных пиков. При обработке йодом 10%-ной концентрации пик D' становится неразличим в плече пика G. Использование йода малых и средних концентраций приводит к изменениям малого пика в плече пика D (~1200 см–1), отражающего наличие кислородсодержащих групп =О. Это может быть обусловлено особенностями реакции между отдельными функциональными группами на поверхности графеновых слоев и йода.
Антибактериальное действие МУНТ. Исследование антибактериальных свойств I-МУНТ показало концентрационнозависимое и йодозависимое увеличение индекса токсичности растворов МУНТ (рис. 4).
По скорости увеличения токсичности с ростом концентрации растворы располагаются в следующем порядке (по убыванию): SDC – I-МУНТ 15% – I-МУНТ 10% – I-МУНТ 5% – МУНТ, т.е. функционализация йодом увеличивает антибактериальные свойства МУНТ. При максимальной концентрации наночастиц в растворах выживаемость микроорганизмов была менее 1% в группах I-МУНТ 15% и I-МУНТ 10%, что сопоставимо с действием эталонного токсиканта – SDC. Уменьшение количества йода до 5% немного снижало биоцидный эффект. МУНТ в чистом виде при 0.1 г/л в растворе вызывали гибель 93% микроорганизмов. При 0.01 г/л наночастиц в суспензиях антибактериальное действие I-МУНТ 15% и I-МУНТ 10% сохранялось, однако для I-МУНТ 5% индекс токсичности снизился до 63 ед., что соответствует 37%-ной выживаемости бактерий. Для МУНТ без йода показатель токсичности был еще ниже – 44 ед. Дальнейшее разбавление растворов повлекло снижение токсичности I-МУНТ 15% почти в 2 раза – выживаемость E. coli составила 45%, в случае с I-МУНТ 10% выжило 85% бактерий, а растворы I-МУНТ 5% и МУНТ не оказали токсического эффекта. При концентрации нанотрубок 0.0001 г/л в растворе не выявлено подавления люминесценции микроорганизмов не зависимо от содержания йода.
На рис. 5 приведены данные по антибактериальной активности растворов йода и растворов I-МУНТ, содержащих то же количество йода. Сравнительный анализ влияния йода в составе МУНТ с чистым йодом показал схожее противомикробное действие йода и I-МУНТ 10–15% в концентрации 0.1 г/л, содержащих аналогичное количество йода. В данных вариантах отмечено 100%-ное гашение люминесценции, т.е. полная гибель микроорганизмов. В случае с раствором I-МУНТ 5% при 0.1 г/л также наблюдался высокий показатель индекса токсичности (98 ед.), однако антибактериальное действие чистого йода в сопоставимой концентрации было ниже – 89.9 ед. При разбавлении I-МУНТ 10 и 15% до 0.01 г/л токсичность растворов оставалась на прежнем уровне (98–99 ед.), тогда как растворы йода в соответствующих дозах (0.0015 и 0.001 г/л) оказали существенно более низкое противомикробное действие – выживаемость 15 и 21% соответственно. Индекс токсичности раствора I-МУНТ 5% с концентрацией 0.01 г/л и соответствующего раствора йода составил около 70%. Дальнейшее уменьшение концентрации I-МУНТ до 0.001 г/л привело к снижению токсичности до 55 ед. для I-МУНТ 15%, до 15 ед. для I-МУНТ 10% и практически до 0 в случае с I-МУНТ 5%. При этом растворы йода соответствующих концентраций оказали высокое линейно зависимое противомикробное действие, индекс токсичности составил 66–53 ед.
Проведенное исследование антибактериальных эффектов I-МУНТ показало значительное увеличение противомикробной активности МУНТ при их модификации 15 и 10 мас. % йода – при концентрации 0.1 г/л выживаемость снизилась на 6%, при 0.01 г/л на 54–55%. Отметим, что в данных концентрациях биоцидное действие I-МУНТ 10 и 15% было сопоставимо с эталонным токсикантом SDS. Доза 0.001 г/л МУНТ не оказала негативного влияния на бактерии, в то время как I-МУНТ 10 и 15% в данной концентрации уменьшили выживаемость бактерий на 15 и 55%. Модификация МУНТ 5 мас. % йода также увеличила токсичность наноматериала – при 0.1 г/л на 4%, при 0.01 г/л на 26%. Исследуемые наноматериалы в концентрации 0.0001 г/л не оказали противомикробного действия.
Сравнительный анализ влияния функционализированных МУНТ и йода показал наличие синергетического эффекта для растворов I-МУНТ 5% 0.1 г/л и I-МУНТ 10 и 15% 0.01 г/л. В данных случаях совокупное токсическое действие I-МУНТ было выше действия МУНТ и йода по отдельности. Однако при дальнейшем разбавлении растворов I-МУНТ их антибактериальное воздействие было ниже, чем у растворов йода соответствующих концентраций, что, вероятно, связано с удержанием низкоконцентрированного йода нанотрубками.
Цитотоксическое действие МУНТ. Изучение цитотоксических свойств I-МУНТ показало тенденцию к снижению выживаемости клеток при возрастании концентрации растворов МУНТ и процентного содержания в них йода (рис. 6).
По уменьшению степени выраженности токсического эффекта (выживаемости клеток) растворы располагаются в следующем порядке: SDC – I-МУНТ 15% – I-МУНТ 10% – I-МУНТ 5% – МУНТ. Отметим, что функционализация йодом влияет на возрастание цитотоксических свойств МУНТ не так существенно, как в случае с бактериями.
При концентрациях 0.0001, 0.001 и 0.01 г/л выживаемость клеток в растворе МУНТ и в растворе I-МУНТ 5% была примерно одинакова (78%). При концентрации 0.1 г/л выживаемость клеток в данных растворах снижалась на 1% в растворе МУНТ и на 2% в растворе I-МУНТ 5%. Выживаемость клеток в растворах I-МУНТ 10% и I-МУНТ 15% каждый раз снижалась на 1% при переходе к большей концентрации раствора в следующем ряду: 0.0001, 0.001, 0.01 и 0.1 г/л. При этом среднее значение цитотоксического действия растворов нефункционализированных и функционализированных МУНТ при определенной концентрации заметно уступало токсичности раствора SDC (при 0.0001 г/л – на 7.5%, при 0.001 г/л – на 8%, при 0.01 г/л – на 8.5%, при 0.1 г/л – на 9%).
С ростом процентного содержания йода в составе МУНТ несколько увеличивалась разница в выживаемости клеток между растворами МУНТ и I-МУНТ. Разница в выживаемости клеток между растворами МУНТ и I-МУНТ 10% составляла ~1%, между растворами МУНТ и I-МУНТ 15% ~3%.
Более существенно с увеличением процентного содержания йода в составе МУНТ уменьшалась разница в выживаемости клеток между растворами I-МУНТ и SDC. Разница в выживаемости клеток между растворами I-МУНТ 15% и SDC составила ~7%, между растворами I-МУНТ 10% и SDC ~ 8%, между растворами I-МУНТ 5% и SDC ~ ~ 9%. Такое же значение (~9%) имеет разница между растворами МУНТ и SDC.
В ходе сравнения растворов функционализированных МУНТ между собой наблюдается незначительное возрастание токсичности при увеличении разницы в процентном содержании йода в МУНТ. Разница в выживаемости клеток между растворами I-МУНТ 5% и I-МУНТ 10% составила 1%, между растворами I-МУНТ 10% и I-МУНТ 15% – 1%, между растворами I-МУНТ 10% и I-МУНТ 15% – 2%.
Сравнение влияния йода в концентрациях, используемых для модификации МУНТ и I-МУНТ, показало, что цитотоксическое действие чистого йода было гораздо выше, чем действие МУНТ, содержащих йод в тех же количествах (рис. 7). Показатель выживаемости клеток линейно снижался с 72% при 0.00005 г/л до 69% при 0.015 г/л. В то время как для I-МУНТ минимальная выживаемость клеток составила 74% при максимальной концентрации I-МУНТ 15%, что на 5% выше, чем при воздействии йода без МУНТ. Самый высокий показатель выживаемости среди экспериментальных групп I-МУНТ отмечен в варианте с самой низкой концентрацией (0.0001 г/л) I-МУНТ 5% в растворе – ~78%, т.е. на 6% выше, чем в случае с раствором, содержащим соответствующую концентрацию чистого йода.
Отмечена более высокая токсичность растворов йода по отношению к клеткам MCF-7 по сравнению с растворами МУНТ, содержащими те же концентрации йода. Данные результаты могут свидетельствовать о связывании нанотрубками ионов йода, что снижает их цитотоксическое действие.
ОБСУЖДЕНИЕ
Антибактериальные и цитотоксические эффекты МУНТ описаны достаточно подробно [16–19], при этом отмечается высокая чувствительность бактерий к этому типу наноматериалов [20, 21]. Одним из основных механизмов возникновения повреждающих эффектов углеродных наноматериалов считается окислительный стресс [22]. Однако работ, посвященных воздействию функционализированных галогенами углеродных нанотрубок на живые организмы или биомолекулы, крайне немного.
В исследовании [23] отмечается, что легирование углерода неметаллическими гетероатомами может изменить электронную структуру и электрохимические свойства исходных углеродных материалов, что является эффективным методом улучшения их каталитической активности. Были синтезированы легированные фтором углеродные нанотрубки (F-УНТ), которые проявили повышенную каталитическую активность в ходе гетерогенного каталитического озонирования для разложения органических загрязнителей. Эффективность удаления щавелевой кислоты с помощью F-УНТ была примерно в 2 раза выше, чем у чистых УНТ, а также превышала эффективность четырех традиционных катализаторов на основе металлов (ZnO, Al2O3, Fe2O3 и MnO2). Исследования с помощью методов рентгеновской фотоэлектронной спектроскопии и КРС подтвердили, что в УНТ происходит образование ковалентных связей C–F и sp2-гибридизация атомов углерода меняется на sp3, что не только приводит к высокой плотности положительного заряда атомов C, соседних с атомами F, но и сохраняет неповрежденной делокализованную π-систему углеродной структуры F-УНТ, которая способствует превращению молекул озона (O3) в активные формы кислорода (АФК) и высокой эффективности разложения щавелевой кислоты. Кроме того, исследования электронно-спинового резонанса показали, что доминирующими АФК, ответственными за разложение щавелевой кислоты в этих каталитических системах, являются супероксидные радикалы (O2–) и синглетный кислород (1O2). Как известно, окислительный стресс является одним из ключевых механизмов токсичности углеродных наноматериалов. Например, в [24] показано снижение жизнеспособности клеток опухоли легких человека A549 по причине развития апоптоза и оксидативного стресса под влиянием МУНТ. Было установлено, что МУНТ способствовали образованию АФК и малонового диальдегида, а также уменьшению активности каталазы и глютатиона.
Легированные фтором углеродные нанотрубки использовались и в [25], где катализатор состава F-УНТ использовался при изготовлении газодиффузионного электрода для электрохимического получения пероксида водорода. Было обнаружено, что легирование F активизирует восстановление кислорода и увеличивает выход H2O2. Нанотрубки, содержащие 0.6 M HF (F-УНТ-0.6), обеспечивали более высокий выход H2O2 (47.6 мг/л) и выход по току (89.5%), чем у чистых УНТ (29.6 мг/л и 70.1%) при напряжении смещения –1.3 В и pH 7. Установлено, что высокая каталитическая активность F-УНТ-0.6 может сохраняться в пяти последовательных реакционных циклах. Характеристики материала и электрохимические испытания показали, что легирование F не оказало значительного влияния на площадь поверхности УНТ, но увеличило степень их дефектности. Также указано, что повышенная эффективность получения H2O2 может быть связана с образованием CF2 и CF3 на поверхности УНТ, легированных фтором.
Единичным исследованием, где описано воздействие функционализированных галогеном УНТ на живые клетки, стала работа [26], в которой был синтезирован композит МУНТ – со-легированные фтором и TiO2. Исследовалась антимикробная и фотокаталитическая активность полученных образцов. Установлено, что композиты обладали улучшенными абсорбционными свойствами в УФ-диапазоне по сравнению с чистым TiO2. Композиты F–TiO2–МУНТ показали значительную фотокаталитическую активность в генерации АФК, что нашло отражение в антибактериальных эффектах. Композиты действовали на S. aureus и P. aeruginosa как сильное антибактериальное средство, при этом зона подавления роста культуры S. aureus (22 мм) оказалась выше, чем у P. aeruginosa (18 мм).
Таким образом, с учетом перечисленных выше данных, а также принимая во внимание сообщения об изменении характера переноса электронов в ОУНТ при допировании их йодом [27, 28] и росте фотокаталитической активности МУНТ при модификации их сложными оксидами, содержащими йод [29], можно предположить, что наличие йода на поверхности МУНТ катализирует процессы окисления молекул воды и редукции растворенного в воде кислорода, что способствует образованию АФК, которые являются причиной окислительного стресса, повреждающего клетки. Данные о повышении гидрофильности УНТ при функционализации йодом [30] также могут свидетельствовать о потенциале повышения биодоступности/токсичности таких композитов.
ЗАКЛЮЧЕНИЕ
Получены композиты МУНТ с йодом и проведены тесты на бактериях E. coli и опухолевых клетках аденокарциномы молочной железы MCF-7.
В тесте на бактериях отмечено существенное увеличение противомикробной активности МУНТ при их модификации 15 и 10 мас. % йода – при концентрациях 0.1 и 0.01 г/л выживаемость бактерий составила менее 2%, в то время как для МУНТ без йода показатель составил 7 и 30% соответственно. Модификация МУНТ 5 мас. % йода также усилила антибактериальные свойства нанотрубок, но менее существенно. На клетки MCF-7 наибольшее цитотоксическое действие оказали МУНТ, содержащие 15 и 10% йода. В отличие от бактерий разница показателей выживаемости клеток по сравнению с чистыми МУНТ была не более 3%. Различия в цитотоксичности между группами I-МУНТ были незначительными. Сравнение влияния йода в составе МУНТ и чистого йода показало, что для бактерий большей токсичностью обладали функционализированные МУНТ в концентрациях выше 0.001 г/л, тогда как для клеток растворы чистого йода обладали большей цитотоксичностью.
Предполагаемым механизмом противомикробного и цитотоксического действия композитов I-МУНТ является окислительный стресс, возникающий в результате образования АФК в водной среде на границе с поверхностью наноматериалов, при этом йод, вероятно, служит дополнительным катализатором этого процесса.
Важным выводом проведенной работы является то, что, варьируя количество йода на стадии синтеза, можно управлять антибактериальными свойствами получаемых композитов I-МУНТ. Безусловно, механизмы отмеченных явлений требуют дальнейшего изучения.
Полученные результаты могут быть полезны при разработке нанотехнологических методов очистки воды от бактериальных загрязнений, а также в биомедицинских исследованиях.
Работа выполнена при финансовой поддержке ФГБОУ ВО “РЭУ им. Г.В. Плеханова”.
Список литературы
Global Carbon Nanotubes (CNT) Market by Type (Single Walled & Multi Walled), End-Use Industry (Electronics & Semiconductors, Chemical Materials & Polymers, Structural Composites, Energy & Storage, Medical), Method, and Region – Forecast to 2026. 2021. 232 p. (URL – https://www.researchandmarkets.com/reports/5328286/global-carbon-nanotubes-cnt-market-by-type)
Deline A.R., Frank B.P., Smith C.L. et al. // Chem. Rev. 2020. V. 120. P. 11651. https://doi.org/10.1021/acs.chemrev.0c00351
Nayak T.R., Jian L., Phua L.C. et al. // ACS Nano. 2010. V. 4. P. 7717. https://doi.org/10.1021/nn102738c
Liu D., Yi C., Zhang D. et al. // ACS Nano. 2010. V. 4. P. 2185. https://doi.org/10.1021/nn901479w
Chowdhry A., Kaur J., Khatri M. et al. // Heliyon. 2019. V. 5. P. e02605. doi.org/https://doi.org/10.1016/j.heliyon.2019.e02605
Jiang T., Amadei C.A., Gou N. et al. // Environ. Sci.: Nano. 2020. V. 7. P. 1348. https://doi.org/10.1039/D0EN00230E
Mrakovcic M., Meindl C., Leitinger G. et al. // Toxicol. Sci. 2015. V. 144. P. 114. https://doi.org/10.1093/toxsci/kfu260
Gutiérrez-Praena D., Pichardo S., Sánchez E. et al. // Toxicol. In Vitro. 2011. V. 25. P. 1883https://doi.org/10.1016/j.tiv.2011.05.027
Zhao Y., Wei J., Vajtai R. et al. // Sci. Rep. 2011. V. 1. P. 83. https://doi.org/10.1038/srep00083
Janas D., Herman A.P., Boncel S. et al. // Carbon. 2014. V. 73. P. 225. https://doi.org/10.1016/j.carbon.2014.02.058
Mogil'naia O.A., Puzyr A.P., Bondar V.S. // Prikl. Biokhim. Mikrobiol. 2010. V. 46. P. 40.
Zarubina A.P., Lukashev E.P., Deev L.I. et al. // Nanotechnologies in Russia. 2009. V. 4. P. 871. https://doi.org/10.1134/S1995078009110159
Zakharova O.V., Godymchuk A.Y., Gusev A.A. et al. // Biomed. Res. Int. 2015. V. 2015. 412530. https://doi.org/10.1155/2015/412530
Ciapetti G., Cenni E., Pratelli L. et al. // Biomaterials. 1993. V. 14. P. 359. https://doi.org/10.1016/0142-9612(93)90055-7
Szymonowicz M., Korczynski M., Dobrzyński M. et al. // Materials. 2017. V. 10. P. 590. https://doi.org/10.3390/ma10060590
Chen M., Sun Y., Liang J. et al. // Environ. Int. 2019. V. 126. P. 690. https://doi.org/10.1016/j.envint.2019.02.005
De Maio F., Palmieri V., De Spirito M. et al. // Expert Rev. Med. Devices. 2019. V. 16. P. 863. https://doi.org/10.1080/17434440.2019.1671820
Wu Z.L., Zhao J., Xu R. // Int. J. Nanomed. 2020. V. 15. P. 9587. https://doi.org/10.2147/ijn.s279652
Riley P.R., Narayan R.J. // Curr. Opin. Biomed. Eng. 2021. V. 17. P. 100262. https://doi.org/10.1016/j.cobme.2021.100262
Maas M. // Materials (Basel). 2016. V. 9. P. 617. https://doi.org/10.3390/ma9080617
Mocan T., Matea C.T., Pop T. et al. // Cell. Mol. Life Sci. 2017. V. 74. P. 3467. https://doi.org/10.1007/s00018-017-2532-y
Johnston H.J., Hutchison G.R., Christensen F.M. et al. // Nanotoxicology. 2010. V. 4. P. 207. https://doi.org/10.3109/17435390903569639
Wang J., Chen S., Quan X. et al. // Chemosphere. 2018. V. 190. P. 135. https://doi.org/10.1016/j.chemosphere.2017.09.119
Srivastava R.K., Pant A.B., Kashyap M.P. et al. // Nanotoxicology. 2011. V. 5. P. 195. https://doi.org/10.3109/17435390.2010.503944
Wang W., Lu X., Su P. et al. // Chemosphere. 2020. V. 259. P. 127423. https://doi.org/10.1016/j.chemosphere.2020.127423
Sangari M., Umadevi M., Mayandi J. et al. // Spectrochim. Acta A. 2015. V. 139. P. 290. https://doi.org/10.1016/j.saa.2014.12.061
Zhao Y., Wei J., Vajtai R. et al. // Sci. Rep. 2011. V. 1. P. 83. https://doi.org/10.1038/srep00083
Park T., Sim K., Lee J. et al. // J. Nanosci. Nanotechnol. 2012. V. 12. P. 5812. https://doi.org/10.1166/jnn.2012.6338
Li S., Hu S., Xu K. et al. // Nanomaterials. 2017. V. 7. P. 22. https://doi.org/10.3390/nano7010022
Song H., Ishii Y., Al-zubaidi A. et al. // Phys. Chem. Chem. Phys. 2013. V. 15. P. 5767. https://doi.org/10.1039/C3CP50506E
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии