Российские нанотехнологии, 2022, T. 17, № 2, стр. 216-224
Инактивация вирусов гриппа гетерополикислотами
Ф. И. Далидчик 1, Е. М. Балашов 1, *, О. В. Бакланова 2, Е. А. Гущина 2, Н. М. Ивашкевич 3, Е. И. Исаева 2, С. А. Ковалевский 1, А. И. Кулак 3, О. А. Лопатина 2, И. Т. Федякина 2, М. В. Мезенцева 2
1 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
Москва, Россия
2 Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи,
Минздрава России
Москва, Россия
3 Институт общей и неорганической химии НАН Беларуси
Минск, Беларусь
* E-mail: embalashov@yandex.ru
Поступила в редакцию 02.04.2021
После доработки 15.07.2021
Принята к публикации 20.07.2021
Аннотация
Изучено противовирусное действие гетерополикислот (ГПК) Кеггина в отношении вируса гриппа человека А/Калифорния/07/09 (H1N1) pdm09 в культуре клеток MDCK. Методом просвечивающей электронной микроскопии выявлены новые особенности разрушения вирусных частиц ГПК. Предложена протонно-анионная модель, учитывающая основные биохимические процессы, ведущие к разрушению оболочечных вирусов – истощение мембранного холестерина анионами ГПК, закисление матриксного белка М1 протонами среды и анионный лизис липидных мембран. Предсказаны аррениусовские зависимости биологических свойств ГПК от температуры. Описан общий механизм формирования высокой биологической активности ГПК, основу которого составляет новый для биохимии полиоксометаллатов эффект – анионное истощение холестерина в билипидных мембранах.
ВВЕДЕНИЕ
Грипп и другие вирусные инфекции угрожают здоровью людей. Эта угроза остро проявляется пандемией COVID-19. Высказываются опасения, что подавление этой инфекции будет затруднено синергетическим взаимодействием вирусов SARS-CoV-2 и сезонных гриппов [1, 2].
В связи с мутациями вирусов мир постоянно пребывает в опасности обнуления возможностей всех существующих в данный момент противовирусных средств, что заставляет вести фундаментальные исследования, нацеленные на выяснение молекулярной природы биологической активности противовирусных препаратов и создание на этой основе быстро модифицируемых вакцин и лекарств. Одно из современных направлений этих работ предполагает применение полиоксометаллатов (ПОМ) [3–6].
Давно известные как эффективные катализаторы ПОМ интенсивно изучаются сегодня как новые перспективные наноматериалы, область возможных применений которых простирается от нанофизики и нанохимии до нанобиологии и наномедицины [7–10]. В последнее десятилетие биологические свойства ПОМ (противовирусные, антибактериальные и противораковые [3–6]) были дополнены примерами создания на их основе новых препаратов, перспективных для лечения болезни Альцгеймера, гепатита, астмы, ряда новых опасных вирусных инфекций [10–12]. Противовирусная активность гетерополикислот (ГПК) Кеггина установлена для многих оболочечных вирусов [3–6, 10–20], в том числе для коронавирусов SARS-CoV-1 и MERS-CoV – генетических предшественников вируса SARS-Cov-2 [21, 22]. О первых положительных результатах тестирования ГПК как эффективных инактиваторов вируса SARS-Cov-2 сообщалось в [23].
Высокие терапевтические показатели обычно достигаются только при тщательном подборе ПОМ и соответствующих им биологических мишеней. Причины высокой избирательности ПОМ, которая препятствует созданию лечебных средств широкого спектра, как и сама природа общей высокой биологической активности ПОМ, остаются неизвестными.
Цель настоящей работы – на примере вируса гриппа человека A(Н1N1) (California/07/09 H1N1) выявить основные особенности концентрационных зависимостей биологической активности ГПК и сформулировать молекулярную биохимическую модель, достаточную для описания инактивации вирусов гриппа ПОМ – соединениями при средних и высоких концентрациях.
Согласно предлагаемой модели процессы разрушения клеточных мембран (КМ) и вирусных оболочек гетерополикислотами начинаются с истощения многозарядными анионами мембранного холестерина, ведущего к образованию в мембранах сквозных отверстий – нанопор, играющих роль дополнительных (липидных) ионных каналов. В зависимости от концентрации ГПК, липидного состава мембран, температуры и кислотности среды эти нанодефекты могут либо затекать, либо, увеличиваясь в размерах, приводить к разрушению (в отдельных случаях к коллапсу) билипидных мембран (БЛМ). Процессами деструкции и гибели клеток под воздействием ГПК определяется токсичность этих соединений. У вирусных частиц (ВЧ) разрушению мембран предшествуют процессы закисления (деструкции) протонами среды матриксного белка М1. Деструкция этого белка запускает два новых процесса, ведущих к инактивации ВЧ. Один связан с удалением поверхностных гликопротеинов, дистальные концы которых в нативных ВЧ заякорены в белке М1. Второй процесс – потеря матриксным белком его функционально важных свойств. При достаточно высоких концентрациях ГПК одновременно с разрушением белка М1 могут быть эффективными процессы анионного травления краев липидных ионных каналов. Эти процессы быстро превращают нанопоры в сквозные микроотверстия, через которые вытекают растворенные протонами белки. Травление сквозных дефектов БЛМ в отдельных случаях приводит к лизису этих структур. Протонно-анионная модель дает простое объяснение имеющимся экспериментальным данным по разрушению вирусных частиц ГПК, предсказывает температурные (аррениусовские) зависимости биологических свойств ГПК и раскрывает природу общей высокой биологической активности ПОМ, связывая ее с новым для биохимии ПОМ эффектом – истощением (до 50%) многозарядными анионами мембранного холестерина [24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Гетерополикислоты. Использовали ванадийсодержащие ГПК Кеггина: Н4PMo11VO40, Н5PMo10V2O40 и Н4PW11VO40, синтезированные в Институте общей и неорганической химии БАН, Минск11.
Вирусы. Противовирусные свойства выбранных ГПК исследовали на примере пандемического вируса A/California/07/09, который был получен из Государственной коллекции вирусов при ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи” Минздрава России. Вирус культивировали в аллантоисной полости 9- и 10-дневных куриных эмбрионов (48 ч, 37°С). Инфекционную (ИА) и гемагглютинирующую активности (ГА) вирусов определяли методами, рекомендованными ВОЗ [25].
Культуры клеток. Использовали клетки почки собаки (MDCK) из коллекции клеточных культур при ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи” Минздрава России. Культивирование клеток осуществляли на среде Игла MEM с двойным набором аминокислот, 5% фетальной бычьей сыворотки крови (HyClone, США), 10 мМ глутамина и 4%-ным гентамицином.
Методы
Определение цитотоксического действия ГПК в культуре клеток MDCK. Клетки МDCK вносили в 96-луночные планшеты в концентрации 10 000 кл/лунку в среде Игла МЕМ (ИПВЭ РАМН) с добавлением 5% фетальной бычьей сыворотки (HyClone), 10 мМ глутамина и антибиотиков и культивировали в течение 72 ч. Затем после двукратной промывки культуры клеток бессывороточной средой Игла МЕМ в лунки вносили предварительно подготовленные на поддерживающей среде водные растворы ГПК, начиная с разведения 1 : 10 до разведения 1 : 5120. Каждое разведение тестировали в четырех параллельных лунках. Далее клетки инкубировали с тестируемыми веществами в течение 72 ч в CO2-инкубаторе при температуре 37°С, после чего удаляли культуральную среду и в каждую лунку добавляли по 100 мкл поддерживающей среды и по 20 мкл раствора MTS (Promega, № G3581). После инкубации в течение 3 ч при 37°С определяли оптическую плотность при длине волны 492 нм и референсной длине волны 620 нм при помощи планшетного спектрофотометра BIO-RAD. Концентрация тестируемого вещества, уменьшающая значение оптической плотности на 50% по сравнению с контролем клеток, принималась за 50%-ную цитоптоксическую дозу (СС50).
Противовирусную активность тестируемых веществ учитывали по снижению инфекционного титра вируса гриппа в клетках MDCK по цитопатическому действию (ЦПД) и в реакции гемагглютинации (РГА).
Предварительно культуру клеток MDCK подготавливали так же, как и в опытах по определению цитотоксического действия ГПК. Перед заражением вирусом клетки MDCK 2 раза промывали бессывороточной средой Игла МЕМ и добавляли изучаемые вещества в необходимой концентрации в 100 мкл поддерживающей среды и инкубировали 1 ч при температуре 37°С. Затем добавляли по 100 мкл предварительно приготовленных 10-кратных разведений вируса в среде Игла МЕМ с добавлением трипсина (TPCK treated, Sigma) в концентрации 2 мкг/мл и инкубировали 72 ч в СО2-инкубаторе при 37°С. Контроли вирусов и клеток культивировали в той же среде. Учет результатов проводили по ЦПД и в РГА. Гемагглютинирующую активность вирусов определяли по РГА, следуя общепринятой методике с 0.5%-ными эритроцитами кур. pH среды после добавления ГПК (100 мкМ) составляла 6.5.
Вирулицидную активность ГПК определяли по результатам их непосредственного воздействия на ВЧ гриппа A/Калифорния/07/09(H1N1) pdm09. Для этого к 0.5 мл раствора тестируемых ГПК различных концентраций (от 25 до 250 мкМ) вносили вирусную суспензию в рабочем разведении 0.1 ТСID50. В контрольную пробирку к 0.5 мл вирусной суспензии добавляли 0.5 мл среды Игла MEM. Все приготовленные смеси инкубировали при температуре 26°С в течение 1 ч. Затем определяли гемагглютинирующий титр каждого образца в РГА. Через 72 ч определяли инфекционный титр вируса в культуре клеток MDCK в контрольном и опытных образцах.
Электронная микроскопия (ЭМ) клеток и вирусов. Влияние ГПК на структуру вируса гриппа A/California/07/09(Н1N1) pdm09 в культуре клеток MDCK исследовали методом ультратонких срезов. Клетки MDCK культивировали в 24-луночных планшетах, используя поддерживающую среду Игла МЕМ с двойным набором аминокислот. После образования монослоя клеток вносили 100 мкл среды с ГПК. Через 2 ч инкубирования при температуре 37°С монослой клеток инфицировали вирусом гриппа A/California/07/09(Н1N1) pdm09 в дозе 0.1 ТСID 50/кл. Клетки культивировали в условиях СО2-термостата при 37°С в течение 24 ч, затем центрифугировали, и полученный осадок фиксировали в 2.5%-ном растворе глютаральдегидана в 0.15 М фосфатном буфере. Осадок клеток отмывали фосфатным буфером, вторично фиксировали 1%-ным водным раствором ОsO4, последовательно обезвоживали в серии спиртов и дегидрировали пропиленоксидом. Пропитку и заливку осадка проводили в смесях ЭРОN. Ультратонкие срезы получали на ультратоме LКВ Broma, которые контрастировали 5%-ным раствором урацилацетата и цитратом свинца.
Исследование влияния ГПК на морфологию вирионов гриппа проводили методом негативного контрастирования. Содержащую вирусы гриппа A/California/07/09 суспензию в концентрации 5.5 lgTCID50/мл смешивали в соотношении 1 : 1 с водными растворами ГПК. Концентрация ГПК составляла 100 мкМ. Смесь инкубировали 1 ч при температуре 25°С. Суспензию ВЧ, обработанную образцами ГПК, наносили на гальваническую сетку с формваровой подложкой, высушивали в течение 30 мин и контрастировали 1%-ным водным раствором уранилацетата. Образцы изучали в трансмиссионном электронном микроскопе JEOL 100XC.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Токсическое и противовирусное действие исследуемых ГПК характеризуют результаты, представленные на рис. 1–5 и в табл. 1, 2.
Рис. 1.
Противовирусная активность ГПК в отношении вируса А/California/07/09 (H1N1)pdm09, репродуцируемого в культуре клеток MDCK.
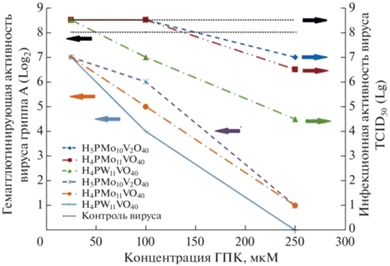
Рис. 2.
Пример почкующихся (овальных) и отпочковавшихся (сферических) ВЧ вблизи поверхности неповрежденной клетки MDCK, зараженной вирусом гриппа человека A/California/07/09(Н1N1) pdm09 (контрольное изображение).
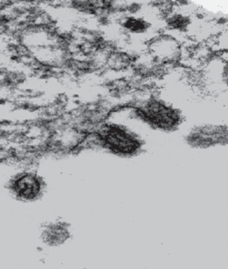
Рис. 3.
Скопление сферических ВЧ на краю разрыва плазматической мембраны клетки MDCK, зараженной вирусом гриппа A/California/07/09 (Н1N1) pdm09 (Н4PMo10VO40, 100 мкМ, 1 ч). Рамкой выделен участок, увеличенное изображение которого приведено на рис. 4.

Рис. 4.
Сферические ВЧ с дефектами различных типов (начальный этап разрушения): 1 – интактная частица, 2 – частица с небольшим участком утраченных пепломеров, 3 – частица с фрагментарно разрушенным капсидом и сохранившимся участком пепломеров, 4 – частица с полностью разрушенной пепломерной структурой, 5 – частица с сильно разрушенной вирусной оболочкой и вытекающими белками.

Рис. 5.
Пример фрагментов ВЧ со сквозными микроотверстиями в оболочках и с разрушенными белками, иллюстрирующий малочисленность этих дефектов на одной оболочке и повышение противовирусной активности ГПК при повышении заряда аниона, описанного в [29] (A/California/07/09 (Н1N1) pdm09, H5PMo10V2O40, 100 мкМ).

Таблица 1.
Цитотоксическое действие ГПК на клетки MDCK
| ГПК | Цитотоксичность (СС50), мкМ, время инкубации 72 ч |
|---|---|
| Н5PMo10V2O40 | 25 |
| Н4PМо11VO40 | 25 |
| Н4PW11VO40 | 31 |
Таблица 2.
Противовирусная активность ГПК в отношении вируса A/California/07/09 (H1N1) pdm09 в культуре клеток MDCK
| ГПК | Концентрация ГПК, мкМ | ИА вируса (ТСID50 Lg) |
|---|---|---|
| Н5PMo10V2O40 | 25 | 9.5 |
| 12.5 | 10.0 | |
| Н4PМо11VO40 | 25 | 9.0 |
| 12.5 | 10.0 | |
| Н4PW11VO40 | 25 | 7.0 |
| 12.5 | 10.0 | |
| Контроль | 0 | 10.0 |
Анализируя приведенные в табл. 2 и на рис. 1 концентрационные зависимости противовирусной активности тестируемых ГПК, можно заметить две особенности. Первая – это отсутствие противовирусного действия всех ГПК при предварительной инкубации клеток в питательных средах с низким содержанием кислот (12.5 мкМ). Снижение ИА, зависящее от элементного состава ГПК, становится достаточно большим (0.5–3.0 ТСID50 Lg) только при концентрациях порядка СС50. Причина этого снижения может быть связана либо с первичным действием ГПК на клетки (до их заражения), либо с последующим действием ГПК одновременно и на клетки, и на вирусы. Ответ нетрудно получить, если учесть результаты тестирования вирулицидной активности ГПК, приведенные на рис. 1. Согласно этим результатам в случае прямого воздействия ГПК на вирусные частицы снижение ИА становится существенным только при концентрациях, превышающих 25 мкМ. Следовательно, снижение ИА, которое при концентрации 25 мкМ наблюдается в условиях репликации вирусов в клеточной культуре (табл. 2), связано с действием ГПК только на клетки.
На рис. 2 можно заметить вторую интересную особенность концентрационных зависимостей ГА и ИА вирусов, измерявшихся после прямого воздействия на вирусы различных ГПК. При малых концентрациях здесь регулярно наблюдаются достаточно большие изменения ГА (двукратное снижение), но изменения ИА отсутствуют.
Морфологические и структурные характеристики клеток и вирусов до и после воздействий на них ГПК
Примеры ЭМ-изображений, демонстрирующие морфологические и структурные особенности клеток MDCK и ВЧ гриппа A/California/07/09(Н1N1) pdm09 до и после воздействия на них ГПК, приведены на рис. 2–5. Анализ этих (и многих других в целом подобных) снимков приводит к выводу, что разрушение КМ, т.е. процесс в данном случае определяет токсические свойства ГПК (табл. 1), становится существенным при концентрациях, при которых оболочки вирусов могут находиться еще на ранних стадиях разрушения. Анализируя изображения ВЧ, приведенные на рис. 5, можно заметить интересную особенность поверхностных дефектов типа сквозных микроотверстий (отверстий, хорошо различимых на ЭМ-снимках) – такие дефекты всегда малочисленны. На каждой оболочке их не более двух–трех. Видимо, это общая особенность сквозных микроотверстий, которые могут образовываться в БЛМ под воздействием ГПК22.
Вопрос о механизмах появления и эволюции сквозных отверстий в БЛМ представляет значительный интерес, ему посвящено большое количество публикаций (например, [23–25]). Ниже будет предложена элементарная модель ускоренного ГПК-стимулированного превращения нанопор БЛМ в одиночные микроотверстия, изображения которых помимо приведенных на рис. 5 отчетливо видны на рис. 2 работы [22] и на рис. 8 работы [26].
ОБСУЖДЕНИЕ
Молекулярные механизмы деструкции БЛМ гетерополикислотами
При комнатных температурах первичные взаимодействия ГПК с вирусами и клетками можно рассматривать как акты неупругого трехэтапного отражения многозарядных анионов от соответствующих БЛМ [5, 26, 27]. Согласно этим представлениям на первом этапе происходит образование колебательно возбужденного поверхностного липидо-анионного комплекса (ЛАК), который после релаксации распадается. Мембрану при распаде покидает новый комплекс, в состав которого могут входить различные мембранные липиды. Вероятность удаления из мембраны вторичных комплексов определенного липидного состава Wif зависит от температуры Т и потенциальных барьеров Vif, разделяющих области свободного движения удаляемого (f-го) комплекса и области локализации его составляющих в распадающемся (i-м) комплексе:
где k – постоянная Больцмана.Значения барьеров Vif, т.е. энергий активации распадов по определенным каналам тем больше, чем больше энергия связи этого комплекса в БЛМ. Отсюда следует принципиально важный вывод об истощении ГПК слабосвязанных липидов биологических мембран. К таким липидам можно отнести холестерин (в случае бездефектных мембран), а также молекулы липидов, формирующих края сквозных поверхностных дефектов от нанопор, о появлении которых можно судить только по косвенным признакам, например по повышению проницаемости мембран, до микроотверстий, доступных наблюдению методами ЭМ.
Обсудим следствия этого вывода, начав с эффекта истощения холестерина, который был обнаружен в [24] методом времяпролетной масс-спектрометрии вторичных ионов при изучении процессов разрушения клеток фибробласт эмбриона человека растворами кремний-молибденовой кислоты (H4SiMo12O40, 10–100 мкМ, 300°С, 48 ч).
Холестерин – жизненно важный липид, играющий роль ключевого регулятора всех основных биологических свойств клеточных и вирусных мембран [28–31], включая биомеханические, такие как текучесть и проницаемость, которые возрастают при истощении холестерина [32, 33]. Клеточный холестерин, синтезирующийся в эндоплазматическом ретикулуме, содержится преимущественно в плазматической мембране, точнее, в “рафтах” – в плотных, прочных, утолщенных, структурно хорошо организованных поверхностных кластерах, обогащенных холестерином и содержащих закрепленные, необходимые для жизнедеятельности клеток белки [34–37]. Рафты участвуют во многих клеточных и вирусных процессах, играя во всех случаях определяющую роль. При истощении холестерина (обычно с этой целью применяется метил-β-циклодекстрин, MβЦД [38, 39]) рафты, теряя молекулы связующего липида, разрушаются [40]. Последствия такого разрушения, биологические и медицинские, сегодня хорошо известны (например, обзоры [41, 42]).
В рафтах содержатся белки, некоторые из них выполняют роль рецепторов, необходимых для адсорбции ВЧ перед этапом их внедрения в клетку. На рафтах происходит сборка и отпочкование вторичных (репликационных) ВЧ [43, 44], поэтому мембраны вирусов также существенно обогащены холестерином, который вовлекается почти во все биохимические процессы, идущие на различных этапах жизненного цикла. Как следствие, снижение холестерина (независимо от причин) в вирусных мембранах также сопровождается адекватным снижением инфекционной активности ВЧ.
Снижение холестерина в вирусных мембранах и соответствующее снижение ИА оболочечных вирусов под воздействием органических модуляторов (в основном MβЦД) исследовались ранее во многих работах (например, [44–50]). Для ГПК роль истощения холестерина в подавлении ИА вирусов гриппа впервые демонстрируют экспериментальные результаты, представленные выше33. Анализ этих результатов приводит к построению физически прозрачной модели разрушения КМ и ВЧ новыми – гетерополикислотными – модуляторами холестерина.
Пороговый эффект при подавлении ИА в культуре клеток
Рассмотрим, например, пороговый эффект, который демонстрирует результаты, приведенные в табл. 2. Отсутствие снижения ИА при концентрации 12.5 мкМ, не связанное с воздействием анионов непосредственно на вирусы, можно рассматривать как указание на отсутствие снижения холестерина в клеточных рафтах. Это возможно при достаточно низких концентрациях ГПК, когда потери рафтового холестерина по анионному механизму могут быть скомпенсированы процессами его внутриклеточного восстановления. При более высоких концентрациях (но все еще в условиях отсутствия прямого воздействия ГПК на вирусы, как это имеет место при концентрации ГПК 25 мкМ), когда процессы истощения холестерина в клеточных рафтах превалируют над процессами его восстановления, рафты частично разрушаются, что проявляется снижением ИА, зависящим от элементного состава аниона. Эту зависимость, по-видимому, можно отнести к зависимости скорости истощения клеточного холестерина от элементного состава ГПК.
Ясно, что при достаточно высоких концентрациях ГПК одновременно с разрушением рафтов могут идти процессы деструкции КМ. Стартуя с актов зарождения малых дефектов (видимо, с “нанопор”) и ускоряясь (см. ниже), эти процессы быстро приводят к разрушению (в отдельных случаях к разрывам) КМ и, соответственно, гибели клеток, определяющей значения СС50. Избирательный характер истощения краевых липидов в этих процессах проявляется зависимостями цитотоксичности ГПК от элементного состава их анионов. Пример разрыва КМ, на краю которого адсорбированы частично разрушенные ВЧ, приведен на рис. 3.
Протонно-анионная модель инактивации оболочечных вирусов
Обсудим механизмы разрушения ВЧ. О них можно судить, анализируя ЭМ-изображения ВЧ, приведенные на рис. 2–5, и привлекая информацию, представленную в табл. 1–3 и на рис. 1. Прежде всего отметим, что при концентрациях порядка СС50 и выше в определенной степени разрушенными могут быть все составляющие ВЧ, липидные и белковые, внешние (пепломеры) и внутренние. Примеры полного или частичного разрушения пепломеров отчетливо видны на ЭМ-снимках. О разрушении матриксного белка М1, который в нативном состоянии удерживает дистальные участки трансмембранных гликопротеинов и придает вирусной оболочке свойства прочности и жесткости, можно судить по ряду внешних признаков. Например, по появлению частиц неправильной (несферической) формы, частиц с поверхностными вмятинами и малочисленных микроотверстий (или разрывами) с признаками вытекающих белков. Образование любого из этих дефектов в определенной степени снижает ИА вирусов. Масштабы снижения ИА, как это следует из результатов экспериментов (рис. 1, табл. 2), существенно зависят от концентрации ГПК и от химического состава их анионов.
Рассмотрим более подробно молекулярные механизмы образования различных дефектов ВЧ, начав с процесса анионного истощения мембранного холестерина. Заметим, что согласно формуле (1) скорости этого истощения зависят от температуры экспоненциально. Подобные зависимости можно ожидать для биологических свойств ГПК, если последние формируются вторичными процессами, скорости которых лимитируются актами истощения холестерина.
Коэффициент снижения (КС) ГА определен в табл. 3 соотношением: КС/ГА = (1 – – ГА(С)/ГА(0)) × 100%, где ГА(С) – ГА вирусов после воздействия раствора ГПК заданной концентрации С. ГА(0) – значение ГА без применения ГПК. Коэффициент ингибирования (КИ) инфекционной активности (КИ/ИА) определяется таким же выражением с заменой ГА на ИА, lg.
В роли вторичных процессов, снижающих ИА вирусов, могут выступать процессы разрушения и перестройки поверхностных белков (трансмембранных гликопротеинов), протонных каналов (белки М2) и матриксных белков М1. Опишем механизмы этих процессов, ориентируясь на результаты титрования и ЭМ-исследований. Учитывая данные табл. 3, выделим два этапа подавления инфекционной активности ВЧ. Первый соответствует малым концентрациям ГПК, при которых наблюдается снижение титра ГА, но титр ИА остается без изменений. Второй этап соответствует более высоким концентрациям ГПК. Здесь наблюдается симбатное анион-зависящее снижение обоих титров, причем по мере роста концентрации снижение титров ИА все в большей степени опережает снижение титров ГА. Эти особенности коррелирующих титров ГА и ИА можно объяснить, если учесть, что начальное истощение холестерина в вирусных мембранах повышает их текучести [32, 33], при этом, очевидно, снижается прочность фиксации проксимальных участков трансмембранных гликопротеинов. Как следствие, становится возможным нарушение нативной организации системы шипов, что может проявиться наблюдаемым на опыте снижением адсорбционной способности ВЧ на эритроцитах. Однако в целом строение и свойства гликопротеинов, а также структура белка М1, в котором заякорены шипы, при повышении текучести вирусной мембраны могут оставаться неизменными. ИА частиц при этом также может оставаться без изменений. Для удаления шипов, т.е. для уменьшения ИА, которое наблюдается при более высоких концентрациях, необходимо разрушение (растворение [51]) белка М1. Это возможно под воздействием протонов среды, проникающих сквозь вирусную оболочку по трансмембранным протонным каналам, белковым, М2, и/или липидным. Протонные каналы М2 открываются лишь в кислых средах, когда рН < 5 [51]. В проводившихся экспериментах кислотности среды были заметно ниже (рН ≈ 6.5), т.е. проникновение протонов сквозь вирусную мембрану скорее всего осуществлялось по липидным каналам44.
Возможность образования мембранных нанопор (липидных ионных каналов) при истощении вирусного холестерина ранее, видимо, не обсуждалась. Эта гипотеза – один из выводов настоящей работы, достоверность которого подтверждают результаты ЭМ-исследований, приведенные на рис. 3, 4, а также на рис. 8 в работе [26]. Здесь хорошо видны отдельные микроотверстия, которые могли образоваться в процессах травления нанопор анионами. Опишем вероятный механизм образования таких микроотверстий. Выделим в нем два основных этапа. На первом в результате повышения текучести мембраны и, соответственно, возросшей вероятности крупномасштабных флуктуаций плотности появляется возможность стохастического образования множественных, но малых и нестабильных гидрофильных нанопор [53–55]. Последующее травление краев этих пор анионами ГПК осуществляется по механизму образования и распада краевых ЛАК. Поскольку в каждый момент времени вероятность образования краевого комплекса пропорциональна размеру существующего дефекта, L, кинетика разрушения БЛМ под воздействием анионов должна быть, очевидно, экспоненциальной:
где L – характерный размер сквозного отверстия, τ – время жизни краевого ЛАК, K – безразмерная постоянная, зависящая от строения краевого распадающегося ЛАК. Согласно (2) процессы превращения нанодефектов в микроотверстия носят характер быстрого растворения (коллапсов) БЛМ55. В рамках такой модели экспериментально наблюдаемая малочисленность видимых поверхностных дефектов есть следствие высокой скорости травления наноотверстий (малых значений времен τ/K по сравнению с характерными временами рождения нанопор).Отметим, что отрыв дистальных концов трансмембранных гликопротеинов от частично разрушенного (растворенного) матриксного белка М1 – важный, но не единственный процесс, ведущий к инактивации ВЧ. С учетом хорошо известной роли этого белка в жизненном цикле вируса [51] следует ожидать, что с ростом концентрации ГПК нарастающее разрушение М1, слабо снижая уже достаточно низкий уровень ГА, будет все в большей степени разрушать ВЧ, снижая, соответственно, значения ИА. Это и наблюдается в опыте (табл. 3).
Оценивая приведенные результаты изучения противовирусной активности ГПК в культуре клеток, нужно иметь в виду, что при достаточно высоких концентрациях (порядка или больше СС50) в случае оболочечных вирусов, мембраны которых формируются из плазмолитических мембран, содержащих большое количество холестерина (например, в случае гриппов А), деструкция ВЧ может быть маловероятной (по сравнению с деструкцией КМ). Для оболочечных вирусов, мембраны которых формируются из внутриклеточных, менее прочных мембран (содержащих малое количество холестерина), деструкция ВЧ должна быть преобладающей. Примерами таких ВЧ могут быть вирусы гепатита С [10, 11], лихорадки Зика [12] и многочисленные коронавирусы, в том числе пандемические вирусы SARS-CoV-1, MERS-CoV и SARS-CoV-2 [21, 22].
ЗАКЛЮЧЕНИЕ
Отметим значение сделанного в работе вывода о разрушении многозарядными анионами ГПК холестериновых рафтов. Учитывая важную, часто определяющую роль этих поверхностных структур во многих клеточных и вирусных процессах [34–37], можно предположить, что истощение холестерина в рафтах является одной из основных причин общей высокой биологической активности ГПК и ПОМ.
Отметим также возможное значение липидных ионных каналов в процессах инактивации коронавирусов [56]. Поскольку повышение текучести мембран и соответствующий рост вероятности спонтанного рождения нанопор возможны не только при истощении холестерина, но и при повышении температуры, следует ожидать, что для вируса SARS-CoV-2 образование ионных липидных каналов будет проявляться выраженным кислотным эффектом – ускоренной гибелью вирусов в узком диапазоне температур (вблизи основного фазового перехода, Т0 ≈ 30°С [57]) в средах с достаточно малыми значениями рН.
Работа выполнена в рамках государственного задания по теме “Фундаментальные основы создания наноструктурированных систем нового поколения с уникальными эксплуатационными электрическими и магнитными свойствами” № 0082-2018-0003 (регистрационный номер АААА-А18-118012390045-2) и при финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-54-00004 Бел_а) и Белорусского фонда фундаментальных исследований (договор № Х18Р-110).
Список литературы
Azekawa S., Namkoong H., Mitamura K. et al. // IDCases. 2020. V. 20. P. e00775 (1–3). https://doi.org/10.1016/j.idcr.2020.e00775
Stowe J., Tessier E., Zhao H. et al. // Preprint at medRxiv 2020. https://doi.org/10.1101/2020.09.18.20189647
Rhule J.T., Hill C.L., Judd D.A. et al. // Chem. Rev. 1998. V. 98. P. 327. https://doi.org/10.1021/cr960396q
Hasenknopf B. // Front. Biosci. 2005. V. 10. № 1. P. 275. https://doi.org/10.2741/1527
Bijelic A., Aureliano M., Rompel A. // Angew. Chem. Int. Ed. Engl. 2019. V. 58. № 10. P. 2980. https://doi.org/10.1002/anie.201803868
Yamase T. // J. Mater. Chem. 2005. V. 15. P. 4773. https://doi.org/10.1039/B504585A
Далидчик Ф.И., Балашов Е.М., Буданов Б.А. и др. // Хим. физика. 2010. Т. 29. № 11. С. 21.
Pope M.T. // Encyclopedia of Inorganic and Bioinorganic Chemistry, 1st ed. / Ed. Scott R.A. Somerset; NJ; USA: John Wiley and Sons, Inc. 2011. 208 p.
Long D.L., Tsunashima R., Cronin L. // Angew. Chem. Int. Ed. 2010. V. 49. P. 1736. https://doi.org/10.1002/anie.200902483
Pope M.T., Sadakane M., Kortz U. // Eur. J. Inorg. Chem. 2019. V. 3–4. P. 340. https://doi.org/10.1002/ejic.201801543
Qi Y., Han L., Qi Y. et al. // Antivir. Res. 2020. V. 179. P. 104813. https://doi.org/10.1016/j.antiviral.2020.104813
Francese R., Civra A., Ritta M. et al. // Antivir. Res. 2019. V. 163. P. 29. https://doi.org/10.1016/j.antiviral.2019.01.005
Лопатина О.А., Суетина И.А., Мезенцева М.В. и др. // Хим. физика. 2020. Т. 39. № 1. С. 52.
Shigeta S. // Drugs R D. 1999. V. 2 (3). P. 153. https://doi.org/10.2165/00126839-199902030-00001
Shigeta S. // Antivir. Chem. Chemother. 2001. V. 12. Suppl. 1. P. 179.
Shigeta S., Yamase T. // Antivir. Chem. Chemother. 2005. V. 16 (1). P. 23. https://doi.org/10.1177/095632020501600103
Shigeta S., Mori S., Watanabe J. et al. // Antivir. Chem. Chemother. 1996. V. 7 (6). P. 346.
Shigeta S., Mori S., Watanabe J. et al. // Antimicrob. Agents Chemother. 1997. V. 41 (7). P. 1423. https://doi.org/10.1128/AAC.41.7.1423
Shigeta S., Mori S., Yamase T. et al. // Biomed. Pharmacother. 2006. V. 60. P. 211. https://doi.org/10.1016/j.biopha.2006.03.009
Лопатина О.А., Исаева Е.И., Суетина И.А. и др. // Нанотехнологии: разработка, применение – XXI век. 2016. Т. 8. № 2. С. 14.
Chang F.-Y., Chen H.-C., Chen P.-J. et al. // J. Biomed. Sci. 2020. V. 27. P. 1. https://doi.org/10.1186/s12929-020-00663-w
Di Maria E., Latini A., Borgiani P., Novelli G. // Human Genomics. 2020. V. 14. P. 1. https://doi.org/10.1186/s40246-020-00280-6
Dan K., Fujinami K., Sumitomo H. // Appl. Sci. 2020. V. 10 (22). P. 8246. https://doi.org/10.3390/app10228246
Ковалевский С.А., Гулин А.А., Лопатина О.А. и др. // Российские нанотехнологии 2019. Т. 14. № 9–10. С. 77. https://doi.org/10.21517/1992-7223-2019-9-10-77-84
Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005. 832 с.
Kobayashi D., Ouchi Y., Sadakane M. et al. // Chem. Lett. 2017. V. 46. P. 533. https://doi.org/10.1246/cl.161172
Sakamoto A., Unoura K., Nabika H. // J. Phys. Chem. C. 2018. V. 122. P. 1404. https://doi.org/10.1021/acs.jpcc.7b11251
Maxfield F.R., van Meer G. // Curr. Opin. Cell Biol. 2010. V. 22. P. 422. https://doi.org/10.1016/j.ceb.2010.05.004
Chakraborty S., Doktorova M., Molugu T.R. et al. // PNAS. 2020. V. 202004807. P. 1. https://doi.org/10.1073/pnas.2004807117
De Oliveira Andrade L. // Biomed. Spectrosc. Imaging. 2016. V. 5. P. S101. https://doi.org/10.3233/bsi-160157
Heaton N.S., Randall G. // Trends Microbiol. 2011. V. 19 (7). P. 368. https://doi.org/10.1016/j.tim.2011.03.007
Cooper R.A. // J. Supramol. Struct. 1978. V. 8 (4). P. 413. https://doi.org/10.1002/jss.400080404
Mollinedo F. // Front. Oncol. 2012. V. 2. Art. 140. P. 1. https://doi.org/10.3389/fonc.2012.00140
Brown D.A., London E. // Annu Rev. Cell Dev. Biol. 1998. V. 14. P. 111. https://doi.org/10.1146/annurev.cellbio.14.1.111
Braga S.S. // Biomolecules. 2019. V. 9. P. 801. https://doi.org/10.3390/biom9120801
Crini G. // Chem. Rev. 2014. V. 114. P. 10940. https://doi.org/10.1021/cr500081p
Christian A.E., Haynes M.P., Phillips M.C., Rothblat G.H. // J. Lipid Res. 1997. V. 38. P. 2264.
Biswas A., Kashyap P., Datta S. et al. // Biophys. J. 2019. V. 116. P. 1456. https://doi.org/10.1016/j.bpj.2019.03.016
Barman S., Nayak D.P. // J. Virology. 2007. V. 81 (22). P. 12169. https://doi.org/10.1128/jvi.00835-07
Breen M.R., Camps M., Carvalho-Simoes F. et al. // PLoS ONE. 2012. V. 7(4). P. e34516. https://doi.org/10.1371/journal.pone.0034516
Greenlee J.D., Subramanian T., Liu K., King M.R. // Cancer Res. 2020. https://doi.org/10.1158/0008-5472.can-20-2199
Chen S., He H., Yang H. et al. // J. Med. Virol. 2019. V. 91. P. 949. https://doi.org/10.1002/jmv.25414
Chazal N., Gerlier D. // Microbiol. Mol. Biol. Rev. 2003. V. 67 (2). P. 226. https://doi.org/10.1128/MMBR.67.2.226-237.2003
Choi K.S., Aizaki H., Lai M.M.C. // J. Virol. 2005. V. 79 (15). P. 9862. https://doi.org/10.1128/jvi.79.15.9862-9871.2005
Ruiz-Herrero T., Hagan M.F. // Biophys. J. 2015. V. 108 (3). P. 585. https://doi.org/10.1016/j.bpj.2014.12.017
Guo H., Huang M., Yuan Q. et al. // PLoS ONE. 2017. V. 12 (1). P. e0170123. https://doi.org/10.1371/journal.pone.0170123
Kerviel A., Thomas A., Chaloin L. et al. // Virus Res. 2013. V. 171 (2). P. 332. https://doi.org/10.1016/j.virusres.2012.08.014
Yang Q., Zhang Q., Tang J., Feng W.-H. // Virology. 2015. V. 484. P. 170. https://doi.org/10.1016/j.virol.2015.06.005
Danthi P., Chow M. // J. Virol. 2004. V. 78 (1). P. 33. https://doi.org/10.1128/JVI.78.1.33-41.2004
Takahashi T., Suzuki T. // Open Dermatology J. 2009. V. 3. P. 178. https://doi.org/0.2174/1874372200903010178
Жирнов О.П., Маныкин А.А. // Вопросы вирусологии. 2014. Т. 3. С. 41.
Martyna A., Bahsoun B., Madsen J.J. et al. // J. Phys. Chem. B. 2020. V. 124. № 31. P. 6738. https://doi.org/10.1021/acs.jpcb.0c03331
Антонов В.Ф., Смирнова Е.Ю., Шевченко Е.В. Липидные мембраны при фазовых превращениях мембранных липидов. М.: Наука, 1992. 123 с.
Богатырева Н.Э., Шевченко Е.В., Яковенко Е.В. и др. // Биофизика 1998. Т. 43. С. 57.
Corvalán N.A., Kembro J.M., Clop P.D., Perillo M.A. // Biochim. Biophys. Acta. 2013. V. 1828 (8). P. 1754. https://doi.org/10.1016/j.bbamem.2013.03.019
Guo Xiling, Chen Yin, Wang Ling et al. // Sci. Rep. 2021. V. 11. P. 2418.
Gallaher J., Wodzińska K., Heimburg T., Bier M. // Phys. Rev. E. 2010. V. 81 (6. Pt. 1). P. 061925. https://doi.org/10.1103/PhysRevE.81.061925
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


