Российские нанотехнологии, 2022, T. 17, № 2, стр. 196-205
Фотокаталитическое обесцвечивание различных красителей биогенными наночастицами сульфида кадмия
В. С. Кулигин 1, 2, *, О. А. Журавлева 1, 2, Т. А. Воейкова 1, 2, В. Г. Дебабов 1, 2
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов
НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: vs.kuligin@yandex.ru
Поступила в редакцию 22.06.2021
После доработки 22.06.2021
Принята к публикации 23.06.2021
Аннотация
Исследована способность биогенных наночастиц сульфида кадмия, полученных микробным синтезом с использованием штамма Bacillus subtilis 168 (NPsCdS/Bacillus) в аэробных условиях при оптимальной для бактериального штамма температуре, к фотокаталитической деколоризации девяти синтетических органических красителей – тиазинового, трифенилметанового семейств и азокрасителей – при воздействии УФ-излучения (365 нм). Характеристики NPsCdS определены методами просвечивающей электронной микроскопии с анализом элементного состава, спектрофотометрии, динамического светорассеяния, методом масс-спектроскопии. Установлено, что наиболее эффективно обесцвечиваются красители трифенилметанового семейства – бриллиантовый зеленый, малахитовый зеленый, бромкрезоловый пурпурный. Изучена динамика деколоризации красителей в зависимости от времени и мощности УФ-облучения, концентрации NPsCdS/Bacillus в растворе. Показана возможность трехкратного эффективного использования NPsCdS/Bacillus для деколоризации метиленового синего и бриллиантового зеленого, что указывает на фотостабильность наноматериала, полученного микробным синтезом, и делает его перспективным для экологического приложения.
ВВЕДЕНИЕ
В настоящее время одним из самых ценных природных ресурсов в мире является пресная вода. Последние исследования Международного института управления водными ресурсами и Всемирной организации здравоохранения показали, что более 800 млн человек во всем мире не имеют доступа к чистой питьевой воде [1]. Промышленные предприятия текстильной, косметической, бумажной, кожевенной, фармацевтической и пищевой промышленности, сбрасывая потенциально вредные для всех живых организмов красители в водоемы, создают угрозу для экологии и здоровья людей и вносят существенный вклад в загрязнение водной среды. Так, текстильные сточные воды содержат различные синтетические красители, которые часто являются устойчивыми к деградации и канцерогенными по своей природе из-за наличия N=N-связи [2]. Эти красители в основном состоят из сложных ароматических структур, которые трудно поддаются биологическому разложению. Поэтому экологическое законодательство всех стран обязывает промышленные предприятия очищать сточные воды перед сбросом в естественные водоемы [3].
Очистка сточных вод включает в себя различные физико-химические методы, которые подробно рассмотрены в [4]. Эти процессы являются дорогостоящими, часто приводят к появлению токсичных аминных остатков. Поэтому важно разрабатывать новые эффективные и экономичные подходы к обеззараживанию сточных вод, содержащих органические красители. Фотокатализ с использованием полупроводниковых материалов показал большой потенциал в деградации органических красителей, поскольку в результате этого процесса макромолекулярные органические красители могут быть частично переведены в такие соединения, как H2O и CO2 [5, 6]. Механизм фотокатализа исследован для ряда полупроводниковых материалов и обусловлен особенностями их электронной структуры, а именно существованием в них валентной зоны проводимости. Для того чтобы в полупроводниках появилось достаточное количество электронов проводимости, необходимо перебросить электроны из заполненной зоны в зону проводимости. Для этого электроны должны получить дополнительную энергию и преодолеть так называемую ширину запрещенной зоны. Эту добавочную энергию кристаллы полупроводников получают за счет энергии света. При этом образуются возбужденные пары электрон–дырка, которые генерируют реактивные свободные радикалы, способные реагировать с кислородом и гидроксильными ионами, инициируя окисление и деградацию молекул красителей [7, 8].
Полупроводниковые наноматериалы, такие как диоксид титана, оксид цинка, сульфиды кадмия и цинка, показали отличную фотокаталитическую активность при УФ-облучении [9–11].
Чтобы удовлетворить экспоненциально растущий технологический спрос на фотонанокатализаторы, во всем мире идет поиск новых эффективных и экологичных методов синтеза наноматериалов. Поэтому исследователи обращают внимание на природоподобные, биотехнологические пути синтеза наноструктур с применением различных биологических субстанций – микроорганизмов, водорослей, грибов, экстрактов растений. Природные биополимеры, содержащиеся в этих субстанциях, обладают функцией восстановления металлов из их солей, способны адсорбироваться на поверхности наночастиц (NPs), предотвращая агломерацию наноматериала и стабилизируя его в водных суспензиях [12]. Толщина поверхностного слоя биополимерных молекул, формируемого биологическим объектом, определяемая как гидродинамический диаметр (ГД), может в десятки раз превышать диаметр NPs, увеличивая тем самым площадь поверхности и способствуя образованию координационных центров, поглощающих большее количество молекул загрязняющих веществ, что приводит к возрастанию фотокаталитической активности [13]. Биосинтез NPs происходит в жидкой среде, где присутствуют биологическая субстанция, ионы металла, а в случае получения сульфида металла ионы серы, при оптимальной для биологического объекта температуре, атмосферном давлении, чаще в аэробных условиях. “Зеленый” синтез NPs экологически безопасен, дешев, не требует сложной аппаратуры и больших энергозатрат, агрессивных, дорогостоящих химических веществ и может стать удачным дополнением к физико-химическим процессам получения наноматериала [14].
Известно, что фотокаталитические свойства полупроводниковых наноматериалов существенно зависят от их характеристик, таких как размер, форма, величина запрещенной зоны, пространственная архитектура и удельная площадь поверхности [15]. Исследования показали, что микроорганизмы могут синтезировать NPs с заданной морфологией, по стабильности не уступающие наноматериалу, полученному физико-химическими способами [16]. Фотокаталитическая способность биогенных NPs позволяет использовать их для деградации красителей [17–19].
Активно исследуются возможности получения биополимерных наноматериалов путем присоединения NPs металлов, их оксидов и сульфидов к природным полимерам [20]. Такие полисахариды, как хитозан, крахмал, декстран и целлюлоза, получаемые из растений и микробных биопленок, являются безопасными биополимерами для получения композитных наноматериалов. Продемонстрирована возможность применения этих бионанокомпозитов для обесцвечивания красителей в процессе фотокатализа [21–24].
Среди полупроводниковых фотокатализаторов сульфид кадмия (CdS) является одним из широко используемых материалов в рекультивации окружающей среды и одним из важнейших полупроводниковых материалов (запрещенная зона ~2.4 эВ), поглощающих в видимой области спектра [25, 26]. Для синтеза наноструктур CdS применяются различные физико-химические [27, 28], а также биотехнологические методы [17, 19].
Значительный интерес представляет “зеленый” синтез биогенных NPsCdS (наночастиц сульфида кадмия) с использованием микроорганизмов. В одной из первых работ по получению биогенных NPsCdS продемонстрирован процесс биосинтеза стабильных NPs с использованием пигмента С-фикоэритрина, экстрагированного из морских цианобактерий Phormidium tenue NIDM05. Было предложено использовать пигменты, помеченные NPsCdS, в качестве биомаркера [29]. В [30] проведен анализ влияния бактерий различных видов на характеристики биогенных NPsCdS и показана зависимость от вида бактерий, применяемых для биосинтеза наноматериала, таких параметров, как форма и размер NPs, состав белкового покрытия, величина ГД, ζ-потенциала, интенсивности флуоресценции. Биогенные NPsCdS, полученные с использованием различных биологических субстратов, активно исследуются в качестве фотокатализаторов для деградации органических красителей. Так, Klebsiella pneumonia обладает способностью синтезировать на своей клеточной мембране электронно-плотные нанокристаллические материалы, которые могут индуцировать фоторедукцию метилового оранжевого [31]. NPsCdS, полученные с помощью цианобактерии Spirulina sp. и водоросли Chlamydomonas reinhardtii, при облучении видимым и УФ-светом способны полностью обесцвечивать малахитовый зеленый и метиленовый синий [32, 33]. Нами впервые была продемонстрирована способность биогенных NPsCdS, полученных внеклеточным микробным синтезом с применением бактериального штамма Bacillus subtilis 168 (NPsCdS/Bacillus), осуществлять фотокаталитическое обесцвечивание МС при воздействии УФ-света с длиной волны 365 нм и мощностью источника излучения 9 Вт [34]. В данном исследовании были использованы NPsCdS/Bacillus, параметры которых изучили ранее. Характеристика NPsCdS/Bacillus, полученная методом просвечивающей электронной микроскопии с последующим анализом электронной дифракционной картины выбранной области, показала образование сферических, монодисперсных, кристаллических NPsCdS диаметром 5 ± 1 нм. Результаты энергодисперсионной рентгеновской спектроскопии подтвердили наличие Cd и S в нанокристаллах. Анализ оптических свойств NPsCdS показал, что длина волны наибольшего поглощения составляет 270 нм, при этом максимум полосы флуоресценции находится в синей области спектра (400–480 нм), что характеризует NPs как квантовые точки. Установлено, что ζ-потенциал NPs составляет от −20 до −27 мВ, ГД – от 200 до 550 нм. На поверхности NPsCdS/Bacillus идентифицирован один белок флагеллин FliC c молекулярной массой 35 кДа, входящий в состав жгутиков бактерии B. subtilis 168 [30].
Цель настоящей работы – исследование фотокаталитической активности биогенных NPsCdS/Bacillus в отношении деколоризации девяти синтетических органических красителей, принадлежащих различным химическим семействам – тиазиновому, трифенилметановому и азокрасителям – с последующей оценкой возможности многократного использования биогенных NPsCdS в процессах обесцвечивания красителей. Оценка влияния мощности УФ-облучения на эффективность процесса фотокатализа.
МЕТОДЫ
Бактериальный синтез NPsCdS/Bacillus. Бактериальный штамм B. subtilis 168 (№ В-7360) получен из Национального биоресурсного центра Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт” – ГосНИИгенетика.
Культуральную жидкость (КЖ), содержащую выращенные клетки B. subtilis 168, получали в колбах, объемом 750 мл, содержащих 100 мл питательной среды Lysogeny broth, приготовленной на деионизированной воде Milli Q, г/л: триптон – 10.0, дрожжевой экстракт – 5.0, натрий хлористый – 5.0; рН = 7.0. Колбы засевали клетками штамма, выращенными на агаризованной среде LB, культивировали при перемешивании на круговой качалке (220 об./мин, 30°С, 24 ч).
Для получения биогенных NPsCdS/Bacillus в колбу с КЖ вносили водные растворы реакционных солей хлорида кадмия – CdCl2 · 2.5H2O (ч.д.а., Химмед, Россия) и сульфида натрия – Na2S · 9H2O (ч.д.а., Химмед, Россия) до конечной концентрации 2:2 мМ, и инкубировали при перемешивании (220 об./мин, 30°С, 24 ч). Далее клетки осаждали центрифугированием при 8000 об./мин, 50 мин. Для удаления фрагментов клеточной биомассы надосадочную жидкость, содержащую NPs, фильтровали через обеззоленный мелкопористый (диаметр пор 2–3 мкм) бумажный фильтр “Синяя лента”, который характеризуется высокой плотностью и низкой скоростью фильтрации. NPs из фильтрата осаждали на высокоскоростной центрифуге (Beckman Coulter, США) и двукратно промывали стерильной деионизированной водой Milli Q (32 000 об./мин, 1 ч). Полученные в виде осадка NPsCdS ресуспендировали в 1 мл деионизированной воды и хранили в микропробирках “Eppendorf” при 4°С.
Концентрацию NPs в образцах определяли гравиметрическим методом [34]. Для установления корреляции между значениями оптической плотности (ОП) и концентрациями NPs в водных суспензиях была построена калибровочная кривая. Полученный график использовали для оценки концентрации NPsCdS/Bacillus в исследуемых образцах на основании измерения ОП.
Красители. Метиленовый синий (МС), ч.д.а. (Реахим, Россия); бриллиантовый зеленый (БЗ), 90% (Sigma-Aldrich, США); малахитовый зеленый (МЗ), ч.д.а. (Интерхим, Россия); янус зеленый (ЯЗ), 90% (Alfa Aesar, Германия); бромкрезоловый пурпурный (БКП), ч.д.а.; метиловый фиолетовый (МФ), ч.д.а.; амидо черный 10Б (АЧ), ч.д.а.; метиловый оранжевый (МО), ч.д.а.; сафранин (СН), ч. – производства Ленреактив, Россия.
Красители растворяли в воде класса Milli Q, выдерживали до полного растворения вещества, контролируя процесс по изменению ОП. Все выбранные красители растворимы в воде, некоторые из них, например МС, БЗ, труднорастворимы, поэтому процесс растворения проводили в течение нескольких часов, затем фильтровали растворы и определяли ОП; краситель МО растворяли в горячей воде.
Фотодеколоризация красителей. Для оценки фотокаталитической активности NPsCdS/Bacillus была исследована кинетика деколоризации девяти различных органических красителей в концентрации 25 мг/л (25 ppm). Название и характеристики красителей приведены в табл. 1.
Таблица 1.
Название и характеристики красителей
| Краситель | Химическое семейство | Длина волны максимального поглощения, нм |
|---|---|---|
| Метиленовый синий | Тиазиновое | 665 |
| Бриллиантовый зеленый | Трифенилметановое | 625 |
| Бромкрезоловый пурпурный | 580 | |
| Малахитовый зеленый | 617 | |
| Метиловый фиолетовый | 580 | |
| Амидо черный | Азокрасители | 614 |
| Метиловый оранжевый | 464 | |
| Сафранин | 470 | |
| Янус зеленый | 670 |
Фотокатализ красителей проводили в присутствии биогенных NPsCdS при УФ-облучении реакционных растворов, рН = 7, в течение 3 ч с использованием двух источников УФ-излучения с длиной волны 365 нм – лампа Вуда (ОЛДД-1, Россия) мощностью 9 Вт и бездроссельная ртутная лампа черного света “HSBW 160W” (SYLVANIA, КНР) мощностью 160 Вт, установленных на высоте 30 см от объекта. Во избежание перегрева источника УФ-излучения и повышенного испарения растворов красителей макет установки был оснащен воздушным охлаждением. Суспензию NPsCdS/Bacillus (1 мл) вводили в раствор красителя (15 мл), контролируя конечную концентрацию NPs. Реакцию фотодеколоризации растворов красителей проводили в чашках Петри (диаметр 9 см). Измерения эффективности деколоризации для каждого красителя проводили в трех повторностях. В контрольных экспериментах оценивали влияние УФ‑излучения на обесцвечивание красителей в отсутствие NPsCdS, используя чашки Петри, содержащие 15 мл раствора красителя и 1 мл воды в указанном ранее режиме облучения.
Динамику обесцвечивания красителей определяли, измеряя величину исходной ОП (С0) всех проб до начала эксперимента и далее с интервалом в 1 ч оценивали ОП реакционных растворов (С) на фотоколориметре КФК-2МП (ЗОМЗ, Россия). На основании величин начальной (С0) и конечной (С) ОП реакционных растворов, содержащих NPsCdS, и соответствующих контрольных образцов без NPs вычисляли эффективность фотодеколоризации.
Зависимость фотодеколоризации красителей от мощности УФ‑излучения исследовали при использовании двух источников УФ‑излучения мощностью 9 и 160 Вт, установленных на расстоянии 30 см от облучаемого реакционного раствора.
Фотодеколоризация красителей МС и БЗ при различных концентрациях NPsCdS. Концентрация NPsCdS/Bacillus в образцах растворов красителей МС и БЗ составляла 0.25 и 0.5 мг/мл, мощность лампы УФ-облучения – 160 Вт.
Многократное использование NPsCdS/Bacillus для деколоризации красителей МС и БЗ. Для оценки возможности повторного использования биогенных NPsCdS в процессе фотодеколоризации красителей проводили три цикла обесцвечивания МС и БЗ при концентрации NPs 0.5 мг/мл в реакционных растворах и мощности УФ-лампы 160 Вт. Для каждого цикла фотокатализа готовили новый раствор красителя в концентрации 25 ppm. После проведения очередного этапа УФ-облучения красителя в течение 3 ч NPsCdS из всего объема реакционного раствора осаждали и дважды отмывали в стерильной деионизированной воде Milli Q (32 000 об./мин, 1 ч). Полученный осадок NPsCdS ресуспендировали в 1 мл стерильной воды и использовали повторно для нового цикла фотокатализа красителей. По результатам эксперимента в программе Microsoft Excel 2016 строили гистограмму зависимости фотодеколоризации красителей от количества циклов использования NPsCdS/Bacillus. Статистическую обработку данных проводили с помощью MS Excel 2016 для малой выборки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эффективность фотокаталитического обесцвечивания красителей различных химических групп. Исследованные в работе синтетические органические красители относятся к различным химическим семействам (табл. 1). Тиазиновое семейство представлено МС, широко используемым в качестве модельного тест-объекта для оценки эффективности фотокаталитического обесцвечивания красителей с применением различных видов NPs. Являясь акцептором водорода, МС способен обратимо связывать его, переходя в бесцветную лейкоформу. Обесцвечивание МС происходит на свету, при УФ-облучении, воздействии восстановителей. Катализировать процессы обесцвечивания могут NPs различного состава. Так, в [35] исследована фотокаталитическая деградация МС c помощью TiO2/УФ, приводящая к быстрому удалению цвета и одновременному окислению красителя до образования простых соединений CO2, NH$_{4}^{ + }$, NO$_{3}^{ - }$ и SO$_{4}^{{2 - }}$, что может быть использовано в качестве метода очистки промышленных сточных вод. В [34] продемонстрирована возможность использования биогенных NPsCdS/Bacillus для фотокаталитического обесцвечивания МС при малой мощности УФ-облучения, 9 Вт. В настоящей работе МС использован как модельный краситель наряду с другими, различными по химическому составу веществами, для исследования эффективности фотокаталитического действия NPsCdS/Bacillus. Как следует из табл. 2, краситель МС достаточно устойчив к выцветанию при 160 Вт УФ-облучении (8%) в отличие от большинства красителей трифенилметанового семейства, но восприимчив к воздействию NPsCdS/Bacillus (36%).
Таблица 2.
Эффективность деколоризации красителей трифенилметанового семейства и метиленового синего
| Мощность УФ-облучения, Вт | 160 | 9 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Наличие NPsCdS (0.5 мг/мл) | Контроль без NPsCdS | NPsCdS | Контроль без NPsCdS | NPsCdS | ||||||||
| Время облучения, ч | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 |
| Фотодеколоризация красителей, % | ||||||||||||
| Бриллиантовый зеленый | 19 | 31 | 43 | 46 | 63 | 85 | 19.9 | 22.2 | 25.4 | 34 | 58 | 63 |
| Бромкрезоловый пурпурный | 7 | 11 | 14 | 19.5 | 35 | 51 | 2.6 | 5.1 | 8.3 | 12 | 16.6 | 22 |
| Малахитовый зеленый | 21 | 26 | 35 | 29 | 48 | 64 | 6.7 | 20 | 24.2 | 16.7 | 30 | 41.6 |
| Метиловый фиолетовый | 3 | 5 | 7 | 13 | 18 | 22 | 1 | 2 | 3 | 5 | 7.8 | 11 |
| Метиленовый синий | 4 | 6 | 8 | 19.5 | 29 | 36 | 2.0 | 3.4 | 5.7 | 10 | 14 | 17.8 |
Красители трифенилметанового семейства, использованные в работе, являются кислотно-основными индикаторами, большинство из которых нестойки к свету. Исследована способность биогенных NPsCdS к фотокаталитическому обесцвечиванию красителей БЗ, МЗ, БКП и МФ. Группа азокрасителей представлена сафранином – основным диазиновым красителем, и его производными – АЧ и ЯЗ, а также МО, которые имеют свойства кислотно-основного индикатора. Результаты экспериментов, представленные в табл. 2, показывают, что наибольший процент обесцвечивания реакционных растворов красителей, содержащих NPsCdS/Bacillus в качестве фотонанокатализатора, при УФ-облучении (160 Вт) характерен для представителей трифенилметанового ряда (БЗ – 85, МЗ – 64, БКП – 51%). Отметим, что контрольные растворы этих красителей, не содержащие NPs, при УФ-облучении демонстрируют достаточно высокий процент обесцвечивания, т.е. подтверждают свою характеристику нестойкости к свету (БЗ – 43, МЗ – 35, БКП – 14%). Следовательно, непосредственный вклад NPsCdS/Bacillus составляет для БЗ – 42, МЗ – 29, БКП – 37%, т.е. увеличивает практически вдвое процесс деколоризации данных красителей. Таким образом, для достижения эффективного обесцвечивания растворов различных видов красителей необходимо обязательное участие как биогенных NPs, так и УФ-облучения.
Механизм выцветания трифенилметановых красителей исследовали еще в середине XX века. В обзоре [36] отмечается, что под действием солнечного света и воздуха МЗ превращается в n-диметиламинобензофенон и, соответственно, в кетон Михлера, полупродукт в производстве триарилметановых красителей. При наличии солнечного света без доступа воздуха образуются только соответствующие лейкосоединения, бесцветные или слабо окрашенные восстановленные формы красителя, что указывает на важную роль процессов окисления в выцветании красителей. Применение NPs различных типов существенно повышает эффективность фотодеколоризации красителей в условиях облучения. Так, в [37] сообщается о существенной роли магнитных NPs с покрытием TiO2/WO3 в фотодеградации шестнадцати органических красителей, в числе которых были красители трифенилметанового семейства. Фотокатализатор на основе нанокомпозитного материала ZnO/глины также продемонстрировал высокую фотокаталитическую активность обесцвечивания MЗ в условиях солнечного излучения [38].
Краситель МФ, который является смесью метилированных фуксинов, характеризуется более высокой устойчивостью к выцветанию при действии УФ-облучения (7%). При наличии NPsCdS фотодеколоризация МФ повышается и составляет 22% (табл. 2), тогда как при использовании NPs иного химического состава, в частности Co3O4, возможна более эффективная фотодеколоризация данного красителя [39]. Эти данные указывают на необходимость подбора NPs определенного химического состава для эффективной деколоризации красителей.
Анализ динамики деколоризации красителей в зависимости от длительности УФ-облучения. Показано, что значительное обесцвечивание реакционных растворов, содержащих биогенные NPsCdS, происходит в течение 1 ч УФ-облучения (от 20 до 45%), за исключением МФ, который демонстрирует более низкую степень обесцвечивания (табл. 2). Затем в течение 2- и 3-го ч экспозиции деколоризация составляет 10–20% в час в зависимости от вида красителя. Предполагается, что этот эффект может быть связан с высокой адсорбцией на начальном этапе взаимодействия молекул красителя с белковым покрывающим слоем NPsCdS/Bacillus и слабой десорбцией красителя с этой поверхности, что приводит к закрытию ряда координационных активных центров и уменьшению количества свободных радикалов, образующихся на поверхности белок-покрытых NPs и необходимых для обесцвечивания растворов.
Эффективность фотокаталитического обесцвечивания красителей в зависимости от мощности источника УФ-излучения. При использовании различных источников облучения (мощностью 160 и 9 Вт) были получены результаты, демонстрирующие зависимость эффективности деколоризации МС и красителей трифенилметанового семейства от мощности лампы УФ-излучения, как контрольных образцов, так и реакционных растворов, содержащих NPsCdS/Bacillus. Для контрольных образцов наблюдали снижение уровня деколоризации при лампе 9 Вт в среднем в 1.5 раза по сравнению со значениями, полученными при 160 Вт (рис. 1). При использовании 160 Вт в присутствии NPsCdS уровень деколоризации наиболее выражен для растворов красителей БЗ, МЗ, БКП (85, 64 и 51% соответственно), что превышает значения деколоризации, полученные при использовании УФ-лампы мощностью 9 Вт, в 2.48, 3.76 и 4.25 раза соответственно (табл. 2).
Рис. 1.
Эффективность деколоризации красителей трифенилметанового семейства в зависимости от мощности УФ-излучения: 160 (а) и 9 Вт (б).

В отношении азокрасителей, более устойчивых к облучению, наблюдается аналогичный эффект зависимости обесцвечивания от мощности УФ-источника, но при меньших значениях уровня деколоризации (табл. 3).
Таблица 3.
Эффективность деколоризации азокрасителей
| Мощность УФ-облучения, Вт | 160 | 9 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Наличие NPsCdS (0.5 мг/мл) | Контроль без NPsCdS | NPsCdS | Контроль без NPsCdS | NPsCdS | ||||||||
| Время облучения, ч | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 |
| Фотодеколоризация красителей, % | ||||||||||||
| Метиловый оранжевый | 4 | 8 | 13.3 | 6 | 13 | 17 | 3 | 7.7 | 11.1 | 7.6 | 11.9 | 15.2 |
| Сафранин | 2 | 3.8 | 5 | 4 | 7 | 11 | 0 | 1 | 2 | 0 | 2 | 2 |
| Амидо черный | 0 | 0 | 1 | 9 | 16 | 21 | 0 | 0 | 1 | 3 | 5.5 | 8 |
| Янус зеленый | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
Фотодеколоризация красителей при различных концентрациях NPsCdS/Bacillus. Для определения зависимости эффективности фотодеколоризации красителей (25 ppm) от концентрации биогенных NPs (0.25 и 0.5 мг/мл) использовали растворы МС и БЗ при УФ-облучении 160 Вт (табл. 4). Полученные результаты показали, что при увеличении концентрации NPsCdS от 0.25 до 0.5 мг/мл эффективность обесцвечивания БЗ составляет 47 ± 0.2 и 85 ± 0.2% соответственно. Отметим, что для контрольного раствора БЗ степень деколоризации составила 43%. Таким образом, NPsCdS/Bacillus в концентрации 0.25 мг/мл практически не увеличивают продуктивность фотокатализа, тогда как повышение концентрации NPs вдвое приводит к резкому возрастанию его эффективности. Для МС продемонстрировано наличие нелинейной зависимости уровня обесцвечивания красителя от концентрации NPsCdS/Bacillus. Так, при концентрации NPs 0.25 и 0.5 мг/мл эффективность обесцвечивания составила 21 ± 0.2 и 36 ± 0.2% соответственно. Эффективность деколоризации красителей МС, БЗ в зависимости от концентрации NPsCdS/Bacillus представлена на рис. 2.
Таблица 4.
Эффективность фотодеколоризации красителей метиленового синего и бриллиантового зеленого в зависимости от концентрации NPsCdS/Bacillus
| Концентрация NPsCdS, мг/мл | 0.25 | 0.5 | Контроль без NPsCdS | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Время облучения, ч (160 Вт) | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 |
| Фотодеколоризация красителей (25 ppm), % | |||||||||
| Метиленовый синий | 10 | 16 | 21 | 19 | 29 | 36 | 4 | 6 | 8 |
| Бриллиантовый зеленый | 25 | 34 | 47 | 46 | 63 | 85 | 19 | 31 | 43 |
Рис. 2.
Эффективность деколоризации красителей метиленового синего и бриллиантового зеленого в зависимости от концентрации NPsCdS/Bacillus.

Результаты, показывающие зависимость эффективности деколоризации красителей МС, БЗ от концентрации биогенных NPsCdS, могут быть связаны с ростом числа реакционных центров и образованием свободных радикалов при увеличении концентрации биогенных NPs (рис. 2). Наличие белков, адсорбированных на поверхности NPsCdS/Bacillus, увеличивает площадь их взаимодействия с молекулами красителя и способствует повышению эффективности процесса фотокатализа. Таким образом, при проведении фотокаталитического обесцвечивания красителей с применением биогенных NPsCdS необходимо подбирать концентрацию NPs для достижения максимальной эффективности деколоризации.
Многократное использование NPsCdS/Bacillus для фотокаталитического обесцвечивания красителей МС и БЗ. Для оценки возможности многократного использования биогенных NPs в качестве фотонанокатализаторов были выбраны красители различных семейств – МС как модельный краситель и БЗ как наиболее восприимчивый к действию УФ (160 Вт) – в концентрации 25 ppm и NPsCdS/Bacillus в концентрации 0.5 мг/мл (рис. 3).
Рис. 3.
Эффективность фотодеколоризации красителей метиленового синего и бриллиантового зеленого при многократном использовании NPsCdS/Bacillus.

Показано, что в течение первого цикла применения NPsCdS/Bacillus красители МС и БЗ обесцветились на 36 ± 0.2 и 85 ± 0.2% соответственно; второй цикл – 21 ± 0.2 и 49 ± 0.2%; третий – 15 ± ± 0.2 и 32 ± 0.2%.
Причинами снижения эффективности деколоризации красителей при многократном использовании биогенных NPs может являться неполное удаление молекул красителя с поверхности белкового слоя NPs либо потеря небольшой части NPs в процессе их выделения, очистки и ресуспендирования.
Наличие фотокаталитической активности NPsCdS в течение второго и третьего циклов фотодеградации показывает фотостабильность исследуемых биогенных NPs в растворах красителей трифенилметановой и тиазиновой групп. Показана возможность использования NPsCdS/Bacillus как минимум в трех циклах со снижением эффективности, которой все еще достаточно для продолжения процесса фотодеколоризации красителей, что соотносится с полученными в [34] результатами по фотообесцвечиванию МС при УФ-облучении мощностью 9 Вт. Таким образом, продемонстрирована возможность эффективного трехкратного фотокаталитического обесцвечивания красителей различных семейств в присутствии NPsCdS/Bacillus с применением УФ-облучения 160 Вт, что способствует дальнейшей эксплуатации биогенных NPs в реальных условиях деколоризации и очистки промышленных сточных вод для решения экологических проблем.
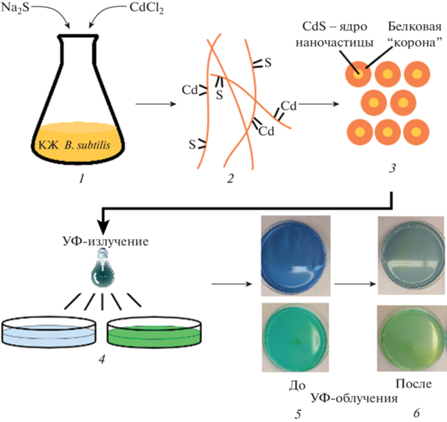
На рис. 4 представлена общая схема экспериментальной работы по деколоризации красителей на примере МС и БЗ в условиях УФ-облучения (160 Вт) в присутствии NPsCdS. Наночастицы получены простым, экологически безопасным способом в жидкой среде с использованием бактерии B. subtilis 168. Как видно из рисунка, в процессе образования наноразмерного бинарного неорганического ядра (CdS) на его поверхность адсорбируются белки, синтезированные бактериями в процессе культивирования. В случае использования B. subtilis 168 для микробного синтеза NPs на поверхность адсорбируется практически только белок флагеллин FliC, тогда как при использовании других штаммов были идентифицированы различные белки внешней мембраны бактерий. Причины адсорбции на поверхность NPs определенных белков из большого пула белковых молекул, синтезированных клетками бактерий, пока не изучены. Наличие белкового покрытия на NPsCdS предотвращает агрегацию NPs в водной суспензии и может сыграть положительную роль в увеличении площади контакта с молекулами красителя, их поглощении и взаимодействии с биогенными NPs.
Рис. 4.
Деколоризация красителей в присутствии биогенных NPsCdS в условиях УФ-облучения: 1 – введение солей Na2S и CdCl2 в колбу с КЖ B. subtilis 168; 2 – адсорбция ионов кадмия и серы на молекулах белка в КЖ; 3 – биогенные NPsCdS, содержащие на поверхности белки B. subtilis 168; 4 – облучение УФ-светом раствора красителя, содержащего NPsCdS/Bacillus; 5 – растворы красителей МС и БЗ с NPsCdS/Bacillus до УФ-облучения; 6 – растворы красителей МС и БЗ после УФ-облучения.
ЗАКЛЮЧЕНИЕ
Продемонстрирована способность биогенных наночастиц сульфида кадмия, полученных микробным синтезом с использованием штамма Bacillus subtilis 168 (NPsCdS/Bacillus) в присутствии солей CdCl2 и Na2S, к фотокаталитической деколоризации девяти синтетических органических красителей, принадлежащих к тиазиновому, трифенилметановому семействам и азокрасителям при воздействии УФ-излучения с длиной волны 365 нм.
Показано, что эффективность деколоризации красителей данных семейств существенно различается при одинаковых концентрациях NPsCdS и красителей в реакционных растворах. Установлено, что наиболее значительно обесцвечиваются красители трифенилметанового семейства – бриллиантовый зеленый, малахитовый зеленый, бромкрезоловый пурпурный. При увеличении концентрации NPsCdS возрастает уровень деколоризации исследуемых красителей.
Эффективность деколоризации красителей может возрастать более чем в 4 раза при увеличении мощности источника УФ-излучения (9 и 160 Вт).
Показана возможность трехкратного продуктивного использования NPsCdS/Bacillus для деколоризации красителей на примере метиленового синего и бриллиантового зеленого, что указывает на возможность применения биогенных NPsCdS, полученных микробным синтезом, в качестве фотонанокатализаторов для обесцвечивания красителей различных химических семейств, и фотостабильность бионаноматериала, делая его перспективным для экологического приложения.
Авторы выражают благодарность Национальному биоресурсному центру Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт” – ГосНИИгенетика за предоставление бактериальных штаммов.
Исследование выполнено при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 19-04-00088). Исследование выполнено в рамках государственного задания НИЦ “Курчатовский институт” № АААА-А20-120093090016-9.
Список литературы
Wutich A., Rosinger A.Y., Stoler J. et al. // Am. J. Hum. Biol. 2020. V. 32. № 1. P. 1. https://doi.org/10.1002/ajhb.23350
Singh R.L., Singh P.K., Singh R.P. // Int. Biodeterior. Biodegrad. 2015. V. 104. P. 21. https://doi.org/10.1016/j.ibiod.2015.04.027
Yaseen D.A., Scholz M. // Int. J. Environ. Sci. Technol. 2019. V. 16. № 2. P. 1193. https://doi.org/10.1007/s13762-018-2130-z
Crini G., Lichtfouse E. // Environ. Chem. Lett. 2019. V. 17. № 1. P. 145. https://doi.org/10.1007/s10311-018-0785-9
Chen X., Wu Z., Liu D., Gao Z. // Nanoscale Res. Lett. 2017. V. 12. P. 143. https://doi.org/10.1186/s11671-017-1904-4
Durgalakshmi D., Rajendran S., Naushad M. // Advanced nanostructured materials for environmental remediation / Eds. Naushad Mu. et al. Springer, 2019. P. 1. https://doi.org/10.1007/978-3-030-04477-0_1
Tatarchuk T., Peter A., Al-Najar B., Vijaya J.J. // Photocatalysis: Activity of Nanomaterials. In book: Nanotechnology in Environmental Science / Eds. Hussain C.M., Mishra A.K. Wiley-VCH Verlag GmbH & Co. KGaA, 2019. P. 209. https://doi.org/10.1002/9783527808854.ch8
Venkatesh N., Sabarish K., Murugadoss et al. // Environ. Sci. Pollut. Res. 2020. V. 27. № 34. P. 43212.
Xu C., Anusuyadevi P.R., Aymonier C. et al. // Chem. Soc. Rev. 2019. V. 48. № 14. P. 3868. https://doi.org/10.1039/C9CS00102F
Arachchige I.U., Nahar L. // JSM Nanotechnol. Nanomed. 2013. V. 1. № 1. P. 1.
Chiu Y.-H., Chang T.M., Chen C.-Y. et al. // Catalysts. 2019. V. 9. № 5. P. 430. DOI 16https://doi.org/10.3390/catal9050430
Воейкова Т.А., Журавлева О.А., Булушова Н.В. и др. // Молекулярная генетика, микробиология и вирусология. 2017. Т. 35. № 4. С. 151.
Gour A., Jain N.K. // Artif. Cell. Nanomed. B. 2019. V. 47. № 1. P. 844. https://doi.org/10.1080/21691401.2019.1577878
Prasad R. Nanotechnology in the Life Science. Switzerland: Springer Nature Switzerland AG, 2019. 332 p. https://doi.org/10.1007/978-3-030-16383-9_3
Dey P.C., Das R. // Spectrochim. Acta. A. Mol. Biomol. Spectrosc. 2020. V. 231. P. 118122.
Dahoumane S.A., Jeffryes C., Mechouet M., Aga-thos S.N. // Bioengineering. 2017. V. 4. № 14. P. 1. https://doi.org/10.3390/bioengineering4010014
Fang X., Wang Y., Wang Z. et al. // Energies. 2019. V. 12. № 1. P. 190. https://doi.org/10.3390/en12010190
Mohan S., Manickam V.D. // Green Process. Synth. 2019. V. 8. № 1. P. 895. https://doi.org/10.1515/gps-2019-0060
Rani M., Shanker U. // Handbook of Smart Photocatalytic Materials / Eds. Hussain C.M., Mishra A.K. Elsevier Inc, 2020. P. 11. https://doi.org/10.1016/B978-0-12-819051-7.00002-6
Shankar S., Rhim J.W. Reference Module In Food Science. Amsterdam: Elsevier, 2018. P. 1. https://doi.org/10.1016/B978-0-08-100596-5.21875-1
Adnan M.A.M., Phoon B.L., Julkapli N.M. // J. Clean. Prod. 2020. V. 261. P. 1. https://doi.org/10.1016/j.jclepro.2020.121190
Elfeky A.S., Salem S.S., Elzaref A.S. et al. // Carbohydr. Polym. 2020. V. 230. P. 1. https://doi.org/10.1016/j.carbpol.2019.115711
Farshchi E., Pirsa S., Roufegarinejad L. et al. // Carbohydr. Polym. 2019. V. 216. P. 189.https://doi.org/10.1016/j.carbpol.2019.03.094
Mansur A.A.P., Mansur H.S., Ramanery F.P. et al. // Appl. Catal. B. Environ. 2014. V. 158–159. P. 269. https://doi.org/10.1016/j.apcatb.2014.04.026
Venkatesh N., Sabarish K., Murugadoss G. et al. // Environ. Sci. Pollut. Res. 2020. V. 27. № 34. P. 43212. https://doi.org/10.1007/s11356-020-10268-3
Nyamukamba P., Moloto M.J., Mungondori H.H. // J. Nanotechnol. 2019. V. 2019. P. 1. https://doi.org/10.1155/2019/5135618
Reddy C.V., Vattikuti S.P., Shim J. // J. Mater. Sci. Mater. Electron. 2016. V. 27. № 8. P. 7799. https://doi.org/10.1007/s10854-016-4769-x
Malik R., Singh C., Garg R. // Anal. Chem. Lett. 2016. V. 6. № 5. P. 492. https://doi.org/10.1080/22297928.2016.1241718
Mubarak Ali D., Gopinath V., Rameshbabu N., Thajuddina N. // Mater. Lett. 2012. V. 74. P. 8. https://doi.org/10.1016/j.matlet.2012.01.026
Воейкова Т.А., Кожухова Е.И., Журавлева О.А. и др. // Российские нанотехнологии. 2020. Т. 15. № 2. С. 194. https://doi.org/10.1134/S199272232002020X
Das R.K., Pachapur V.L., Lonappan L. et al. // Nanotechnol. Environ. Eng. 2017. V. 2. № 1. P. 18. https://doi.org/10.1007/s41204-017-0029-4
Mandal R.P., Sekh S., Sarkar N.S. // Mater. Res. Express. 2016. V. 3. № 5. P. 1. https://doi.org/10.1088/2053-1591/3/5/055007
Rao M.D., Pennathur G. // Mater. Res. Bull. 2016. V. 85. P. 64. https://doi.org/10.1016/j.materresbull.2016.08.049
Кулигин В.С., Журавлева О.А., Воейкова Т.А., Дебабов В.Г. // Биотехнология. 2020. Т. 36. № 6. С. 127. https://doi.org/10.21519/0234-2758-2020-36-6-127-137
Houas A., Lachheb H., Ksibi M. et al. // Appl. Catal. B. Environ. 2001. V. 31. № 2. P. 145. https://doi.org/10.1016/S0926-3373(00)00276-9
Venkataraman K. // Chemistry of synthetic dyes. New York: Academic Press, 1952. P. 737.
Liu H., Guo W., Li Y. et al. // J. Environ. Chem. Eng. 2018. V. 6. № 1. P. 59. https://doi.org/10.1016/j.jece.2017.11.063
Hadjltaief H.B., Ameur S.B., Da Costa P. et al. // Appl. Clay Sci. 2018. V. 152. P. 148. https://doi.org/10.1016/j.clay.2017.11.008
Sukhin Saravan R., Muthukumaran M., Muba-shera S.M. et al. // Optik. 2020. V. 207. P. 1. https://doi.org/10.1016/j.ijleo.2020.164428
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


