Российские нанотехнологии, 2022, T. 17, № 2, стр. 243-251
Современные ранозаживляющие гели с антибактериальными свойствами на основе наночастиц меди
О. А. Богословская 1, *, И. П. Ольховская 1, М. Н. Овсянникова 2, А. Г. Яблоков 1, Н. Н. Глущенко 1
1 Институт энергетических проблем химической физики им. В.Л. Тальрозе ФИЦ химической физики
им. Н.Н. Семенова РАН
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля РАН
Москва, Россия
* E-mail: obogo@mail.ru
Поступила в редакцию 11.06.2021
После доработки 07.10.2021
Принята к публикации 29.10.2021
Аннотация
Показано, что полифункциональный гель с наночастицами (НЧ) меди диаметром 65 нм обладает ранозаживляющими свойствами, увеличивая скорость регенерации ран на 30–40% по сравнению с контролем. Гистологический анализ срезов раневой ткани свидетельствует об активной реэпителизации, образовании соединительной ткани и коллагеновых волокон с упорядоченной структурой в раневом ложе при лечении гелем с НЧ меди с большей интенсивностью, чем у контрольных животных. Гель с НЧ меди обладает антибактериальными свойствами в отношении грамположительных и грамотрицательных бактерий, в большей степени по отношению к стафилококку. Гель с НЧ меди обладает хорошей биосовместимостью, оцененной на модели пролиферации фибробластов in vitro. Одним из механизмов высокой регенерирующей активности геля с НЧ меди на начальной стадии процесса заживления ран является активация сигнального пути регенеративного процесса – повышение уровня NO в раневой ткани, что было подтверждено исследованиями с помощью электронного парамагнитного резонанса.
ВВЕДЕНИЕ
Каждый год миллионы людей страдают от различных видов травм, в том числе хронических язв, пролежней, сосудистых воспалительных и ревматических повреждений, количество которых увеличивается с ростом числа больных сахарным диабетом, гепатитом, синдромом приобретенного иммунодефицита и старением населения [1].
В настоящее время доступны самые разнообразные лекарственные средства, адаптированные к различным типам ран и используемые в клинической практике. К ним относятся гидрогели [2–5], пленки [6, 7], нановолокна [8], пены, пластыри [9], губки, бинты [10].
Несмотря на широкий ассортимент доступных средств по уходу за ранами, поиск новых препаратов продолжается. Это обусловлено не только распространением травм, но и инфицированием их резистентными штаммами, устойчивыми к антибиотикам. Создание новых средств для ухода за ранами стало возможным благодаря появлению современных материалов и технологий, в том числе нанотехнологий. Наночастицы (НЧ) Ag, Cu, Au, Ti, ZnO и т.д. рассматривают в качестве эффективных агентов для лечения ран [11–13].
Разработки гидрогелей проводят на основе природных полимеров, таких как хитозан, целлюлоза, гиалуроновая кислота и др. Преимущество использования биополимеров связано с такими свойствами, как их биоразлагаемость, биосовместимость и непроникновение в ткани раны. Сама по себе целлюлоза и ее производные ускоряют процесс заживления, способствуя поддержанию факторов роста фибробластов и эпидермиса, активности фосфодиэстеразы, которые, в свою очередь, способствуют миграции и распространению фибробластов, а также предотвращают распространение бактерий в ране [14].
В [15, 16] показано, что НЧ меди оказывают ранозаживляющее и антимикробное действие, стимулируют антиоксидантные ферменты и играют роль синергиста в поиске наилучшего ранозаживляющего препарата с низкомолекулярными производными хитозана. Причем наивысшей ранозаживляющей активностью обладают НЧ с содержанием кристаллической меди не меньше 96%.
В связи с этим цель настоящего исследования – разработка геля на основе целлюлозы с НЧ меди, изучение свойств геля, его влияния на кинетику заживления ран и выяснение механизма индукции медью ранней контракции ран.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Антибактериальное действие гелей с НЧ меди изучали на тест-культурах грамотрицательных бактерий Escherichia coli AB1157 госпитального штамма раневых инфекций, полученного из музея НИИ микробиологии и эпидемиологии им. Н.Ф. Гамалея РАМН (г. Москва), и на тест-культурах грамположительных бактерий Staphylococcus epidermidis, полученных из Музея кафедры микробиологии МГУ им. М.В. Ломоносова (г. Москва).
Биосовместимость мазей определяли in vitro на клеточной культуре фибробластов мышей линии NIH/3T3, полученных из Российской коллекции клеточных культур (г. Санкт-Петербург).
Для получения НЧ использовали медную проволоку 99.99%-ной чистоты.
Для исследования ранозаживляющих свойств НЧ металлов использовали мышей-самок линии SHK массой 18–20 г. Животных получали из Центрального питомника лабораторных животных РАМН.
Получение наночастиц меди. НЧ меди получали струйно-левитационным методом из медной проволоки [17]. Аттестацию НЧ проводили методами растровой электронной микроскопии (РЭМ) на микроскопе Jeol JSM 7401F (Япония), просвечивающей электронной микроскопии (ПЭМ) на микроскопе LEO 912 AB OMEGA, Carl Zeiss (Германия) и рентгенофазового анализа на рентгеновском анализаторе АДП-1 (РФ).
Определение формы и размера НЧ металлов проводили методом РЭМ при напряжении –1 кВ. Для определения среднего диаметра НЧ микрофотографии, полученные методом ПЭМ, обрабатывали с помощью компьютерной программы Micran 25 путем измерения поперечника как минимум тысячи частиц. На основании полученных данных рассчитывали распределение НЧ металлов по размерам.
Приготовление гелей проводили в несколько этапов. На первом этапе использовали метилцеллюлозу (в качестве основы), в которую вводили консервант – метиловый эфир парагидроксибензойной кислоты (Е218).
На следующем этапе готовили вазелиновую суспензию НЧ меди: суспендировали точную навеску порошка меди в вазелиновом масле на ультразвуковом диспергаторе УЗДН-А в режиме: 0.5 А, 44 кГц при охлаждении по схеме 30 с озвучивания/1 мин перерыва (три цикла).
К смеси метилцеллюлозы с консервантом, полученной на первом этапе, прибавляли Твин-80 (моноэфир полиоксиэтилированного сорбитана (спена) и олеиновой кислоты) и эмульгировали.
На заключительном этапе к вазелиновой суспензии с НЧ меди добавляли равное количество полученного геля метилцеллюлозы и перемешивали с помощью мешалки фирмы MLW ER-10 (Германия) со скоростью 1200 об./мин, следя за тем, чтобы полученная масса не насыщалась пузырьками воздуха. Постепенно добавляли оставшееся количество геля метилцеллюлозы, каждый раз тщательно перемешивая [18]. В качестве контроля использовали гель, приготовленный в тех же условиях, но не содержащий НЧ.
Электронно-микроскопическое исследование гелей. РЭМ-исследования проводили на микроскопе Philips SEM 515 (Голландия). Для этого навеску геля массой 1 г растворяли в 120 мл раствора толуол:этиловый спирт (1:1). Через сутки пробу объемом 0.02 мл помещали на предметное стекло и высушивали. Капля растекалась тонким слоем, занимая площадь ~1 см2. После испарения растворителя на поверхности оставались частички мази, содержащие агломераты НЧ меди. Для РЭМ-исследования топографии поверхности образца мази и распределения элементов с помощью микроскопа Philips-515 исследуемый образец со стекла переносили на углеродный пластырь.
Для РЭМ-исследования в микроскопе Camebax MBX-1 на поверхность полученного образца напыляли тонкий слой алюминия ~4 нм. Распределение частиц в прессованных образцах изучали электронно-зондовым методом по характеристическому излучению алюминия.
Антибактериальную активность гелей оценивали методом диффузии в агар по размеру зоны задержки роста клеток вокруг дисков с нанесенными на них образцами гелей. Питательная среда состояла из пептона, дрожжевого экстракта, хлорида натрия, агар-агара (2%) [19]. Предварительно бумажные диски диаметром 5 мм стерилизовали при температуре 180°С в течение 2–3 ч, равномерно распределяли на них точную навеску (0.2 г) образцов гелей и помещали на поверхность агара, засеянную бактериальной культурой. Готовые чашки Петри выдерживали в термостате при температуре 37°C в течение 24 ч. Для количественной оценки антибактериального действия гелей фотографии чашек Петри обрабатывали на компьютере с помощью программы ImageJ и оценивали диаметр зон задержки роста. Для каждой зоны измерение проводили 3 раза.
Оценка цитосовместимости гелей. Для оценки потенциальной цитотоксичности гелей использовали МТТ-тест на культуре клеток мышиных фибробластов NIH/3T3. Для этого стерильные образцы суспензии исследуемых гелей в разведении 1: 10 в количестве 100 мкл помещали в 12-луночный планшет, содержащий клетки плотностью 10 000 клеток/лунку с культуральной средой (10% фетальной бычьей сыворотки, 1% пенициллина/стрептомицина) и образцы среды в качестве контроля. Клетки культивировали при температуре 37°C в течение 48 ч. Жизнеспособность клеток через 24 и 48 ч определяли при помощи метилтиазола тетразолия (МТТ) в соответствии с протоколами производителя.
Модель экспериментальных полнослойных ран. Экспериментальные исследования на животных проводили в соответствии с инструкциями, рекомендуемыми Институтом энергетических проблем химической физики им. В.Л. Тальрозе РАН, 1987 г. и “The guide for the care and use of laboratory animals (National Academy Press Washington, D.C. 1996)”. Мышей самок массой 18–20 г, трехмесячного возраста делили на группы по пять–семь животных в каждой. На фронтальной поверхности спины у мыши удаляли волосяной покров и под эфирным наркозом резецировали полнослойный фрагмент кожи площадью 60 мм2. Животным опытной группы сразу после операции (и далее ежедневно до полного заживления) на поверхность раны наносили 0.2 г геля с НЧ меди. Мышам контрольной группы наносили 0.2 г основы мази без НЧ по той же схеме. Контуры раны 1 раз в сутки переносили на прозрачные пленки, которые затем сканировали с помощью Umax Astra 4500 (Китай). Площадь раны определяли в компьютерной программе ImageJ 1.30 v. По кинетическим кривым изменения площадей ран в процессе регенерации рассчитывали удельную скорость ранозаживления (V) как tg α-угла наклона: V = tg α = ∆S/∆t (мм2/день–1).
Гистологический анализ кожи. Из области с нанесенной раной площадью 60–70 мм2 отбирали образец вместе с прилегающей тканью, замораживали и сохраняли при температуре жидкого азота. Образцы без предварительной фиксации нарезали на криостате Leica CM 1950 (Германия) при температуре –18°С на держателе и –15°С в камере, толщина срезов составляла 9 мк. Срезы последовательно фиксировали в нейтральном 10%-ном формалине, обрабатывали по стандартному протоколу и окрашивали гематоксилин-эозином и по Массону. Полученные препараты исследовали на микроскопе Axi Oberver.z.1 Carl Zeiss (Германия) для гистологической оценки степени регенерации ткани.
Подготовка образцов для ЭПР-спектроскопии. Для подготовки к исследованию методом электронного парамагнитного резонанса (ЭПР) за 20 мин до декапитации животного раневую поверхность обкалывали 0.25%-ным раствором нитрита натрия из расчета 1.5 мг NaNO2 на мышь. Фрагмент области с нанесенной раной промывали в 15 мM буфере HEPES, рН 7.4, и помещали в тефлоновые пробирки. Пробы замораживали и хранили в контейнерах с жидким азотом до измерения. Спектры ЭПР регистрировали при 77 К с помощью радиоспектрометра ESP-300 (Ducker) в X-диапазоне (8–12 ГГц), а также при высокочастотной (ВЧ) модуляции 100 кГц, амплитуде ВЧ-модуляции 4 Гс, мощности СВЧ 20 мВт. Для увеличения отношения сигнал/шум провели четыре накопления сигнала ЭПР.
Статистическую обработку экспериментальных данных проводили по общепринятым статистическим методам с помощью компьютерной программы STATISTICA 6.0. Рассчитывали среднее значение (X), стандартную ошибку среднего (±SE). Оценку достоверности различий между средними значениями двух групп проводили по критерию Стьюдента. Различия считали достоверными при р ≤ 0.05.
РЕЗУЛЬТАТЫ
Разработка и создание ранозаживляющих гелей. Изучая ранозаживляющие и антибактериальные свойства НЧ меди с модифицированной поверхностью, установили зависимость между их физико-химическими свойствами и регенерирующей способностью, антимикробной активностью. В [15, 16] показано, что наилучшими регенерирующими свойствами обладают НЧ меди, содержащие не менее 96% кристаллической меди. В связи с этим для приготовления геля были синтезированы НЧ меди со следующими характеристиками: размер частиц – 65 нм, содержание металлической кристаллической фазы меди – 100% (рис. 1).
Рис. 1.
ПЭМ-изображение НЧ меди (а), гистограмма распределения НЧ меди по размерам (б), рентгенофазовый анализ НЧ меди (в). СЭМ-изображение агломератов НЧ меди, высадившихся из раствора геля, полученных в режимах регистрации вторичных электронов (г), и характерного излучения меди (д).

Учитывая высокую реакционную активность НЧ металлов, их способность немедленно вступать в реакцию с любыми компонентами среды, на поверхности НЧ меди была сформирована “гидрофобная шуба” из вазелинового масла. Далее НЧ были добавлены в гидрофильную основу – метилцеллюлозу. Такой прием позволил не только создать гели, содержащие НЧ меди, сохранив высокую реакционную способность НЧ, но и распределить НЧ в мазевой основе, о чем свидетельствуют СЭМ-изображения агломератов НЧ, полученных осаждением из геля (рис. 1г, 1д).
Антимикробная активность геля с НЧ меди. Исследование антимикробных свойств гелей с НЧ меди проводили на клетках грамположительных (St. epidermidis) и грамотрицательных (E. coli AB 1157) бактерий (рис. 2).
Рис. 2.
Чашки Петри с нанесенными на диски гелями: 1 – гель без НЧ меди, 2 – гель с НЧ меди (I и III). Поверхностная антибактериальная активность геля (II) без НЧ меди (A) и с НЧ меди (0.002%) по отношению к E. coli AB 1157 (Б) и St. epidermidis (В).

Видно, что НЧ меди в геле сохраняют свою антибактериальную активность. Причем нанокомпозитный гель с НЧ меди проявляет преимущественную эффективность в отношении стафилококка.
Ранозаживляющая активность геля с НЧ меди. На рис. 3а представлены фотографии кожных ран в процессе лечения гелем с НЧ меди сразу после операции и через 3, 7, 10, 14 сут после нанесения травмы. Через трое суток наблюдается активное сокращение площади ран, особенно выраженное при действии геля с НЧ меди. При этом признаков воспаления или появления инфекции в ранах в процессе заживления не наблюдается. На рис. 3д представлены гистограммы сравнительного изменения площади ран у контрольных и экспериментальных животных. Видно, что при лечении гелем с НЧ меди происходит активное сокращение площади ран, превышающее контрольное значение на 30–40%.
Рис. 3.
Фотографии ран в процессе лечения гелем с НЧ меди (а), гистологические изображения (б) окрашенных препаратов тканей кожи гематоксилин-эозином (в) и по Массону (г) после 14 дней заживления (при увеличении 160×); гистограмма изменения площади зажившей части раны контрольных и экспериментальных животных в процессе заживления (д).
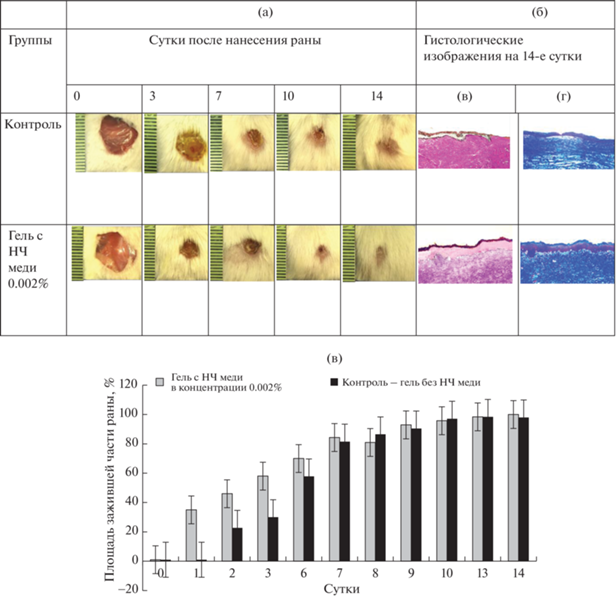
На рис. 3б представлены гистологические срезы ран на 14-е сутки после нанесения ран, окрашенные гематоксилин-эозином (в) и окрашенные по Массону (г). При окрашивании препаратов тканей гематоксилин-эозином видно, что на поверхности ран, обработанных мазью с НЧ меди, сформирован новый эпителий, ровным слоем покрывающий рану, в отличие от ран контрольных животных. При окрашивании препаратов тканей по Массону видно активное формирование коллагеновых волокон в раневом ложе. Коллаген является преобладающим структурным белком в коже, который необходим для эффективной реконструкции ткани кожи в местах ран. В раневой ткани, леченой гелем с НЧ меди, видны плотно упакованные коллагеновые волокна с параллельным расположением во внеклеточном матриксе в отличие от контрольных образцов с менее упорядоченными коллагеновыми волокнами в раневом ложе. Известно, что накопление коллагеновых волокон способствует активному образованию грануляционной ткани, что хорошо видно на тканевых срезах при сравнении экспериментальных и контрольных животных.
Оценка токсичности геля с НЧ меди. Ионы меди относительно токсичны. При длительном лечении медь может диффундировать в кровеносные сосуды и попадать в различные органы. Кроме того, медь легко вступает в реакцию Хабер–Вайса с образованием ОН-радикалов, которые могут провоцировать развитие окислительного стресса и гибель фибробластов. Однако ионы меди высвобождаются из НЧ постепенно, что является ключом к предотвращению системных токсических реакций. Кроме того, в экспериментах по установлению острой токсичности НЧ меди по сравнению с сульфатом меди установлено, что токсичность НЧ меди в пересчете на металл по показателям МПД (максимально переносимая доза), ЛД50 (полулетальная доза, при которой гибнет 50% животных) и ЛД100 (летальная доза) меньше, чем у сульфата меди, в 1.5–6.6, 2.0–4.0, 2.8–4.3 раза соответственно [20].
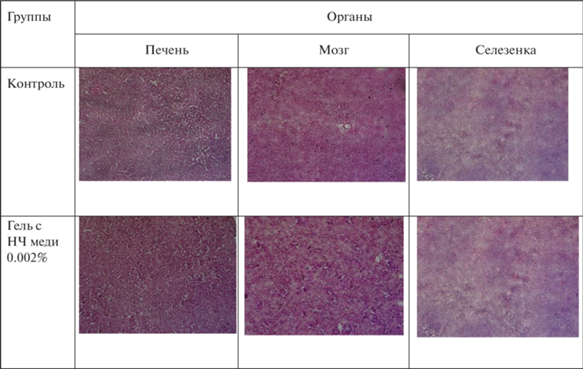
Для оценки потенциальной органной токсичности геля с НЧ меди через 14 сут обработки ран были отобраны образцы некоторых органов: печень, мозг и селезенка от экспериментальных и контрольных животных, и окрашены гематоксилин-эозином для проведения гистопатологического анализа. Видно, что патологических изменений в структуре изученных органов не наблюдается (рис. 4).
Рис. 4.
Окрашенные гематоксилин-эозином препараты органов контрольных и экспериментальных животных при лечении гелем с НЧ меди в концентрации 0.002%.
Для потенциальной возможности использования гелей с НЧ меди в клинике необходима оценка его биосовместимости, которую проверяют in vitro на клеточной культуре фибробластов. Анализ показал, что количество клеток через 24 и 48 ч инкубации с суспензией геля практически не отличается от контроля. Это свидетельствует о хорошей биосовместимости геля, содержащего НЧ меди.
Индукция нитрозильных комплексов и ЭПР-сигнала раневой ткани после лечения гелем с НЧ меди. Исследования показали, что особенностью влияния НЧ меди на заживление ран является активная стимуляция регенерации кожи в первые трое суток после травмы. Это важное свойство НЧ меди, позволяющее уменьшить площадь раны и избежать ее повторного инфицирования. Какой механизм лежит в основе такой особенности НЧ меди? По-видимому, активное заживление под воздействием меди связано с активацией сигнального пути репаративных процессов, а именно с изменением уровня внутриклеточных сигнальных молекул (вторичных посредников) – оксида азота. Чтобы определить фактор, обеспечивающий такую быструю реакцию, провели регистрацию ЭПР-сигнала нитрозильных комплексов гемоглобина (HbNO) в ткани раны. Положение линий ЭПР характеризуется значением g-фактора, величина которого определяется как отношение частоты ν, на которой проводилось измерение спектра, к величине магнитной индукции, при которой наблюдался максимум эффекта. Сигналы с g-фактором 2.03–1.98 соответствуют нитрозильным комплексам гемоглобина вследствие сверхтонкого взаимодействия несвязанного электронного спина с ядром азота. Второй компонент триплета соответствует комплексу HbNO. Регистрация спектров ЭПР образцов через 0, 1, 3, 4, 6 и 24 ч после травмы при обработке гелем с НЧ меди и без них представлена на рис. 5. Сигнал ЭПР раневой ткани не изменялся в течение одного часа. Резкое увеличение интенсивности сигнала HbNO возникает через 3, 4, 6, 24 ч, превышая контрольный уровень на 125, 80, 52, 10% соответственно. Следовательно, обработка раны гелем с НЧ меди приводит к повышению содержания NO в ране.
ОБСУЖДЕНИЕ
Лечение травм представляет важнейшую проблему в клинике и повседневной жизни. Идеальными являются средства, обеспечивающие быстрое исцеление по разумной цене и удобные в использовании. Поэтому разработка мягких лекарственных форм (мазей и гелей) на основе полимеров с НЧ металлов является приоритетным направлением [2–5].
В настоящей работе с учетом биологических свойств биополимеров, роли меди в протекании репаративных процессов, создали полифункциональный композит с НЧ меди на основе метилцеллюлозы. В [15, 16] была установлена связь между особенностями структуры НЧ меди и их антимикробными и ранозаживляющими свойствами.
Провели исследования по влиянию геля с НЧ, имеющими размер 65 нм и фазовый состав, представленный 100%-ной кристаллической медью, на заживление экспериментальных полнослойных ран. Показано, что гель с описанными характеристиками НЧ меди активно влияет на регенерацию ран, увеличивая скорость заживления на 30–40% по сравнению с контролем и предотвращая их инфицирование (рис. 3д).
Данные морфологического исследования регенерации раны свидетельствуют о миграции фибробластов, синтезе соединительной ткани, выработке коллагена и активной эпителизации. На 14-й день лечения травмы гелем с НЧ меди в экспериментальной группе, в отличие от контрольной, наблюдаются более быстрый и качественный процесс реэпителизации, активное формирование коллагеновых волокон в раневом ложе и полное заживление ран. Окрашенные гематоксилин-эозином препараты фрагментов раневой зоны показывают, что при действии геля с НЧ меди происходит утолщение грануляционной ткани в экспериментальной группе по сравнению с контрольными животными (рис. 3в). Препараты, окрашенные по Массону, демонстрируют увеличение содержания коллагена с упорядоченной структурой в раневом ложе по сравнению с контрольными животными (рис. 3г). Полученные результаты подтверждают данные [21–24] о ведущей роли меди в регенерации кожных ран, формировании соединительной ткани и эпителия.
НЧ меди являются антимикробными агентами, которые, разными путями воздействуя на клеточную стенку, цитоплазматическую мембрану, дыхательную цепь, белки, липиды, приводят к гибели бактерий. Действительно, гель с НЧ меди проявляет антибактериальную активность в отношении грамположительных (St. epidermidis) и грамотрицательных (E. coli AB 1157) бактерий с преимущественной эффективностью в отношении стафилококка (рис. 2). Следовательно, гель с НЧ меди, с одной стороны, может эффективно стимулировать регенерацию кожи, с другой стороны, подавляет патогенную микрофлору в ране. Учитывая продолжительность лечения ран и при этом вероятное попадание меди в систему кровообращения и органы животных, для оценки ее возможного токсического влияния на органы были проанализированы окрашенные гематоксилин-эозином срезы печени, селезенки и головного мозга. Показано, что при обработке ран гелем с НЧ меди изменений в структуре тканей органов мышей не происходит (рис. 4).
При создании ранозаживляющих средств важно найти баланс между антибактериальным действием и цитотоксичностью, т.е. возможностью избирательно уничтожать бактерии и не повреждать нормальные клетки млекопитающих. Проведение теста на цитосовместимость на модели пролиферации фибробластов in vitro позволило установить, что гель с НЧ меди практически не влияет на выживаемость фибробластов. Это подтверждает хорошую биосовместимость исследуемого геля и открывает потенциальные возможности использования его в клинике.
Важным фактором в процессе регенерации кожи при лечении ран гелем с НЧ меди является активная контракция ран в начальной стадии процесса заживления. Такое свойство геля позволяет избежать дополнительного инфицирования ран и осложнений при лечении. Каков механизм запуска ранней реакции при действии медных НЧ? По-видимому, НЧ меди активируют сигнальный путь регуляции репарации ран, а именно, увеличивают образование вторичного посредника – NO в тканях раны, что подтверждено исследованиями ЭПР. NO взаимодействует с внутренним супероксидным анионом раны с образованием пероксинитритов. Они действуют как прооксиданты и активируют внутреннюю антиоксидантную систему [25]. Это приводит к снижению концентрации супероксидных анионов, увеличению эндогенного NO и, наконец, к ускоренной регенерации ран.
ЗАКЛЮЧЕНИЕ
Разработанный гель с НЧ меди, имеющими размер 65 нм и содержащими 100%-ную кристаллическую фазу металла, отвечает требованиям к современным средствам для обработки ран: активно стимулирует регенерацию, проявляет антибактериальные свойства и обладает хорошей биосовместимостью. Это позволяет надеяться на дальнейшее использование разработанного геля с НЧ меди для индивидуального применения и в клинической практике для лечения инфицированных ран.
Авторы выражают благодарность за помощь в проведении экспериментов сотрудникам лаборатории ИНЭП ХФ РАН им. В.Л. Тальрозе ФИЦ ХФ РАН под руководством А.Н. Жигача.
Работа выполнена при поддержке Министерства образования и науки РФ.
Список литературы
Sorg H., Tilkorn D.J., Hager S. et al. // Eur. Surg. Res. 2017. V. 58. P. 81. https://doi.org/10.1159/000454919
Li M., Liang Y., He J. et al. // Chem. Mater. 2020. V. 32. № 23. P. 9937. https://doi.org/10.1021/acs.chemmater.0c02823
Zhang B., He J., Shi M. et al. // Chem. Eng. J. 2020. V. 400. P. 125994. https://doi.org/10.1016/j.cej.2020.125994
Qu J., Zhao X., Liang Y. et al. // Biomaterials. 2018. V. 183. P. 185. https://doi.org/10.1016/j.biomaterials.2018.08.044
Zhao X., Wu H., Guo B. et al. // Biomaterials. 2017. V. 122. P. 34. https://doi.org/10.1016/j.biomaterials.2017.01.011
Türe H. // Int. J. Biol. Macromol. 2019. V. 123. P. 878. https://doi.org/10.1016/j.ijbiomac.2018.11.143
Shahzad A., Khan A., Afzal Z. et al. // J. Biol. Macromol. 2019. V. 124. P. 255. https://doi.org/10.1208/s12249-016-0607-y
El-Aassar M.R., Ibrahim O.M., Fouda M.M.G. et al. // Carbohydr. Polym. 2020. V. 238. P. 116175. https://doi.org/10.1016/j.carbpol.2020.116175
Sheth N.S., Mistry R.B. et al. // J. Appl. Pharm. Sci. 2011. V. 1. № 3. P. 96. https://doi.org/10.7439/ijasr
Kuddushi M., Patel N.K., Gawali S.L. et al. // J. Mol. Liq. 2020. V. 306. P. 112922. https://doi.org/10.1016/j.molliq.2020.112922
Bhattacharya D., Ghosh B., Mukhopadhyay M. // IET Nanobiotechnol. 2019. V. 13. № 8. P. 778. https://doi.org/10.1049/iet-nbt.2018.5312
Alberti T., Coelho D.S., Voytena A. et al. // Cur. Pharm. 2017. V. 23. P. 3515. https://doi.org/10.2174/1381612823666170503152550
Naderi N., Karponis D., Mosahebi A. et al. // Front Biosci (Landmark Ed). 2018. V. 1. № 23. P. 1038.https://doi.org/10.2741/463228930588
Alven S., Aderibigbe B.A. // Int. J. Mol. Sci. 2020. V. 21. P. 9656. https://doi.org/10.3390/ijms21249656
Rakhmetova A.A., Alekseeva T.P., Bogoslovskaya O.A. et al. // Nanotechnologies in Russia. 2010. V. 5. № 3–4. P. 271. https://doi.org/10.1134/S199507801003016X
Bogoslovskaja O.A., Rakhmetova A.A., Ovsyannikova M.N. et al. // Nanotechnologies in Russia. 2014. V. 9. № 1–2. P. 82. https://doi.org/10.1134/S1995078014010042
Leipunsky I.O., Zhigach A.N., Kuskov M.L. et al. // J. Alloys. Compd. 2019. V. 778. P. 271. https://doi.org/10.1016/ j.jallcom.2018.11.088
Богословская О.А., Рахметова А.А., Глущенко Н.Н. Препарат, ускоряющий ранозаживление. Пат. 2460532 (Россия). 2012.
Case C.L., Johnson T.R. // 2011. Laboratory experiments in microbiology. California: Benjamin Cummings Pub. Inc., 2011. P. 126.
Богословская О.А., Сизова Е.А., Полякова В.С. и др. // Вестн. Омск. гос. ун-та. 2009. № 2. P. 124.
Xiao J., Chen S., Yi J. et al. // Adv. Funct. Mater. 2017. V. 27. № 1. P. 1604872. https://doi.org/10.1002/adfm.201604872
Mroczek-Sosnowska N., Sawosz E., Vadalasetty K.P. et al. // Int. J. Mol. Sci. 2015. V. 16. № 3. P. 4838. https://doi.org/10.3390/ijms16034838
Li J., Zhai D., Lv F. et al. // Acta Biomater. 2016. V. 36. P. 254. https://doi.org/10.1016/j.actbio.2016.03.011
Yang Y., Dong Z., Li M. et al. // Int. J. Nanomed. 2020. V. 15. P. 8231. https://doi.org/10.2147/IJN.S278631
Malone-Povolny M.J., Maloney S.E., Schoenfisch M.H. // Adv. Healthc. Mater. 2019. V. 8. № 12. P. e1801210. https://doi.org/10.1002/adhm.201801210
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



