Российские нанотехнологии, 2022, T. 17, № 2, стр. 234-242
Хемометрический анализ рентгенофлуоресцентных спектров в исследовании распределения элементов в костной ткани
Е. Ю. Терещенко 1, 2, *, В. В. Волков 1, **, А. Ю. Серегин 1, 2, В. И. Гулимова 3, С. В. Савельев 3
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Научно-исследовательский институт морфологии человека им. акад. А.П. Авцына
Российского научного центра хирургии им. акад. Б.В. Петровского
Москва, Россия
* E-mail: elenatereschenko@yandex.ru
** E-mail: volkicras@mail.ru
Поступила в редакцию 01.03.2021
После доработки 22.07.2021
Принята к публикации 22.07.2021
Аннотация
Представлены результаты применения методов хемометрического анализа рентгенофлуоресцентных данных для исследования биологических образцов. На примере изучения элементного состава проксимальных хвостовых позвонков мышей после 30-суточного космического полета и виварного контроля показана эффективность применения алгоритмов самомоделирования для выявления распределения элементов и включений в костном матриксе. Использованный подход позволил исключить из рассмотрения остаточные корреляции между элементами и выделить характерные особенности распределения элементов в костной ткани хвостовых позвонков мышей.
ВВЕДЕНИЕ
Исследования скелета человека и экспериментальных животных после пребывания в невесомости проводятся более полувека. Однако в ходе этих работ в основном исследовались Ca, P, Mg и S – основные структурные элементы, которые откладываются в виде солей и сложных минеральных комплексов. Уже давно стало понятно, что скелет животных с различной биологией и способами передвижения реагирует на невесомость различно. Более того, дифференциальная реакция костной ткани на изменение гравитации отмечена в разных элементах скелета одного животного и даже внутри отдельных костей.
Однако методические ограничения при непродолжительных полетах не позволяют оценить причинно-следственные связи наблюдаемых изменений. При этом большую роль могут играть лимитирующие, но не главные структурные элементы костной ткани, которые плохо исследованы и могут дать новую информацию об адаптивных перестройках костей. Такими элементами являются Fe, Zn, Mn и Cd, выполняющие вспомогательные функции в минеральном обмене, но обязательно присутствующие в составе кости. При этом элементный состав кости многих животных хорошо охарактеризован [1], но мало известно о том, как он может меняться в экстремальных условиях, в частности под действием факторов космического полета.
Учитывая видоспецифичность минерального состава костей, надо принимать во внимание тип питания конкретного вида животных и условия нормального содержания [2, 3]. В зависимости от них в костях могут меняться концентрации Pb, As, Hg, Ag, Zr, Sb, Ti, Al, V, Si и Sn. Относительное содержание элементов зависит от метаболизма костной ткани, который также может изменяться в невесомости.
В [2–6] для идентификации метаболических перестроек костной ткани применялся дискриминантный анализ рентгенофлуоресцентных данных (РФлА) об элементном составе. Также с помощью этого метода успешно сопоставляли метаболизм костей человека и животных [3, 4].
Отметим, что распределение элементов и их накопление в тканях имеют большое значение для экспериментальной физиологии, патологии и экологии [1]. Например, уменьшение содержания основных и/или следовых элементов коррелирует с такими патологиями, как остеоартроз и переломы костей у человека [6] и остеоартриты у собак [7].
Показано, что продолжительное пребывание в условиях космического полета может индуцировать региональную потерю внеклеточного матрикса кости [8]. Кости модельных экспериментальных животных после пребывания в невесомости исследуются преимущественно методом рентгеновской микротомографии [9].
Известно, что наиболее выраженные изменения после пребывания в невесомости у людей и животных наблюдаются в механически нагруженных при земной гравитации костях скелета [10–12]. Однако есть данные о том, что изменения элементов скелета после космического полета специфичны не только для разных костей, но и для разных участков одной и той же кости. Кроме того, они не всегда однозначно коррелируют с механической нагрузкой [13]. После орбитальных экспериментов чаще всего исследуют либо механически нагруженные [10–12], либо нагруженные и ненагруженные [13] кости скелета. Представлялось интересным оценить возможные изменения в проксимальных хвостовых позвонках, которые у мышей не несут серьезной механической нагрузки в земных условиях, но могут быть более нагружены в невесомости при использовании хвоста во время флотации, а также для опоры и прикрепления к решетке клетки. С помощью мускулатуры проксимальные хвостовые позвонки связаны с поясом задних конечностей и функционально являются его продолжением, обеспечивая опору для балансных движений хвоста при изменении положения тела. Кроме того, проксимальные хвостовые позвонки мышей в [14] исследовались у мышей после длительного орбитального эксперимента, а в [15] они были изучены у хрящепалых гекконов, использующих хвост как на Земле, так и в невесомости, в том числе для коммуникации. Таким образом, проксимальные хвостовые позвонки представляют собой доступный, компактный, удобный для исследования объект, а их выбор для анализа предоставляет интересные возможности как для сопоставления результатов с ранее полученными данными для мышей, так и для сравнительного анализа рептилий и млекопитающих.
Объектом настоящего исследования стали проксимальные хвостовые позвонки мышей после 30-суточного космического полета на борту биоспутника “Бион-М1” (19 апреля–19 мая 2013 г.), детали эксперимента подробно описаны в [16]. Ранее мы исследовали эти кости методом рентгеновской микротомографии на синхротронной станции “РТ-МТ” НИЦ “Курчатовский институт (энергия 20 кэВ) и на лабораторном микротомографе в Институте кристаллографии РАН с использованием рентгеновских трубок с молибденовым и медными анодами (энергии 17.4 и 8 кэВ соответственно). Полученные данные не выявили статистически значимых различий между группами [15]. Хвостовые позвонки полетных и контрольных мышей из этого же эксперимента были изучены в [14] с помощью рентгеновской микротомографии на mCT 50 (SCANCO Medical, Brüttisellen, Switzerland). По данным [14] космический полет значительно снизил объемную фракцию костной ткани позвоночника, минеральную плотность кости и толщину трабекул. Позднее бедренные кости, грудные и поясничные позвонки полетных и контрольных мышей из этого же орбитального эксперимента были исследованы с помощью рентгеновской микротомографии, гистологии и иммуногистохимии, ИК-спектроскопии с преобразованием Фурье, цифровой микрорадиографии, наноиндентирования и синхротронного анализа [8]. В позвонках полетных мышей были выявлены уменьшение общего объема кости и изменение модуля упругости на периферии трабекул.
Анализ распределения элементов в костной ткани необходим для лучшего понимания изменений, происходящих в скелете млекопитающих при микрогравитации. Однако из-за совпадения элементного состава разделение вклада базиса матрикса и неоднородностей представляет собой весьма сложную задачу. Эту проблему можно попытаться решить, используя методы хемометрики, ранее показавшие свою эффективность при анализе перекрытых спектров [17]. В частности, этот подход может быть применен для анализа костей, так как в них наблюдаются неоднородности распределения элементов, с одной стороны, связанные с особенностями морфогенеза, а с другой, обусловленные целым рядом физиологических и биологических факторов [18].
Основная цель представленной работы заключалась в адаптации предложенного ранее хемометрического подхода [19] для обработки многокомпонентных рентгенофлуоресцентных спектров на примере исследования хвостовых позвонков мышей.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Все образцы представляли собой проксимальные хвостовые позвонки мышей-самцов линии C57/bl6 возрастом 4–5 мес:
– fox – виварный контроль (ВК), мыши, которые находились в стандартных условиях вивария со дня старта непилотируемого космического аппарата (НКА) Бион-М1 (19 апреля–19 мая 2013 г.) до дня посадки и были подвергнуты эвтаназии в день посадки;
– ajs – полетная группа (П) – животные, которые находились в течение 30 сут на борту НКА (19 апреля–19 мая 2013 г.) и были подвергнуты эвтаназии в день посадки (через 13 ч после посадки НКА);
– gpy – группа реадаптации после полета (П-Б2). Эти мыши также находились в течение 30 сут на борту НКА Бион-М1 (19 апреля–19 мая 2013 г.). После приземления они были помещены в виварий и подвергнуты эвтаназии через 7 сут после посадки НКА.
Для данной работы из каждой группы был выбран один образец. Образцы представляли собой 2.5–3 позвонка (1–1.2 см), выделенные из хвостов мышей. Ширина образцов составляла ~2–2.5 мм.
РФлА проводили на рентгеновском дифрактометре с вращающимся анодом SmartLab (Rigaku) на энергии MoKα1. Формирование монохроматичного пучка выполняли в два этапа: расходящийся пучок из трубки преобразовывался зеркалом Гебеля в параллельный, далее пучок коллимировался двукратным Ge (220) монохроматором.
Образец располагали вертикально, размер пучка составлял 2 × 0.03 мм (в направлении сканирования). Сканирование образца проводили путем перемещения пучка вдоль образца с шагом 0.03 мм с одновременной регистрацией флуоресцентных спектров и интенсивности пучка, прошедшего через образец. Регистрацию флуоресцентных спектров осуществляли кремниевым дрейфовым детектором SDD Amptek X-123, время накопления – 30 с. Регистрацию интенсивности пучка, прошедшего через образец, выполняли точечным сцинтилляционным детектором.
Первичную обработку спектров для построения экспериментального распределения содержания элементов по данным интенсивности выхода флуоресцентного излучения проводили с помощью программы PyMCA [20]. Для этого в PyMCA задавали конфигурационный файл, описывающий фон, первичный пучок и выбор соответствующих линий. После минимизации расхождения между экспериментальными и расчетными спектрами были получены значения площадей пиков элементов.
Хемометрический анализ данных выполняли методом самомоделирования (“self modeling”) с помощью программы REMIX, детали алгоритмов которой описаны в [19]. Характеристические флуоресцентные спектры можно рассматривать как аддитивные, так как положение спектральных линий различных элементов, преимущественно K- и L-серий, обусловлено переходами на внутренних энергетических уровнях атомов. В таком случае эффективный ранг матрицы, составленной из спектров, снятых от разных участков образца при условии, что концентрационный состав образца меняется от точки к точке, должен быть равен числу составляющих его элементов. Этот случай рассматривается в хемометрике – области аналитической химии, занимающейся методами численного анализа неразделяемых аддитивных смесей по их спектрам [21–23].
Можно выделить две ветки алгоритмов анализа – методы факторного анализа и родственное ему семейcтво алгоритмов самомоделирования [24]. Последнее семейство выглядит предпочтительным для рассматриваемого случая, так как обязательное требование наличия участков частичной неперекрытости спектров компонентов и/или их концентрационных профилей (что на практике редко выполняется из-за шумов в данных) не является строго обязательным для получения приемлемого результата. При этом методы самомоделирования позволяют эффективно работать с числом компонентов более двух–трех [19].
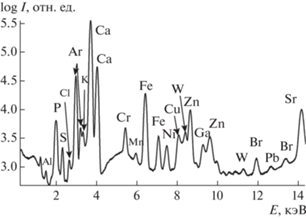
В настоящей работе применены алгоритмы оценки числа компонентов с помощью анализа спектра сингулярных чисел S матрицы данных D (разложение D = USV T), восстановления индивидуальных спектров путем поиска максимально различающихся контуров с учетом априори заданных компонентов, как это описано в [19]. Контуры индивидуальных спектров ищут путем линейной комбинации значимых левых сингулярных векторов (U), число которых задает пользователь как максимальный номер сингулярного вектора, который также содержит систематические отклонения при условии максимального различия контуров спектров компонентов (рис. 1), неотрицательности спектров и их концентрационных профилей (которые находятся путем решения системы линейных уравнений с матрицей коэффициентов, составленной из текущих спектров компонентов). Основным критерием различия спектральных контуров является малая величина числа обусловленности матрицы, составленной из текущего набора индивидуальных спектров.
Рис. 1.
Пример сингулярных векторов U матрицы данных образца fox, участвующих в формировании контуров спектров компонентов. Показаны первые 25 векторов, представленных в спектральных координатах (кэВ), разнесенных по вертикали для лучшей визуализации. Нумерация векторов – сверху вниз.
Матрица данных размерностью MxN составлена из N спектров рентгеновской флуоресценции, записанных с шагом 30 мкм в N = 250 точках образца и включающих 1826 каналов (M = 1826) от 2 до 17 кэВ.
Априори известные индивидуальные спектры (также называемые контурами) могут быть включены в матрицу компонентов. Такие спектры считают фиксированными. Неизвестные спектры подбираются в процессе минимизации интегральной квадратичной невязки между экспериментальными и расчетными спектрами путем составления линейной комбинации из левых сингулярных векторов. При этом параметрами поиска являются вклады (концентрации) компонентов с учетом их максимального различия, штрафов за отрицательные значения контуров и соответствующих концентраций [19]. Критерием полноты теоретического набора является шумовой характер дополнительного компонента, который определяется как остаток описания расчетными компонентами всего массива экспериментальных данных. Наличие в этом компоненте выраженных полос свидетельствует об искаженности теоретических спектров и/или неполноте их набора.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно РФлА во всех образцах было идентифицировано присутствие 18 элементов: Si, P, S, Cl, Ar, K, Ca, Cr, Mn, Fe, Ni, Cu, Zn, Ga, Br, Sr, W, Pb (рис. 2).
Анализ экспериментального распределения этих элементов по длине образцов, рассчитанного в pyMCA при первичной обработке спектров, дал концентрационные профили (пример для образца ajs представлен на рис. 3), интерпретация которых с точки зрения разделения вклада матрикса и включений затруднена. Поэтому далее будем рассматривать результаты, полученные методом самомоделирования.
Рис. 3.
Распределения элементов по длине образца ajs, полученные из первичной обработки экспериментальных спектров.

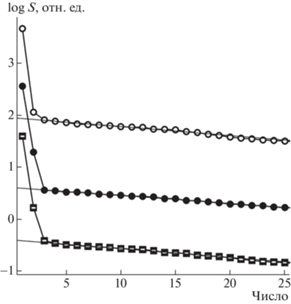
Анализ спектров сингулярных чисел матриц данных флуоресценции показал наличие только двух–трех значимых компонентов (рис. 4).
Рис. 4.
Спектры сингулярных чисел матриц данных образцов ajs (кружки), fox (точки) и gpy (квадраты). Число значимых компонентов соответствует количеству значений, превышающих уровень прямой линии, аппроксимирующей область малых значений.
Однако контуры левых сингулярных векторов U матриц данных, представленных в виде спектров, содержат информацию о 25 возможных компонентах (на рис. 1 представлен пример для образца fox), часть из которых, тем не менее, могут оказаться шумовыми. Число компонентов соответствует количеству векторов, контуры которых содержат спектральную информацию. Начиная с 26-го вектора в контурах содержится информация о шумах измерений.
Превышение числа компонентов относительно количества идентифицированных элементов может быть обусловлено корреляциями между низкочастотными составляющими шумов или неучтенными малоинтенсивными компонентами. Ab initio-поиск компонентов без учета априорной информации об их контурах показал, что разделение компонентов неудовлетворительно: индивидуальные контуры представляли собой смесь двух–трех элементов, а их концентрации имели отрицательные значения. Причиной этого могло быть сходство концентрационных профилей для нескольких компонентов (в этом случае они численно неразличимы в силу плохой обусловленности обратной задачи). Поэтому разложение на компоненты было выполнено с использованием априори заданных теоретических спектров 18 элементов (рис. 5), которые рассматривали как полный набор компонентов. Но поскольку согласно сингулярному анализу может быть до 25 независимых компонентов, был введен еще один свободный спектр, который выступал в роли контрольного остаточного контура. Если число компонентов действительно превышает 18, этот контрольный компонент должен объединить недостающие спектры и на его контуре должны проявиться новые спектральные полосы.
Рис. 5.
Спектры компонентов, использованные при описании данных флуоресценции от образца fox. Компонент с номером 0 (вверху) найден в качестве неизвестного остаточного спектра. Остальные компоненты заданы априори (названия элементов приведены справа). Верхний график – компонент 0 в логарифмическом масштабе, на котором видно отсутствие интенсивных неучтенных спектральных полос. Полосы около 4 кэВ обусловлены небольшим аппаратным дрейфом по энергии.

В рассчитанных с помощью pyMCA контурах спектров отдельных элементов полуширины пиков были скорректированы по результатам проектирования этих контуров на матрицу экспериментальных данных [25]. Без такой коррекции в решениях возникали сильные отрицательные концентрации.
Таким образом, при поиске разложения на компоненты программе задавали набор известных спектров, которые были зафиксированы, и для обеспечения надежности результата один компонент оставляли неизвестным, и его контур определялся в ходе поиска решений. При этом обусловленность обратной задачи существенно улучшилась – число обусловленности не превышало 20–30. Этот свободный компонент (кривая 0 в линейном и логарифмическом масштабе на рис. 5) представляет собой спектр, найденный с помощью программы REMIX, который обобщает остаточные систематические вариации экспериментальных данных. Как видно из рис. 5, компонент 0 не содержит новых спектральных полос, что говорит о полноте набора априорных спектров. Слабые полосы ранее идентифицированных элементов, присутствующие в контрольном компоненте, отражают остаточную корреляцию между соответствующими элементами, обусловленную вторичным возбуждением флуоресцентного излучения. В совокупности этот набор описывает экспериментальные данные с точностью до случайных шумов с χ2 = 1.04.
Следующий шаг интерпретации результатов – анализ распределения элементов по длине образца по данным концентрационных профилей, рассчитанных в программе REMIX. Матрица концентраций, соответствующая набору заданных спектральных контуров и контрольного компонента, показала, что интегральное содержание компонентов различается более чем в 100 раз. Поскольку основная задача заключалась в сравнении профилей распределения элементов по длине образца, полученные концентрационные кривые были нормированы к единице в максимуме (рис. 6).
Рис. 6.
Распределение основных элементов по длине образцов L согласно расчетам REMIX: ajs (а), fox (б), gpy (в).
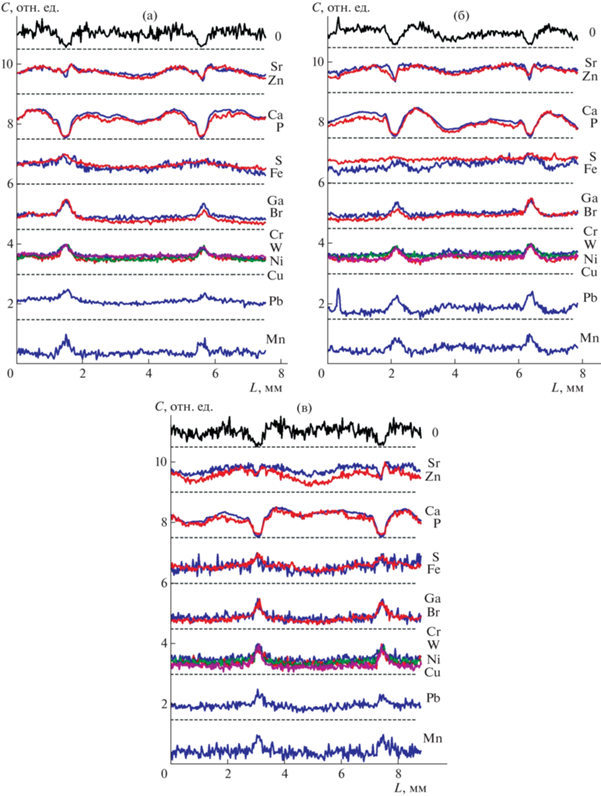
В работе наблюдали разное поведение расчетных профилей концентраций. Так, для Ar, Cl, K и Si наблюдается практически равномерное распределение. Флуоресцентный сигнал от Ar связан с рассеянием рентгеновского излучения на воздухе, его вклад обязательно учитывался при расчете компонентов и концентрационных профилей, но он не рассматривался как элемент, входящий в состав образцов. Калий, хлор и кремний являются примесями, обусловленными процедурами пробоподготовки, и присутствуют равномерно во всем образце – данные элементы являются следами водных растворов фиксаторов, в которых хранились биологические образцы.
Кроме этого, есть профили с характерными особенностями (рис. 6), причем сходство профилей распределения определенных элементов дает основание рассматривать следующие возможности концентрационной корреляции между ними.
1. Распределение Ca и P как основных структурных компонентов отражает состояние костного матрикса в позвонках. Вариация содержания по плотности Сa и P в образце может достигать 2–5 крат. Минимумы концентрации Сa и P соотносятся с максимумами интенсивности прошедшего пучка и, следовательно, указывают на положение межпозвонкового пространства. Надо отметить существенные вариации содержания Ca и P в центре позвонков. Причем наибольшие вариации наблюдаются в образце виварного контроля – fox.
2. На профилях распределения Zn и Sr также присутствуют минимумы в межпозвонковом пространстве. Но обращает на себя внимание то, что у этих элементов область минимума имеет асимметричный характер, а также она существенно уже по сравнению с Ca–P-профилями. Это можно рассматривать как свидетельство концентрации Zn и Sr на торцах позвонков. Более того, у полетных образцов ajs и gpy асимметрия более выражена по сравнению с виварным образцом fox.
3. Fe и S показывают одинаковое поведение для полетных образцов ajs и gpy, а для образца fox характер профилей этих элементов сильно различается. Вероятно, в данном случае речь не идет о корреляции между данными элементами. Присутствие и характер распределения Fe могут быть обусловлены остатками в образцах железосодержащих биологических жидкостей, в то время как повышение концентрации S в межпозвонковой области скорее всего связано с коллагеном межпозвонковых дисков.
4. Далее имеем примерно одинаковые профили распределения для целого ряда элементов, которые могут иметь разные причины:
– группа элементов Ni, Cr, W, Cu, у которых профили распределения совпадают с интенсивностью прошедшего пучка, скорее всего соответствует аппаратной функции – загрязнению спектра вследствие рассеяния рентгеновского излучения на деталях держателей и флуоресцентного детектора;
– Ga, Br также показывают распределение с небольшими максимумами в межпозвонковой зоне, но скорее всего они имеют естественное происхождение и до появления дополнительных данных их можно рассматривать как элементы пищевого происхождения, участвующие в метаболизме костей.
5. Кроме того, отметим два элемента – Mn и Pb, которые имеют индивидуальные профили распределения по длине образца. Марганец является одним из пищевых компонентов, участвующим в метаболизме костей. Свинец как токсичный элемент достаточно легко вовлекается в метаболизм живых организмов из пищи. Поскольку их максимумы в межпозвонковой зоне более широкие, чем у описанных выше групп элементов (Ni, Cr, W, Cu, Ga, Br), можно предположить их накопление в этой зоне, а также в торцах позвонков.
Таким образом, использование алгоритмов самомоделирования позволило исключить из рассмотрения остаточные корреляции между элементами и выделить характерные особенности распределения элементов в костной ткани хвостовых позвонков мышей. Более точные выводы о природе того или иного распределения определенного вида атомов можно будет сделать при накоплении большого статистического материала.
ЗАКЛЮЧЕНИЕ
Полученные результаты показали целесообразность вовлечения алгоритмов самомоделирования в исследования биологических объектов, представляющих собой сложные многокомпонентные системы.
На примере изучения распределения элементов по длине хвостовых позвонков мышей продемонстрирована возможность выделить коррелирующие элементы и, следовательно, уточнить распределение элементов, связанных с матриксом, и включений различного состава и происхождения.
Данный метод перспективен для исследования наноматериалов различной природы на современных синхротронах с ультрамалым эмиттансом.
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (грант № 18-29-26028 мк) в части исследования биологических объектов и Министерства науки и высшего образования РФ в рамках государственного задания ФНИЦ “Кристаллография и фотоника” РАН в части развития методов характеризации многофазных многокомпонентных систем. Работа выполнена с использованием оборудования “Кристаллография и фотоника” при поддержке Мин-обрнауки (проект RFMEFI62119X0035).
Список литературы
Buddhachat K., Klinhom S., Siengdee P. et al. // PLoS ONE. 2016. V. 11. № 5. P. e0155458. https://doi.org/10.1371/journal.pone.0155458
Sharma R.P., Shupe J.L. // Sci. Total Environ. 1977. V. 7. P. 53.
Zimmerman H.A., Meizel-Lambert C.J., Schultz J.J., Sigman M.E. // Sci. Justice. 2015. V. 55. P. 131.
Nganvongpanit K., Buddhachat K., Klinhom S. et al. // Forensic Sci. Int. 2016. V. 263. P. 101.
Dermience M., Lognay G., Mathieu F. et al. // J. Trace Elem. Med. Biol. 2015. V. 32. P. 86. https://doi.org/10.1016/j.jtemb.2015.06.005
Helliwell T.R., Kelly S.A., Walsh H.P.J. et al. // Bone. 1996. V. 18. P. 151.
Nganvongpanit K., Brown J.L., Buddhachat K. et al. // Biol. Trace Elem. Res. 2016. V. 170. P. 94.
Gerbaix M., Gnyubkin V., Farlay D. et al. // Sci. Rep. 2017. V. 7. Art. 2659. https://doi.org/10.1038/s41598-017-03014-2
Giuliani A., Mazzoni S., Ruggiu A. et al. // Front. Physiol. 2018. V. 9. Art. 181. https://doi.org/10.3389/fphys.2018.00181
Vico L., Collet P., Guignandon A. et al. // Lancet. 2000. V. 355. P. 1607.
Lang T., LeBlanc A., Evans H. et al. // J. Bone Miner. Res. 2004. V. 19 (6). P. 1006.
Gerbaix M., Gnyubkin V., Farlay D. et al. // Sci Rep. 2017. V. 7. 7. Art. 2659. https://doi.org/10.1038/s41598-017-03014-2
Keune J.A., Branscum A.J., Iwaniec U.T., Turner R.T. // Sci Rep. 2015. V. 5 (1). P. 18671. https://doi.org/10.1038/srep18671
Berg-Johansen B., Liebenberg E.C., Li A. et al. // J. Orthop. Res. 2015. V. 34. P. 48. https://doi.org/10.1002/jor.23029
Савельев С.В., Гулимова В.И., Барабанов В.М. и др. // Космический научный проект “БИОН-М1”: медико-биологические эксперименты и исследования / Под ред. Григорьева А.И. М.: ГНЦ РФ – ИМБП РАН, 2016. С. 298.
Andreev-Andrievskiy A., Popova A., Boyle R. et al. // PLoS ONE. 2014. V. 9. № 8. P. e104830. https://doi.org/10.1371/journal.pone.0104830
Родионова О.Е., Померанцев А.Л. // Успехи химии. 2006. Т. 75. № 4. С. 302.
Buzmakov A., Chukalina M., Nikolaev D. et al. // J. Appl. Cryst. 2015. V. 48. P. 693. https://doi.org/10.1107/S1600576715006214
Volkov V.V. // Appl. Spectrosc. 1996. V. 50. № 3. P. 320.
Solé V.A., Papillon E., Cotte M. et al. // Spectrochim. Acta. B. 2007. V. 62. P. 63.
Malinowski E.R. Factor Analysis in Chemistry / Eds Malinowski E.R., Howery D.G. New York: R.E. Krieger Publishing Company, 1980. 251 p.
Ramos L.S., Beebe K.R., Carey W.P. et al. // Anal. Chem. 1986. V. 58. № 5. P. 294R.
Delaney M. // Anal. Chem. 1984. V. 56. № 5. P. 261R.
Lawton W.H., Sylwestre E.A. // Technometrix. 1971. V. 13. № 3. P. 617.
Волков В.В., Гречушников Б.Н. // Журн. прикл. спектроскопии. 1984. Т. 40. Вып. 2. С. 264.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии