Российские нанотехнологии, 2022, T. 17, № 2, стр. 225-233
Передача маркерных наночастиц Pt в трехзвенной трофической цепи Chlorella Beijer–Daphnia magna Straus–Cyprinus carpio
Ю. Н. Моргалёв 1, *, Т. Г. Моргалёва 1, С. Ю. Моргалёв 1
1 Томский государственный университет
Томск, Россия
* E-mail: yu.morgalev@gmail.com
Поступила в редакцию 30.06.2020
После доработки 09.10.2020
Принята к публикации 09.10.2021
Аннотация
Поступление маркерных наночастиц (НЧ) Pt в гидросферу приводит к ассоциации с одноклеточными водорослями Chlorella (фактор биоаккумуляции достигает 10 000). Наблюдается значительное время элиминации (t1/2 = 7 сут) даже при однократной контаминации гидросферы. НЧ Pt, попадая в гидросферу, накапливаются в организме Daphnia magna Straus в большом количестве (фактор биоаккумуляции составляет 1000–2000), начиная с первых суток, что может представлять опасность для консументов более высокого трофического уровня. Накопление НЧ происходит как в пищеварительном тракте, так и на поверхности тела (t1/2 = 3 ч). Аккумуляция НЧ при передаче по пищевой цепи с хлореллой, контаминированной наночастицами, превышает аккумуляцию из окружающей среды в 4 раза, что связано с предварительной аккумуляцией НЧ кормом (хлореллой) и поглощением дафниями НЧ в концентрированном виде. НЧ накапливаются в организме рыб из среды (фактор биоаккумуляции до 2500) и по пищевой цепи (фактор биоаккумуляции до 350). Очищение от НЧ при накоплении по пищевой цепи происходит значительно медленнее, чем в серии с накоплением НЧ из среды. При использовании продуктов рыбоводства, подвергшихся контаминации НЧ, наибольшую опасность представляют такие органы и ткани, как кожа, мышцы и скелет.
ВВЕДЕНИЕ
В настоящее время из-за множественных путей выброса наноматериалов в окружающую среду растет их воздействие на экосистемы и здоровье человека [1–3]. Установлено, что кроме токсического воздействия на бактерии [4–6], низшие и высшие растения [7–9] некоторые наночастицы (НЧ) на основе металлов и высвобождающиеся из них ионы металлов могут адсорбироваться в водных организмах и передаваться по пищевым цепям водной экосистемы. Aдсорбция, которая существенно зависит от свойств поверхности НЧ, является первым и важным этапом взаимодействия между НЧ и водными видами животных. После адсорбции НЧ могут накапливаться на поверхности клеток или проходить во внутриклеточную среду путем диффузии или эндоцитоза [10–12].
Адсорбция НЧ индуцирует повреждение клеточной стенки, вызывает тяжелую острую токсичность у пресноводных и морских водорослей Pseudokirchneriella subcapitata, Phaeodactylum tricornutum, Chlorella sp., Dunaliella tertiolecta [13, 14]. Наблюдалось прилипание НЧ (НЧ TiO2, Al2O3, многостенных углеродных нанотрубок) к внешней поверхности Daphnia magna, Ceriodaphnia dubia, Artemia sallina, Danio rerio в течение первых 48 ч от начала воздействия и накопление в кишечнике, липидных везикулах, фагоцитах с последующим снижением их содержания после 48 ч экспозиции [15–17]. Концентрация в Daphnia magna увеличивалась с ростом концентрации НЧ TiO2 в среде [18]. Cкорость вымывания НЧ Ag у дафний значительно ниже, чем ионов Ag, что свидетельствует о более медленной элиминации НЧ Ag [19]. При экспозиции Ceriodaphnia dubia в течение 6 ч в дисперсных средах с разной концентрацией (1–50 мг/л) НЧ Fe2O3 максимальное накопление НЧ наблюдалось при концентрации 20 мг/л [20]. При экспозиции нектонных организмов, таких как рыбы Danio rerio, в дисперсных системах НЧ TiO2 с концентрациями 0.1 и 1.0 мг/л могут биоаккумулировать НЧ с коэффициентом биоаккумуляции (КБА) 25.38 и 181.38 соответственно [21]. Однако после 25 дней экспозиции карпа (Cyprinus carpio) в дисперсных системах НЧ TiO2 с концентрациями 3 и 10 мг/л зависимость КБА от концентрации была не столь выражена, и он был равен 675 и 595 соответственно [22].
Накапливаясь в отдельных видах фито- и зоопланктона НЧ переносятся по пищевой цепи, что приводит к значительной биомагнификации: верифицирован перенос квантовых точек из водорослей (Pseudokirchneriella subcapitata) в зоопланктон (Ceriodaphnia dubia) после обработки ими водорослей [23]; квантовые точки CdSe, накапливаясь в бактериях (Pseudomonas aeruginosa), переносятся на Tetrahymena thermophila [24]; высокое содержание НЧ Au в видах первичного звена пищевой цепи приводит к высокому содержанию Au в первичном потребителе Daphnia magna [21]; использование контаминированной Artemia salina в качестве пищи золотой рыбки (Carassius auratus) привело к накоплению НЧ CuO и ZnO в кишечнике, жабрах, печени [25]. Наряду с этим выявлена отрицательная биомагнификация НЧ TiO2 в упрощенной пищевой цепи из-за депурации НЧ TiO2 из контаминированного корма [21]. Кроме того, продемонстрирован трехуровневый трофический перенос квантовых точек по водной пищевой цепи [26]. Прием контаминированной НЧ пищи может представлять собой их основной маршрут по трофической сети [21–26], что является потенциальным путем для НЧ войти в пищевую цепь человека.
Таким образом, НЧ могут накапливаться в водных организмах и переноситься на различные трофические уровни, включая водоросли, рыб и бентосных животных. Однако по-прежнему имеются некоторые противоречивые результаты в отношении биомагнификации НЧ в водной среде, требующие дальнейшего изучения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
НЧ Pt в виде водного коллоидного раствора с концентрацией 50 мг/дм3 приобретены в лаборатории новых материалов и перспективных технологий Сибирского физико-технического института Томского государственного университета. Коллоидные растворы НЧ получали методом лазерной абляции в дистиллированной воде из слитков металла высокой степени чистоты [27]. Для определения среднего размера НЧ использовали анализатор “Zetasizer Nano ZS” (США) и просвечивающий электронный микроскоп “Phillips CM-12” (Франция). Удельную площадь поверхности измеряли методом БЭТ (метод Брунауэра–Эммета–Теллера) (“TriStar 3000”, США). Для определения концентрации ионной фракции в суспензии применяли атомно-адсорбционной спектроскоп “SOLAAR S2” (США). Концентрацию элемента Pt в образцах биообъектов определяли методом масс-спектрометрии с индуктивно связанной плазмой (спектрометр “Elan DRC-e”, США). Оптическую плотность суспензии клеток водорослей определяли измерителем плотности суспензий ИПС-3 (“Европолитест”, Россия).
Тестируемые дисперсные системы (ДС) НЧ Pt создавали по разработанной нами методике путем разведения исходного коллоидного раствора с концентрацией 50.0 мг/дм3 культивационной средой и последующего ультразвукового редиспергирования (мощность ультразвука 30 Вт/л) в течение 5 мин [2]. Культивационной средой для водорослей служила 10%-ная среда Тамия, для Daphnia magna и Cyprinus carpio – питьевая вода, аэрированная, соответствующая нормативным документам [28]. На основании предыдущих исследований стабильности и токсичности ДС [29] для работы была выбрана концентрация НЧ Pt 1.0 мг/дм3.
Тест-организмы Chlorella vulgaris Beijer и Daphnia magna Straus приобретены в OOO “Европолитест” (Россия). Молодь Cyprinus carpio (масса 3–5 г, один помет) предоставлена ООО “Томский научно-производственный рыбоводный комплекс” (Россия). Условия содержания тест-организмов до и во время эксперимента соответствовали требованиям стандартных методик биотестирования: фотопериод 12/12, рН 7.0–8.2, содержание О2 26 мг/л [30]. Ежесуточно обновляли 10% культивационной среды.
Исследования по аккумуляции включали в себя две фазы: накопления и очищения. Пробы для количественного определения концентрации Pt в тест-организмах отбирали в фазе накопления для хлореллы в конце 1, 2, 3, 4, 5, 10 и 20 сут культивирования, для дафний – в конце 1, 5, 10, 20 и 28 сут, для рыб – в конце 1, 5, 10, 20 сут. В фазе очищения – в конце 1 и 7 сут после переноса в среду, свободную от НЧ.
Суспензию хлореллы концентрировали трехкратным сепарированием с промывкой культивационной средой и финальным центрифугированием 15 мин при 1600 об./мин. Осадок подсушивали на фильтровальной бумаге. На анализ передавали образцы сырой массой ~1 г. Всего 33 образца.
Рачков дафний собирали с помощью сита, ополаскивали сверху культивационной водой и подсушивали на марлевой салфетке в течение 5 мин, после чего собирали в пробирку и взвешивали. На анализ передавали образцы сырой массой ~1 г. Всего 42 образца.
Молодь рыб после отлавливания обезболивали с помощью раствора трикаина и декапитировали. Для оценки интегральной аккумуляции проводили гомогенизирование. Для оценки накопления в органах рыб препарировали и готовили гомогенат тканей. На анализ передавали образцы сырой массой ~1 г. Всего 55 образцов.
Параллельно по той же схеме проводили исследования с культивационной средой, свободной от НЧ.
Статистическая обработка полученных данных выполнена в программах Statistica 10 и Excel 2010.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
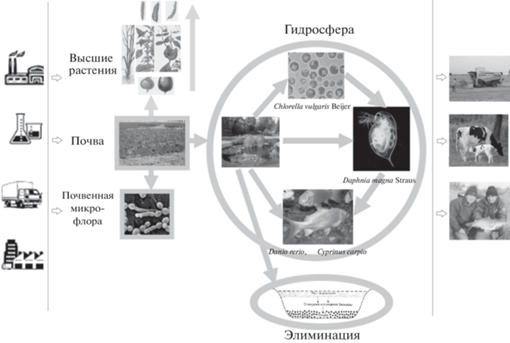
Представленные в работе результаты относятся к части процесса транслокации наноматериалов в окружающей среде – транслокации в пищевой цепи гидробионтов (рис. 1).
Использованные в исследовании маркерные НЧ характеризовались следующими показателями: средний размер НЧ Δ50 = 5 нм, удельная площадь поверхности Ssp ≈ 15 м2/г, концентрация ионной фракции в суспензии не превышала 0.2%.
Аккумуляция НЧ Pt хлореллой. Вопрос о дисперсности аккумулированных частиц не рассматривали, так как во множестве публикаций показано накопление именно НЧ в разнообразных биологических объектах [23–25]. В проведенной работе в пользу аккумуляции Pt в форме НЧ свидетельствует как ее низкая растворимость и, соответственно, практическое отсутствие ионной формы, так и накопление в тканях мышц и скелета даже при поступлении через желудочно-кишечный тракт.
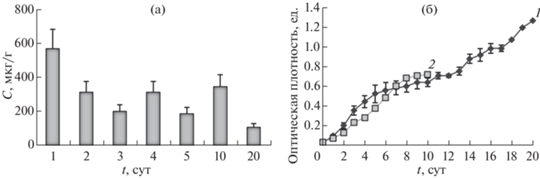
При культивировании одноклеточной водоросли Chlorella в дисперсной системе НЧ Pt концентрация элемента Pt через 24 ч возрастала до 570 ± 96 мкг/г (рис. 2а). По мере увеличения времени экспозиции концентрация Pt в хлорелле снижалась и через 20 сут составляла 106 ± 18 мкг/г.
Рис. 2.
Содержание Pt во фракции хлореллы по данным ICP-MS (а) и динамика оптической плотности суспензии водоросли Chlorella при культивировании в контрольной (1) и опытной среде (2) (б).
Одним из важных параметров для оценки накопления НЧ гидробионтами из среды является фактор биоаккумуляции (ФБА), который отражает отношение концентрации вещества в тест-организме к концентрации вещества в среде культивирования тест-организма [31, 32] и вычисляется по формуле: ФБА = Схл/Сw, где Схл – концентрация химического элемента в хлорелле, Сw – концентрация химического элемента в культивационной среде.
Учитывая начальную концентрацию НЧ Pt, равную 1 мг/л (1 мкг/мл), следовало бы ожидать диапазон КБА от 100 до 600, однако в реальности происходит ряд процессов, существенно изменяющих этот показатель.
Контакт НЧ с водной средой при их попадании в экосистему приводит к сложной цепи физико-химических перестроек структуры ДС, одним из важнейших звеньев которой является агрегация с последующей седиментационной или флотационной элиминацией НЧ из среды обитания гидробионтов в донные отложения или на поверхность водоемов. Процессы элиминации НЧ наряду с концентрационными параметрами определяются рядом факторов: электролитным составом среды, температурой, рН среды, зарядом частиц, степенью аэрации и т.д. [33].
Кроме того, существенный вклад вносят процессы захвата НЧ клетками хлореллы в первые 24 ч культивирования (концентрация в среде при этом снижается с 1.0 до 0.005 мг/л). Последующее добавление в тест-систему суспензий НЧ не может полностью скомпенсировать это изменение.
Расчетным методом оценить устойчивость ДС, особенно при ее полиэлектролитном составе, характерном для природных водных сред, крайне сложно. В связи с неустойчивостью дисперсной системы НЧ Pt, согласно принципам согласованной на глобальном уровне системы классификации опасности и маркировки химических веществ [34], при определении КБА необходимо проводить расчеты с учетом эффективной концентрации поллютанта в среде, которая рассчитывается как среднее геометрическое из начальной и конечной концентрации НЧ за период экспозиции.
Однако исследования [29] показали, что вычисление эффективной концентрации по формуле С e = (С inС fin)1/2, где С in и С fin – начальная и конечная концентрация соответственно, возможно только при разовом введении НЧ. При повторных внесениях НЧ в концентрации С in (недопустимо внесение в более высоких концентрациях, так как возможны эффекты кратковременного воздействия повышенных концентраций на тест-организмы) в первые сутки $C_{1}^{e}$ = (С inС in(e–Ke×24))1/2 = = С ine–Ke×12. Коэффициент элиминации (Kе) является коэффициентом уравнения экспоненциальной аппроксимации Сt = C0e–Ket графика снижения концентрации взвешенных НЧ при отстаивании, где C0 – исходная концентрация НЧ, t – время экспозиции в часах. Этот показатель, характеризующий устойчивость ДС, эффективную концентрацию воздействия диспергированных НЧ и возможное время их воздействия на тест-организм, необходимо определять экспериментально. Согласно [29] эта величина для используемых дисперсных систем НЧ Pt 1.0 мг/л составляет: в культивационной среде для хлореллы – 0.0144 ч–1, в культивационной среде для дафний – 0.0201 ч–1, в культивационной среде для рыб – 0.0261 ч–1 .
Для последующих i = (n – 1) сут $C_{i}^{m}$ = (($C_{{i - 1}}^{{{\text{fin}}}}$ + + С inKrep)$C_{i}^{{{\text{fin}}}}$)1/2, где $C_{{i - 1}}^{{{\text{fin}}}}$ – конечная концентрация в предыдущие сутки, Krep – коэффициент замены культивационной среды в долях объема. Тогда среднюю концентрацию за период n > 1 суток можно вычислить по формуле
Альтернативой являются многократный (в течение каждых суток) отбор проб культуры, очистка их от тест-организмов, измерение концентраций НЧ в среде методом масс-спектрометрии и интегрирование полученных значений. Однако это приводит как к нарушению условий культивирования, так и к существенному удорожанию получения результатов.
Другим важным источником ошибки в определении ФБА является рост хлореллы в процессе экспозиции. При малых количествах НЧ, вносимых в среду, клетки водорослей последующих поколений являются “разбавителями”, не ассоциировавшими НЧ в тех же количествах, что и клетки первого поколения. Таким образом, необходимо учитывать скорость роста хлореллы и корректировать на него как величину определяемой концентрации НЧ, адсорбированных хлореллой, так и значение ФБА.
На рис. 2б показана динамика роста хлореллы, определенная стандартным методом измерения оптической плотности суспензии [35].
Отчетливо видно, что продолжительность фазы экспоненциального роста составляет трое суток. В эту фазу экспоненциального роста культуры в контрольной среде коэффициент среднего удельного прироста µ = lnCt/t составил 0.71. При культивировании Clorella vulgaris Beijer в дисперсионной среде НЧ Pt коэффициент среднего удельного прироста увеличивается до µ = 1.04, что указывает на стимулирующий эффект НЧ Pt в фазе экспоненциального роста.
Исходя из полученных данных и применяя указанную коррекцию, можно рассчитать основные показатели биоаккумуляции: kcl – коэффициент скорости очищения тест-организмов после переноса в среду, свободную от НЧ, и t1/2 – время “полуочищения” – период, за который концентрация ассоциированных НЧ снижается в 2 раза:
Результаты, полученные через 1 и 7 сут отмывания, показывают, что процесс очищения со временем замедляется. В первые сутки kcl = = 0.16/сут, t1/2 = 4.2 сут, в интервале 1–7 сут kcl = = 0.10/сут, t1/2 = 7.0 сут. Это может быть связано с быстрым начальным очищением культуры от НЧ, слабо связанных с поверхностью клеток.
Коэффициент скорости накопления НЧ (kup) вычисляется по формуле
Поскольку Cхл и Cw изменяются по ходу фазы накопления, значения коэффициента также не постоянны (табл. 1).
Таблица 1.
Значение коэффициента накопления (Kup), кинетического (ФБАк) и статического (ФБА) факторов биоаккумуляции НЧ Pt в тест-системе Chlorella
| Экспозиция, сут | Kup | ФБАк | ФБА |
|---|---|---|---|
| 1 | 750 ± 140 | 7000 ± 1300 | 710 ± 140 |
| 2 | 3300 ± 620 | 31000 ± 5800 | 5900 ± 1100 |
| 3 | 1900 ± 360 | 18000 ± 3300 | 4800 ± 920 |
| 4 | 2400 ± 450 | 22000 ± 4200 | 7700 ± 1500 |
| 5 | 1000 ± 200 | 9500 ± 1800 | 4000 ± 750 |
| 10 | 1500 ± 290 | 14000 ± 2700 | 9400 ± 1800 |
| 20 | 310 ± 60 | 2900 ± 560 | 2600 ± 490 |
Кинетический фактор биоаккумуляции (ФБАк) вычисляется по формуле
Обращает на себя внимание различие в величинах ФБА. Максимальное значение ФБА составляет 9400 ± 1800, в то время как ФБАк на вторые сутки экспозиции достигает значения 31 000 ± 5800. Данный факт может отражать потенциальную способность культуры хлореллы накапливать значительное количество НЧ. Реализация этой возможности ограничивается снижением пассивного сорбирования НЧ в связи с насыщением локусов связывания, замедлением роста хлореллы вне фазы экспоненциального роста и, возможно, ограниченностью количества НЧ, способных в естественных условиях длительное время существовать в свободном состоянии. При этом высокий уровень накопления НЧ Pt уже в первые сутки экспозиции указывает на существенную значимость этого процесса в возможной передаче НЧ вверх по пищевой цепи.
Аккумуляция НЧ Pt дафниями из культивационной среды. В данной и последующих сериях экспериментов проводили измерения содержания Pt в контрольных условиях без внесения НЧ. Во всех случаях зарегистрированная в тест-организмах концентрация Pt не превосходила значения 0.0002 ± 0.0004 мкг/г массы.
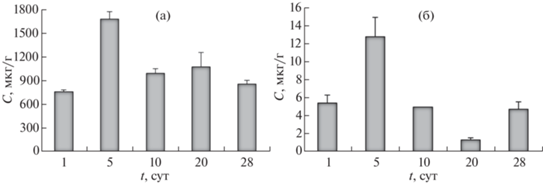
При инкубировании в среде, содержащей НЧ Pt, концентрация элемента Pt в рачках дафний максимально возросла через 5 сут до 1680 ± 96 мкг/г. В дальнейшие дни отмечалось снижение концентрации – до 860 ± 45 мкг/г через 28 сут (рис. 3а). Снижение концентрации Pt в рачках дафний с 10 по 28 сут экспозиции частично связано с ее потерей при двух–трех линьках, которые происходили за это время, с выведением через пищеварительный тракт и с рождением молоди, которую не передавали на анализ.
Рис. 3.
Cодержание Pt в тест-организме Daphnia magna Straus при культивации в дисперсной системе НЧ Pt с концентрацией 1.0 мг/л (а) и при поступлении с кормом (б).
Результаты, полученные через одни сутки отмывания, показывают, что очищение дафний от накопленных НЧ Pt проходит очень быстро: kcl= = 5.2/сут (0.2/ч), t1/2 = 0.13 сут (3.2 ч).
Это указывает на накопление НЧ на поверхности тела и в пищеварительном тракте дафний и их достаточно быстрое вымывание при переходе в свободную от НЧ среду. Кроме того, присутствует фактор адгезии НЧ к экзоскелету, описанный в [36] для НЧ TiO2. Подтверждением этому может служить общий баланс аккумулированной Pt за сутки инкубации: при весе дафнии ~50 мг и фильтрации до 10 дм3 жидкости в сутки 1 г дафний из среды с концентрацией 1 мг/дм3 может поглотить не более 200 мкг Pt. Превышение этого значения указывает на процесс адгезии.
Основные показатели биоаккумуляции также не постоянны и зависят от длительности экспозиции (табл. 2).
Таблица 2.
Значение коэффициента накопления (kup), кинетического (ФБАк) и статического (ФБА) факторов биоаккумуляции из среды НЧ Pt в тест-организмах Daphnia magna
| Экспозиция, сут | kup | ФБАк | ФБА |
|---|---|---|---|
| 1 | 12 000 ± 920 | 940 ± 170 | 840 ± 160 |
| 5 | 5700 ± 2300 | 2300 ± 420 | 2000 ± 380 |
| 10 | 2300 ± 1100 | 1100 ± 200 | 1000 ± 200 |
| 20 | 7000 ± 1300 | 1300 ± 240 | 1200 ± 230 |
| 28 | 5600 ± 1100 | 1100 ± 190 | 960 ± 180 |
Таким образом, НЧ, попадающие в гидросферу, накапливаются в организмах Daphnia magna в большом количестве уже в первые сутки после поступления в среду обитания и достигают максимальной концентрации в течение одной недели. Количество накопленных НЧ (концентрирование приблизительно в 2 тыс. раз) может представлять опасность для консументов более высокого трофического уровня, а факт такого накопления должен учитываться при оценке возможного влияния объектов наноиндустрии на прилегающую территорию.
Аккумуляция НЧ Pt дафниями при кормлении контаминированными водорослями. В данном эксперименте в качестве корма для дафний использовали суспензию хлореллы, выращенной при 24-часовой культивации в дисперсной системе НЧ Pt с концентрацией 1.0 мг/дм3. После отмывания от среды Тамия и свободных НЧ (как указано выше) концентрат хлореллы разводили культивационной водой до оптической плотности, равной 0.300 ед., что соответствует 1.7 × 107 клеток/мл суспензии. Экспозицию дафний проводили в двухлитровых емкостях из расчета 1 л культивационной среды на 25 дафний. На 1 литр вносили 20 мл суспензии корма.
Исходя из среднего диаметра клетки хлореллы 2.5 мкм, указанной численности клеток в миллилитре суспензии, концентрации Pt 600 мкг/г хлореллы, при разовом кормлении в тест-систему вносили ~1.6 мкг Pt на литр культивационной среды (1.6 × 10–9 г/г среды).
Через 24 ч после поступления НЧ в виде пищи с контаминированными водорослями концентрация Pt в организме дафний составила 5.44 ± ± 0.91 мкг/г и через 5 сут кормления увеличилась до 12.83 ± 2.16 мкг/г (рис. 3б). Таким образом, в первые сутки ФБА составил 3400, что превосходит биоконцентрирование из среды.
Коэффициент скорости очищения kcl= 0.7/сут (0.03/ч), t1/2 = 1 сут, что существенно меньше, чем при поступлении непосредственно из среды. Это указывает на возможный переход НЧ из желудочно-кишечного тракта (ЖКТ) в ткани и затрудненное очищение после переноса в интактную среду.
Основные показатели биоаккумуляции в зависимости от длительности экспозиции приведены в табл. 3.
Таблица 3.
Значения параметров биоаккумуляции дафниями НЧ Pt 5 нм из культивационной среды (ср) и по пищевой цепи (пц) от контаминированной наночастицами хлореллы
| Экспозиция, сут | kup ср | kup пц | ФБА ср | ФБА пц |
|---|---|---|---|---|
| 1 | 12 000 ± 920 | 15 000 ± 1200 | 840 ± 160 | 3600 ± 600 |
| 5 | 5700 ± 2300 | 18 000 ± 1500 | 2000 ± 380 | 8000 ± 1300 |
| 10 | 2300 ± 1100 | 7000 ± 930 | 1000 ± 200 | 4600 ± 760 |
| 20 | 7000 ± 1300 | 1900 ± 650 | 1200 ± 230 | 420 ± 120 |
| 28 | 5600 ± 1100 | 6600 ± 970 | 960 ± 180 | 1900 ± 530 |
Полученные данные согласуются с данными по биоконцентрации, представленными в [22]. Так, для НЧ Au диаметром 4 и 18 нм показано накопление за четверо суток с ФБА 6641 и 10 207 [37]. Однако не выдерживают критики приведенные здесь же расчеты по биоаккумуляции от контаминированных водорослей Selenastrum capricornutum без учета количества вносимых с водорослями НЧ.
Отметим сложность моделирования данных процессов в применении к НЧ. В условиях инкубирования одновременно протекают несколько процессов:
– поглощение дафниями клеток хлореллы, контаминированной НЧ, определяемое коэффициентом трофической активности;
– переход части НЧ в ткани дафний (активный и пассивный);
– выброс из организма дафний части НЧ с отходами жизнедеятельности (kcl);
– снижение удельной концентрации НЧ в биомассе дафний, связанное с “разбавлением” растущей биомассой (kg).
Кроме того, протекают процессы очищения клеток хлореллы от НЧ, определяемые kcl хлореллы, и переход НЧ в культивационную среду с последующей агрегационно-седиментационной элиминацией. Это создает существенные сложности для моделирования и предполагает – как оптимальный – путь непосредственного измерения указанных величин для оценки потенциальных рисков попадания НЧ в окружающую среду.
Аккумуляция НЧ Pt рыбами из культивационной среды. Эксперимент по оценке ФБА молодью Carpio проводили по стандартной методике [31]. Через 24 ч инкубирования в опытной среде, содержащей Pt размером 5 нм в концентрации 1 мг/л, концентрация элемента Pt в организме рыб увеличилась незначительно – до 0.7 ± 0.1 мкг/г. Максимальный рост концентрации наблюдался через 10 сут – до 51.7 ± 10.0 мкг/г (рис. 4а). Последующее снижение концентрации до 18.8 ± 3.2 мкг/г может быть связано с активацией защитных механизмов, препятствующих накоплению тяжелых металлов.
Рис. 4.
Содержание Pt в тест-организме Danio rerio при культивации в дисперсной системе НЧ Pt с концентрацией 1.0 мг/л (а) и при поступлении с кормом (б).
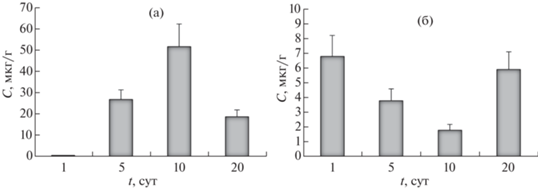
Эффективная среднесуточная концентрация была рассчитана для каждого периода с учетом ежедневной замены раствора на 10% и полной смены раствора 1 раз в 10 дней. Одновременно с каждым отбором проб Carpio проводили анализ проб культивационной воды. Исходя из полученных данных коэффициент скорости очищения kcl = 5/сут (0.1/ч), t1/2 = 0.3 сут (6.73 ч).
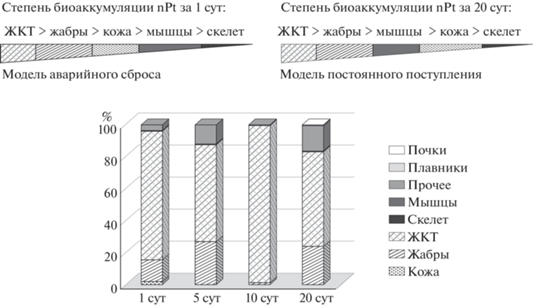
Очищение Carpio от накопленных НЧ проходит очень быстро. Возможно, преимущественное накопление НЧ происходит на коже и в пищеварительном тракте Carpio, а в фазу очищения происходит их достаточно быстрое вымывание при переходе в свободную от НЧ среду. Это предположение подтверждают результаты анализа накопления в органах и тканях карпиков (рис. 5).
Основные показатели биоаккумуляции в зависимости от длительности экспозиции приведены в табл. 4.
Таблица 4.
Значение коэффициента накопления (kup), кинетического (ФБАк) и статического (ФБА) факторов биоаккумуляции НЧ Pt из среды в тест-организмах Cyprinus carpio
| Экспозиция, сут | kup | ФБАк | ФБА |
|---|---|---|---|
| 1 | 7 ± 1 | 3 ± 1 | 3 ± 1 |
| 5 | 1100 ± 200 | 420 ± 80 | 430 ± 60 |
| 10 | 5800 ± 1200 | 2300 ± 470 | 2400 ± 440 |
| 20 | 1100 ± 200 | 450 ± 90 | 450 ± 90 |
Аккумуляция НЧ Pt рыбами при кормлении контаминированными дафниями. В использованной модели контаминирования Carpio по пищевой цепи источником НЧ являлись дафнии в возрасте 4–6 дней после 24-часового культивирования в дисперсной системе НЧ Pt. Концентрация НЧ, ассоциированных с дафниями, составляла 3063 ± ± 582 мкг/г.
Carpio содержали в культивационной воде НЧ из расчета 3 л воды на 1 г влажного веса рыб. Ежедневно проводили замену 10% культивационной воды на свежую. Кормление проводили в объеме 1–2% от влажного веса рыбы. Такой объем корма позволяет поддерживать постоянный вес рыбы [31]. Исходя из концентрации НЧ, накопленных в дафниях, массы дафний, которую использовали для кормления, и объема воды, концентрация НЧ Pt в модели составляла – 0.02 мг/л (0.02 мкг/г среды).
Через 24 ч после поступления НЧ в виде пищи концентрация Pt в гомогенате рыб возросла до 6.8 ± 1.4 мкг/г с последующим снижением и повторным ростом до 5.9 ± 1.2 мкг/г на 20-е сутки (рис. 4б).
Несмотря на существенное различие концентраций НЧ, вносимых в среду указанными методами (1.0 мг/л в ДС и 0.02 мг/л в дафниях), накопленная концентрация в рыбах различается не столь существенно – максимальные зарегистрированные значения составляют соответственно 51.7 и 6.8 мкг/л.
Очищение от НЧ в данном эксперименте происходило значительно медленнее, чем в серии с накоплением НЧ из среды. Коэффициент скорости очищения (kcl) составляет 0.8/сут (0.03/ч), t1/2 = 0.9 сут (21.7 ч), что в 3 раза медленнее, чем в эксперименте по накоплению НЧ из среды. Основные показатели биоаккумуляции в зависимости от длительности экспозиции приведены в табл. 5.
Таблица 5.
Значение коэффициента накопления (kup), кинетического (ФБАк) и статического (ФБА) факторов биоаккумуляции НЧ Pt по пищевой цепи в тест-организмах Cyprinus carpio
| Экспозиция, сут | kup | ФБАк | ФБА |
|---|---|---|---|
| 1 | 490 ± 100 | 630 ± 130 | 340 ± 70 |
| 5 | 150 ± 30 | 190 ± 40 | 190 ± 40 |
| 10 | 66 ± 13 | 87 ± 17 | 87 ± 17 |
| 20 | 220 ± 40 | 290 ± 60 | 290 ± 60 |
| 28 | 55 ± 11 | 72 ± 14 | 72 ± 14 |
Распределение НЧ Pt в тканях и органах Carpio при аккумуляции из культивационной среды. Как после первых суток экспозиции, так и в последующие сроки распределение накопленной Pt по тканям было неравномерным (рис. 5). Если рассматривать аккумуляцию в первые сутки как модель аварийного сброса наноматериалов, то опасность употребления и изготовления животноводческих кормов уменьшается в ряду: ткани ЖКТ–жабры–кожа–мышцы–скелет. При длительном воздействии опасность уменьшается в ряду: ткани ЖКТ–жабры–мышцы–скелет–кожа.
ЗАКЛЮЧЕНИЕ
Установлено, что введение НЧ Pt в среду обитания гидробионтов приводит к аккумуляции с хлореллой с коэффициентом, близким к 10 000 (9400 ± 1800).
Накопление Pt из окружающей среды в ракообразных и рыбах приблизительно одинаково (ФБАmax = 2000 ± 380 и 2400 ± 440 соответственно). Но при передаче по пищевой цепи наблюдается более высокий уровень аккумуляции НЧ в Daphnia (ФБАmax = 8000 ± 1300), чем в Carpio (ФБАmax = 340 ± 70), что, по всей видимости, связано с накоплением НЧ в их корме – хлорелле.
После аварийного сброса наноматериалов в среду для очищения рыб от НЧ необходима экспозиция в чистой воде в течение не менее трех суток.
Исследование выполнено при финансовой поддержке Российского научного фонда (грант № 20-17-00185).
Список литературы
Morgaleva T., Morgalev Y., Gosteva I. et al. // AIP Conf. Proc. 2017. V. 1899. P. 1. 050004. https://doi.org/10.1063/1.5009867
Morgalev S., Morgaleva T., Gosteva I., Morgalev Y. // IOP Conf. Ser.: Mater. Sci. Eng. 2015. V. 98. https://doi.org/10.1088/1757-899X/98/1/012006
Coll C., Notter D., Gottschalk F. et al. // Nanotoxicology. 2016. V. 10. P. 436.
Lushchaeva I.V., Morgalyev Y.N., Loiko S.V. // Nano Hybrids Composites. 2017. V. 13. P. 108.
Li Y., Zhang W., Niu J., Chen Y. // Environ. Sci. Technol. 2013. V. 47. P. 10293.
Zhang W., Li Y., Niu J., Chen Y. // Langmuir. 2013. V. 29. P. 4647.
Astafurova T., Zotikova A., Morgalev Y. et al. // IOP Conf. Ser.: Mater. Sci. Eng. 2015. V. 98. https://doi.org/10.1088/1757-899X/98/1/012004
Wang Z.Y., Li J., Zhao J., Xing B.S. // Environ. Sci. Technol. 2011. V. 45. P. 6032.
Geisler-Lee J., Wang Q., Yao Y. et al. // Nanotoxicology. 2013. V. 7. P. 323.
Zhang W., Rittmann B., Chen Y. // Environ. Sci. Technol. 2011. V. 45. P. 2172.
Patil S., Sandberg A., Heckert E. et al. // Biomaterials. 2007. V. 28. P. 4600.
Schwegmann H., Feitz A.J., Frimmel F.H. // J. Colloid Interface Sci. 2010. V. 347. P. 43.
Lekamge S., Miranda A.F., Ball A.S. et al. // PLOS One. 2019. V. 14. № 4. https://doi.org/10.1371/1
Wang Y., Zhu X., Lao Y. et al. // Sci. Total Environ. 2016. V. 565. P. 818.
Zhu B., Zhu S., Li J. et al. // Toxicol. Res. (Camb). 2018. V. 7. № 5. P. 897. https://doi.org/10.1039/c8tx00084k
Zhu X., Zhu L., Chen Y., Tian S. // J. Nanopart. Res. 2009. V. 11. P. 67.
Adams L.K., Lyon D.Y., McIntosh A., Alvarez P.J. // Water Sci. Technol. 2006. V. 54. P. 327.
Zhu X., Chang Y., Chen Y. // Chemosphere. 2010. V. 78. P. 209.
Zhao C.M., Wang W.X. // Environ. Sci. Technol. 2010. V. 44. P. 7699.
Hu J., Wang D., Wang J. // Environ. Pollut. 2012. V. 162. P. 216.
Zhu X., Wang J., Zhang X. et al. // Chemosphere. 2010. V. 79. P. 928.
Zhang X., Sun H., Zhang Z. et al. // Chemosphere. 2007. V. 67. P. 160.
Bouldin J.L., Ingle T.M., Sengupta A. et al. // Environ. Toxicol. Chem. 2008. V. 27. P. 1958.
Werlin R., Priester J.H., Mielke R.E. et al. // Nat. Nanotechnol. 2011. V. 6. P. 65.
Ates M., Arslan Z., Demir V. et al. // Environ Toxicol. 2015. V. 30. № 1. P. 119. https://doi.org/10.1002/tox.22002
Lee W.M., Yoon S.J., Shin Y.J., An Y.J. // Environ. Pollut. 2015. V. 201. P. 10.
Svetlichnyi V., Shabalina A., Lapin I. et al. // Appl. Surf. Sci. 2016. V. 372. P. 20.
ISO Water Quality Sampling. 1997. ISO 5667. Pt 16. Guidance on biotesting of samples. Wiley-VCH. Weinheim-New York. Available. http://www.iso.org
Morgalev S., Morgaleva T., Morgalev Y., Gosteva I. // Adv. Mater. Res. 2015. V. 1085. P. 424. https://doi.org/10.4028/www.scientific.net/amr.1085.424
OECD Test № 236. “Fish Embryo Acute Toxicity (FET)”. Guideline for Testing of Chemicals. 2013.
OECD Test № 305. “Bioaccumulation in Fish: Aqueous and Dietary Exposure”. OECD Guidelines for the Testing of Chemicals. Section 3. OECD Publishing. Paris. 2012. https://doi.org/10.1787/9789264185296-en
OECD Test № 317. “Bioaccumulation in Terrestrial Oligochaetes”. OECD Guidelines for the Testing of Chemicals. Section 3. OECD Publishing. Paris. 2010. https://doi.org/10.1787/9789264090934-en
Klaine S.J., Alvarez P.J., Batley G.E. et al. // Environ. Toxicol. Chem. 2008. V. 27. № 9. P. 1825.
Globally Harmonised System of Classification and Labelling of Chemicals. ST/SG/AC.10/30/Rev.6. 2015. P. 536. https://doi.org/10.18356/4e868e57-ru
ПНД Ф Т 14.1:2:4.10-2004. “Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод и отходов, питьевой, сточной и природной воды по изменению оптической плотности культуры водоросли Chlorella vulgaris Beijer”. Москва. 2014.
Zhu X., Wang J., Zhang X. et al. // Chemosphere. 2010. V. 79. P. 928.
Osborne-Koch M. “Uptake of Gold Nanoparticles in an Algae – Daphnid Food Chain”. A Thesis Presented to the Graduate School of Clemson University. In Partial Fulfillment of the Requirements for the Degree Master of Science Environmental Toxicology. 2009. 44 p.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии