Российские нанотехнологии, 2023, T. 18, № 1, стр. 44-52
ИЗУЧЕНИЕ ПОВЕРХНОСТНЫХ СВОЙСТВ И БИОСОВМЕСТИМОСТИ ПЛЕНОК, ПОЛУЧЕННЫХ МЕТОДОМ ЦЕНТРИФУГИРОВАНИЯ ИЗ РАСТВОРОВ ХИТОЗАНА В ПРИСУТСТВИИ СШИВАЮЩЕГО РЕАГЕНТА
Н. Р. Кильдеева 1, *, В. А. Захарова 1, О. В. Баранов 2, В. Б. Метелин 1, 3, И. А. Василенко 1, 3
1 Российский государственный университет им. А.Н. Косыгина
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
3 Московский областной научно-исследовательский и клинический институт им. М.Ф. Владимирского “МОНИКИ”
Москва, Россия
* E-mail: kildeeva@mail.ru
Поступила в редакцию 05.10.2022
После доработки 31.10.2022
Принята к публикации 31.10.2022
Аннотация
Тонкие хитозансодержащие пленки представляют собой уникальные матричные материалы, используемые для иммобилизации интактных клеток. Продемонстрирована возможность проведения неинвазивной оценки структуры поверхности биоактивных аминосодержащих тонких полимерных покрытий из хитозана и его композиции с фиброином, сшитых дженипином, полученных методом центрифугирования. Исследовано влияние композиционного состава, морфологии и получения методом центрифугирования тонких пленок на морфофункциональные характеристики клеточного материала. Определены условия использования методов тензиометрии, атомно-силовой и лазерной модуляционной интерференционной микроскопии для исследования структуры поверхности как гладких, так и шероховатых наноразмерных биополимерных покрытий.
ВВЕДЕНИЕ
При создании новых материалов для биомедицинской инженерии биосовместимость является важнейшим фактором. К сожалению, ограниченное число материалов обладает хорошей биосовместимостью и может применяться в/или на теле человека. В этой связи поверхностные свойства приобретают наибольшую актуальность, поскольку поверхность объекта соприкасается с тканями организма. Поверхностные свойства материала определяют его биосовместимость при контакте со средой организма [1]. Зачастую для повышения биосовместимости медицинских имплантатов и уменьшения риска их капсуляции изделия покрывают белками, полисахаридами, а также биокомпозиционными материалами [2]. Кроме того, покрытия из биополимеров способны обеспечивать структурную целостность имплантата, контролировать доставку лекарств и ферментов, служить адгезивами или барьерами между живой тканью и различными поверхностями [3].
Покрытия на основе биополимеров могут быть получены различными физическими или химическими методами. Если покрытие формируют за счет химических реакций между биополимером и субстратом, как правило, требуется предварительная обработка поверхности подложки. С использованием физических методов раствор биополимера наносят непосредственно на подложку с помощью определенной техники, например методом полива или погружением, электроформованием или распылением и т.д. Погружение или полив на твердую подложку с последующим испарением растворителя являются наиболее простыми способами нанесения биополимера, однако при этом формируется пленка толщиной несколько десятков микрометров, что может быть неприемлемым при последующей эксплуатации материала. Уникальным направлением поверхностной модификации является получение моно- и многослойных нано- и микрополимерных пленочных покрытий методом центрифугирования (spin coating). Такое покрытие позволяет получать однородные тонкие пленки и покрытия варьируемой толщины на твердой подложке с помощью вращения с высокой скоростью. Данный метод широко используется в разработках, связанных с тканевой инженерией, из-за удобства исследования клеточной адгезии на микро- и наноразмерной поверхности с известной морфофункциональностью [4–7]. Конечная толщина покрытия зависит от состава, концентрации и реологии раствора биополимера, а также от параметров центрифугирования и внешних условий [8, 9].
В [10–12] был разработан ряд материалов (нетканые волокнистые материалы, пленки, биополимерные пористые матриксы) на основе полисахарида хитозана, его композиций с белками (коллагеном, спидроином, фиброином, кератином) [13] и сшивающего реагента природного происхождения дженипина, показаны биологическая активность и отсутствие цитотоксичности полученных материалов. Для системы раствор хитозана–дженипин нами было обнаружено наличие индукционного периода роста вязкости, что позволило использовать ее для формования полимерных материалов из раствора. Исследование свойств тонких пленок на основе хитозан-фиброинового комплекса позволит на микроуровне оценить биосовместимость данного материала с перспективой его дальнейшего использования в регенеративной медицине и тканевой инженерии как в качестве покрытий отдельных медицинских изделий, так и создании на его основе матричных структур.
Цель настоящей работы – получение методом центрифугирования и изучение поверхностных и морфофункциональных свойств биополимерных покрытий на основе растворов хитозана, его композиции с фиброином и дженипином.
МЕТОДЫ
Приготовление рабочих растворов. Рабочие 2%-ные растворы хитозана готовили путем растворения в 2%-ном растворе уксусной кислоты в воде навески сухого полисахарида хитозана (C.E. Roeper GmbH, Германия) при комнатной температуре и постоянном перемешивании на магнитной мешалке (ПЭ-6110, Россия) со скоростью 1000 об./мин. Рабочие 2%-ные растворы фиброина готовили путем растворения в воде навески лиофильно высушенного белкового порошка при комнатной температуре. Совместный раствор биополимеров был подготовлен путем смешения указанных растворов в соотношении 1:1.
Растворы сшивающего агента дженипина (Sigma-Aldrich, США) готовили путем растворения в дистиллированной воде навески сухого вещества при температуре 35°С. Концентрацию раствора дженипина рассчитывали исходя из заданной степени сшивки при его мольном соотношении с аминогруппами хитозана (моль дженипина/моль ‒NH2-групп), равном 0.04, 0.005, 0.001 моль/моль. Сшивку полисахарида и белково-полисахаридного комплекса проводили по методике, описанной в [12].
Изучение динамической вязкости растворов хитозана в процессе сшивки дженипином регистрировали в открытой ячейке вибрационного вискозиметра “Sv-10A” (AND, Япония) при комнатной температуре. Время резкого роста вязкости идентифицировали как точку гелеобразования.
Получение тонких пленочных покрытий методом spin coating. Тонкие однослойные пленочные покрытия получали на предварительно охарактеризованных кремний-алюминиевых пластинах (Toshiba, Япония) и предметных стеклах методом центрифугирования (spin coating) из растворов биополимеров, а также их реакционноспособной смеси, содержащей дженипин. Варьирование наносимого на подложку объема раствора, времени и скорости вращения рабочей установки позволяет управлять процессом структурирования поверхности пространственно сшитых матриц в процессе испарения растворителя и сшивки для получения изделий с необходимой толщиной и топографией поверхности. Для формирования равномерного покрытия с необходимой толщиной заданный объем раствора наносили на предварительно закрепленную в установке “ОПн-8” подложку и центрифугировали в течение 5 мин при скорости вращения 2000 об./мин до полного испарения растворителя.
Исследование размерных эффектов при смачивании поверхности. Тензиометрию проводили на приборе “Tracker” (IT Concept, Франция). В качестве тестовой жидкости для определения межфазной энергии подложек и покрытий использовали дистиллированную воду. Измерение краевых углов θ проводили при комнатной температуре методом лежащей капли с использованием программы WDROP, а расчет σ – методом Оуэнса–Вендта–Кьельбле [14, 15]. С использованием полученных данных установили количественные значения энергии когезии и адгезии исследуемой поверхности.
Исследование морфологии биополимерных покрытий методом интерференционной микроскопии. Определение основных параметров полученных покрытий – толщины и морфологии поверхности – проводили с помощью лазерного модуляционного интерференционного микроскопа MIM-340 (Швабе, Россия) путем измерения локальных фаз промодулированной объектом световой волны по разности высот между границами пленка–подложка и пленка–поверхность с учетом зеркальной поверхности подложки и того, что фазовая модуляция при этом эквивалентна регулированию оптической толщины интерферометра. Полученные на микроскопе МIМ-340 изображения преобразовывали в цифровые данные с помощью программы Мatrix Laboratory-2017 для получения 3D-карты поверхности, а также возможности количественного определения значения шероховатости (Ra) поверхности и толщины полученного образца в нанометрах.
Изучение поверхности биополимерных покрытий методом атомно-силовой микроскопии (АСМ). В качестве сравнительного метода использовали АСМ на основе микроконсольной системы “NtegraPrima” (NT-MDT, Россия). Электронная схема контроллера была переключена в полуконтактный режим с использованием зондового датчика CSG01 (размер – 3.4 × 1.6 × 0.3 мм, радиус кончика иглы – 10 нм, жесткость – 0.03 Н/м), с заданием основных параметров в соответствии с выбранной конфигурацией (коэффициент усиления цепи, частота пьезодрайвера, амплитуда выходного сигнала, коэффициент усиления входного детектора). Полученные данные подвергали обработке и сравнительному анализу в программе управления сканирующим зондовым микроскопом “Nova” на базе платформы ИНТЕГРА и Solver.
Изучение влияния поверхностных свойств и состава биополимерных покрытий на морфологию и функциональное состояние клеточного материала (тромбоцитов). Проводили забор цельной крови из кубитальной вены в объеме 4 мл в вакуумные пробирки с КЭДТА. Для получения плазмы, обогащенной тромбоцитами, кровь центрифугировали при 1000 об./мин в течение 5 мин. Взвесь тромбоцитов объемом 1.0 мл выдерживали 120 мин при 37°С на пленочных биополимерных покрытиях и далее проводили неинвазивную количественную денситометрическую оценку структурных и размерных показателей живых тромбоцитов с использованием МIМ-340. В режиме реального времени анализировали морфоденситометрические показатели каждой отдельной клетки и исследуемой популяции в целом, включая геометрические (размерные) параметры – диаметр, периметр, площадь и оптические – фазовую высоту (толщину) и объем, отражающие состояние грануломера. Параллельно оценивали функциональный (активационный) статус каждой клетки по их распластыванию, сферолизации, появлению отростков. Контролем служили исходные показатели морфофункционального состояния тромбоцитов до контакта с полимером, а также пробы, в которых клетки инкубировали в отсутствие тонких покрытий.
С помощью программ MatLab и Мatrix Laboratory-2017 осуществляли анализ количественных показателей морфофункционального состояния клеток путем визуализации топограммы, профиля и 3D-реконструкции живых клеток на интерферограммах.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для изучения структурно-функциональных свойств поверхности был получен ряд биополимерных матриц на основе хитозана методом центрифугирования из растворов, содержащих и не содержащих сшиваюший реагент дженипин. Данный метод позволяет сформировать пленки и покрытия с наиболее гладкой поверхностью, благодаря которым можно получить достоверную информацию о клеточной адгезии, пролиферации и цитотоксичности материалов заданного состава и функциональности.
Тонкие однослойные хитозановые покрытия получали путем нанесения дозированного объема раствора заданной концентрации на кремний-алюминиевые пластины. Путем варьирования наносимых на поверхность подложки объемов раствора хитозана (от 50 мкл до 1 мл) и параметров центрифугирования (время и скорость оборотов в минуту) были выбраны оптимальные условия получения биополимерного тонкого покрытия с учетом необходимости полного испарения растворителя и формирования планарно-ориентированного однородного равномерного покрытия. Все исследуемые пленки получали центрифугированием 300 мкл формовочного раствора в течение 5 мин при скорости 2000 об./мин.
Для оценки морфологии помимо АСМ использовали интерференционную микроскопию, которая представляет собой современный, достоверный, сверхразрешающий метод, используемый в основном для решения прикладных и фундаментальных задач биомедицинских исследований, позволивший быстро оценить структурные и функциональные свойства биополимерных покрытий.
Введение в состав формовочного раствора сшивающего реагента приводит к увеличению вязкости системы и формированию трехмерной сшитой структуры полимера, препятствующей растворению в воде даже протонированной его формы.
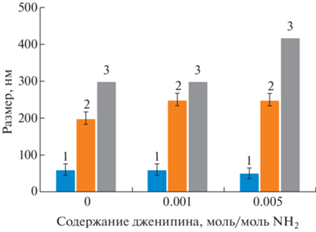
В MatLab визуализированы интерферограммы, с помощью которых можно оценить влияние сшивки дженипином на морфологию поверхности хитозановых тонких покрытий (рис. 1). Размерные параметры шероховатостей поверхности исходных и модифицированных хитозановых покрытий практически идентичны, однако толщина сшитых тонких пленок, измеренная на одинаковом расстоянии от края, на 25% (что соответствует разности в 50 нм) выше соответствующих значений для исходных хитозановых пленок (рис. 2). Данную разность в показателях толщины тонких покрытий можно объяснить заметным увеличением вязкости наносимого раствора в процессе сшивки.
Рис. 1.
Фазовые изображения края (а, в) и поверхности (б, г) хитозановых пленок (а, б) и хитозановых пленок, сшитых дженипином (в, г).

Рис. 2.
Зависимость шероховатости (1) и толщины пленок из хитозана (среднее (2) и максимальное (3) значения) от содержания дженипина.
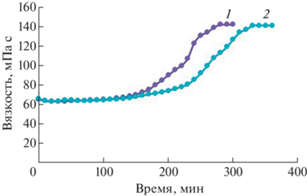
Из результатов, представленных на рис. 3, видно, что в процессе сшивки дженипином происходит значительный рост вязкости раствора хитозана. Это обусловливает формирование более толстых покрытий за счет затруднения процесса растекания наносимого объема раствора по подложке под действием центробежных сил в процессе центрифугирования.
Рис. 3.
Кинетика гелеобразования раствора хитозана в присутствии дженипина 0.005 (1) и 0.001 (2) моль/моль NH2.
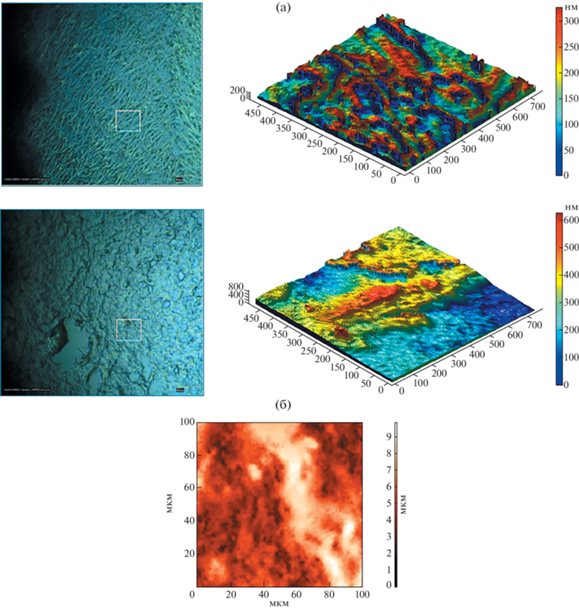
Добавление к хитозану белка фиброина обеспечивает формирование покрытий с составом, подобным внеклеточному матриксу (естественной среде формирования живых тканей [16]) и позволяет регулировать морфофункциональные свойства биополимерного матрикса. При исследовании поверхностных свойств тонкопленочных фиброин-хитозановых покрытий, представленных на рис. 4, установлено, что средний размер шероховатостей составляет 50–60 нм.
Рис. 4.
Морфология поверхности тонких хитозановых пленок, содержащих фиброин (1:1): а – оптические (слева) и фазовые (справа) изображения поверхности; б – АСМ-изображения (слева) и микропрофиль (справа) поверхности.
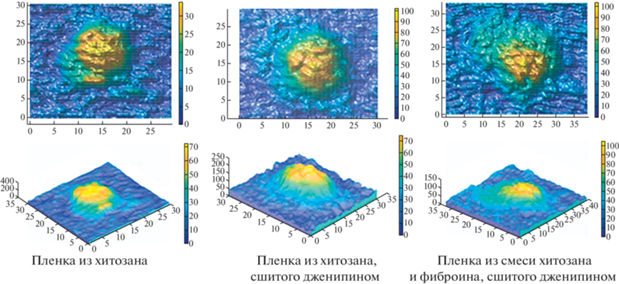
Наличие аминогрупп у хитозана и фиброина обеспечивает возможность включения белка в трехмерную структуру сшитого дженипином хитозана. Оптические, АСМ и фазовые интерференционные изображения поверхности пленок, полученных из смешанных растворов фиброина и хитозана, сшитых дженипином, представлены на рис. 5. При добавлении фиброина при сшивке хитозана дженипином в результате фазового разделения в процессе удаления растворителя на интерферограммах были выделены отдельные области микронных образований, обусловленные неоднородностью рельефа композиционного тонкопленочного матричного покрытия. При сравнении АСМ-изображений можно сделать вывод о наличии неровностей и шероховатости рельефа поверхности, позволяющей прогнозировать хорошую адгезию и способствование распластыванию клеток [17] при использовании данных покрытий в тканевой инженерии.
Рис. 5.
Морфология поверхности сшитых дженипином тонких хитозановых пленок, содержащих фиброин (1:1): а – оптические (слева) и фазовые (справа) изображения поверхности; б – АСМ-изображения (слева) и микропрофиль поверхности (справа).

Для предварительной оценки адгезии живого клеточного материала к поверхности матрикса используют характеристики поверхностной энергии [18] на границе раздела исследуемая поверхность покрытия–тестовая полярная жидкость. В качестве тестовой полярной жидкости использовали дистиллированную воду. Данный выбор обусловлен тем, что вода является основной составляющей интерстициальной жидкости, омывающей ткани, она также находится в клетках организма в свободной и в связанной форме. Изучение поведения воды на границе раздела с исследуемой поверхностью является важным для характеристики поверхностных свойств материалов, предназначенных для контакта со средой живого организма [19].
C использованием метода капельной тензиометрии определили значения поверхностной энергии контактирующих фаз, показания краевого угла смачивания покрытия, когезию и работу адгезии. В качестве объектов изучения были выбраны тонкие пленки из хитозана, хитозана, сшитого дженипином, и сшитых дженипином композиционных пленочных покрытий на основе хитозана и фиброина (табл. 1).
Таблица 1.
Поверхностные свойства пленочных покрытий на основе хитозана и дженипина
| Характеристика | Состав пленочного покрытия | ||
|---|---|---|---|
| Хитозан | Хитозан, сшитый дженипином | Хитозан–фиброин (1:1), сшитые дженипином | |
| Изображение капли |  |
 |
 |
| Краевой угол смачивания (θ), град | 79.6 | 88.5 | 25.6 |
| Межфазное поверхностное натяжение (σ), мН/м | 42.73 | 51.35 | 42.913 |
| Работа когезии Wк, мДж/м2 | 85.5 | 102.7 | 85.83 |
| Работа адгезии, Wа, мДж/м2 | 48.67 | 45.1 | 81.61 |
Из данных табл. 1 можно сделать вывод, что сшивка хитозана дженипином приводит к некоторой гидрофобизации поверхности материала, появляющейся в увеличении показателя поверхностной энергии и снижении работы адгезии. При контакте поверхности сшитого хитозанового покрытия с тестовой полярной жидкостью (дистиллированной водой) работа адгезии меньше работы когезии, что соответствует установлению равновесия между смачивающей полярной жидкостью и поверхностью сшитого хитозанового покрытия, которое препятствует растеканию жидкости по поверхности матрицы, и, как следствие, возможно некоторое препятствование закреплению клеток на поверхности хитозана.
Введение белка фиброина даже в присутствии сшивающего реагента способствует снижению показателя краевого угла смачивания до 25.6° и увеличению растекания капли. Увеличение растекаемости полярной жидкости на поверхности покрытия связано с близкими значениями работы адгезии и когезии. Полученные методом тензиометрии показатели, а также зафиксированная методами микроскопии высокая шероховатость сшитых дженипином хитозан-фиброиновых композиционных тонких пленок позволяют сделать вывод, что данная поверхность может способствовать адгезии и распластыванию клеток при использовании в качестве матричных покрытий для тканевой инженерии. Изложенные предположения о перспективе использования пленочных покрытий на основе исследуемых систем в качестве матриксов для тканевой инженерии были проверены в опытных цитологических исследованиях in vitro.
Для изучения биологических свойств и биоактивности полученных покрытий на основе аминосодержащих полимеров анализировали особенности их взаимодействия с живыми клетками с использованием технологии реального времени количественного фазового имиджинга (QPI) на основе сверхразрешающей лазерной модуляционной интерференционной микроскопии. Оценка морфофункционального состояния тромбоцитов при контакте с биополимерными тонкими пленками, сформованными на зеркальной подложке методом центрифугирования, приведена на рис. 6.
Рис. 6.
Фазовая топограмма поверхности цитообъекта и 3D-реконструкция при контакте с образцами хитозан- и фиброинсодержащих полимерных покрытий, полученная с использованием модуляционной интерференционной микроскопии.
Известно, что химические, физические, структурные и механические свойства биоматериалов модулируют биохимические сигналы (лиганд–рецептор), которые определяют процесс взаимодействия клетки с биополимерными матрицами [20].
Полученные результаты свидетельствуют о достаточно значимой степени активации анализируемой популяции клеток после контакта с субстратом за счет увеличения числа активированных клеток с тенденцией к распластыванию и формированию многочисленных отростков. Согласно “модели клеточной адгезии” чем больше клетка распластывается, тем большим сродством к поверхности она обладает. При контакте клетки с анализируемыми аминосодержащими поверхностями проявляют признаки функциональной активности, количественно характеризующиеся увеличением диаметра, периметра и площади. Из визуализированных 3D-реконструкций и фазовых топограмм, представленных на рис. 6, следует, что наибольшей биологической активностью обладает сшитое дженипином покрытие состава фиброин/хитозан 1:1. Сродство клеток к субстрату является решающим фактором в проектировании и разработке биоматериалов. Можно предположить, что на уровень активации популяции тромбоцитов, включая выраженность адгезивных свойств, влияет степень неоднородности образцов полимера.
ЗАКЛЮЧЕНИЕ
Создание на твердых поверхностях тонких покрытий из полимеров является одним из методов улучшения биосовместимости материалов. С использованием центрифугирования (spin coating) получены однородные тонкие пленки варьируемой толщины на основе растворов хитозана и фиброина в присутствии и в отсутствие сшивающего реагента. Исследовано влияние композиционного состава, морфологии и особенностей получения тонких покрытий из хитозана и его композиции с фиброином, сшитых дженипином, на их морфофункциональные характеристики при взаимодействии с клеточным объектом согласно модели клеточной адгезии [21]. На градиент толщины и шероховатость биополимерного покрытия, полученного методом центрифугирования при постоянной скорости вращения из эквиконцентрированных растворов хитозана, влияет содержание сшивающего реагента: чем выше молярное соотношение дженипин/NH2, тем в большей степени увеличивается вязкость раствора в процессе сшивки хитозана. Анализ влияния состава и неоднородности композиционного покрытия на состояние поверхности тонких биополимерных покрытий показал увеличение показателя поверхностной энергии и снижение работы адгезии, что указывает на гидрофобизацию поверхности. Продемонстрирована возможность проведения оценки структуры поверхности биоактивных аминосодержащих тонких полимерных покрытий из хитозана и его композиции с фиброином, сшитых дженипином, и установлена корреляция методов тензиометрии и лазерной модуляционной интерференционной микроскопии поверхности для оценки поверхностных свойств и биосовместимости тонких полимерных покрытий. С использованием интерференционной микроскопии для визуализации и количественной неинвазивной оценки изменений клеточной архитектоники обнаружен статистически значимый уровень активации тромбоцитов после контакта с биополимерным субстратом на основе хитозана и фиброина, проявляющийся изменением их морфологии, размеров, появления отростков и т.д., объективно отражающий степень неоднородности покрытий, что позволяет рассматривать эти клетки в качестве своеобразного биосенсора при оценке особенностей структуры полимерных композитов.
Работа выполнена при частичной финансовой поддержке Российского научного фонда (проект № 22-13-00261).
Список литературы
Ratner B.D. // Host response to biomaterials. Academic Press, 2015. P. 37. https://doi.org/10.1016/B978-0-12-800196-7.00003-7
Park S.B., Lih E., Park K.S. et al. // Prog. Polym. Sci. 2017. V. 68. P. 77. https://doi.org/10.1016/j.progpolymsci.2016.12.003
Song J., Winkeljann B., Lieleg O. // Adv. Mater. Interfaces. 2020. V. 7. № 17. P. 2000850. https://doi.org/10.1002/admi.202000850
Wang X., Kim H.J., Xu P. et al. // Langmuir. 2005. V. 21. № 24. P. 11335. https://doi.org/10.1021/la051862m
Minoura N., Aiba S.I., Gotoh Y. et al. // J. Biomed. Mater. Res. 1995. V. 29. № 10. P. 1215. https://doi.org/10.1002/jbm.820291008
Inoue I., Shino K., Noji S. et al. // J. Biochem. Biophys. Methods. 1998. V. 37. № 3. P. 159. https://doi.org/10.1016/S0165-022X(98)00024-4
Sofia S., McCarthy M.B., Gronowicz G., Kaplan D.L. // J. Biomed. Mater. Res. 2001. V. 54. № 1. P. 139. https://doi.org/10.1002/1097-4636(200101)54:1<139: :AID-JBM17>3.0.CO;2-7
Tyona M.D. // Adv. Mater. Res. 2013. V. 2. № 4. P. 195. https://doi.org/10.12989/amr.2013.2.4.195
Norrman K., Ghanbari-Siahkali A., Larsen N.B. // Annual Rep. C. 2005. V. 101. P. 174. https://doi.org/10.1039/B408857N
Zakharova V.A., Kildeeva N.R. // Polysaccharides. 2021. V. 2. № 1. P. 154. https://doi.org/10.3390/polysaccharides2010011
Sazhnev N.A., Gridina N.N., Kil’deeva N.R. // Fibre Chem. 2021. V. 52. № 6. P. 394. https://doi.org/10.1007/s10692-021-10219-9
Kildeeva N., Chalykh A., Belokon M. et al. // Polymers. 2020. V. 12. № 5. P. 1086. https://doi.org/10.3390/polym12051086
Laurencin C.T., Jiang T., Kumbar S.G., Nair L.S. // Curr. Top. Med. Chem. 2008. V. 8. № 4. P. 354. https://doi.org/10.2174/156802608783790974
Owens D., Wendt R. // J. Appl. Polym. Sci. 1969. V. 13. P. 1741. https://doi.org/10.1002/app.1969.070130815
Kaelble D.H. // J. Adhesion. 1970. V. 2. P. 66 https://doi.org/10.1080/0021846708544582
Spang M.T., Christman K.L. // Acta Biomater. 2018. V. 68. P. 1. https://doi.org/10.1016/j.actbio.2017.12.019
Díaz-Visurraga J., Garcia A., Cardenas G. // J. Appl. Microbiol. 2010. V. 108. № 2. P. 633. https://doi.org/10.1111/j.1365-2672.2009.04447.x
Hallab N.J., Bundy K.J., O’Connor K. et al. // Tissue Engineering. 2001. V. 7. № 1. P. 55. https://doi.org/10.1089/107632700300003297
Bhattacharjee P., Naskar D., Maiti T.K. et al. // Appl. Mater. Today. 2016. V. 5. P. 52. https://doi.org/10.1016/j.apmt.2016.09.007
Di Cio S., Gautrot J.E. // Acta Biomater. 2016. V. 30. P. 26. https://doi.org/10.1016/j.actbio.2015.11.027
Richards R.G. // Injury. S. 1996. V. 27. P. 38. https://doi.org/10.1016/0020-1383(96)89031-0
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


