Российские нанотехнологии, 2023, T. 18, № 1, стр. 38-43
ВЛИЯНИЕ ВОЗРАСТА ПОСЕВНОГО МАТЕРИАЛА НА РОСТ ЦИАНОБАКТЕРИИ Arthrospira platensis И НАКОПЛЕНИЕ С-ФИКОЦИАНИНА
Я. Э. Сергеева 1, 2, *, Д. В. Сухинов 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Московский физико-технический институт (Национальный исследовательский университет)
Долгопрудный, Россия
* E-mail: yanaes2005@gmail.com
Поступила в редакцию 05.10.2022
После доработки 07.11.2022
Принята к публикации 07.11.2022
Аннотация
Свыше половины антропогенных выбросов углерода фиксируется и повторно используется в цикле углерода, при этом до 30% осуществляется с участием цианобактерий. Цианобактерии рода Arthtrospira являются одними из наиболее широко культивируемых в промышленных масштабах фототрофных микроорганизмов ввиду высокого содержания белка, а также биологически активных соединений с высокой добавленной стоимостью. Исследовано влияние возраста посевного материала (инокулята) на рост цианобактерии Arthrospira platensis В-12619 (ВКПМ) при культивировании в колбах Эрленмейера на питательных средах разного состава. Выявлено, что продуктивность биомассы зависит от возраста инокулята и эта зависимость отмечена для всех испытанных составов питательных сред. Максимальный выход С-фикоцианина не менее 300 мг/л достигнут при использовании четырехсуточного инокулята.
ВВЕДЕНИЕ
Высокие выбросы двуокиси углерода в результате антропогенной деятельности стали глобальной проблемой. Текущие стратегии контроля выбросов CO2 включают в себя каталитическое восстановление, повышение энергоэффективности, использование менее углеродоемких видов топлива, ядерную энергию, возобновляемые источники энергии и улучшение биологических поглотителей. Одним из альтернативных способов, который естественным образом способствует улавливанию CO2, является фитосеквестрация – фиксация атмосферного углерода растениями и фототрофными микроорганизмами (водорослями и цианобактериями) [1].
Известно, что ~57% антропогенных выбросов углерода фиксируется и повторно используется в цикле углерода [2] и до 30% глобальной фиксации углерода осуществляется цианобактериями [3]. По эффективности фиксации углекислого газа фототрофные микроорганизмы, в том числе цианобактерии, в десятки раз превосходят наземные растения [4]. Цианобактерии характеризуются высокой скоростью роста, кроме того, за короткие промежутки времени они способны синтезировать и накапливать различные ценные компоненты.
Цианобактерии рода Arthtrospira являются одними из наиболее широко культивируемых в промышленных масштабах фототрофных микроорганизмов в виду высокого содержания белка, а также биологически активных соединений с высокой добавленной стоимостью.
Благодаря присвоению A. platensis статуса GRAS (общепризнано безопасным) и значительному содержанию в ней незаменимых амино- и жирных кислот, антиоксидантов и витаминов биомасса цианобактерии широко используется как пищевая добавка в виде сухого порошка или капсул, а также как кормовая добавка в животноводстве [5]. Помимо этого, в продукты здорового питания могут включаться биологически активные соединения с высокой добавленной стоимостью (каротиноиды, хлорофиллы, полиненасыщенные жирные кислоты и пр.) [6].
Одним из наиболее ценных компонентов, получаемых из биомассы A. platensis, является С-фикоцианин (С-ФЦ) – пигмент-белковый комплекс, обладающий рядом полезных свойств, среди которых антиоксидантные, противовоспалительные, иммуностимулирующие и противораковые [7, 8]. Учитывая эти свойства и естественный насыщенный синий цвет, С-ФЦ используется не только в качестве натурального пищевого красителя, но и как действующий агент для косметической и фармацевтической промышленностей, а также как флуоресцентный краситель в лабораторных исследованиях [9]. Кроме того, возможно использование С-ФЦ в проточной цитометрии, флуоресцентном иммуноанализе и флуоресцентной микроскопии [10].
При рассмотрении крупномасштабного (промышленного) производства биомассы фототрофных организмов (микроводорослей и цианобактерий), а также ценных продуктов, синтезируемых данными организмами, одним из ключевых вопросов для исследователей и инвесторов является определение экономической целесообразности производства. Анализ затрат любого производства зависит от досконального знания всех этапов производственного процесса: от входных данных, баланса массы и энергии до деталей используемого оборудования [11].
Доказано, что на активность ростовых процессов и накопление биомассы Arthrospira, на ее способность синтезировать белки и C-ФЦ влияет ряд химических и физических факторов, а именно, состав питательной среды, концентрация солей, температура, интенсивность освещения, световой режим, а также параметры культивирования и конфигурации фотобиореактора [5].
Arthrospira, будучи алкофильной, характеризуется стабильным ростом на средах с высоким рН (9–11) и высокими концентрациями солей (карбонаты и бикарбонаты) [12]. Отметим, что бикарбонаты включаются в состав компонентов питательной среды для достижения высокой щелочности, обеспечивая при этом постоянное снабжение источником углерода для оптимального роста [5].
Стандартной, классической, эталонной питательной средой для культивирования Arthrospira (Spirulina) является среда Заррука [13] ввиду оптимального состава компонентов, который способствует быстрому росту и высокому выходу (г/л) биомассы. Для крупномасштабного культивирования цианобактерии классический состав питательной среды Заррука подвергался различным модификациям за счет изменения концентрации компонентов, а также с использованием недорогих источников питательных веществ [14]. Кроме того, в качестве альтернативы для обеспечения экономической жизнеспособности производства Arthrospira были рассмотрены сточные воды [15, 16], промышленные отходы, такие как стоки анаэробного сбраживания, меласса [11].
Отметим, что наряду с данными о составах питательных сред одним из ключевых моментов для создания рентабельного производства и экономической эффективности культивирования коммерчески значимых цианобактерий и микроводорослей являются фундаментальные знания о физиологии организма, в том числе для подготовки и производства инокулята [11, 17].
Цель исследования – изучение влияние возраста инокулята на рост цианобактерии A. platensis и накопление С-ФЦ для стандартизации инокулята.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования была выбрана нитевидная цианобактерия Arthrospira platensis В-12619 (ВКПМ).
Условия культивирования. Культивирование проводили в колбах Эрленмейера (объемом 500 мл с 200 мл питательной среды) на питательных средах трех составов [13, 17, 19] в шейкере-инкубаторе Innova 42R (30°С, 140 об./мин, круглосуточное освещение с плотностью потока фотонов 15 ± 1 мкмоль/(м2 ⋅ с)).
Рост и накопление биомассы контролировали по изменению оптической плотности суспензии клеток при 750 нм (OD750, спектрофотометр Genesys 10S UV-Vis) и величине рН.
Биомассу собирали центрифугированием (12500 g, 15 мин, SL40R Thermo Scientific, США), дважды промывали дистиллированной водой и до проведения анализов хранили при –20°С.
Определение характеристик посевного материала. Содержание белка определяли согласно [20], липидов – [21, 22], хлорофиллов – [23].
Продуктивность биомассы цианобактерии рассчитывали по формуле
(1)
${\text{Продуктивность}}\,{\text{(мг/(л}} \cdot {\text{сутки)}}) = \frac{{{{m}_{2}} - {{m}_{1}}}}{{{{t}_{2}} - {{t}_{1}}}},$Экстракция С-фикоцианина. Исчерпывающую экстракцию С-ФЦ из предварительно обработанной (трехкратный цикл замораживание/оттаивание: –20/25°C) влажной биомассы проводили 0.1 М натрий-фосфатным буфером (pH 7.00 ± 0.02) при 4°C. Клеточный дебрис отделяли центрифугированием (20 500 g, 30 мин, 4°C), спектры поглощения раствора С-ФЦ снимали в диапазоне 190–700 нм.
Концентрацию (мг/мл) C-ФЦ рассчитывали согласно [24]:
(2)
${\text{С - ФЦ}}\,{\text{(мг/мл)}} = \frac{{({{А}_{{620}}} - 0.474 \times {{А}_{{650}}})}}{{5.34}},$Содержание (мг/г) С-ФЦ в биомассе рассчитывали по формуле
(3)
${\text{С - Ф}}{{{\text{Ц}}}_{m}}\,{\text{(мг/г)}} = \frac{{{\text{С - ФЦ}}\,{\text{(мг/мл)}} \times {{V}_{э}}({\text{мл}})}}{{{{m}_{{{\text{б/м}}}}}{\text{(г}})}},$Выход (мг/л) С-ФЦ с литра питательной среды рассчитывали по формуле
(4)
${\text{С - Ф}}{{{\text{Ц}}}_{{v}}}\,{\text{(мг/л)}} = \frac{{{\text{С - ФЦ}}\,{\text{(мг/мл)}} \times {{V}_{э}}({\text{мл}})}}{{{{V}_{{\text{а}}}}{\text{(л}})}},$Статистический анализ. Численные результаты представлены как среднее значение не менее чем трех независимых повторов (n ≥ 3). Планки погрешностей – стандартное отклонение (SD). Односторонний дисперсионный анализ (ANOVA) и критерий Тьюки использовали для оценки значимости различий (значения p < 0.05 считали статистически значимыми).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно [17] для инициации и поддержания культуры необходима минимальная популяция клеток, тогда как для получения инокулята культуры требуется выращенная концентрированная культура цианобактерии. Различные фазы роста отражают изменения в биохимическом составе биомассы.
С целью стандартизации инокулята исследовали влияние возраста посевного материала на рост цианобактерии A. platensis и накопление С-ФЦ на питательных средах разного состава.
Отметим, что в публикациях, посвященных культивированию цианобактерий и микроводорослей, количество вносимого посевного материала (инокулята) выражается либо в количестве биомассы в пересчете на сухой вес (не более 200 мг/л), либо как процент (объемный) суспензии клеток (не более 10%), либо указывается начальная величина OD при определенной длине волны (560, 680, 720 или 880 нм).
При проведении исследований посевной материал вносили в питательную среду до достижения начальной величины OD750 0.050, что обусловлено результатами предварительных исследований по влиянию исходной концентрации биомассы на рост цианобактерии (данные не приведены). При культивировании A. platensis на классической среде Заррука с начальными величинами OD750 0.050, 0.100, 0.150, 0.200 существенной разницы в конечных (максимальных) значениях не выявлено. Все кривые роста достигали стационарной фазы на 15–16-е сутки (OD750 1.90 ± ± 0.05), что согласуется с результатами, полученными в [25].
Согласно [26] при культивировании фототрофных микроорганизмов в начале лагфазы можно наблюдать некоторую задержку роста, которая, с одной стороны, может быть связана с наличием в посевном материале нежизнеспособных клеток, с другой, может быть обусловлена периодом физиологической адаптации из-за изменений в питательных веществах или условиях культивирования. Следовательно, сократить лагфазу можно при использовании в качестве инокулята клеток в поздней экспоненциальной фазе роста, которые были выращены на той же питательной среде в аналогичных условиях культивирования.
При проведении исследований биомассу A. platensis, используемую в качестве инокулята, выращивали на среде того же состава в условиях, аналогичных эксперименту.
В данной работе исследовали влияние возраста инокулята при культивировании цианобактерии A. platensis на трех питательных средах: среда I – классическая среда Заррука [13] и на двух ее модификациях: среда II – модификации Корнета [18] и среда III – модификации Аиба–Огава [19].
В качестве инокулята использовали 4-, 10- и 17-суточную культуру клеток. В табл. 1 представлены данные о содержании белка, липидов и фотосинтетических пигментов инокулята. Как видно из таблицы, наибольшее содержание белка, липидов и фотосинтетических пигментов отмечено для инокулята, выращенного на среде III. При рассмотрении разновозрастного инокулята отмечено, что 4-суточный инокулят характеризуется максимальным содержанием липидов и белка, за исключением среды II, для которой максимальное содержание белка отмечено для 10-суточного инокулята. Что касается содержания фотосинтетических пигментов (С-ФЦ и хлорофилла), их максимальное содержание было у 10-суточного инокулята независимо от состава среды культивирования.
Таблица 1.
Химический состав разновозрастного инокулята для культивирования A. platensis на питательных средах различного состава
| Среда, возраст инокулята | Белки, %* |
Липиды, % |
С-ФЦ мг/г |
Хлорофиллы, мг/г |
|
|---|---|---|---|---|---|
| I | 4 c | 48.02 ± 2.20 | 7.26 ± 0.33 | 122.69 ± 6.39 | 17.43 ± 1.00 |
| 10 c | 38.06 ± 2.20 | 6.65 ± 0.14 | 232.20 ± 5.71 | 22.26 ± 0.94 | |
| 17 c | 36.01 ± 1.54 | 5.88 ± 0.39 | 212.59 ± 5.66 | 19.21 ± 0.47 | |
| II | 4 c | 35.80 ± 3.63 | 8.72 ± 0.44 | 110.18 ± 1.45 | 24.19 ± 2.50 |
| 10 c | 43.25 ± 2.11 | 7.27 ± 0.19 | 222.21 ± 3.49 | 27.99 ± 1.22 | |
| 17 c | 37.30 ± 2.35 | 4.95 ± 0.46 | 171.92 ± 7.95 | 17.09 ± 0.78 | |
| III | 4 c | 56.63 ± 2.47 | 9.65 ± 0.24 | 140.84 ± 8.11 | 19.03 ± 1.03 |
| 10 c | 42.09 ± 2.41 | 7.03 ± 0.55 | 248.69 ± 6.07 | 25.77 ± 2.42 | |
| 17 c | 33.77 ± 1.78 | 6.16 ± 0.38 | 209.95 ± 3.65 | 20.01 ± 0.34 | |
Кривые роста A. platensis на трех испытуемых средах представлены на рис. 1. Как видно из рисунка, при культивировании цианобактерии на средах I и II стационарная фаза роста, характеризующаяся максимальными значениями OD750, достигнута при использовании 17-суточного инокулята (на 25-е и 23-и сутки культивирования – рис. 1а, 1б соответственно). При использовании более молодого инокулята (4- и 10-суточного) стационарная фаза роста достигалась быстрее (15-е и 17-е сутки соответственно независимо от типа используемой среды), при этом максимальная величина OD750 была несколько ниже, чем при использовании 17-суточного инокулята. При анализе кривых роста цианобактерии на среде III установлено, что возраст инокулята не оказывал существенного влияния на максимальную величину биомассы (отклонения значений OD750 статистически незначимы). Кроме того, кривые роста при культивировании A. platensis на среде III при 4- и 10-суточном инокуляте практически идентичны (рис. 1в).
Рис. 1.
Кривые роста цианобактерии A. platensis на среде I (а), II (б) и III (в) при засеве 4- (1), 10- (2) и 17-суточным (3) инокулятом.
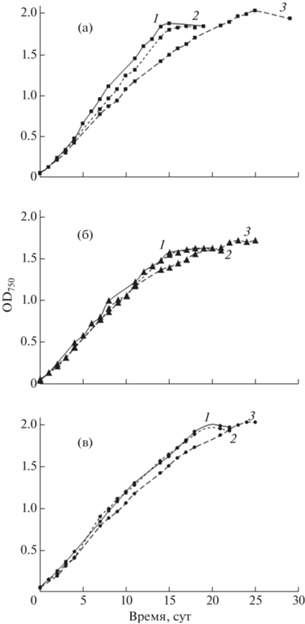
В табл. 2 приведены данные о максимальном выходе биомассы цианобактерии: при культивировании на среде II выход биомассы с литра среды (1.12–1.18 г/л) был меньше, чем на средах I (1.28–1.42 г/л) и III (1.37–1.42 г/л). Отметим, что биомасса с использованием самого молодого инокулята характеризовалась наибольшей продуктивностью: для среды I продуктивность составила ~95 мг/(л⋅сутки) и ~76 мг/(л⋅сутки) для сред II и III (табл. 2). Независимо от состава питательной среды выявлена зависимость продуктивности биомассы (мг/(л⋅сутки)) от возраста инокулята: снижение продуктивности при увеличении возраста инокулята.
Таблица 2.
Влияние возраста инокулята на выход биомассы и С-фикоцианина при культивировании A. platensis на питательных средах различного состава
| Среда | Возраст инокулята | Биомасса | С-ФЦ, мг/л |
|
|---|---|---|---|---|
| мг/(л ⋅ сутки) | г/л | |||
| I | 4 c | 95.43 ± 0.70 | 1.30 ± 0.23 | 299.30 ± 1.15 |
| 10 c | 91.55 ± 0.35 | 1.28 ± 0.18 | 290.52 ± 3.63 | |
| 17 c | 66.81 ± 0.10 | 1.42 ± 0.27 | 281.45 ± 2.53 | |
| II | 4 c | 75.56 ± 0.56 | 1.12 ± 0.07 | 201.63 ± 2.28 |
| 10 c | 71.43 ± 0.36 | 1.12 ± 0.04 | 198.15 ± 2.31 | |
| 17 c | 60.21 ± 0.30 | 1.18 ± 0.10 | 147.74 ± 1.64 | |
| III | 4 c | 76.14 ± 0.68 | 1.40 ± 0.14 | 332.05 ± 4.19 |
| 10 c | 75.85 ± 0.33 | 1.37 ± 0.09 | 311.28 ± 2.42 | |
| 17 c | 63.24 ± 0.21 | 1.42 ± 0.10 | 292.03 ± 2.32 | |
Полученные данные отличаются от полученных ранее для Spirulina platensis (из коллекции Центра изучения автотрофных микроорганизмов Национального исследовательского совета университета Флоренции, Италия) [27]. Согласно которым при культивировании в колбах Эрленмейера на 500 мл с 200 мл питательной среды в экспериментах с 10- и 14-суточным инокулятом был отмечен слабый рост, а при культивировании в 5‑литровых емкостях в опыте с 14-суточным инокулятом роста не наблюдали. Это объяснили тем фактом, что клетки находились в фазе отмирания и была нарушена адаптация к условиям культивирования. Таким образом, используемая в настоящей работе A. platensis B-12619 обладает большей жизнеспособностью.
В результате определения выхода С-ФЦ (мг/л) установлено, что независимо от типа питательной среды максимальный выход достигается при использовании 4-суточного инокулята, при этом максимальный выход на среде II составил ~200 мг/л, на среде I ~300 и ~330 мг/л на среде III.
Таким образом, при культивировании на среде II выход биомассы и С-ФЦ с литра среды был наименьшим для трех исследованных сред. Тогда как среды I и III могут быть рекомендованы для дальнейших исследований процесса масштабирования для выращивания цианобактерии A. platensis B-12619 для получения С-ФЦ.
ЗАКЛЮЧЕНИЕ
С целью стандартизации инокулята для культивирования цианобактерии A. platensis исследовано влияние возраста инокулята (посевного материала) на рост культуры и накопление С-ФЦ на классической питательной среде Зарукка и двух ее модификациях.
Выявлена зависимость продуктивности биомассы от возраста инокулята для всех испытанных составов питательных сред.
Максимальный выход С-ФЦ не менее 300 мг/л был достигнут при использовании 4-суточного инокулята.
Работа выполнена в рамках тематического плана исследований НИЦ “Курчатовский институт” 1.8. “Создание платформенной технологии для глубокой переработки биомассы фототрофных микроорганизмов с получением широкого спектра востребованной химической продукции”.
Список литературы
Nogia P., Sidhu G.K., Mehrotra R., Mehrotra S. // Int. J. Low-Carbon Technol. 2016. V. 11. № 2. P. 266. https://doi.org/10.1093/IJLCT/CTT077
Friend A.D., Geider R.J., Behrenfeld M.J., Still C.J. // Photosynthesis in silico. Dordrecht: Springer, 2009. P. 465. https://doi.org/10.1007/978-1-4020-9237-4_20
Noreña-Caro D., Benton M.G. // J. CO2 Util. 2018. V. 28. P. 335. https://doi.org/10.1016/J.JCOU.2018.10.008
Yadav G., Sen R. // J. CO2 Util. 2017. V. 17. P. 188. https://doi.org/10.1016/j.jcou.2016.12.006
Thevarajah B., Nishshanka G.K.S.H., Premaratne M. et al. // Biochem. Eng. J. 2022. V. 185. P. 108541. https://doi.org/10.1016/J.BEJ.2022.108541
Nass P.P., do Nascimento T.C., Fernandes A.S. et al. // Food Res. Int. 2022. V. 157. P. 111469. https://doi.org/10.1016/J.FOODRES.2022.111469
Furmaniak M.A., Misztak A.E., Franczuk M.D. et al. // Front. Microbiol. 2017. V. 8. DEC. https://doi.org/10.3389/fmicb.2017.02541
Liu Q., Huang Y., Zhang R. et al. // Evidence-Based Complement. Altern. Med. 2016. https://doi.org/10.1155/2016/7803846
Seyedi S., Parvin P., Jafargholi A. et al. // Spectrochim. Acta. A. 2020. V. 239. P. 118468. https://doi.org/10.1016/j.saa.2020.118468
Li W., Su H.N., Pu Y. et al. // Biotechnol. Adv. 2019. V. 37. № 2. P. 340. https://doi.org/10.1016/j.biotechadv.2019.01.008
Costa J.A.V., Freitas B.C.B., Rosa G.M. et al. // Bioresour. Technol. 2019. V. 292. P. 121946. https://doi.org/10.1016/J.BIORTECH.2019.121946
Soni R.A., Sudhakar K., Rana R.S. // Energy Reports. 2019. V. 5. P. 327. https://doi.org/10.1016/J.EGYR.2019.02.009
Zarrouk C. Contribution à l’étude d’une cyanophycée. Influence de divers facteurs physiques et chimiques sur la croissance et la photosynthèse de Spirulina maxima (Seth et Gardner) Geitler. University of Paris (1966). Thesis. (In French)
Yuan D., Yao M., Wang L. et al. // Algal Res. 2019. V. 44. P. 101718. https://doi.org/10.1016/J.ALGAL.2019.101718
Olguín E.J., Galicia S., Mercado G., Pérez T. // J. Appl. Phycol. 2003. V. 15. № 2. P. 249. https://doi.org/10.1023/A:1023856702544
Wuang S.C., Khin M.C., Chua P.Q.D., Luo Y.D. // Algal Res. 2016. V. 15. P. 59. https://doi.org/10.1016/J.ALGAL.2016.02.009
Soni R.A., Sudhakar K., Rana R.S. // Trends Food Sci. Technol. 2017. V. 69. P. 157. https://doi.org/10.1016/J.TIFS.2017.09.010
Cornet J.F., Dussap C.G., Cluzel P., Dubertret G. // Biotechnol. Bioeng. 1992. V. 40. № 7. P. 826. https://doi.org/10.1002/bit.260400710
Aiba S., Ogawa T. // J. Gen. Microbiol. 1977. V. 102. № 1. P. 179. https://doi.org/10.1099/00221287-102-1-179
Lowry O.H., Rosebrough N.J., Farr A.L., Randal R.J. // J. Biol. Chem. 1951. V. 193. № 1. P. 265. https://doi.org/10.1016/s0021-9258(19)52451-6
Liu J., Liu Y., Wang H., Xue S. // Bioresour. Technol. 2015. V. 176. P. 284. https://doi.org/10.1016/j.biortech.2014.10.094
Сергеева Я.Э., Мостова Е.Б., Горин К.В. и др. // Биотехнология. 2017. Т. 33. № 1. С. 53. https://doi.org/10.21519/0234-2758-2017-33-1-53-61
Lichtenthaler H.K., Buschmann C. // Curr. Protoc. Food Anal. Chem. 2001. V. 1. № 1. P. F4.3.1. https://doi.org/10.1002/0471142913.faf0403s01
Bennett A., Bogorad L. // J. Cell Biol. 1973. V. 58. № 2. P. 419.
Delrue F., Alaux E., Moudjaoui L. et al. // Ferment. 2017. V. 3. № 4. P. 59. https://doi.org/10.3390/FERMENTATION3040059
Lee Y.K. // Algae Biotechnol. 2016. P. 1. https://doi.org/10.1007/978-3-319-12334-9_1
Pelizer L.H., Danesi E.D.G., Rangel C. de O. et al. // J. Food Eng. 2003. V. 56. № 4. P. 371. https://doi.org/10.1016/S0260-8774(02)00209-1
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


