Российские нанотехнологии, 2023, T. 18, № 1, стр. 53-62
ПОТЕНЦИАЛ МИКРОВОДОРОСЛИ Micractinium simplicissimum IPPAS C-2056 ДЛЯ “ЗЕЛЕНОГО” СИНТЕЗА НАНОЧАСТИЦ МАРГАНЦА, ЖЕЛЕЗА И ФОСФОРА
С. Г. Васильева 1, 2, *, П. А. Зайцев 1, 3, О. И. Баулина 1, Е. С. Лобакова 1, А. Е. Соловченко 1, 2, О. А. Горелова 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт естествознания, Тамбовского государственного университета им. Г.Р. Державина
Тамбов, Россия
3 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
Москва, Россия
* E-mail: vankat2009@mail.ru
Поступила в редакцию 05.10.2022
После доработки 27.11.2022
Принята к публикации 27.11.2022
Аннотация
Благодаря своим ценным свойствам наночастицы (НЧ) востребованы в промышленности, медицине и экологии. Традиционные физико-химические методы синтеза НЧ энергозатратны и (или) осуществляются с участием токсичных веществ, ограничивающих их последующее использование, например, в медицине. В этой связи привлекает внимание “зеленый” синтез НЧ, в том числе с участием клеток микроводорослей. C помощью методов просвечивающей электронной микроскопии в сочетании с энергодисперсионной рентгеновской спектроскопией показана способность клеток зеленой микроводоросли Micractinium simplicissimum IPPAS C-2056 к формированию сверхмалых НЧ Fe (1–4 нм) и P (3–9 нм), НЧ Mn (10–60 нм), а также разнообразных по составу смешанных НЧ (P‒Fe, P–Mn, Fe–Mn, Fe–P–Cа–Mg), локализованных в межклеточном матриксе, на поверхности и в клеточной стенке. Полученные данные свидетельствуют о высоком потенциале M. simplicissimum IPPAS С-2056 для “зеленого” синтеза НЧ, содержащих Mn, Fe и P. Обсуждаются детерминанты этой способности и перспективы применения микроводорослей для получения НЧ с ценными свойствами.
ВВЕДЕНИЕ
Наночастицы (НЧ) обладают целым рядом особенностей и преимуществ в сравнении с макрообъектами из тех же материалов, включая более развитую поверхность, повышенную реакционную способность, адгезионные свойства и др. [1]. Эти свойства обусловили широкое применение НЧ в промышленности, медицине и экологии, например для химического катализа, адресной доставки лекарств, фотоабляционной терапии, создания биосенсоров и решения множества других задач [2–4]. Традиционно для синтеза НЧ используют физико-химические методы, такие как фотохимическое восстановление, литография, УФ-облучение, лазерная абляция, обработка ультразвуком [1, 5]. Однако эти методы энергозатратны и (или) требуют использования токсичных химических веществ, что ограничивает применение полученных таким способом НЧ [2, 5]. В этой связи особое внимание привлекают так называемые “зеленые” способы получения НЧ – их биосинтез с использованием растительных экстрактов и ферментов, а также живых микроорганизмов (бактерий, водорослей и грибов) при атмосферном давлении и комнатной температуре [2, 3]. В отличие от физико-химических методов “зеленые” методы наносят меньший ущерб окружающей среде и открывают больше возможностей для управляемого синтеза биосовместимых, нетоксичных и стабильных нанокристаллитов с заданными свойствами [2, 6].
Известно, что биосинтез НЧ может протекать как в живых клетках микроводорослей, так и с использованием клеточных экстрактов. Синтезируемые данным способом НЧ имеют полисахаридное покрытие, которое стабилизирует водные взвеси НЧ, предотвращает их агрегацию, увеличивает намагниченность НЧ без ущерба для структуры и других свойств [2, 3, 7]. Размер и форма НЧ зависят от условий культивирования и вида микроводоросли [2, 8]. В живых клетках микроводорослей синтез НЧ возможен на поверхности клеток, в клеточной стенке либо в цитоплазме [2, 5].
Образование металлических НЧ на поверхности клеток происходит в результате адгезии ионов металлов с последующим их восстановлением. В этом процессе участвуют карбонильные группы и аминогруппы углеводов и гликопротеинов поверхностных структур клеток [3]. При внутриклеточном образовании НЧ ионы металлов восстанавливаются с участием НАД·H- или НАДФ·H-зависимых редуктаз [9]. Преимуществом использования живых культур является возможность биосинтеза сверхмалых НЧ (≤5 нм), обладающих уникальными свойствами [7].
Наиболее подробно описаны механизмы, условия и виды микроводорослей для “зеленого” биосинтеза НЧ Au и Ag, в то время как образование НЧ других металлов и соединений требует дальнейшего изучения [8]. Большое внимание уделяется “зеленому” синтезу железосодержащих НЧ, таких как магнетит (Fe3O4), маггемит (γFe2O3) и пирротин (Fe1 –хS). Эти НЧ биосовместимы, химически инертны, обладают адсорбционной стабильностью и высокой магнитной восприимчивостью. Благодаря этому они являются идеальными кандидатами для доставки лекарственных препаратов к мишеням в организме [10], а также могут применяться для адсорбции и деградации поллютантов из окружающей среды [11]. Способность к синтезу НЧ Fe до настоящего времени была выявлена у представителей ограниченного числа родов микроводорослей (Chlorococcum, Euglena, Chlorella и некоторых других) [8, 11].
Отдельные виды микроорганизмов способны синтезировать НЧ Mn окислением Mn2+ до Mn4+ с образованием частиц нерастворимого оксида марганца [12, 13]. Такие НЧ характеризуются электрокаталитическими и флуоресцентными свойствами, обладают антибактериальной и противогрибковой активностью. Это позволяет применять их для производства суперконденсаторов, литиевых аккумуляторов, в медицине, в аналитической химии, для детоксикации опасных микрополлютантов и в других областях [14]. Синтез НЧ Mn описан преимущественно для клеток бактерий и грибов, их образование в клетках микроводорослей наблюдается значительно реже, за исключением нескольких видов микроводорослей [12].
Активно разрабатываются методы получения НЧ фосфатов различных металлов [15]. Так, НЧ Ca3(PO4)2 и FePO4 обладают антимикробной и противогрибковой активностью и применяются в медицине (например, для восстановления костной ткани), а также в сельском хозяйстве в качестве эффективных удобрений [15, 16]. Однако образование подобных НЧ хорошо изучено только у клеток дрожжей [15]. В живой природе также часто встречаются полифосфаты – НЧ, содержащие фосфор, кислород и металлы-противоионы (Mg, Ca и Na). Образуют их и микроводоросли, формирующие полифосфаты в разных компартментах клеток в виде включений микрометровых размеров [17].
Микроводоросли известны своей способностью к биоконцентрированию тяжелых металлов, например Сu, Zn, Fe, Co, Mn, Ag [18], в частности, из сточных вод при их очистке. Эти металлы накапливаются и в форме НЧ [3]. Образование некоторых видов НЧ, например НЧ Fe, увеличивает адсорбцию биогенных элементов (P и N), повышая эффективность биологической очистки сточных вод [19]. Таким образом, бросовые ресурсы (сточные воды) возможно использовать не только для получения тоннажных биопродуктов (биоудобрений и биотоплива [20]), но и различных НЧ с применением микроводорослей.
В целом образование НЧ Fe, P, Mn в клетках микроводорослей мало изучено, поэтому поиск и исследование новых культур микроводорослей, способных к синтезу НЧ, – важная фундаментальная и прикладная задача. Цель данной работы – исследование способности нового штамма зеленых микроводорослей из рода Micractinium к формированию НЧ, обогащенных Fe, Mn и P; определение элементного состава НЧ методами аналитической электронной микроскопии; установление локализации НЧ в поверхностных структурах клеток в зависимости от доступности P и Mn в среде культивирования.
МАТЕРИАЛЫ И МЕТОДЫ
Условия культивирования. Объектом исследования служила альгологически чистая суспензионная культура оригинального штамма зеленой микроводоросли Micractinium simplicissimum IPPAS С-2056. Данный штамм был выделен из эвтрофицированного фосфором биотопа озера Большая Имандра вблизи апатит-нефелиновой обогатительной фабрики (АНОФ-2, г. Апатиты). Результаты предварительных исследований показали, что M. simplicissimum IPPAS С-2056 адаптирован к существованию в условиях повышенных концентраций фосфатов [21].
Культуру микроводоросли выращивали в периодическом режиме в стеклянных колбах (объем 750 мл) на инкубационном шейкере Innova 44R (“New Brunswick”, США) при постоянном перемешивании (120 об./мин), температуре 23°C и освещении интенсивностью 40 мкмоль фотонов ФАР/(м2 · с) на среде BG-11 [22], содержащей 22 мг/л неорганического фосфата (далее Pi) в форме K2HPO4, 0.5 мг/л Mn2+ (далее Mn) в форме MnCl2·4H2O и 1 мг/л Fe2+ (далее Fe) в форме Fe2SO4·7Н2О.
Далее культуры инкубировали с высокими концентрациями Pi (1500 мг/л) и Mn (500 мг/л), подобранными по результатам предварительных исследований [21, 23]. Для получения культур с варьированием внутриклеточного содержания фосфора использовали метод последовательного истощения–обогащения культуры Pi [24]. Для получения культур с истощенными внутриклеточными резервами P следовали протоколу, описанному ранее [24], включая осаждение центрифугированием (5 мин, 3000 g; “Eppendorf” 5440R, Германия) и промывание средой, не содержащей Pi, с последующей инкубацией клеток в бесфосфорной среде в течение 14 сут. При восстановлении фосфорного питания к суспензии клеток M. simplicissimum добавляли Pi в форме КH2PO4 до конечной концентрации Pi в среде 1500 мг/л и культивировали в течение 7 сут.
Для экспериментов с культивированием микроводоросли в присутствии высоких концентраций ионов Mn клетки предкультуры (указано выше) осаждали центрифугированием, ресуспендировали в среде BG-11 с добавлением Mn (в виде MnСl2) до конечной концентрации 500 мг/л и культивировали 5 сут.
Просвечивающая электронная микроскопия (ПЭМ). Мониторинг ультраструктурной организации клеток микроводоросли вели с помощью традиционной ПЭМ ультратонких (менее 70 нм) срезов. Элементный анализ проводили методом аналитической ПЭМ, а именно энергодисперсионной рентгеновской спектроскопии (ЭДРС) полутонких (200−250 нм) срезов. Клетки осаждали центрифугированием (5 мин, 3000 g; “Eppendorf” 5440R, Германия) и фиксировали по стандартному протоколу [25], используя последовательно 2%-ный (по объему) раствор глутарового альдегида в 0.1 М какодилатном буфере (pH 6.8–7.4 в зависимости от pH культуры) в течение 30 мин и 1%-ный (по массе) раствор тетраоксида осмия в том же буфере в течение 4 ч при комнатной температуре.
Обезвоживание фиксированных образцов проводили в серии водных растворов этилового спирта возрастающих концентраций от 30 до 96% (по объему) и троекратно в 100%-ном этиловом спирте (“Sigma”, США). Последнюю процедуру обезвоживания сочетали с контрастированием 2%-ным (по массе) раствором уранилацетата в абсолютном этиловом спирте (“Sigma”, США) в течение 1 ч при комнатной температуре. Далее образцы заключали в эпоксидную смолу Araldite (“Sigma-Aldrich”, США), проводили полимеризацию при 56°С и получали срезы заданной толщины на ультрамикротоме Leica EM UC7 (“Leica”, Австрия). Срезы монтировали на медные сеточки для электронной микроскопии с ультратонкой подложкой из формвара (“Ted Pella”, США). Для изучения ультраструктуры клеток методом ПЭМ срезы дополнительно контрастировали раствором цитрата свинца [26]. Изображения получали на электронном микроскопе JEM-1011 (“JEOL”, Япония) при ускоряющем напряжении 80 кВ, а также на микроскопе JEM-1400Flash (“JEOL”, Япония) при ускоряющем напряжении 120 кВ. Размеры структур определяли по изображениям ПЭМ в программе Fiji (ImageJ) v. 20200708-1553 (“NIH”, США).
ЭДРС полутонких срезов, не контрастированных цитратом свинца, проводили, как описано в [27], на аналитическом электронном микроскопе JEOL-2100 (“JEOL”, Япония), оснащенном светлопольным детектором для работы в режиме сканирующей просвечивающей электронной микроскопии (СПЭМ) (“JEOL”, Япония) и рентгеновским кремний-дрейфовым детектором X-Max с активной площадью кристалла 80 мм2 (“Oxford Instruments”, Великобритания). Энергодисперсионные рентгеновские спектры от выбранных точечных или зональных участков образца регистрировали в диапазоне энергий рентгеновского излучения от 0 до 10 кэВ в режиме светлопольной СПЭМ. Время сбора сигнала для одного спектра составляло 120 с. Регистрацию и обработку энергодисперсионных спектров проводили в режиме “Point&ID” в программе INCA (“Oxford Instruments”, Великобритания). Полученные спектры представлены в диапазоне 0.15–7.00 кэВ, в который входят наиболее интенсивные пики всех биологически значимых элементов, включая Mn и Fe. Во всех спектрах ЭДРС, приведенных в указанном диапазоне, присутствовали полосы характеристического рентгеновского излучения углерода (Kα = 0.28 кэВ) и кислорода (Kα = 0.53 кэВ) – основных химических элементов органических соединений биологических образцов и эпоксидной смолы, используемой в процедуре пробоподготовки. Также в спектрах регистрировались пики меди (Lα = 0.93 кэВ) – основного компонента сеточек, на которые монтировали срезы перед их ПЭМ-анализом, осмия (Mβ = 1.91 кэВ) и урана (Mα = 3.16 кэВ, Mβ = 3.34 кэВ), использованных при фиксации клеток. Присутствие пиков кремния (Kα = 1.74 кэВ) и алюминия (Kα = 1.49 кэВ) в спектрах относится к элементам аппаратного фона. Перечисленные элементы на спектрах, представленных на рисунках, не аннотировали.
РЕЗУЛЬТАТЫ
Идентификация НЧ, образующихся при культивировании M. Simplicissimum в средах с различным содержанием фосфатов. Ультраструктурная организация исследуемой микроводоросли M. Simplicissimum соответствовала таковой для представителей родственных таксонов. Ее основные черты включали в себя одноклеточность, наличие одного ядра, одного пристеночного хлоропласта с одним пиреноидом (рис. 1а). Клеточная стенка состояла из двух–трех слоев, различающихся по электронной плотности, но не имела трехламелларного (спорополленин-подобного, или альгинатного) слоя. В цитоплазме были выявлены регулярные органеллы: рибосомы, митохондрии, элементы аппарата Гольджи и вакуоли. Среди запасающих структур кроме крахмальных зерен присутствовали олеосомы в цитоплазме и включения в вакуолях (рис. 1а–1в, 1е).
Рис. 1.
Ультраструктура клеток Micractinium simplicissimum IPPAS С-2056, выращенных на средах с различным содержанием Mn и Pi: ПЭМ-изображения ультратонкого среза клетки (а) и ее периферических участков при 22 мг/л Pi и 0.5 мг/л Mn (б, в); СПЭМ-изображения полутонких срезов участков клеток, анализированных ЭДРС: г, д – периферия клеток после 7 сут в среде с 0 мг/л Pi и 0.5 мг/л Mn; через 4 ч (е), 1 сут (ж), 3 сут (з) после добавления 1500 мг/л Pi; клетки и клеточная периферия после 5 сут инкубации в среде с 22 мг/л Pi и 500 мг/л Mn (и–л). В – вакуоль, КЗ – крахмальные зерна, КС – клеточная стенка, М – межклеточный матрикс. П – пиреноид, Ос – олеосома, Хл – хлоропласт. Наночастицы указаны стрелками.
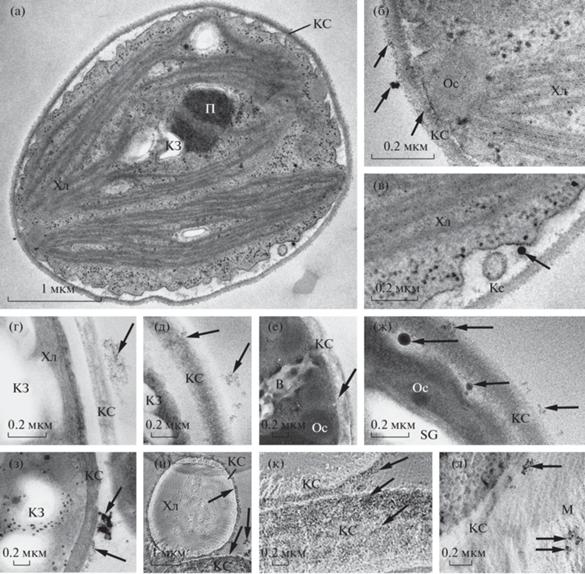
При анализе срезов клеток, культивировавшихся в среде c 22 мг/л Pi и 0.5 мг/л Mn, было установлено наличие в поверхностном слое клеточной стенки скопления НЧ размером ~3 нм и округлых гранул средней и высокой электронной плотности (рис. 1б). При этом ~90% из их числа имели диаметр от 9 до 37 нм и только 2% более 100 нм. В ЭДРС-спектрах округлых гранул (рис. 2а) идентифицировались пики P (Kα = = 2.01 кэВ), N (Kα = 0.39 кэВ) и S (Kα = 2.31 кэВ). Наряду с клеточной стенкой аналогичные НЧ были обнаружены на поверхности клеток (рис. 1а, 1б), ~90% таких НЧ имели округлую форму и диаметр в диапазоне 8–37 нм. Судя по ЭДРС-спектрам (рис. 2б), эти НЧ содержали P и Fe (Kα = 6.40 кэВ, Lα = 0.71 кэВ). Помимо Fe и P в частицах были зарегистрированы небольшие пики Сa (Kα = 3.70 кэВ) и Mg (Kα = 1.25 кэВ) (рис. 2б, табл. 1). Округлые НЧ (7–36 нм) были выявлены и в пространстве между клеточной стенкой и цитоплазматической мембраной (периплазме) (рис. 1в), по элементному составу они были схожи с НЧ, обнаруженными на поверхности клеточной стенки (табл. 1). При просмотре срезов клеток, культивировавшихся в среде, не содержащей фосфор, было обнаружено наличие на поверхности клеточной стенки (рис. 1г) и в клеточной стенке (рис. 1д) сверхмалых частиц (1–4 нм), объединенных тонко-фибриллярной сетью. ЭДРС-анализ подтвердил наличие в них Fe (рис. 2в). Через 4 ч после добавления Pi к клеткам, предварительно инкубированным в бесфосфорной среде в течение 7 сут, на поверхности клеток было выявлено образование НЧ размером 1–9 нм (рис. 1е). При ЭДРС-анализе не были детектированы пики P, Ca и Mg, а только небольшие пики Fe (табл. 1). В клеточной стенке НЧ не обнаруживались, при этом в спектрах ЭДРС участков клеточной стенки присутствовали пики P и Ca.
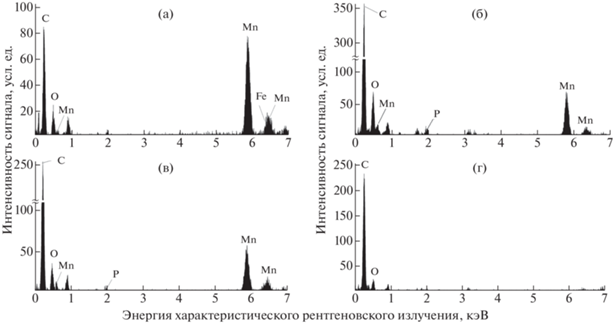
Рис. 2.
Репрезентативные спектры ЭДРС клеток микроводоросли Micractinium simplicissimum IPPAS С-2056. Инкубация с 0.5 мг/л Mn2+ и 22.0 мг/л Pi (а, б), инкубация без фосфора (в), а также через 1 сут (г–ж) и 3 сут (з) после добавления 1500 мг/л Pi к клеткам, прединкубированным в бесфосфорной среде. Спектры зарегистрированы с электронно-плотных НЧ, локализованных в клеточной стенке (а, ж), на поверхности клеток (б, в, д, з), в периплазматическом пространстве (e), и в области препарата, не содержащего клеточных структур и межклеточного матрикса (эпоксидная смола, г).

Таблица 1.
Выявление, локализация и элементный состав наночастиц в поверхностных структурах клеток Micractinium simplicissimum IPPAS С-2056 и в окружающем пространстве при культивировании в средах разного состава*
| Концентрация Pi/Mn в среде (мг/л)* | Область анализа, выявление и состав наночастиц (данные ЭДРС) | ||||
|---|---|---|---|---|---|
| Поверхность клеточной стенки | Клеточная стенка | Периплазма** | Межклеточный матрикс | Смола | |
| 22/0.5 | Fe–P–Cа–Mg | P | P–Cа–Mg | НВ*** | НВ |
| 22/500 | Mn–P, Mn, Mn–Fe | Mn, Mn–Fe, Mn–P | НВ | Mn–P, Mn, Mn–Fe | НВ |
| 0/0.5 | Fe | Fe | НВ | НВ | НВ |
| 1500/0.5, 4 ч**** | Fe | НВ | НВ | НВ | НВ |
| 1500/0.5, 1 сут**** | Fe, Fe–P, P–Ca, P–Mg, P–Mg–Ca | Fe–P | P–Ca, P–Mg, P–Mg–Ca | НВ | НВ |
| 1500/0.5, 3 сут**** | Fe–P–Ca–Mg, Fe | P–Mg | НВ | НВ | НВ |
| 1500/0.5, 7 сут**** | P | НВ | НВ | НВ | НВ |
Через сутки после добавления Pi в периплазме и на поверхности клеток M. Simplicissimum формировались НЧ диаметром 16–92 нм (рис. 1ж), содержащие P в сочетании с Са и (или) Mg (рис. 2д, 2е). Наряду с более крупными НЧ на поверхности клеток были обнаружены частицы размером 2–9 нм, содержащие Fe и P, а также частицы размером 1–4 нм, в спектрах которых выявлялся только пик Fe (табл. 1). Наряду с этим в периферическом слое клеточной стенки были выявлены частицы размером 2–9 нм, при ЭДРС-анализе которых было подтверждено наличие в них пиков Fe и P (табл. 1).
Через трое суток инкубации на поверхности клеток идентифицировали НЧ (15–75 нм) смешанного состава, содержащие Fe, P и Ca (рис. 2з). Как и после суточной инкубации, на поверхности клеток были обнаружены прикрепленные сверхмалые НЧ диаметром 1–4 нм, содержащие Fe. Через 7 сут после добавления Pi к клеткам, прединкубированным в бесфосфорной среде, НЧ были выявлены только на поверхности клеток, при этом в спектрах ЭДРС указанных частиц был найден только пик Р.
В спектрах ЭДРС клеточных стенок из всех тестированных образцов были зарегистрированы характеристические рентгеновские излучения, соответствующие азоту и сере.
Идентификация НЧ, образующихся при культивировании M. simplicissimum в среде с высоким содержанием марганца. Культивирование в среде с повышенной, но не токсичной концентрацией марганца (500 мг/л, [23]) не вызывало значительных изменений ультраструктуры клеток. Округлые НЧ размером 10–20 нм были выявлены на поверхности клеток и спорангиев, а также в периферическом слое клеточной стенки (рис. 1и, 1к). На поверхности клеток и спорангиев НЧ образовывали нередко сплошной слой толщиной до 100 нм. В клеточной стенке НЧ располагались в виде волнистых слоев без признаков их слипания между собой. В межклеточном матриксе наряду с округлыми были обнаружены НЧ тетрагональной формы размером до 40−60 нм (рис. 1л). В ЭДРС-спектрах, регистрируемых от скоплений НЧ (рис. 3а–3в), были идентифицированы три пика излучения марганца (Lα = 0.64 кэВ, Kα = 5.89 и Kα = 6.49 кэВ), что указывает на обогащенность этим элементом исследуемых НЧ. В НЧ, локализованных в клеточной стенке, также был выявлен пик Fe (рис. 3а, табл. 1), а в НЧ, расположенных на поверхности клеток и внеклеточном матриксе, – небольшой пик P (рис. 3б, 3в, табл. 1). Интересно отметить, что в спектрах ЭДРС клеточных стенок в этом случае не были зарегистрированы характеристические рентгеновские излучения, соответствующие азоту и сере.
Рис. 3.
Репрезентативные спектры ЭДРС клеток микроводоросли Micractinium simplicissimum IPPAS С-2056, инкубированной с 500 мг/л Mn2+ и 22.0 мг/л Pi: электронно-плотные наночастицы в клеточной стенке (а), на поверхности клетки (б) и межклеточном матриксе (в), в области препарата, не содержащего клеточных структур и межклеточного матрикса (эпоксидная смола, г).
ОБСУЖДЕНИЕ
Многие виды фотоавтотрофных микроорганизмов, такие как Chlorococcum sp., Chlorella sp., Euglena gracilis, Klebsormidium flaccidum, Anabaena flos-aquae, Spirulina platensis и Calothrix pulvinate, способны синтезировать широкий спектр НЧ [4, 28]. Предполагается, что гидроксильные, карбоксильные и аминогруппы различных компонентов клетки микроводорослей могут выступать в качестве восстанавливающих и стабилизирующих агентов. Образование НЧ может происходить на поверхности клеток, в клеточной стенке, а также в цитоплазме, но точные механизмы биосинтеза до сих пор не известны [2].
Новый штамм M. simplicissimum IPPAS C-2056 привлек внимание по причине его толерантности к действию высоких концентраций экзогенного фосфата и марганца, описанной в [21, 23].
Исследования по изучению токсичности высоких концентраций фосфатов на клетки этой зеленой миководоросли показали, что одним из механизмов, обеспечивающих ее высокую толерантность к избытку экзогенного Pi (до 14 г/л), является помимо образования обильных и разнообразных внутриклеточных обогащенных фосфором включений способность адсорбировать фосфор на поверхности клеток и в клеточной стенке, таким образом препятствуя проникновению его избытка внутрь клетки [21]. Именно в этой работе мы впервые столкнулись с детекцией Fe в спектрах ЭДРС от клеточной стенки.
При подробном исследовании микроводоросли M. simplicissimum, выращенной в средах с различным содержанием фосфатов, было выявлено образование фосфорсодержащих НЧ, локализующихся на поверхности клеток, в периферическом слое клеточной стенки и периплазме (табл. 1). Помимо пиков P в спектрах ЭДРС от таких НЧ в большинстве случаев были идентифицированы пики Mg и/или Ca. Такой элементный состав НЧ и специфическая флуоресценция поверхностных структур клеток, окрашенных красителем 4',6-диамидино-2-фенилиндолом (4′,6-diamidino-2-phenylindole, DAPI) [21], могут указывать на то, что эти НЧ содержат P в форме полифосфатов. Косвенным подтверждением этой гипотезы может служить присутствие в клеточной стенке заметных количеств азота и серы, возможно, принадлежащих белкам-ферментам биосинтеза полифосфатов [29].
Помимо фосфорсодержащих НЧ было обнаружено образование сверхмалых НЧ размером до 5 нм, содержащих Fe, локализующихся преимущественно в клеточной стенке и на ее поверхности (рис. 1б, 1г–1з, 2б, 2в, 2ж, 2з, табл. 1). Присутствие пика кислорода в спектрах ЭДРС от этих НЧ не исключает участие в них кислорода в виде оксидов железа.
В процессе биосинтеза НЧ Fe клетками микроводорослей выделяют три фазы [30–33]: активации (медленный рост НЧ и частичное восстановление ионов металлов биомолекулами), роста (полное восстановление ионов металлов с агрегацией НЧ) и терминации (возникновение покрытия из слоя биомолекул, переход НЧ в стабильную форму и их обособление). Синтезированные физико-химическими методами НЧ, как правило, реакционноспособны и легко подвергаются окислению кислородом воздуха, их суспензии неустойчивы и легко агрегируют. Напротив, НЧ, полученные методами “зеленого” синтеза, более устойчивы в силу наличия “покрытия” из полисахаридов и других биомолекул [2]. Отметим, что изученная микроводоросль M. simplicissimum способна к биосинтезу НЧ Fe при сравнительно низких концентрациях ионов этого металла в среде. Так, для синтеза НЧ Fe к культурам Chlorella sp., Chloroccum sp. и Euglena gracilis добавляли от 0.5 г до 10 г/л ионов Fe2+, в то время как клетки M. simplicissimum синтезировали НЧ при значительно более низких концентрациях Fe2+ в среде (1 мг/л) [7, 11].
Помимо НЧ FeOx клетки микроорганизмов могут синтезировать НЧ фосфата железа. Так, при добавлении к клеткам дрожжей хлорида железа ионы Fe3+ связываются с гидроксильными группами и аминогруппами белков поверхностных структур клеток; при последующем добавлении фосфата натрия на поверхности клеток образуются НЧ фосфата железа [34]. В представленных экспериментальных условиях клетки M. simplicissimum помимо НЧ, содержащих только Fe либо P, формировали НЧ смешанного состава: в их спектрах ЭДРС одновременно с Fe и P выявлялись Ca и (или) Mg (рис. 2б, 2ж, 2з, табл. 1), которые отличались, как правило, более крупными размерами (см. выше). Клетки M. simplicissimum, прединкубированные в бесфосфорной среде, формировали в клеточной стенке и на ее поверхности НЧ, содержащие Fe, но не содержащие P, Ca, Mg. Интересно, что при восстановлении фосфорного питания (добавлением Pi) образование НЧ смешанного состава, включавших P, наблюдалось только через сутки. Возможное объяснение этого явления связано с предполагаемым присутствием P в составе НЧ именно в форме полифосфатов. В этом случае для ассимиляции экзогенного Pi и конверсии его в полифосфаты требуется энергия (обычно в виде аденозинтрифосфата, генерированного в ходе фотосинтеза) и время для активации метаболизма клетки после выхода из фосфорного голодания [35].
У микроводоросли M. simplicissimum была обнаружена способность к образованию НЧ марганца в самых разных внеклеточных сайтах и структурах: на поверхности клеток, в клеточной стенке, оболочке спорангиев и в межклеточном матриксе. Известно, что этот процесс связан с окислением растворенного в среде Mn2+ до Mn4+ и образованием нерастворимого оксида марганца [14, 36, 37]. Окислению могут способствовать рост pH среды при поглощении клетками неорганического углерода и синтез активных форм кислорода внеклеточными пероксидазами, участвующими в “сшивке” молекул клеточной стенки [12]. Отметим, что в составе клеточной стенки НЧ Mn были обнаружены преимущественно в ее периферическом слое, при этом в их локализации отмечалась упорядоченность, что может свидетельствовать об участии в их синтезе ферментных комплексов клеточной стенки, а не только спонтанных химических реакций. Возможно, способность M. simplicissimum к синтезу широкого спектра НЧ Mn детерминирована развитыми поверхностными структурами этого организма. Известно, что экзополисахаридный межклеточный матрикс бактерий, водорослей и грибов, в котором возможно повышение рН и концентрации различных субстратов и ферментов, выделяемых клетками, может быть местом образования и адсорбции НЧ MnOx [37]. Сайтами связывания ионов металла в клеточной стенке микроводорослей могут быть также тиоловые группы белков, аминокислот, карбоксильные группы пектинов, белков, уроновых кислот [2]. Однако в проведенных экспериментах в поверхностных структурах и межклеточном матриксе M. simplicissimum не были обнаружены характеристические рентгеновские излучения азота и серы, что, очевидно, обусловлено пределами чувствительности метода ЭДРС (регистрировали не точечные спектры, региональные для зон скопления НЧ). В спектрах НЧ были детектированы также небольшие пики P и Fe (рис. 3).
Помимо поверхностных структур пики Mn были обнаружены в вакуолярных фосфорсодержащих включениях, по элементному составу схожих с гранулами полифосфатов [17]. Накопление Mn в такой форме описано для микроводоросли Chlamydomonas reinhardtii [38]. Физиологическое значение интенсивного образования НЧ Mn на поверхности клеток и в межклеточном матриксе, а также структурированного накопления НЧ Mn в клеточной стенке и оболочке спорангиев может быть связано с необходимостью исключить избыток потенциально токсичного Mn из метаболически активных компартментов, препятствуя его проникновению внутрь клетки. Эти представления соответствуют выявленной в [23] толерантности M. simplicissimum к высоким концентрациям этого тяжелого металла.
Отметим, что при повышенных концентрациях экзогенных P и Mn непосредственно в области препарата, не содержащего клеточных структур и межклеточного матрикса (эпоксидная смола), частицы, обогащенные этими элементами, не были обнаружены, что указывает исключительно на биогенную природу НЧ.
В целом полученные данные позволяют сделать вывод о высоком потенциале исследованного штамма M. simplicissimum IPPAS С-2056 для “зеленого” синтеза разнообразных по составу и размерам НЧ, содержащих Mn, Fe и P. Вероятно, одним из его детерминантов является высокая толерантность данной микроводоросли к экзогенным уровням Pi и Mn. Полученные данные, а также опубликованные позволяют предположить, что и другие виды микроводорослей, толерантные к высоким уровням поллютантов, могут быть использованы для получения НЧ, синтез которых традиционными физико-химическими методами был бы затруднителен. Существенно и то, что на характеристики синтезируемых клетками НЧ влияют состав и концентрация соединений соответствующих элементов в среде культивирования. Это открывает возможности для параметрического управления “зеленым” синтезом НЧ клетками микроводорослей, но и требует дополнительных исследований. Особого внимания заслуживают поиск и исследование новых штаммов микроводорослей – потенциальных продуцентов НЧ с ценными свойствами.
Авторы выражают благодарность сотрудникам кафедры биоинженерии биологического факультета МГУ им. М.В. Ломоносова Л.Р. Семеновой, И.О. Селях и П.Н. Щербакову за помощь в культивировании в экспериментах последовательного истощения–обогащения культуры M. simplimissimum фосфатами и предоставление образцов суспензий клеток для приготовления препаратов ПЭМ.
Исследования методом ПЭМ проведены с использованием оборудования ЦКП “Электронная микроскопия в науках о жизни” МГУ им. М.В. Ломоносова (УНУ “Трехмерная электронная микроскопия и спектроскопия”).
Выявление субклеточного распределения Mn выполнено при поддержке Российского научного фонда (грант № 21-74-20004). Анализ фосфатных НЧ выполнен при поддержке Научно-образовательной школы МГУ “Молекулярные технологии живых систем и синтетическая биология”.
Список литературы
Cuenya B.R. // Thin Solid Films. 2010. V. 518. № 12. P. 3127. https://doi.org/10.1016/j.tsf.2010.01.018
Khan F., Shahid A., Zhu H. et al. // Chemosphere. 2022. V. 293. P. 133571. https://doi.org/10.1016/j.chemosphere.2022.133571
Khanna P., Kaur A., Goyal D. // J. Microbiol. Methods. 2019. V. 163. P. 105656. https://doi.org/10.1016/j.mimet.2019.105656
Mukherjee A., Sarkar D., Sasmal S. // Front. Microbiol. 2021. V. 12. P. 693899. https://doi.org/10.3389%2Ffmicb.2021.693899
LewisOscar F., Vismaya S., Arunkumar M. et al. // Algae-organisms for imminent biotechnology / Eds. Thajuddin N., Dhanasekaran D. London: IntechOpen, 2016. V. 7. P. 157. https://doi.org/10.5772/61365
Kamran U., Bhatti H.N., Iqbal M. et al. // Z. Phys. Chem. 2019. V. 233. № 9. P. 1325. https://doi.org/10.1515/zpch-2018-1238
Win T.T., Khan S., Bo B. et al. // Sci. Rep. 2021. V. 11. № 1. P. 1. https://doi.org/10.1038/s41598-021-01538-2
Shankar P.D., Shobana S., Karuppusamy I. et al. // Enzyme Microb. Technol. 2016. V. 95. P. 28. https://doi.org/10.1016/j.enzmictec.2016.10.015
Senapati S., Syed A., Moeez S. et al. // Mater. Lett. 2012. V. 79. P. 116. https://doi.org/10.1016/j.matlet.2012.04.009
Chertok B., Moffat B.A., David A.E. et al. // Biomaterials. 2008. V. 29. № 4. P. 487. https://doi.org/10.1016/j.biomaterials.2007.08.050
Taghizadeh S.M., Taherpoor A., Ebrahiminezhad A. // JAMSAT. 2020. V. 5. № 1. https://doi.org/10.30476/jamsat.2020.84697.1009
Tebo B., Bargar J., Clement B. et al. // Annu. Rev. Earth Planet. Sci. 2004. V. 32. P. 287. https://doi.org/10.1146/annurev.earth.32.101802.120213
Learman D.R., Voelker B.M., Vazquez-Rodriguez A.I. et al. // Nat. Geosci. 2011. V. 4. P. 95. https://doi.org/10.1038/ngeo1055
Hoseinpour V., Ghaemi N. // J. Photochem. Photobiol. B. 2018. V. 189. P. 234. https://doi.org/10.1016/j.jphotobiol.2018.10.022
Tarafdar J.C., Raliya R., Rathore I. // J. Bionanosci. 2012. V. 6. № 2. P. 84. https://doi.org/10.1166/jbns.2012.1077
Fatima F., Hashim A., Anees S. // ESPR. 2021. V. 28. № 2. P. 1292. https://doi.org/10.1007/s11356-020-11218-9
Sanz-Luque E., Bhaya D., Grossman A.R. // Front. Plant Sci. 2020. V. 11. P. 938. https://doi.org/10.3389/fpls.2020.00938
Arunakumara K., Xuecheng Z. // J. Ocean Univ. Chin. 2008. V. 7. P. 60. https://doi.org/10.1007/s11802-008-0060-y
Saif S., Tahir A., Chen Y. // Nanomaterials. 2016. V. 6. № 11. P. 209. https://doi.org/10.3390/nano6110209
Junior W.G.M., Gorgich M., Corrêa P.S. et al. // Aquac. 2020. V. 528. P. 735562. https://doi.org/10.1016/j.aquaculture.2020.735562
Lobakova E.S., Selyakh I.O., Semenova L.R. et al. // J. Appl. Phycol. 2022. https://doi.org/10.1007/s10811-022-02812-0
Stanier R., Kunisawa R., Mandel M. et al. // Microbiol. Mol. Biol. Rev. 1971. V. 35. P. 171.
Васильева С.Г., Горелова О.А., Баулина О.И. и др. // Физиология растений. 2022. Т. 69. № 5. С. 1. https://doi.org/10.31857/S0015330322050220
Solovchenko A., Gorelova O., Karpova O. et al. // Cells. 2020. V. 9. № 9. P. 1933. https://doi.org/10.3390/cells9091933
Gorelova O., Baulina O., Solovchenko A. et al. // Arch. Microbiol. 2015. V. 197. P. 181. https://doi.org/10.1007/s00203-014-1036-5
Reynolds E. // J. Cell Biol. 1963. V. 17. P. 208. https://doi.org/10.1083/jcb.17.1.208
Shebanova A., Ismagulova T., Solovchenko A. et al. // Protoplasma. 2017. V. 254. P. 1323. https://doi.org/10.1007/s00709-016-1024-5
Perfiliev Y.D., Tambiev A.K., Konnychev M.A. et al. // J. Trace Elem. Med. Biol. 2018. V. 48. P. 105. https://doi.org/10.1016/j.jtemb.2018.02.030
Solovchenko A., Khozin-Goldberg I., Selyakh I. et al. // Algal Res. 2019. V. 43. P. 101651. https://doi.org/10.1016/j.algal.2019.101651
Gan Y., Lim Y.S., Qiao L. // CBFMAO. 2012. V. 159. № 4. P. 1732. https://doi.org/10.1016/j.combustflame.2011.12.008
Akhtar M.S., Panwar J., Yun Y.-S. // ACS Sustain. Chem. Eng. 2013. V. 1. № 6. P. 591. https://doi.org/10.1021/sc300118u
Jeevanandam J., Chan Y.S., Danquah M.K. // Chem. Bio. Eng. Rev. 2016. V. 3. № 2. P. 55. https://doi.org/10.1002/cben.201500018
Ishak N.M., Kamarudin S.K., Timmiati S.N. et al. // Mater. Res. Express. 2019. V. 6. № 11. P. 112004. https://doi.org/10.1088/2053-1591/ab4458
He W., Zhou W., Wang Y. et al. // Mater. Sci. Eng. C. 2009. V. 29. № 4. P. 1348. https://doi.org/10.1016/j.msec.2008.10.030
Solovchenko A.E., Ismagulova T.T., Lukyanov A.A. et al. // J. Appl. Phycol. 2019. V. 31. № 5. P. 2755. https://doi.org/10.1007/s10811-019-01831-8
Knauer K., Jabusch T., Sigg L. // Aquat. Sci. 1999. V. 61. № 1. P. 44. https://doi.org/10.1007/PL00001321
Chaput D.L., Fowler A.J., Seo O. et al. // Sci. Rep. 2019. V. 9. № 1. P. 1. https://doi.org/10.1038/s41598-019-54403-8
Tsednee M., Castruita M., Salomé P.A. et al. // J. Biol. Chem. 2019. V. 294. P. 17626. https://doi.org/10.1074/jbc.RA119.009130
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


