Российские нанотехнологии, 2023, T. 18, № 1, стр. 107-113
ИЗУЧЕНИЕ ПРОЦЕССОВ КУЛЬТИВИРОВАНИЯ И НАКОПЛЕНИЯ ПОЛЕЗНЫХ ПРОДУКТОВ МИКРОВОДОРОСЛЯМИ Chlorella vulgaris В ФОТОБИОРЕАКТОРЕ С ОПТОВОЛОКОННОЙ СИСТЕМОЙ ОСВЕЩЕНИЯ
А. М. Овчинникова 1, Д. В. Сухинов 2, *, А. О. Романов 2, 3, В. М. Пожидаев 2, П. М. Готовцев 2, 3
1 Московский политехнический институт
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Московский физико-технический институт (Национальный исследовательский университет)
Долгопрудный, Россия
* E-mail: sukhinov.dv@yandex.ru
Поступила в редакцию 05.10.2022
После доработки 25.11.2022
Принята к публикации 25.11.2022
Аннотация
Проведено культивирование микроводоросли Chlorella vulgaris в трубчатом тонкослойном фотобиореакторе уникальной конструкции, для освещения которого использовалось оптоволокно бокового свечения. В результате применения метода интенсивного прототипирования найдена оптимальная конструкция фотобиореактора и достигнута максимальная скорость роста 32 мг/л/сут (против 8 мг/л/сут при контрольном культивировании в люминостате). Содержание общего белка в биомассе, полученной с установки, составило 21 ± 6%, что несколько ниже в сравнении с контролем (26 ± 6%), однако выявленные различия не имеют статистической значимости. Кроме того, по сравнению с контрольным культивированием в образцах биомассы из фотобиореактора повышен уровень насыщенной пальмитиновой (С16:0) и ненасыщенных линолевой (С18:2) и α-линоленовой (С18:3α) жирных кислот. Показана перспективность применения фотобиореактора разработанной конструкции с целью получения питательной биомассы микроводоросли C. vulgaris для систем жизнеобеспечения пилотируемых космических аппаратов.
ВВЕДЕНИЕ
В настоящее время на фоне активного обсуждения возможности создания обитаемых поселений на Луне и Марсе, запуска новых пилотируемых станций на околоземной орбите, а также с постоянно увеличивающимся интересом к длительным космическим полетам среди государственных организаций и частных компаний сформулирована задача создания систем жизнеобеспечения с замкнутым циклом, которые позволили бы совершать продолжительные космические экспедиции без частых регулярных поставок ресурсов с Земли [1, 2].
При создании искусственной системы жизнеобеспечения в условиях замкнутого пространства пилотируемого космического аппарата или обитаемого поселения за основу может быть взят круговорот элементов в земной экосистеме, в котором замыкание цикла обеспечивается многоступенчатым преобразованием веществ живыми организмами (микроорганизмами, растениями, животными, грибами). Различие между искусственной системой жизнеобеспечения и земной экосистемой состоит в масштабах (суммарное количество каждого из элементов) и времени, необходимом для полной регенерации элементов системы. При этом важно учитывать и то, что часть потребляемых веществ остается в организме, где формирует и заменяет структурные элементы тела [3, 4]. А значит, для космической миссии в любом случае потребуется некоторый запас ресурсов.
Предпринято множество попыток создания отдельных элементов замкнутых систем жизнеобеспечения, часть из которых была весьма успешна [5–7]. В ряде исследований в качестве основного источника питательных веществ и кислорода использовались высшие растения, выращиваемые на относительно больших площадях в основном на гидропонике, субстрате в виде твердой среды, а также при воздушно-субирригационном культивировании [8–10]. В исследованиях, изучающих возможность создания замкнутых систем жизнеобеспечения, чаще всего рассматриваются следующие фототрофные микроорганизмы: микроводоросль Chlorella vulgaris [10–12], цианобактерии Arthrospira platensis [10, 13] и Limnospira indica [7, 14].
Важными ограничениями на борту космического аппарата являются электропотребление, габариты и вес системы [2, 15, 16], что необходимо учитывать при создании элементов системы жизнеобеспечения, основой для которых могут стать фотосинтезирующие микроорганизмы, способные как перерабатывать выдыхаемый людьми углекислый газ в кислород, так и использоваться в качестве дополнительного источника пищи. В таком случае большая часть энергозатрат будет приходиться на освещение, поэтому важно достичь максимально эффективного использования света, например, через внедрение тонкослойного культивирования. Этот подход также позволит уменьшить объем культуры микроводорослей при сохранении фотосинтетической продуктивности [17, 18].
Отметим, что в большинстве исследований тонкослойное культивирование проводили в открытых фотобиореакторах, занимающих большую площадь. Однако для космических аппаратов возможно только закрытое культивирование.
В [12] проводили культивирование микроводоросли C. vulgaris в пластинчатом фотобиореакторе. Блок фотобиореактора содержал систему автоматического управления и 1.5-литровый биореактор с двумя светодиодными панелями в качестве источника света [12]. При участии Института медико-биологических проблем РАН [19, 20] проводились различные эксперименты, связанные с изучением способов создания замкнутых экосистем. Среди них были эксперименты, проведенные в условиях космического полета, в частности создана установка, при культивировании в которой на одного человека должен приходиться объем в 15 м3, содержащий 45 л суспензии микроводорослей с концентрацией не менее 10–12 г/л в пересчете на сухой вес.
В ряде работ рассмотрено устройство фотобиореакторов в контексте создания замкнутых экосистем, но сами системы не создавались. Например, в [16] описано использование для этих целей мембранного фотобиореактора. Было предложено применение как поверхностно, так и глубинного культивирования в жидкой среде [16].
Согласно [21] возможно использование группы фотобиореакторных резервуаров или трубок, выстилающих внутреннюю поверхность космического аппарата. Причем стоит обратить внимание на тонкослойное распределение культуры, чтобы обеспечить надлежащее освещение всего объема суспензии микроорганизмов. Предлагаемые в исследовании методы освещения: естественное (прямой солнечный свет или оптоволоконные световые трубки) или искусственное (флуоресцентное или светодиодное) [21]. В [22] предложено использовать шестилитровый плоскопанельный фотобиореактор с эйрлифтом, освещаемый галогенными лампами, скорость роста C. vulgaris в котором достигала 4 г/л/сутки.
В [23] для культивирования C. vulgaris использовали модификацию плоскопанельного биореактора, особенностью которого являлись цилиндрические препятствия, встроенные в камеру реактора. Они создавали вихревые потоки, аналогичные потоку жидкости в наземном биореакторе, а перистальтический насос поддерживал непрерывную циркуляцию внутри системы.
В [11] представлены два адаптированных к микрогравитации реактора общей емкостью 650 мл. Это фотобиореакторы трубчатого типа, которые благодаря своему устройству позволяют легко масштабировать систему за счет использования нескольких дополнительных шестилитровых петель. Максимальная скорость роста, достигнутая на данном этапе в этом реакторе, составила ~0.1 г/л/сут [11]. Камера реактора герметизирована газопроницаемой мембраной, обеспечивающей достаточный перенос CO2 и O2 между газовой фазой снаружи реактора и жидкой фазой внутри него. Поверхности мембраны оптически прозрачны, что обеспечивает пропускание более 98% света [11].
Следует упомянуть исследования, сосредоточенные на создании технологии, способной работать в условиях микрогравитации продолжительное время, например 30-суточное культивирование L. indica [14]. Используемые в исследовании реакторы состояли из двух камер – газовой и жидкостной, разделенных мембраной из политетрафторэтилена. Реакторы работали в периодическом режиме и содержали: газопроницаемую мембрану, светодиодную плату (36 светодиодов, обеспечивающих непрерывное освещение с интенсивностью в диапазоне от 20 до 50 мкмоль/м2/с в фотосинтетически активном диапазоне 400–700 нм), отделение для роста цианобактерий – прозрачный надувной мешок, содержащий культуральную жидкость объемом 51 мл. Температуру в жидкостной камере поддерживали на уровне 33 ± 1°C [14].
Для культивирования C. vulgaris в течение 14 сут использовали фотобиореактор, состоящий из двухканальных биореакторов с двусторонними каналами, содержащими суспензию микроводорослей [11, 24]. Проточный канал глубиной 3 мм и шириной 10 мм был сделан из прозрачного поликарбоната для увеличения отношения поверхности к объему, что облегчило доступ света к клеткам и привело к увеличению поверхности газообмена. Обе составляющие части реактора герметизированы газопроницаемой фторэтиленпропиленовой мембраной. Конструкция светодиодной панели была ориентирована на спектр поглощения C. vulgaris SAG 211-12 в диапазонах 435–475 и 660–680 нм. Выбраны красный (λmax = = 660 нм) и синий (λmax = 470 нм) светодиоды, равномерно распределенные по светодиодной панели [24].
Цель настоящего исследования – создание тонкослойного трубчатого фотобиореактора с максимальным покрытием трубок оптоволокном. Полученная в результате применения метода интенсивного прототипирования финальная модель биореактора должна обеспечивать более высокую скорость роста микроводоросли C. vulgaris по сравнению с контрольным культивированием в люминостате при сохранении высокой питательной ценности биомассы.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В работе использовали микроводоросль Chlorella vulgaris GKV1 из коллекции НИЦ “Курчатовский институт”. Культивирование проводили на среде BBM (г/л): 1.25 NaNO3, 1.25 KH2PO4, 1.0 MgSO4, 1.0 мл/л раствора микроэлементов (по Пфенингу [25]) [26]. Приготовленную среду доводили до pH 7 с помощью 1 Н раствора NaOH.
Рост микроводоросли отслеживали путем измерения оптической плотности культуральной суспензии. Оптическую плотность измеряли спектрофотометрически с помощью мультимодального ридера (Thermo Scientific Varioscan LUX) при 680 и 750 нм, световой путь составлял 1 см. Все измерения проводили в трех повторностях.
Конструкция фотобиореактора и условия культивирования. Условия культивирования и основные параметры финальной модели установки приведены в табл. 1.
Таблица 1.
Условия культивирования Chlorella vulgaris в фотобиореакторной установке
| Продолжительность культивирования, сут | 16 |
|---|---|
| Интенсивность света, люкс | 350 |
| Фотопериод свет : темнота | 7 : 17 |
| Температура, °C | 20–25 |
| Начальная оптическая плотность культуры при 680 нм | 0.14 ± 0.02 |
| Скорость перекачивания перестальтическим насосом, об./мин | 40 |
| Материал трубки | Полиуретан |
| Специализированные светодиоды, закрепленные внутри спирали оптоволокна | Два оптоволокна, четыре светодиода (синий, красный и два белых) |
| Барботирование | Через циркуляционную колбу, компрессором (производительностью 1.6 л/мин) |
Поскольку скорость роста и эффективность фотосинтеза фототрофных микроорганизмов выше при тонкослойном культивировании [29], основываясь на преимуществах и недостатках различных типов фотобиореакторов, выбрали трубчатый тип фотобиореактора. Диаметр трубок составил 4 мм, что позволило осуществить культивирование в тонком слое во избежание взаимного затемнения клеток микроводоросли. Объем собранного фотобиореактора составил 140 мл, общая длина трубки – 11 м. Основываясь на предварительном тестировании фотобиореактора, в качестве материала трубок выбрали полиуретан. Фотобиореакторная система была незамкнута – входная и выходная части трубки опущены в колбу Эрленмейера с рабочим объемом 250 мл.
При предварительном тестировании фотобиореактора был найден оптимальный способ оплетения оптоволокна бокового свечения цельной трубкой фотобиореактора. Он позволил исключить возможность перегибов трубок, а также обеспечить максимальное покрытие излучающей свет поверхности оптоволокна. Схема конструкции фотобиореактора представлена на рис. 1.
Циркуляция клеточной суспензии по трубчатому фотобиореактору осуществлялась при помощи перистальтического насоса LongerPump BT300-2J, скорость перекачивания составляла 40 об./мин (4.9 л/ч). Перекачивание обеспечивало ускоренный выход образовавшегося в системе кислорода, а также насыщение суспензии атмосферным воздухом, содержащим углекислый газ, необходимый для фотосинтеза. Кроме того, благодаря циркуляции суспензии нарастание культуры на стенках фотобиореактора было сведено к минимуму.
Барботирование осуществлялось компрессором с производительностью 1.6 л/мин. Для понижения процесса испарения жидкости при барботировании компрессор предварительно подавал воздух в циркуляционную колбу Бунзена с дистиллированной водой, оттуда увлажненный воздух подавался в колбу Эрленмейера, в которую помещены трубки фотобиореактора.
Источником света были светодиоды, направленные в торец оптоволокна бокового свечения, которое благодаря своим свойствам рассеивает подаваемый свет по всей своей длине. Всего использовалось четыре светодиода (два белых, один красный и один синий) со следующими характеристиками: питание – 12 В, мощность – 1.5 Вт, световой поток – 100 лк. Средняя освещенность по длине оптоволокна составляла 350 лк, световой режим свет:темнота 7 : 17.
Выбор светодиодов красного и синего цвета связан с тем, что, как показано в [15], спектр поглощения клетками C. vulgaris содержит две основные области – в синей и красной областях спектра. Поэтому использование именно этих светодиодов позволит обеспечить энергоэффективность фотобиореакторной установки. Это важно, поскольку в условиях космической миссии электроэнергия является дефицитным ресурсом.
Кроме того, известен эффект Эмерсона, заключающийся в том, что при одновременном возбуждении клеток фотосинтезирующих микроорганизмов коротковолновым и длинноволновым светом скорость фотосинтеза выше, чем сумма скоростей при отдельном возбуждении двумя длинами волн. Это связано с тем, что для нормального протекания процесса фотосинтеза необходимо одновременное возбуждение обеих фотосистем [27].
Для сравнения показателей роста и биохимического состава клеток микроводоросли C. vulgaris проводили культивирование аналогичного объема суспензии (140 мл) в колбе Эрленмейера с рабочим объемом 250 мл в люминостате с освещенностью 900 ± 50 лк. Перемешивание осуществлялось барботированием компрессором с производительностью 1.6 л/мин.
Сбор и биохимический анализ биомассы. Сбор биомассы микроводорослей проводили центрифугированием (12 500 g, 15 мин) на центрифуге SL40R (Thermo Scientific, США). После удаления супернатанта биомассу промывали дистиллированной водой и снова центрифугировали. Оставшийся преципитат замораживали на 12 ч при ‒70°C, а затем лиофильно сушили в течение 10–20 ч на лиофильной сушилке FreeZone 2.5 (Labconco, США). Высушенная биомасса хранилась при –20°C до дальнейшего анализа.
Общий белок определяли методом Лоури [28], состав и содержание метиловых эфиров жирных кислот (ЖК) – согласно [29, 30].
Статистический анализ проводили посредством однофакторного теста ANOVA с апостериорным тестом Тьюки. Численные результаты представлены как среднее значение не менее чем трех независимых повторов (n ≥ 3). Планки погрешностей – стандартное отклонение (SD).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
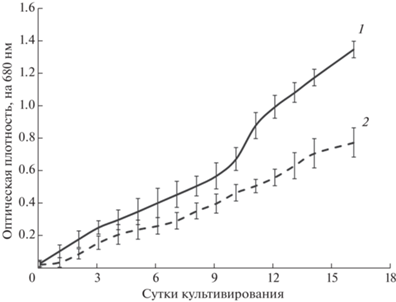
Культивирование и биохимический анализ биомассы. На рис. 2 представлены кривые роста микроводоросли C. vulgaris для фотобиореакторной установки и контрольного образца. Всего в финальной модели установки было проведено три последовательных культивирования, для каждого из которых параллельно ставили контрольную колбу в люминостат, поэтому данные представляют собой усредненные значения. Из приведенных данных видно, что на 16-е сутки культивирования оптическая плотность культуры в фотобиореакторной установке более чем в 1.6 раза выше, чем для контрольного образца.
Рис. 2.
Кривые роста микроводоросли Chlorella vulgaris для фотобиореакторной установки (1) и контрольного образца (2).
В табл. 2 приведены усредненные данные о выходе биомассы с литра питательной среды, содержании белка и суммарных ЖК в биомассе в пересчете на сухой вес.
Таблица 2.
Сравнение параметров накопленной биомассы Chlorella vulgaris в фотобиореакторной установке и контрольном образце
| Выход биомассы с литра среды, мг | Содержание общего белка, % | Содержание суммарных жирных кислот, мг/г | |
|---|---|---|---|
| Установка | 511 ± 28 | 21 ± 6 | 33 ± 5 |
| Контроль | 129 ± 42 | 26 ± 6 | 64 ± 23 |
Так, сухой вес собранной биомассы в среднем составил 71.5 и 18.1 мг из фотобиореактора и контрольного образца в люминостате соответственно. Несмотря на то что скорость роста культуры в фотобиореакторе (32 мг/л/сут) была существенно выше, чем в люминостате (8 мг/л/сут), различия в содержании общего белка в контрольной биомассе (26 ± 6%) и биомассе, полученной с экспериментальной установки (21 ± 6%), статистически незначимы (p > 0.05) (табл. 2).
Относительное содержание насыщенных ЖК в фотобиореакторе и люминостате составило 46.0 ± 1.8 и 46.9 ± 1.6% соответственно, а ненасыщенных – 54.0 ± 2.2 и 53.1 ± 1.3%, из которых мононенасыщенных – 11.5 ± 1.2 и 11.4 ± 1.4%, полиненасыщенных – 42.5 ± 2.1 и 41.7 ± 1.9%. Из представленных данных видно, что статистически значимых различий в содержании отдельных групп ЖК в биомассе C. vulgaris различного происхождения нет (p > 0.05).
Основными ЖК микроводоросли C. vulgaris, выращенной и в фотобиореакторе, и в контроле в люминостате, были насыщенные стеариновая, маргариновая и пальмитиновая и ненасыщенные пальмитолеиновая и незаменимые олеиновая, линолевая и α-линоленовая (рис. 3).
Рис. 3.
Состав и содержание жирных кислот в биомассе Chlorella vulgaris в опытных образцах (1) и контроле (2).
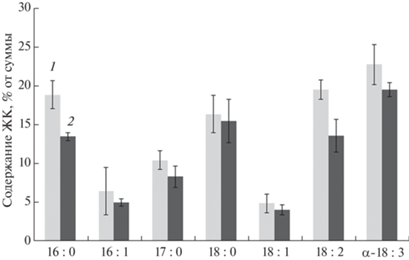
Из представленных на рис. 3 данных видно, что по сравнению с контрольным культивированием в образцах биомассы из фотобиореактора повышен уровень насыщенной пальмитиновой и ненасыщенных линолевой и α-линоленовой ЖК.
Предварительные расчеты масштабирования фотобиореактора как части замкнутой системы жизнеобеспечения. Рассмотрим расчеты, показывающие, какой примерный объем культуры микроорганизмов необходим для поддержания штатной работы системы жизнеобеспечения с экипажем из восьми человек. Человек в среднем потребляет 816 г кислорода в день [21]. Согласно [31] принимаем, что 0.6 г водорослевой биомассы производит ~1 г кислорода в день. Получаем, что для поддержания нормального уровня кислорода в замкнутой атмосфере пилотируемого космического аппарата необходимо проводить непрерывное культивирование не менее 3900 г сухого веса биомассы. Значит, если поддерживать концентрацию биомассы C. vulgaris в фотобиореакторной установке разработанной конструкции, аналогичную максимально полученному в данной работе выходу (не менее 0.5 г/л), то для обеспечения кислородом восьми человек экипажа будет необходимо не менее 0.78 м3 культуры. То есть понадобится не менее 62 км трубки и ~35 км оптоволокна.
Таким образом, благодаря методу интенсивного прототипирования удалось достичь скорости роста биомассы в фотобиореакторе (32 мг/л/сут) выше, чем при контрольном культивировании в люминостате (8 мг/л/сут). В тонкослойном трубчатом фотобиореакторе с оптоволоконной системой освещения с уровнем освещенности 350 лк выход биомассы превысил контрольную величину почти в 4 раза (71.5 мг по сравнению с 18.1 мг). Содержание общего белка в биомассе из фотобиореакторной установки (21 ± 6%) статистически неотличимо от контрольных значений (26 ± 6%). Процент содержания ненасыщенных ЖК (важных с точки зрения питательной ценности) в образцах биомассы составил 54.0 ± 2.2 и 53.1 ± 1.3% в установке и в контроле соответственно.
Для того чтобы удовлетворить потребность в кислороде экипажа из восьми человек, по предварительным расчетам потребуется не менее 62 км трубки фотобиореактора и 35 км оптоволокна.
ЗАКЛЮЧЕНИЕ
Представленная фотобиореакторная установка с оптоволоконной системой освещения благодаря своей конструкции позволила провести культивирование микроводоросли C. vulgaris со скоростью роста, значительно превышающей контрольный образец. По результатам биохимического анализа биомассы установка является весьма перспективной основой для создания замкнутой системы жизнеобеспечения для космического аппарата или поселения на поверхности другой планеты.
Исследования выполнены в рамках работ по тематическому плану 1.10. “Разработка научно-технических основ для создания автономных систем жизнеобеспечения для использования в условиях Крайнего Севера, Арктики и космоса” НИЦ “Курчатовский институт”.
Список литературы
Revellame E.D., Aguda R., Chistoserdov A. et al. // Algal Res. 2021. V. 55. P. 102258. https://doi.org/10.1016/J.ALGAL.2021.102258
Mapstone L.J., Leite M.N., Purton S. et al. // Biotechnol. Adv. 2022. V. 59. P. 107946. https://doi.org/10.1016/J.BIOTECHADV.2022.107946
Brown O.R. Oxygen, the breath of life : boon and bane in human health, disease, and therapy. Sharjah, UAE: Bentham Science Publishers, 2017. 435 p.
Ruyters G. //Blue Light Effects in Biological Systems. Proceedings in Life Sciences. Berlin, Heidelberg: Springer, 1984. P. 283. https://doi.org/10.1007/978-3-642-69767-8_32
Walker J., Granjou C. // Futures. 2017. V. 92. P. 59. https://doi.org/10.1016/J.FUTURES.2016.12.001
Alemany L., Peiro E., Arnau C. et al. // Biochem. Eng. J. 2019. V. 151. P. 107323. https://doi.org/10.1016/J.BEJ.2019.107323
Sachdeva N., Poughon L., Gerbi O. et al. // Front. Astron. Sp. Sci. 2021. V. 8. P. 119. https://doi.org/10.3389/fspas.2021.700270
Boston P.J. // J. Br. Interplanet. Soc. 1981. V. 34. P. 189.
Tikhomirova N., Ushakova S., Kalacheva G., Tikhomirov A. // Acta Astronaut. 2016. V. 126. P. 59. https://doi.org/10.1016/J.ACTAASTRO.2016.04.020
Verseux C., Baqué M., Lehto K. et al. // Int. J. Astrobiol. 2016. V. 15. № 01. P. 65. https://doi.org/10.1017/S147355041500021X
Detrell G., Helisch H., Keppler J. et al. // 49th Int. Conf. Environ. Syst. 2019.
Tong L., Hu D., Liu H. et al. // Ecol. Eng. 2011. V. 37. № 12. P. 2025. https://doi.org/10.1016/J.ECOLENG.2011.08.013
Murukesan G., Leino H., Mäenpää P. et al. // Orig. Life Evol. Biosph. 2016. V. 46. № 1. P. 119. https://doi.org/10.1007/s11084-015-9458-x
Poughon L., Laroche C., Creuly C. et al. // Life Sci. Sp. Res. 2020. V. 25. P. 53. https://doi.org/10.1016/j.lssr.2020.03.002
Detrell G. // 50th Int. Conf. Environ. Syst. 2021. P. 12.
Pickett M.T., Roberson L., Calabria J. et al. // Life Sci. Sp. Res. 2019. https://doi.org/10.1016/j.lssr.2019.10.002
Chuka-ogwude D., Ogbonna J.C., Moheimani N.R. // Algal Res. 2021. V. 60. P. 102509. https://doi.org/10.1016/J.ALGAL.2021.102509
Grivalský T., Ranglová K., da Câmara Manoel J.A. et al. // Folia Microbiol. 2019. V. 64. № 5. P. 603. https://doi.org/10.1007/S12223-019-00739-7
Nelson M., Pechurkin N.S., Allen J.P. et al. // Environ. Biotechnol. 2010. P. 517. https://doi.org/10.1007/978-1-60327-140-0_11
Sychev V.N., Levinskikh M.A., Shepelev Y.Y. // Adv. Space Res. 2003. V. 31. № 7. P. 1693. https://doi.org/10.1016/S0273-1177(03)80016-9
Matula E.E., Nabity J.A. // Life Sci. Sp. Res. 2019. V. 20. P. 35. https://doi.org/10.1016/J.LSSR.2018.12.001
Detrell G. // Front. Astron. Sp. Sci. 2021. V. 8. P. 124. https://doi.org/10.3389/FSPAS.2021.700579/XML/NLM
Belz S., Buchert M., Bretschneider J. et al. // Acta Astronaut. 2014. V. 101. № 1. P. 170. https://doi.org/10.1016/j.actaastro.2014.04.023
Detrell G., Keppler J., Helisch H. et al. // Int. Conf. Environ. Syst. 2020. V. 50. P. 12.
Pfennig N., Lippert K.D. // Arch. Mikrobiol. 1966. V. 55. № 3. P. 245. https://doi.org/10.1007/BF00410246
Gorin K.V., Sergeeva Y.E., Pojidaev V.M. et al. // Results Eng. 2019. V. 4. P. 100041. https://doi.org/10.1016/J.RINENG.2019.100041
Rubin A.B. // Biophysics. 2004. V. 2. P. 275.
Lowry O.H., Rosebrough N.J., Farr A.L., Randal R.J. // J. Biol. Chem. 1951. V. 193. № 1. P. 265. https://doi.org/10.1016/s0021-9258(19)52451-6
Sergeeva Y.E., Mostova E.B., Gorin K.V. et al. // Appl. Biochem. Microbiol. 2017. V. 53. № 8. P. 807. https://doi.org/10.1134/S0003683817080063
Liu J., Liu Y., Wang H., Xue S. // Bioresour. Technol. 2015. V. 176. P. 284. https://doi.org/10.1016/j.biortech.2014.10.094
Денисов А.А., Жуйков В.Ю. // Достижения науки и техники АПК. 2007. Т. 12. С. 54.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



