Российские нанотехнологии, 2023, T. 18, № 1, стр. 99-106
3D-ПЕЧАТЬ ГИДРОГЕЛЕМ НА ОСНОВЕ ЙОТА-КАРРАГИНАНА С ИММОБИЛИЗОВАННЫМИ КЛЕТКАМИ МИКРОВОДОРОСЛЕЙ Chlorella vulgaris
В. А. Захарова 1, *, П. М. Готовцев 2, 3, П. А. Полетаева 1, А. Г. Рогов 2, Н. Р. Кильдеева 1
1 Российский государственный университет им. А.Н. Косыгина
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Московский физико-технический институт (национальный исследовательский университет)
Долгопрудный, Россия
* E-mail: vasilinaqss@gmail.com
Поступила в редакцию 05.10.2022
После доработки 31.10.2022
Принята к публикации 31.10.2022
Аннотация
На основании исследования температурной зависимости процесса гелеобразования водных растворов каррагинана установлены технологические параметры отверждения гидрогелевых “чернил” на основе растворов полисахарида каррагинана. С целью создания материала, являющегося дополнительным источником кислорода и средством реабилитации загрязненных вод в замкнутых экосистемах, продемонстрированы возможности 3D-биопечати матричных структур, содержащих иммобилизованные клетки микроводорослей Chlorella vulgaris.
ВВЕДЕНИЕ
Технологии с использованием фототрофных микроорганизмов находят широкое применение в самых различных сферах деятельности человека. Способность фототрофных микроорганизмов в процессе роста фиксировать значительное количество углекислого газа и делать это более интенсивно, чем высшие растения, дает возможность использовать их в качестве элементов системы нормализации воздуха в городских агломерациях [1, 2]. Конструкция фотобиореактора, в котором происходит культивирование фототрофных микроорганизмов, выбирается в зависимости от задач и, как правило, представляет собой крупную гидравлическую систему, где происходит принудительная циркуляция культуральной жидкости с биомассой [3]. В то же время ведется поиск доходов к созданию компактных систем для применения в помещениях, чтобы обеспечить максимальный выход кислорода. В случае небольших систем производительность по биомассе будет невысокой и зачастую не ставится задача ее собирать. Для подобных систем обсуждается возможность использования фотобиореакторов с иммобилизованными на каком-либо носителе фототрофными микроорганизмами [4]. Следующим шагом в развитии является создание материала с иммобилизованными микроорганизмами, такого, который за счет своих свойств обеспечивал бы поддержание необходимой для микроорганизмов среды [5]. Для решения этой задачи микроорганизмы можно иммобилизовать в гидрогеле: в ряде работ были показаны возможность успешной иммобилизации бактериальных клеток в гель и последующая печать полученной композицией [6–8].
3D-печать – это быстроразвивающаяся современная аддитивная технология, оказывающая революционное влияние на изготовление изделий целевого назначения с заданными размерами, формами и свойствами [9]. В процессе развития аддитивных технологий появилась возможность использовать в качестве “чернил” концентрированные растворы полимеров или гидрогели [10] с гибкими и организованными сетками и получать каркасные структуры для поддержания жизнедеятельности и пролиферационной активности организмов. Данное направление получило название 3D-биопечати. В направлении биопечати можно выделить две большие группы: 3D-печать “чернилами” на основе полисахаридов и белков или печать “чернилами”, содержащими клеточный материал. В основе обоих методов лежит послойное нанесение биоматериала – биополимерной питательной среды, поддерживающей жизнеспособность клеточного материала, с последующим формированием объекта заданной формы по готовой 3D-модели [11].
Проблемы существующих способов и технологий получения биополимерных матриц на основе гидрогелей связаны с необходимостью контроля кинетики отверждения гидрогелевых структур в процессе печати или быстрого отверждения гидрогелевых напечатанных каркасных структур. В этой связи перспективным гелеобразующим биополимером является полисахарид красных водорослей – йота-каррагинана. Особенности строения йота-каррагинана (рис. 1) определяют его растворимость в воде и температурно-зависимую способность к гелеобразованию.
В настоящей работе с целью определения технологических параметров отверждения гидрогелевых чернил в процессе 3D-биопечати каркасных матриц, содержащих микроводоросли, исследована температурная зависимость процесса гелеобразования водных растворов каррагинана.
МЕТОДЫ
Культивирование микроводорослей. Штамм микроводоросли Chlorella vulgaris GKV1 из коллекции НИЦ “Курчатовский институт” предварительно культивировали на среде BBM со следующими концентрациями компонентов (г/л): KNO3 – 1.25, KH2PO4 – 1.25, MgSO4·7H2O – 1, CaCl2 – 0.0835, H3BO3 – 0.1142, FeSO4⋅7H2O – 0.0498, ZnSO4⋅7H2O – 0.0882, MnCl2⋅4H2O – 0.0144, MoO3 – 0.0071, CuSO4⋅5H2O – 0.0157, Co(NO3)2⋅6H2O – 0.0049, EDTA⋅2Na – 0.5. Культивирование проводили в 500 мл колбах Эрленмейера с объемом среды 200 мл.
Приготовление гидрогелевых чернил на основе раствора каррагинана заданной концентрации. Рабочие растворы каррагинана с концентрацией (2, 2.5 и 3%) готовили путем растворения навески йота-каррагинана (Sigma-Aldrich, США) (±0.0001г) в дистиллированной воде при 70°С и перемешивании (200 с–1).
Приготовление гидрогелевых биочернил на основе i-каррагинана, содержащего микроводоросли. Гидрогелевые биочернила, содержащие растительный клеточный материал, готовили путем введения C. vulgaris в питательной среде ВВМ в гель каррагинана с концентрацией при 70°С и перемешивании (2000 об./мин).
Изучение гелеобразования в растворах каррагинана. Изучение кинетики процесса гелеобразования проводили путем измерения динамической вязкости растворов каррагинана заданной концентрации при равномерно понижающейся температуре с использованием анализатора вязкости SV-10 (AND, Япония) с постоянной частотой вибрации, равной 30 Гц. Для этого термостойкую кювету вибровискозиметра наполняли горячим раствором полимера (~70°С). Затем чувствительный элемент, оснащенный температурным датчиком, погружали в жидкую среду кюветы. Устройство фиксировало сигналы изменения вязкости при снижении температуры растворов каждые 15 с. Измерения останавливали по мере образования стабильного гидрогеля и достижения предельного значения, ограниченного показанием прибора, равным 14 000 мПа·с.
Определение энергии активации вязкого течения при гелеобразовании. Энергию активации при изучении процесса гелеобразования рассчитывали с использованием уравнения Аррениуса–Френкеля [12]:
где η – вязкость, η0 – постоянная, Еа – энергия активации, R – универсальная газовая постоянная (R = 8.314 кДж/(моль ∙ К)), T – термодинамическая температура.
Исходя из полученных данных изменения показателей вязкости растворов различной концентрации во времени, в установленном температурном диапазоне строится график зависимости в координатах lnŋ = f(1/Т), на котором искомый параметр определяется по тангенсу α угла наклона линейной зависимости:
Получение гидрогелевых каркасных образцов методом 3D-биопечати. 3D-биопринтер (PharmPrint, Россия), представленный на рис. 2, состоит из подвижного стола с креплениями для чашек Петри, поршневого шприцевого дозатора, положение которых друг относительно друга управляется по осям X и Y в плоскости и по оси Z по вертикали в пределах 250, 150 и 100 мм соответственно. Механизм привода состоит из оснастки для смены одноразового поршневого дозатора, шагового двигателя и линейной направляющей, обеспечивающей передачу вращательного движения в поступательное, обеспечивая равномерное дозирование геля.
Получение гидрогелевого каркаса осуществляли посредством равномерной поршневой экструзии “чернил” на основе водного раствора йота-каррагинана на поверхность чашки Петри при заданных параметрах печати.
Термогравиметрия. С помощью термогравиметрического анализатора (ТА) методом Ramp определяли изменение массы пробы гидрогелей каррагинана, а также гидрогелей, содержащих микроводоросли, полученных методом 3D-биопечати, в процессе нагрева на установке TGAQ50 (TA Instruments, США). Скорость нагрева составляла 15.00°C/мин. Среда газовая – воздух, суммарная скорость подачи которого составляла 100.0 мл/мин. Температурный диапазон от 25 до 250°C. Степень изменения массы определяли с точностью до 0.5%.
Микроскопия. Визуализацию клеток микроводорослей в гелях проводили с помощью флуоресцентного микроскопа Olympus BX-61 (Япония), снабженного иммерсионным объективом 100 × × UPlanFL (NA 1.30) и камерой Olympus DP71 (Япония), под управлением программного обеспечения CellA (Olympus, Япония). Обработку изображений проводили с помощью ICY software [13].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В основе процесса гелеобразования в растворах полисахаридов лежат механизмы, вызывающие формирование стабильной или термообратимой трехмерной сетки, причем характер и число узлов сетки зацеплений определяют реологические и механические свойства геля. Для технологии 3D-печати важно определить условия, при которых раствор полимера проявляет способность к течению, но обладает значительной вязкостью и может использоваться в качестве печатных “чернил”, и параметры перехода к упругому телу матрикса, форма которого задана и адаптирована для считывания 3D-биопринтером.
Для гидрогелей полисахаридов, получаемых без использования сшивающих реагентов, зоны соединения макромолекулярных цепей включают в себя агрегаты участков макромолекул [14]. Связи, участвующие в образовании таких агрегатов, обычно представляют собой нековалентные взаимодействия, такие как водородные связи, гидрофобные взаимодействия, ионные связи и т.д. Гелеобразующие формы каррагинана, к которым относится йота-каррагинан, формируют устойчивые при определенной температуре гидрогели за счет образования водородных связей; число таких связей зависит от концентрации раствора, молекулярной массы полисахарида и рН [15]. Для определения температурно-концентрационной области использования водных растворов йота-каррагинана в качестве “чернил” при получении стабильных матричных структур путем поршневой 3D-биопечати был использован метод вискозиметрии.
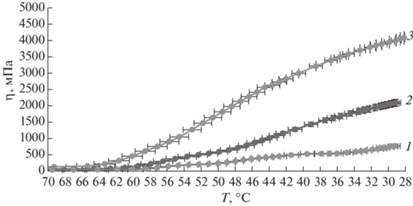
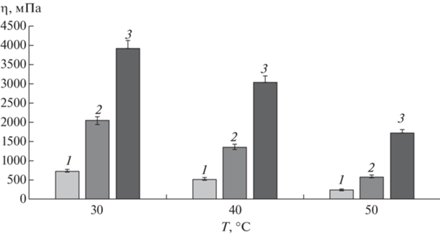
В процессе охлаждения получены температурные зависимости показателей динамической вязкости растворов каррагинана с концентрацией 2, 2.5 и 3%. Кривые охлаждения, представленные на рис. 3, показывают устойчивый рост вязкости всех исследуемых растворов при снижении температуры. С увеличением содержания каррагинана в исследуемых растворах увеличиваются эффективные значения динамической вязкости и температуры эквивязких растворов. Значительное увеличение вязкости растворов при снижении температуры (рис. 4) связано с изменением структуры каррагинана в водном растворе путем включения макромолекул полисахарида в трехмерную агрегированную структуру, внутри которой обеспечивается свободное перемещение молекул воды, что позволяет рассматривать раствор каррагинана в качестве перспективного высокогидратированного биопечатного материала.
Рис. 4.
Влияние температуры на показатели динамической вязкости растворов каррагинана. Концентрация раствора каррагинана 2 (1), 2.5 (2) и 3% (3).
Из полученных кривых охлаждения видно, что степень изменения вязкости, измеренной на вибрационном вискозиметре, в разных температурных интервалах различна. Энергия активации вязкого течения определяется как минимальная энергия, необходимая для преодоления энергетического барьера и начала перемещения сегментов макромолекул, обеспечивающего течение. Были выделены температурные области линейного изменения вязкости в координатах Аррениуса (рис. 5) и рассчитаны значения энергии активации вязкого течения Еа1 и Еа2, которые имели близкие значения для растворов разных концентраций, но сильно различались в разных температурных областях (табл. 1).
Рис. 5.
Зависимость вязкости водного раствора каррагинана от температуры в координатах Аррениуса; концентрация раствора каррагинана – 2 (1), 2.5 (2) и 3% (3).
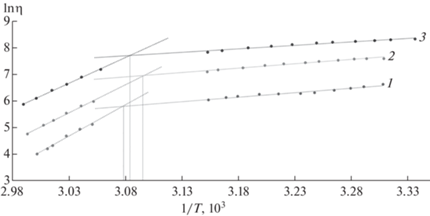
Таблица 1.
Значения энергии активации
| Концентрация, % | Еа1, кДж/моль | Еа2, кДж/моль | Температура начала гелеобразования, °C |
|---|---|---|---|
| 2 | 27.8 | 196.0 | 51.2 |
| 2.5 | 26.9 | 175.0 | 49.9 |
| 3 | 21.8 | 160.7 | 51.7 |
Это различие связано с разной прочностью флуктуационной сетки, разрушением которой определяется активационный процесс деформации при течении раствора. В области температур от 42 до 60°С для 3%-ного раствора и от 36 до 50°С для 2 и 2.5%-ных растворов каррагинана образуется большое число водородных связей, и энергия активации достигает 160–196 кДж/моль, что превышает характерные для вязкого течения значения [16], поэтому можно принять, что Еа2 характеризует процесс гелеобразования – начало формирования устойчивой трехмерной сетки. Значения температур начала гелеобразования, полученные из координаты точки пересечения прямых, аппроксимирующих зависимости вязкости от температуры в координатах Аррениуса, приведенные в табл. 1, показывают, что в исследуемом диапазоне концентраций формирование гидрогеля начинается при температуре 50 ± 1°С и не зависит от концентрации каррагинана. При дальнейшем понижении температуры деформирующие напряжения приводят к нарушению целостности гидрогеля каррагинана.
Характер образования физического геля в растворах за счет водородных мостиков между макромолекулами йота-каррагинана определяет не только его фазовое состояние, но и физико-механические и физико-химические свойства. С использованием биопринтера были получены образцы гидрогелей из растворов разной концентрации. Значения модуля упругости гидрогелей каррагинана, полученные в режиме сжатия на адаптированной для исследования гидрогелей установке Instron 5965 (США), увеличиваются от 7.7 для образца, полученного из 2%-ного раствора, до 18.9 кПа для 3%-ного гидрогеля каррагинана (табл. 2).
Таблица 2.
Зависимость физико-механических показателей
| Концентрация, % | Модуль упругости, кПа |
|---|---|
| 2 | 7.7 |
| 2.5 | 10.5 |
| 3 | 18.9 |
По-видимому, концентрация раствора йота-каррагинана оказывает влияние не столько на температуру гелеобразования, сколько на число водородных связей, обеспечивающих зацепления трехмерной сетки, поддерживающей структуру гидрогеля.
Включение микроводоросли C. vulgaris в структуру гидрогелей проводили методом 3D-биопечати с использованием в качестве чернил дисперсии биоматериала в 2.5%-ном водном растворе йота-каррагинана. Фотографии образцов приведены на рис. 6.
Рис. 6.
Процесс 3D-печати 2.5%-ным гидрогелем йота-каррагинана (а); напечатанный гидрогелевый скаффолд (б); напечатанный матрикс, содержащий C. vulgaris (в).

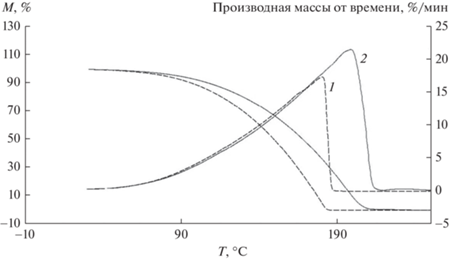
Изучение термической деградации исходных гидрогелей йота-каррагинана и гидрогелевых материалов, содержащих микроводоросли, проводили в процессе нагрева от 25 до 250°C (рис. 7). Гидрогели находились в стабильном термическом состоянии от 0 до ~70°С, после чего наблюдался процесс уменьшения массы геля, сопровождающийся потерей влаги. При введении клеток C. vulgaris процесс начала потери влаги смещается в область более высоких температур, чему может способствовать как удержание влаги в геле микроводорослями за счет межмолекулярного взаимодействия между полисахаридсодержащей клеточной стенкой микроводорослей и каррагинаном, так и формирование более плотной структуры геля за счет комплексообразования каррагинана с ионами металлов, входящих в состав культуральной среды [17]. Дальнейший процесс потери массы гидрогеля каррагинана сопровождается разрушением сетки геля, фрагментацией полисахаридного скелета, завершающейся в конечном итоге разложением, температура которого составляет 183°С. При введении клеток C. vulgaris этот показатель увеличивается до 207°С, что также может свидетельствовать о наличии взаимодействия каррагинана с клеточной стенкой микроводорослей. При этом скорость потери массы гидрогелей каррагинана при увеличении температуры составила 17%/мин, а при введении клеток микроводорослей – 21.5%/мин.
Рис. 7.
Термограммы гидрогелевых образцов: 1 – исходного 2.5%-ного каррагинана (сплошная кривая), 2 – 2.5%-ного каррагинана, наполненного клетками C. vulgaris (пунктирная кривая).
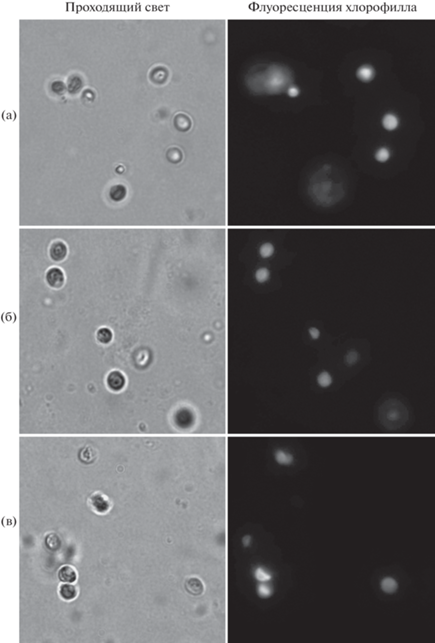
Визуализация клеток микроводорослей C. vulgaris представлена на рис. 8. Различия в четкости клеток в поле зрения связаны с трехмерной структурой геля, где клетки расположены в различных плоскостях относительно фокальной плоскости. Аутофлуоресценция хлорофилла в клетках микроводорослей говорит о сохранности клеток в геле и отсутствии факторов, ингибирующих продукцию хлорофилла.
ЗАКЛЮЧЕНИЕ
3D-печать гидрогелями является крайне перспективным направлением, так как позволяет создавать трехмерные конструкции, содержащие в себе живые клетки. Гидрогель на основе каррагинана может выступать как перспективный носитель клеток фототрофных микроорганизмов, в частности микроводорослей C. vulgaris. Гидрогели могут поддержать гомеостаз клеток и обеспечить их выживаемость. С учетом прочностных свойств представленный в работе биогибридный материал можно рассматривать как биофильтр для фиксации углекислого газа и генерации кислорода в помещениях. Дальнейшие исследования будут направлены на доработку материала для длительной эксплуатации и изучение выживаемости при этом клеток.
Авторы выражают благодарность генеральному директору компании ООО “PharmPrint” В.В. Гордееву за предоставление и неоценимую помощь с 3D-биопринтером.
Список литературы
Talaei M., Mahdavinejad M., Azari R. et al. // Sustain. Energy Technol. Assessments. 2022. V. 52. P. 101894. https://doi.org/10.1016/J.SETA.2021.101894
Gotovtsev P.M., Dyakov A.V. // IEEE 3rd World Forum Internet Things. IEEE. 2016. P. 542. https://doi.org/10.1109/WF-IoT.2016.7845476
Pruvost J., Le Gouic B., Lepine O. et al. // Chem. Eng. J. 2016. V. 284. P. 850. https://doi.org/10.1016/j.cej.2015.08.118
Dębowski M., Krzemieniewski M., Zieliński, M. et al. // Atmosphere. 2021. V. 12. № 8. P. 1031. https://doi.org/10.3390/atmos12081031
Gotovtsev P. // Appl. Sci. 2020. V. 10. № 11. P. 3990. https://doi.org/10.3390/APP10113990
Schaffner M., Rühs P.A., Coulter F. et al. // Sci. Adv. 2017. V. 3. № 12. P. eaao6804. https://doi.org/10.1126/sciadv.aao6804
Bader C., Patrick W.G., Oxman N. et al. // 3D Printing and Additive Manufacturing. 2016. V 3. № 2. P. 79. https://doi.org/10.1089/3dp.2016.0027
Smith R.S.H., Bader C., Oxman N. et al. // Adv. Funct. Mater. 2020. V. 30. № 7. P. 1907401. https://doi.org/10.1002/adfm.201907401
Shahrubudin N., Lee T.C., Ramlan R. // Procedia Manuf. 2019. V. 35. P. 1286. https://doi.org/10.1002/anie.201403192
Singh M., Haring A.P., Johnson B.N. // ACS Appl. Mater. Interfaces. 2019. V. 11. № 6. P. 6652. https://doi.org/10.1021/acsami.8b22164
Mandrycky C., Wang Z., Kim K., Kim D. H. // Biotechnol. Adv. 2016. V. 34. № 4. P. 422. https://doi.org/10.1016/j.biotechadv.2015.12.011
Appel E.A., Forster R.A., Scherman O.A. et al. // Angew. Chem. Int. Ed. 2014. V. 53. № 38. P. 10038. https://doi.org/10.1002/anie.201403192
De Chaumont F., Dallongeville S., Olivo-Marin J.C. et al. // Nature Methods. 2012. V. 9. № 7. P. 690. https://doi.org/10.1038/nmeth.2075
Nishinari K., Zhang H., Ikeda S. // Curr. Opin. Colloid Interface Sci. 2000. V. 5. № 3–4. P. 195. https://doi.org/10.1016/S1359-0294(00)00053-4
Brenner T., Tuvikene R., Nishinari K. et al. // Food Hydrocolloids. 2014. V. 39. P. 272. https://doi.org/10.1016/j.foodhyd.2014.01.024
Zaim S., Mortadi A., El Moznine R. et al. // Iranian Polym. J. 2020. V. 29. № 12. P. 1137. https://doi.org/10.1007/s13726-020-00867-9
Hossain K.S., Miyanaga K., Maeda H., Nemoto N. // Biomacromolecules. 2001. V. 2. № 2. P. 442. https://doi.org/10.1021/bm000117f
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии