Российские нанотехнологии, 2023, T. 18, № 1, стр. 114-120
СТИМУЛЯЦИЯ МЫШЕЧНЫХ КЛЕТОК С ИСПОЛЬЗОВАНИЕМ МИКРОБНОГО БИОТОПЛИВНОГО ЭЛЕМЕНТА
Е. С. Вахницкая 1, 2, *, А. О. Романов 1, 3, К. Ю. Базылева 1, 4, А. Ф. Габдрахманова 5, Д. Д. Гафурова 6, А. Н. Касаткина 7, Н. А. Гуляев 8, И. И. Щембелов 9, Н. М. Богомолов 10, М. К. Барзаев 11, Н. А. Шарикова 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
10 Школа № 444
Москва, Россия
11 Гимназия № 5
Урус-Мартан, Россия
2 Национальный исследовательский ядерный университет “Московский инженерно-физический институт”
Москва, Россия
3 Национальный исследовательский университет “Московский физико-технический институт”
Долгопрудный, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
5 АО “ГЕНЕРИУМ”
Москва, Россия
6 Школа-интернат одаренных детей им А.П. Гужвина
Астрахань, Россия
7 Средняя образовательная школа № 52
Ижевск, Россия
8 Лицей № 136
Новосибирск, Россия
9 Многопрофильный лицей № 4
Псков, Россия
* E-mail: ekaterinavakhnitskaya@yandex.ru
Поступила в редакцию 05.10.2022
После доработки 05.10.2022
Принята к публикации 10.10.2022
Аннотация
Существует довольно много областей, где необходимо применение технологий мягкой робототехники. Основной задачей является поиск устройства, приводящего мягкого робота в движение. Предложен прототип механизма, работающего за счет стимуляции мышечных клеток, которые могут выступать в качестве привода. Исследована возможность использования маломощных биотопливных элементов в качестве устройства для питания приводного механизма. Выбран микробный биотопливный элемент как наиболее подходящий для данной сферы применения. В процессе сборки биотопливной ячейки исследовались материалы электродов и биопленки, а также измерялись выдаваемые ячейкой напряжения. Разработана и собрана плата, генерирующая ШИМ-сигнал для подачи на мышечные клетки импульса с определенными характеристиками с целью их дальнейшей стимуляции. Полученные в ходе экспериментов результаты дают понять, что такой маломощный источник энергии, как биотопливный элемент, может быть успешно применен для стимуляции мышечных клеток при разработке мягких роботов.
ВВЕДЕНИЕ
Одним из наиболее перспективных направлений в разработке современных роботов являются так называемые soft robotics, т.е. технологии мягкой робототехники. Интерес к ним вызван тем, что данные технологии позволят роботам приобрести новые механические навыки, которые помогут им адаптироваться к среде, преимущественно с быстро изменяющимися условиями [1–3]. Использование технологий мягкой робототехники способствует существенному снижению механической нагрузки, а также сложности алгоритмов, связанной с проектированием роботов [1]. Кроме того, гибкая конструкция мягких роботов сможет значительно расширить их функционал: такие роботы способны гасить силу удара, предотвращая деформацию конструкции, проникать в узкие отверстия, передвигаться в вертикальной плоскости, приспосабливаясь к поверхностям для лучшего сцепления и т.д. [1]. Их можно использовать для поисково-спасательных работ, во время стихийных бедствий, при оказании помощи людям, в медицине и т.д. Однако разработка технологии приведения в действие мягких мышц по-прежнему остается одной из основных задач при создании полностью мягких роботов [1].
Отличительными свойствами приводного механизма, работающего на основе стимуляции мышечных клеток, являются масштабируемость (в живых системах она используется в масштабах от миллиметра до метра) и адаптивность (система функционирует в широком диапазоне частот и силовых режимов работы мышц) [2]. Например, масштабируемость напрямую влияет на производительность системы, включающей в себя скелетные мышцы. Востребованность скелетных мышц в мягкой робототехнике можно объяснить их кардинальными различиями с традиционными приводными механизмами, т.е. с их помощью были улучшены такие характеристики робота, как соотношение мощности к весу и силы к весу, механическая гибкость, увеличена плотность энергии (почти на 2 порядка), а также усовершенствовано управление системами [2, 4].
Отличительной чертой биологических приводов является и способность таких систем к регенерации [2]. На уровне ткани скелетные мышцы могут восстанавливать in vivo небольшие повреждения, предотвращая потерю мышечной массы [5]. Кроме того, скелетные мышцы обладают способностью к росту при регулярном выполнении физических упражнений и, соответственно, к увеличению нагрузки, прикладываемой к роботу [6].
Использовать стимуляцию мышечных клеток в технологиях мягкой робототехники можно, только обеспечив способность направлять клетки-предшественники мышц для дифференцировки в клетки скелетных мышц (миотрубки), а затем организовать эти клетки в функциональную ткань [2]. Миогенез был хорошо изучен in vivo [5, 7, 8], однако, несмотря на сложность проектировки иннервируемых и васкуляризованных мышц в 3D-масштабе ткани in vitro, миобласты успешно сливаются в миотрубки [2]. В процессе созревания мышечной ткани необходимым условием является ее работа против нагрузки [6]. Так, например, используется электрическая стимуляция для возбуждения скелетных мышц in vitro [2]. Она деполяризует миотрубки, вызывая сокращение и механическое напряжение, которое увеличивает дифференцировку [2]. Как правило, электроды помещаются по обе стороны емкости с мышечной тканью и подается прямоугольный сигнал с характеристиками 0–100 В по амплитуде, длительностью 10–20 мс и частотой до 100 Гц или более [2]. В проведенных ранее опытах электроимпульсная стимуляция миотрубок линии C2C12 с частотой 1 Гц увеличивала сборку саркомера всего за 2 ч [9].
Однако для того, чтобы обеспечить движение мягкого робота, одних скелетных мышц недостаточно. Для этого необходим некоторый источник энергии, роль которого в организме животных играет аденозинтрифосфат, образующийся при расщеплении полисахаридов, жирных кислот и аминокислот [2].
В настоящее время источниками энергии для роботов являются преимущественно энергоресурсы: топливо, аккумуляторы и т.д. Также используются двигатели, работающие на органическом топливе [10]. Автономность функционирования роботов необходима в среде, где невозможно обеспечить быструю подзарядку, а также для автоматизации задач, выполняемых роботом при дистанционном управлении [11]. Поскольку традиционные системы энергоснабжения мобильных роботов снижают их автономность, разрабатываются подходы по генерации электроэнергии за счет внешних для робототехнической системы ресурсов, среди которых рассматриваются биотопливные элементы (БТЭ). В настоящее время они используются в качестве источника питания для экспериментальных автономных мобильных роботов [12].
Биотопливные элементы – одно из перспективных направлений в биоэнергетике, изучающее возможность получения энергии при помощи механизмов живой природы (природоподобных технологий). Эти маломощные устройства работают за счет преобразования химической энергии органических веществ в электрическую при помощи биокатализаторов [13]. Существуют различные биокатализаторы, у каждого из них свои особенности процесса окисления, которые определяют сферу применения БТЭ [14]. Наиболее часто используются ферменты и клетки для ферментных и микробных топливных элементов соответственно. В микробных биотопливных элементах (МБТЭ) энергия трансформируется за счет метаболической активности микроорганизмов [15].
МБТЭ имеет ряд особенностей по сравнению с ферментными БТЭ: микроорганизмы обладают гораздо меньшей субстратной специфичностью, чем ферменты, что дает им преимущество в том, чтобы окислять в разы большее количество различных веществ; МБТЭ гораздо стабильнее в работе и устойчивее, чем ферментный БТЭ [16]. Примером успешной реализации системы, в которой пища используется в качестве субстрата для работы микробных биотопливных ячеек, является робот “Гастробот” [17].
Цель настоящей работы – демонстрация возможности использования энергии от маломощного источника БТЭ для стимуляции мышечных клеток с целью будущего применения в мягкой робототехнике.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. В качестве электродов БТЭ использовали углеродную ткань ТГН-2МК (АО “НИИГРАФИТ”, Россия). Питательную среду, имитирующую сточные воды, готовили согласно методике, приведенной в [18]. Состав среды приведен в табл. 1. Ячейку БТЭ печатали на 3D-принтере из пластика ПЛА (полилактид). Для демонстрации работы установки использовали мышечные клетки мыши линии С2С12.
Таблица 1.
Состав питательный среды для пропитывания электродов
| Реагент | Количество, мг/л |
|---|---|
| Глюкоза | 1000 |
| NH4Cl | 95.5 |
| Мочевина | 56.3 |
| KH2PO4 | 22.6 |
| FeSO4 · 7H2O | 12.6 |
| NaHCO3 | 309 |
| Дрожжевой экстракт | 35 |
Оптическая микроскопия. Структуру углеродной ткани исследовали на оптическом микроскопе Levenhuk D740T. Фотографии были сделаны при увеличении ×100 и обработаны в программах ScopePhoto и Origin 8.1.
Электрические измерения. Электропроводность углеродной ткани определяли с помощью прибора для измерения низкого удельного сопротивления Loresta GP MCP-T610.
Иммобилизация микроорганизмов на биоаноде. Почвенные бактерии были иммобилизованы на углеродную ткань, пропитанную питательной средой, имитирующей сточные воды. Образцы закапывали в землю на глубину 10 см и оставляли на трое суток. После извлечения из почвы биопленку исследовали на биологическом микроскопе Микромед 1 (2-20 inf.).
Изготовление ячейки БТЭ. Ячейка БТЭ представляет собой кювету, созданную в программном обеспечении Autodesk Fusion 360 и изготовленную из пластика ПЛА. Рабочий объем ячейки составлял 30 мл. Глубина погружения электродов в раствор – 10 мм. В данном методе не применяли протонселективную мембрану, так как ее использование значительно повышает стоимость конечного продукта. Биотопливная ячейка состояла из анода с иммобилизованными микроорганизмами и катода, представляющего собой чистую углеродную ткань. В качестве раствора электролита использовали питательный раствор, имитирующий сточные воды.
Создание платы преобразования сигнала (ШИМ-генератор). Для последующей демонстрации работы установки необходимо преобразовать линейный сигнал, идущий от аккумулятора, который был предварительно заряжен от МБТЭ, в прямоугольный сигнал.
Схема, показанная на рис. 1, использует аккумулятор для автономного питания и имеет две пары клемм. Первая пара используется для подключения аккумулятора, вторая – для его зарядки, а провода с третьей клеммы идут на мышечные клетки. Для зарядки аккумулятора использовали повышающий модуль, который повышает напряжение с БТЭ и подает его на аккумулятор. Если плата переведена в режим работы, то напряжение с аккумулятора идет через тот же повышающий модуль и поступает на таймер, генерирующий прямоугольный сигнал, после этого при помощи делителя (напряжения) напряжение с таймера понижается до ~100 мВ. Переключение режимов работы происходит при помощи кнопки.
Культивирование мышечных клеток. Культивирование адгерантной клеточной линии С2С12 проводили по методу, представленному в [19]. Клетки С2С12 культивировали в среде DMEM/F12, содержащей 10% FBS, с плотностью монослоя не более 70%, так как это может привести к преждевременной дифференциации и слиянию миобластов друг с другом. Вначале удаляли питательную среду и промывали клеточный слой фосфатно-солевым буфером для удаления всех следов сыворотки. Затем добавляли 1–2 мл раствора трипсин–ЭДТА (этилендиаминтетрауксусная кислота) и наблюдали за клетками под инвертированным микроскопом до тех пор, пока клеточный слой не рассеется (в течение 5–10 мин). Далее добавляли 6–8 мл полной питательной среды и осторожно пипетировали клетки. Добавляли соответствующие аликвоты клеточной суспензии в новые сосуды для культивирования: 1.5 × 105 до 1.0 × 106 жизнеспособных клеток/75 см2. В конце инкубировали культуры при 37°C. Частота пересева – каждые два–три дня.
Дифференцировка миобластов с образованием миотрубок. Клеточную линию С2С12 дифференцировали в среде DMEM/F12, содержащей 2% лошадиной сыворотки (Horse serum (HS)). Для этого клетки засевали в 6-луночные планшеты в количестве 0.1 × 106 клеток на лунку в среду для культивирования DMEM/F12, содержащей 10% FBS. Через 5–7 ч меняли среду на среду для дифференцировки (DMEM/F12), содержащей 2% HS. Дифференцировку проводили в течение 10 дней с ежедневной сменой среды.
Для наблюдения сокращения мышечных клеток использовали микроскоп ЛОМО МИБ-Р.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
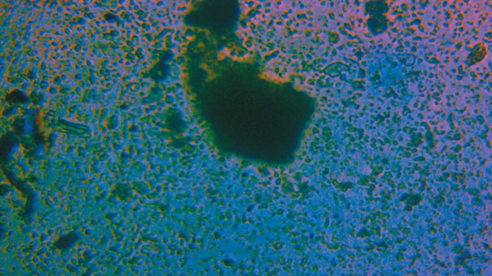
Физические свойства углеродной ткани. На рис. 2 представлены изображения волокон углеродной ткани, а также гистограмма распределения диаметров углеродных волокон. Волокна представляют собой прямые стержневидные нити со средним значением диаметра 10.68 ± 3.49 мкм. Электропроводность углеродной ткани составила 0.3 См/см, что является достаточным показателем для использования этого материала в БТЭ.
Рис. 2.
Оптическая фотография волокон углеродной ткани (а), гистограмма распределения диаметра углеродных волокон (б).

Появление и исследование биопленки на поверхности электродов. Углеродные ткани, выполняющие роль анода в МБТЭ, были закопаны в почву в четырех разных местностях: Имеритинская низменность, Ахштырское ущелье, Кампус образовательного центра “Сириус” и парк “Южные культуры” (рис. 3) с целью выявить наиболее благоприятную для развития бактерий среду, так как в такой среде образованная биопленка сможет обеспечить более эффективный процесс окисления.
Рис. 3.
Места закапывания углеродной ткани для роста биопленки: Ахштырское ущелье (1), парк “Южные Культуры” (2), Имеретинская низменность (3), кампус “Сириуса” (4).

На рис. 4 представлена фотография углеродной ткани, извлеченной из почвы в районе кампуса образовательного центра “Сириус”. В процессе исследования наблюдалось активное движение микроорганизмов, иммобилизованных на аноде, что говорит об успешном заселении микроорганизмами углеродной ткани.
Испытание работы ячейки БТЭ. После исследования биопленки на микроскопе была собрана биотопливная ячейка, а затем сняты показания напряжений, вырабатываемых МБТЭ в зависимости от времени для всех четырех образцов. Диаграммы полученных напряжений представлены на рис. 5.
Рис. 5.
Диаграммы зависимости напряжения от времени для различных образцов анодов: Ахштырское ущелье (1), Имеретинская низменность (2), парк “Южные Культуры” (3), кампус “Сириуса” (4).

Наилучшие результаты получены на анодах, извлеченных из почвы на территории кампуса образовательного центра “Сириус”. Одна ячейка такого МБТЭ выдавала напряжение ~500 мВ. Для увеличения напряжения и последующей зарядки аккумулятора соединили последовательно три ячейки, благодаря чему было получено выходное напряжение, равное 1.5 В.
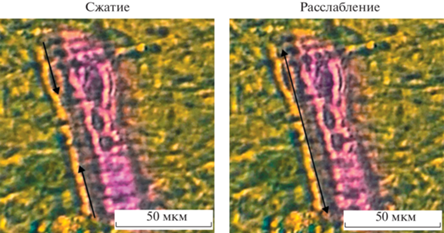
Испытание работы МБТЭ на мышечных клетках. Для стимуляции мышечных клеток спроектировали и собрали плату, генерирующую импульсный сигнал с амплитудой 100 мВ и частотой 5 Гц (рис. 6). Электроды опустили в питательную среду с клетками, дополнительно добавили питательный раствор в качестве электролита. Плату перевели в режим стимуляции клеток. После того, как электроды опустили в питательную среду, по истечении 30 мин наблюдалось сокращение мышечных волокон. На рис. 7 представлены изображения, демонстрирующие продольное сокращение миотрубки. В данной работе удалось достичь такого результата при помощи маломощного источника питания в отличие от предыдущих исследований, где использовали напряжения с большой амплитудой [20, 21].
Рис. 6.
Плата, генерирующая прямоугольный сигнал для стимуляции мышечных клеток: вид сверху (а), вид снизу (б).

Таким образом, в перспективе возможно создавать мягких роботов с использованием маломощных источников питания (БТЭ).
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно сделать вывод о том, что биотопливные элементы способны обеспечить необходимое напряжение для стимуляции мышечных клеток, что дает возможность рассматривать такое устройство в качестве перспективного приводного механизма для мягких роботов. Применение технологий мягкой робототехники позволит значительно расширить функционал таких устройств и использовать их в различных областях.
Работа выполнена при поддержке образовательного центра “Сириус”.
Список литературы
Kim S., Laschi C., Trimmer B // Trends Biotechnology. 2013. V. 31. № 5. P. 287. https://doi.org/10.1016/j.tibtech.2013.03.002
Duffy R.M., Feinberg A.W. // Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 2014. V. 6. № 2. P. 178. https://doi.org/10.1002/wnan.1254
Trivedi D., Rahn C.D., Kier W.M., Walker I.D. // Applied Bionics Biomechanics. 2008. V. 5. № 3. P. 99. https://doi.org/10.1080/11762320802557865
Van Ham R. // IEEE Robotics and Automation Magazine. 2009. V. 2009. P. 81. https://doi.org/10.1109/MRA.2009.933629
Chargé S.B.P., Rudnicki M.A. // Physiol. Rev. 2004. V. 84. № 1. P. 209. https://doi.org/10.1152/physrev.00019.2003
Садртдинов А.А. // Современные научные исследования и инновации. 2016. № 9. С. 45.
Rudnicki M.A., Schnegelsberg P.N., Stead R.H. et al. // Cell. 1993. V. 75. № 7. P. 1351. https://doi.org/10.1016/0092-8674(93)90621-V
Sanger J.W., Wang J., Fan Y. et al. // J. Biomed. Biotechnol. 2010. V. 2010. P. 1. https://doi.org/10.1155/2010/858606
Fujita H., Nedachi T., Kanzaki M. // Exp. Cell Res. 2007. V. 313. № 9. P. 1853. https://doi.org/10.1016/j.yexcr.2007.03.002
Kaisare N.S., Vlachos D.G. // Prog. Energy Combust. Sci. 2012. V. 38. № 3. P. 321. https://doi.org/10.1016/j.pecs.2012.01.001
Gancet J., Urbina D., Letier P. et al. // IFAC-PapersOnLine. 2015. V. 48. № 2. P. 218. https://doi.org/10.1016/j.ifacol.2015.06.036
Gotovtsev P., Vorobiev V., Migalev A. et al. // Robotics. 2018. V. 7. № 1. P. 2. https://doi.org/10.3390/robotics7010002
Potter M.C. // Proc. Univ. Durham Phil. Soc. 1910. V. 3. P. 245.
Плеханова Ю.В., Тарасов С.Е., Сомов А.С. и др. // Российские нанотехнологии. 2019. Т. 14. № 11–12. С. 3. https://doi.org/10.21517/1992-7223-2019-11-12-3-14
Василов Р.Г., Решетилов А.Н., Шестаков А.И. // Природа. 2013. № 12. С. 65.
Алферов В.А., Василов Р.Г., Губин С.П. и др. // Радиоэлектроника. Наносистемы. Информационные технологии. 2014. Т. 6. № 2. С. 187. https://doi.org/10.17725/RENSITe.0006.201412d.0187
Wilkinson S. // Autonomous Robots. 2000. V. 9. № 2. P. 99. https://doi.org/10.1023/a:1008984516499
Salgueiro J.L., Perez L., Sanchez A. et al. // Int. J. Environ. Res. 2018. V. 12. № 6. P. 765. https://doi.org/10.1007/s41742-018-0129-4
Hindi L., McMillan J.D., Afroze D. et al. // Bio-protocol. 2017. V. 7. № 9. P. e2248. https://doi.org/10.21769/BioProtoc.2248
Park H., Bhalla R., Saigal R. et al. // J. Tissue Eng. Regen. Med. 2008. V. 2 № 5. P. 279. https://doi.org/10.1002/term.93
Fujita H., Nedachi T., Kanzaki M. // Exp. Cell Res. 2007. V. 313. № 9. P. 1853. https://doi.org/10.1016/j.yexcr.2007.03.002
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии