Российские нанотехнологии, 2023, T. 18, № 1, стр. 88-92
КУЛЬТИВИРОВАНИЕ МИКРОВОДОРОСЛЕЙ Chlorella vulgaris СОВМЕСТНО С ПОЛИМЕРНЫМ МАТЕРИАЛОМ НА ОСНОВЕ ХИТОЗАНА С ЦЕЛЬЮ СОРБЦИИ ТЯЖЕЛЫХ МЕТАЛЛОВ И БИОМАССЫ
М. Г. Петрова 1, 2, В. М. Пожидаев 1, С. А. Тихомиров 1, О. А. Кондратьев 1, К. Г. Антипова 1, А. В. Бакиров 1, Т. Е. Григорьев 1, К. В. Горин 1, *
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Московский политехнический университет
Москва, Россия
* E-mail: gkvbio@gmail.com
Поступила в редакцию 05.10.2022
После доработки 05.10.2022
Принята к публикации 14.10.2022
Аннотация
Одной из существенных проблем является эвтрофикация водоемов, вызываемая переизбытком попадающих в них питательных веществ, в первую очередь азота и фосфора. Загрязнение водоемов также усугубляется содержащимися в сточных водах тяжелыми металлами. Рассмотрена совместная очистка воды от избыточного количества биомассы микроводорослей Chlorella vulgaris и тяжелых металлов с помощью полимерных материалов на основе хитозана. Проведенный рентгеноструктурный анализ образцов в больших углах выполнен на станции БиоМУР Курчатовского синхротрона.
ВВЕДЕНИЕ
С ростом техногенной и антропогенной нагрузки на окружающую среду экологическая обстановка значительно ухудшается. Загрязнение сточных вод ионами токсичных тяжелых металлов представляет собой серьезную экологическую проблему [1].
Особенностью тяжелых металлов как загрязнителей является их способность к аккумуляции в природных водах. В отличие от токсических веществ органической природы, подверженных химическому и биологическому разложению, они стабильны в любых условиях. При этом за счет химической активности катионы металлов легко включаются в циклы миграции при поступлении их в биосферу [1, 2]. Из природных водных источников и по пищевым цепям они попадают и в организм человека. Растения и животные способны к накоплению определенных металлов в отдельных органах. В результате отдельные продукты склонны к содержанию группы токсикантов. Так, медь обнаруживается чаще всего в печени, моллюсках, грибах, какао-бобах, орехах.
Тяжелые металлы характеризуются высокой степенью токсичности. Медь, относящаяся ко второму классу опасности (умеренно токсичные вещества), при накоплении в организме человека способна вызывать расстройства желудочно-кишечного тракта, нарушения функции почек, тахикардию, а также поражать дыхательную систему и нарушать кроветворные процессы [3, 4].
Основными источниками меди и других тяжелых металлов являются промышленные стоки гальванических производств, обогатительных цехов горнодобывающей промышленности, цветной металлургии, целлюлозно-бумажной отрасли, химических предприятий по производству удобрений и нефтеперерабатывающих цехов. Концентрация катионов меди в них достигает 1000 мг/л. Городские ливневые стоки также содержат медь в значительных количествах.
Очистка стоков традиционно осуществляется следующими методами:
– механическими (отстаивание, фильтрация, в том числе мембранная);
– химическими (осаждение);
– физико-химическими (коагуляция, ионный обмен, экстракция растворителями, адсорбция).
К недостаткам данных методов относятся их высокая стоимость вследствие высокой энергоемкости, дороговизны оборудования и дефицитных химических реагентов, образование сложно утилизируемых токсичных шламов и ограничения по степени очистки. Сложность в исполнении и ориентация на импортное оборудование создают дополнительные проблемы [5].
Современные экономические условия требуют разработки эффективных, опирающихся на применение доступного, дешевого сырья, методов очистки загрязненных стоков с возможностью утилизации или вторичного применения образующихся шлаков. Такие методы, снижающие антропогенную нагрузку на окружающую среду, представляют и научный, и коммерческий интерес.
Наиболее перспективными являются разработка и внедрение биотехнологических методов очистки стоков от тяжелых металлов с применением фототрофных микроорганизмов. Доступность оборудования, низкое энергопотребление, отсутствие агрессивных химических реагентов, высокая степень очистки, возможность использования полученной биомассы, минимизация отрицательного воздействия на окружающую среду обеспечивают высокую эффективность и экономическую выгоду [5, 6].
Принцип биоремедиации – использование метаболического потенциала биологических объектов – применяется для очистки различных объектов окружающей среды. В качестве агентов биоремедиации чаще всего используют микроорганизмы, отвечающие требованиям устойчивости к высокому содержанию загрязнителей, обладающие низкой избирательностью к условиям культивирования, высокой адаптационной способностью к изменению физических и химических параметров окружающей среды. К таким культурам относится Chlorella vulgaris [7].
Относительная индифферентность некоторых штаммов к тяжелым металлам позволяет разрабатывать альтернативные методы очистки сточных вод на основе биоаккумуляции.
Применение данного эффекта в технологических масштабах возможно благодаря способности микроорганизмов накапливать тяжелые металлы в больших количествах, существенно снижая их концентрацию в окружающей среде – растворах или твердых субстратах.
Механизм накопления металлов микроводорослями обеспечивается в основном за счет физической адсорбции на клеточной стенке. Такой преимущественный механизм отмечен для Chlorella vulgaris [6, 8].
Повышение прочности соединения катионов, например меди, клеточными стенками хлореллы обеспечивается возможностью хемосорбции за счет образования комплексных соединений металлов с функциональными группами, способными выступать в качестве лигандов. К таким функциональным группам относятся производные имидазола, тиоэфиров, карбоксильные, гидроксосоединения, входящие в состав биополимерных молекул – полисахаридов, белков и липидов, составляющих клеточные стенки хлореллы. Содержание активных функциональных групп, способных взаимодействовать с катионами металлов (в пересчете на эквивалент катиона водорода), по имеющимся данным составляет:
– карбоксил – 0.02 мэкв Н+/г водоросли;
– лактоны – 0.01 мэкв Н+/г водоросли;
– фенолы – 0.035 мэкв Н+/г водоросли.
Вероятность протекания хемосорбции, а соответственно, более прочное связывание металла, повышается с ростом рН вследствие возрастания степени диссоциации функциональных групп кислотного характера, поэтому эффективность процесса адсорбции металлов может регулироваться с помощью рН в рамках, ограниченных физиологическими требованиями микроводоросли [1, 8].
Невозможность осуществления полной очистки от тяжелых металлов в одностадийном процессе даже при высоких концентрациях культуры может быть скомпенсирована за счет многократной адсорбции. При этом количество биосорбента может быть невысоким.
При культивировании микроводоросли следует учитывать токсичное воздействие тяжелых металлов на любой организм. Не удается избежать таких негативных последствий, как нарушение процесса фотосинтеза, дыхания, замедление размножения и роста, повреждение клеточных органелл и мембран, искажение протекания биохимических процессов клеточного метаболизма, в том числе поглощения питательных веществ и т.д. Однако культура Сhlorella vulgaris проявляет высокие адаптационные способности по отношению к содержанию тяжелых металлов, легко культивируется на сточных водах в лабораторных условиях, что обосновывает ее выбор в качестве агента биоремедиации. Изменение соотношения белковых и липидных клеточных компонентов в присутствии меди может рассматриваться как положительный момент с точки зрения вторичного использования биомассы [9, 10].
С целью снижения неблагоприятных эффектов от присутствия тяжелых металлов в окружающей среде природоохранные организации и органы власти на законодательном уровне ужесточают требования к составу промышленных и коммунальных сбросов в природные и городские ландшафты. Выполнение требований принимаемых норм и стандартов может быть практически обеспечено только благодаря разработке и внедрению инновационных экологичных технологий очистки.
В [11] была показана высокая эффективность сорбции биомассы микроводорослей на полимерных материалах на основе хитозана.
В настоящей работе рассмотрим применение полимерного материала на основе хитозана для сорбции биомассы микроводоросли Chlorella vulgaris и одновременной сорбции тяжелых металлов на примере меди.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Полимерный материал синтезировали из раствора хитозана с добавлением глутарового альдегида как связывающего агента. 2 г хитозана (Primex ChitoClear, молекулярная масса 600 кДа, Исландия) растворяли в 98 мл 2%-ного водного раствора уксусной кислоты. Глутаровый альдегид добавляли в раствор для предотвращения растворения губки в воде. Полученную смесь помещали в 12-луночный планшет (Costar), замораживали в морозилке при температуре –24°C в течение 24 ч, затем лиофилизовали в Martin Christ Alpha 2-4LSC (США) в течение 48 ч. Масса получаемых губок составляла 0.0568 ± 0.0007 г, диаметр – 21 ± 0.5 мм, высота – 6.1 ± 0.1 мм.
Культура и условия выращивания. В качестве культуры был выбран штамм микроводоросли Chlorella vulgaris GKV 1 из коллекции НИЦ “Курчатовский институт”, широко используемый для различных исследовательских задач.
Культивирование проводили в колбах Эрленмейера объемом 250 мл со 150 мл среды Bold’s Basal media (BBM) следующего состава (г/л): KH2PO4 – 1.25, KNO3 – 1.25, MgSO4·7H2O – 2.0; микроэлементы, 1 мл стокового раствора мг/л: EDTA – 5000, FeSO4·7H2O – 2000, ZnSO4·7H2O – 100, MnCl2 – 30, H3BO3 – 300, CaCl2·6H2O – 200, CuCl2 – 10, NiCl2·2H2O – 20, Na2MoO4·2H2O – 20 [12] в течение 7 сут при постоянном барботировании атмосферным воздухом расходом 250 мл/мин, температуре 24 ± 1°С, освещенности 1500 люкс. Контроль роста культуры проводили посредством измерения оптической плотности при длине волны 750 нм с помощью мультимодального ридера Varioscan LUX (Thermo Fisher Scientific, США). В качестве добавки катионов меди использовали раствор сульфата меди (CuSO4·5H2O) с концентрацией катионов меди 100 мг/л. Сбор биомассы осуществляли с помощью центрифуги SL 40R (Thermo Fisher Scientific, США) при 10 000 об./мин в течение 10 мин при 20°C. Биомассу отмывали дистиллированной водой и центрифугировали 2 раза. Собранную влажную промытую биомассу и губки замораживали при температуре –70°С и лиофильно высушивали с помощью настольной лиофильной сушилки FreeZone 2.5 (Labconco, США) в течение 12 ч.
Микроскопическое исследование образцов проводили с помощью микроскопа BX61 (Olympus, Япония).
Приготовление образцов для микроскопирования. Срезы образцов губок осуществляли на микротоме Leica VT 1200S (Leica Biosystems).
Определение содержания тяжелых металлов в образцах биомассы и губках проводили методом микрофлуоресцентного анализа с использованием спектрометра Tornado M4. В качестве источника первичного рентгеновского излучения использовали родиевую трубку, работающую в режиме 50 кВ/300 мкА. Рентгеновское излучение от трубки коллимировалось фокусирующей оптикой, область засветки на образце составляла 25 × × 25 мкм. Флуоресцентные спектры измеряли с использованием двух предварительно откалиброванных энергодисперсионных детекторов в течение 150 с. Затем полученные спектры обрабатывали с использованием программного обеспечения Tornado M4, в ходе обработки вырезали тормозное фоновое излучение и рассеянное Rh, составляли набор элементов, от которых наблюдались флуоресцентные пики, после чего в ходе процедуры минимизации разности между экспериментальным и теоретическим спектром определяли содержание элементов.
Рентгеноструктурный анализ (РСА) образцов в больших углах был выполнен на станции БиоМУР Курчатовского синхротрона. Источником излучения служил поворотный магнит 1.7 Тл с энергией 8 кэВ (1.433 Å), разрешением dE/E 10–3 и потоком фотонов 109. Размер пучка на образце составлял 0.5 × 0.3 мм, для регистрации картин дифракции использовали двумерный детектор Dectris Pilatus 1M. Расстояние образец–детектор составляло 150 мм, перед последующей обработкой проводили вычитание фонового рассеяния. В качестве калибровочных эталонов в малых и больших углах использовали бегенат серебра и NaC(Na2Ca3Al2F14). Диапазон величин вектора обратного рассеяния q составил 0.8–33 нм–1. Для обработки полученных картин рассеяния были применены пакеты программного обеспечения Fit2D и ImageJ. Время экспозиции составило 300 с.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На основе полученных экспериментальных данных отмечено, что в случае хлореллы + губки вся биомасса сорбируется и роста не наблюдается, в случае хлореллы + металл + губки наблюдается незначительный рост биомассы, часть биомассы также сорбируется на губку (рис. 1).
Рис. 1.
Экспериментальные образцы на седьмой день проведения эксперимента: 1 – контроль, 2 – культура + металл + + губка, 3 – культура + губка, 4 – культура + металл, 5 – металл + губка.

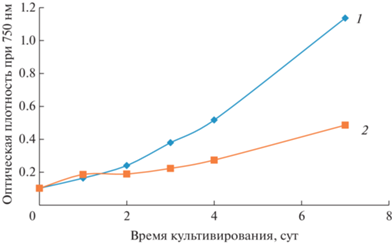
По данным спектрофотометрического анализа установлено, что культура Chlorella vulgaris в присутствии катионов меди (100 мг/л) имеет показатель оптической плотности на 57.2% меньше по сравнению с контролем (рис. 2). Это обусловлено достаточно высокой концентрацией Cu2+, которая оказывает негативное воздействие на физиологические функции микроорганизма. Отметим, что культура продолжает свой рост и в стрессовых условиях.
Рис. 2.
Кривые роста культуры Chlorella vulgaris: 1 – контроль, 2 – с добавлением катионов меди (концентрация 100 мг/л).
Размер пор хитозана составляет 10–20 мкм, что сравнимо с размером клеток исследуемой микроводоросли (3–10 мкм). С помощью микроскопии установили, что клетки Chlorella vulgaris сорбируются не только на поверхности губки, но и проникают вглубь губки, образуя конгломераты (рис. 3).
Рис. 3.
Микрофотографии хитозановой губки в проходящем свете, увеличение ×400: а – нативная губка, б – поверхность губки после культивирования, в – срез губки на глубину 500 мкм после культивирования.

По данным результатам установлено, что сорбция меди на биомассу микроводоросли и губки происходит по-разному: в случае биомассы микроводоросли данный показатель составляет ~50%, тогда как на саму губку ~20%.
Для определения структуры полимерных материалов был выполнен РСА в больших углах (рис. 4). На дифракционных кривых для хитозановых губок с частицами меди наблюдаются два набора рефлексов: узких пиков, соответствующих неорганической фазе меди с большим размером когерентных областей, и широких, соответствующих кристаллической решетке хитозана. Однако на дифрактограммах для других образцов материалов узких рефлексов медной решетки не наблюдается. Введение водорослей не приводит к появлению заметных кристаллических рефлексов, наиболее заметный вклад в кристаллизацию вносит хитозан.
Рис. 4.
Дифрактограммы образцов полимерных материалов и биомассы: 1 – хитозан + медь + микроводоросль, 2 – микроводоросль + медь, 3 – хитозан + + микроводоросль, 4 – хитозан + медь. Кривые сдвинуты по вертикали для ясности.
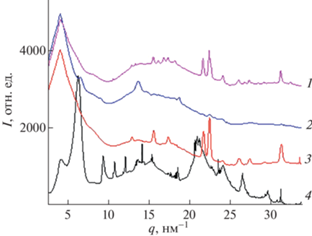
Таблица 1.
Данные микрофлуоресцентного анализа лиофилизированной биомассы и губок
| Лиофилизированная биомасса | Лиофилизированная губка | ||
|---|---|---|---|
| Образец | Содержание меди (от массы образца), % | Образец | Содержание меди (от массы образца), % |
| Культура + Me + губка | 54.98 | Культура + Me + губка | 22.67 |
| Культура + Me | 50.50 | Губка + Me | 28.04 |
| Me + губка (осадок) | 81.35 | Культура + губка | 0.14 |
ЗАКЛЮЧЕНИЕ
Показана возможность выращивания микроводоросли Chlorella vulgaris и сорбции тяжелых металлов (на примере меди) ее биомассой, которая достигает 50%, продуктивность при этом была на 57% меньше по сравнению с контролем. В случае совместного выращивания с хитозановой губкой роста не наблюдалось, хотя при добавлении меди незначительный рост был отмечен. Эти данные могут стать предметом дальнейших исследований. Биомасса микроводоросли сорбируется не только на поверхности хитозановой губки, но и проникает вглубь. Для определения структуры полимерных материалов был выполнен РСА в больших углах. На дифракционных кривых для хитозановых губок с частицами меди наблюдаются два набора рефлексов: узких пиков, соответствующих неорганической фазе меди с большим размером когерентных областей, и широких, соответствующих кристаллической решетке хитозана. Введение водорослей не приводит к появлению заметных кристаллических рефлексов, наиболее заметный вклад в кристаллизацию вносит хитозан.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках соглашения № 075-15-2021-1357.
Список литературы
De Abreu F., da Costa P., Brondi A. et al. // Bulletin of Environ. Contamin. and Toxicol. 2014. V. 93. № 4. P. 405. https://doi.org/10.1007/s00128-014-1363-x
Al-Rub F., El-Naas M., Ashour I. et al. // Process Biochemistry. 2006. V. 41. № 2. P. 457. https://doi.org/10.1016/j.procbio.2005.07.018
Horvathova H., Kadukov J., Stofko M. // Acta Metallurgica Slovaca. 2009. V. 15. № 4. P. 255.
Padria M., Boontianb N., Piasaic C. et al. // Engineer. J. 2020. V. 24. № 6. P. 11. https://doi.org/10.4186/ej.2020.24.6.11
Zeraatkar A., Ahmadzadeh H., Razaviarani V. et al. // Agricult. Environ. Sci. 2021. V. 1. № 1. P. 32.
Fraile A., Penche S., Gonzalez F. et al. // Chem. Ecol. 2005. V. 21. № 1. P. 61. https://doi.org/10.1080/02757540512331334933
Xiong X., Zhang Y., Wang L. et al. // Low Carbon Stabilization and Solidification of Hazardous Wastes. 2022. P. 1.
Vojvodic S., Stanic M., Zechman B. et al. // Biochem. J. 2022. V. 477. № 19. P. 3729. https://doi.org/10.1042/BCJ20200600
Senturk T., Yildiz S. // Turkish J. Biochem. 2016. V. 41. № 2. P. 87. https://doi.org/10.1515/tjb-2016-0015
Kondzior P., Butarewicz A. // J. Ecolog. Eng. 2018. V. 19. № 3. P. 18. https://doi.org/10.12911/22998993/85375
Grigoriev T., Lukanina K., Gotovtsev P. et al. // Appl. Polym. 2020. P. 1. https://doi.org/10.1002/app.49209
Gorin K., Badranova G., Gotovtsev P. et al. // IOP Conf. Ser. Mater. Sci. Eng. 2018. P. 293. https://doi.org/10.1088/1757-899X/292/1/012051
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


