Российские нанотехнологии, 2023, T. 18, № 1, стр. 93-98
ПОВЫШЕНИЕ ПРОДУКТИВНОСТИ МИКРОВОДОРОСЛЕЙ Chlorella vulgaris ЗА СЧЕТ ИСПОЛЬЗОВАНИЯ ГИДРОГЕЛЯ С НАНОЧАСТИЦАМИ
К. В. Горин 1, *, В. М. Пожидаев 1, С. А. Тихомиров 1, О. А. Кондратьев 1, М. Г. Петрова 1, 2, Р. Г. Василов 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Московский политехнический университет,
Москва, Россия
* E-mail: gkvbio@gmail.com
Поступила в редакцию 05.10.2022
После доработки 05.10.2022
Принята к публикации 17.10.2022
Аннотация
Фототрофные микроорганизмы считаются одним из перспективных источников возобновляемого сырья, которое может использоваться для получения энергии и различных ценных продуктов. Проведены исследования по культивированию микроводоросли Chlorella vulgaris GKV 1 в фотобиореакторах горизонтального типа с использованием гидрогеля с наночастицами диоксида титана размером 84 ± 20 нм и адаптивного освещения. Продуктивность микроводоросли C. vulgaris с использованием гидрогеля с наночастицами и адаптивного освещения превышает контроль на 53.4%. Проведен анализ липидов полученной биомассы на качественный состав метиловых эфиров жирных кислот. Полимерный материал исследован на Курчатовском специализированном источнике синхротронного излучения (“КИСИ-Курчатов”).
ВВЕДЕНИЕ
Развитие глобальной биоэкономики создает потребность в новых видах сырья и процессах, направленных на получение топлива и сырья. Использование микроводорослей может играть значительную роль в этих процессах. Попытки повысить ценность биомассы направлены на увеличение содержания липидов и углеводов, как предпочтительные исходные компоненты для конверсии в топливо и другие более ценные продукты. В последнее время внимание сосредоточено на получении микроводорослей с повышенным содержанием белка [1].
Отметим, что фототрофные микроорганизмы широко используются в различных технологиях: по очистке сточных вод, обессоливанию воды, утилизации дымовых газов, образующихся при сжигании ископаемого топлива [2].
При проектировании фотобиореакторов (ФБР) решаются такие задачи, как перемешивание и массоперенос в растущей культуре, создание необходимых температуры и рН, но доминирующим фактором по-прежнему остаются проникающая способность и распределение света. Естественный солнечный свет часто используют для уменьшения себестоимости выращивания, однако падающий свет неизбежно изменяется в зависимости от погоды, суточного цикла и времени года. Плотность светового потока фотонов солнечного света составляет более 2000 мкмоль м2⋅с–1. Однако оксигенные фотомикроорганизмы могут достичь теоретически максимальной эффективности преобразования солнечной энергии в 8–10%. Также важным параметром являются спектральные характеристики света, так как только солнечная радиация в диапазоне 400–700 нм – фотосинтетически активная радиация (ФАР) – может использоваться, составляя 50% от всего солнечного света. Излучение, выходящее за пределы ФАР, является основной причиной повышения температуры при выращивании [3].
Кроме того, УФ-диапазон солнечного света смертелен для клеток. Распределение интенсивности света неравномерно внутри ФБР из-за поглощения и рассеяния в растущей культуре [4], а ослабление излучения зависит от длины волны света, концентрации клеток, геометрии ФБР и проникающей способности. В некоторых случаях свет может проникать только на несколько миллиметров, когда плотность культуры микроводорослей достигает более 10 г ⋅ л–1 в ФБР [3].
В лабораторной практике для культивирования фототрофных микроорганизмов используют ФБР различных конструкций.
Цилиндрические колонные ФБР бывают с барботажем и без. Обычно неподвижные распылители различной конструкции (в виде кольца или дисков, снабженных отверстиями и форсунками или с равномерно расположенными диффузорами из кремнезема, которые работают как пористые твердые тела) для газовой фазы расположены в нижней части ФБР. Расход подаваемого газа составляет от 0.1 до 1.0 объема газа на объем культивируемой среды в минуту. Диаметр таких систем для культивирования, как правило, составляет от 7 до 24 см, а для освещения используют флуоресцентные или светодиодные лампы.
Плоские ФБР – это распространенный тип реакторов для исследования микроводорослей. Они состоят из двух параллельных пластин с небольшим расстоянием между ними, большой поверхности для светового излучения и поэтому обладают высокой эффективностью использования света, а также позволяют избежать “темновых зон”. При разных подходах плоские ФБР размещают вертикально, горизонтально или под определенным углом. Подобно цилиндрическим ФБР с барботажем плоские ФБР могут эксплуатироваться как эрлифтные ФБР с разделенными зонами, одна из которых аэрируемая, подаваемый воздух может распределяться через барботеры, трубки или мембраны для перемешивания растущей культуры и подачи воздушной смеси с диоксидом углерода. В ФБР такого типа часто используются различные перегородки для улучшения перемешивания и распределения света, светодиодное освещение, а также натриевые лампы, люминесцентные, галогенные, неоновые лампы. Освещение может быть как с одной, так и с двух сторон, в некоторых конструкциях второй источник света заменяют на зеркальную поверхность. Освещенность в ФБР такого типа поддерживается на уровне от 80 до 400 мкмоль м2 ⋅ с–1 [5].
В [6] для увеличения массообмена и исключения застойных зон и осаждения биомассы микроводорослей представлен инновационный лабораторный плоский ФБР вертикального эирлифтного типа с уникальной асимметричной U-образной формой объемом 7.2 л. Его эффективность была подтверждена культивированием Chlorella sorokiniana ATCC 22521 – в течение пяти суток выход по оптической плотности при 750 нм составил пять единиц.
Лабораторные ФБР с мешалкой изготавливают из стекла с освещением с внешней стороны. Иногда дополнительный источник освещения помещают внутрь ФБР. Также нередко в таких типах ФБР для освещения используют оптическое волокно, погруженное внутрь растущей культуры.
Трубчатые ФБР состоят из двух частей, соединенных между собой насосами: “солнечного ресивера” и эрлифтной системы. Большая часть фотосинтетических реакций происходит в “солнечном ресивере”, состоящем из прозрачных труб из полимерного материала или стекла различного диаметра и длины, установленных в различных положениях, для обеспечения минимизации занимаемой площади. Вторая часть – “пузырьковая колонна” служит для интенсификации газового обмена между растущей культурой и атмосферой для более полного удаления накопившегося в процессе роста кислорода. Как правило, диоксид углерода подается в конце “пузырьковой колонны”–начале “солнечного ресивера” для увеличения времени его пребывания в системе. Трубчатые ФБР лабораторного масштаба также могут быть упрощенной версии – иметь только часть солнечного приемника с упрощенной насосной системой, что снижает затраты.
Другим типом ФБР является использование для их изготовления полимерных материалов, из которых можно получать ФБР различной конструкции: в виде мешков, подвешивающихся вертикально, под углом, размещающихся непосредственно на поверхности моря для перемешивания с помощью волнового движения. Но, как правило, такие системы имеют недостаточное перемешивание, что может привести к снижению выхода.
Тонкослойные ФБР каскадного типа представляют собой открытые ФБР, в которых растущая суспензия микроводорослей направляется вниз самотеком под действием силы тяжести по каналам, расположенным под определенным регулируемым углом. Суспензия собирается в рециркуляционную емкость и насосом заново подается наверх канала. Регуляция объемного расхода и угла установки каналов позволяет регулировать толщину слоя растущей культуры, который составляет 0.5–1 см. ФБР такого типа могут иметь один или несколько каналов и располагаются, как правило, в теплицах [5].
Для увеличения поглощения диоксида углерода разрабатываются лабораторные ФБР с мембранной системой [7].
В последнее время стали культивировать микроводоросли, иммобилизованные в гидрогелях, что позволяет сократить потребление воды во время выращивания и обеспечить потенциальный физический барьер против бактериальной микрофлоры. Также используется 3D-биопечать для создания различных гидрогелевых структур для выращивания ряда штаммов микроводорослей. Для оптимизации распространения света в гидрогелях их выполняют в форме кораллов. Однако выращивание микроводорослей в системах на основе гидрогелей все еще требует развития в отношении газового обмена и метаболитов, необходимых для жизнедеятельности микроводорослей [8].
В [9] было показано положительное влияние гидрогелей на рост микроводорослей с наночастицами оксида алюминия и оксида циркония при культивировании в колбах, тогда увеличение продуктивности достигло 20%.
В настоящей работе для увеличения продуктивности микроводоросли Chlorella vulgaris в плоском ФБР горизонтального типа использовали гидрогель с наночастицами диоксида титана, а также адаптивную систему освещения.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. В работе использовали йота-каррагинан (Special Ingredients, Великобритания), поливиниловый спирт (ПВС) 22 000 г/моль (Авилон-КомпаниХим, Россия), диоксид титана чистотой 99.5% (BDT, Россия).
Культура и условия выращивания. В качестве культуры выбран штамм микроводоросли Chlorella vulgaris GKV 1 из коллекции НИЦ “Курчатовский институт”, широко используемый для различных исследовательских задач.
Культивирование осуществляли в горизонтальном плоском ФБР общим объемом 5 л, выполненном из прозрачного органического стекла толщиной 5 мм. Объем культивируемой среды вместе с посевным материалом составлял 4.3 л. Перемешивание осуществлялось за счет прокачивания среды с помощью водяного насоса с расходом 1000 мл/мин. Температура при культивировании – 24 ± 1°С. В качестве питательной среды использовали модифицированную среду Bold’s Basal Media (BBM) следующего состава г/л: KNO3 – 1.25, KH2PO4 – 1.25, MgSO4⋅7H2O – 1, CaCl2 – 0.0835. Добавляли 1 мл стокового раствора микроэлементов. Его состав по Пфеннигу мг/л: EDTA – 5000, FeSO4⋅7H2O – 2000, ZnSO4⋅7H2O – 100, MnCl2 – 30, H3BO3 – 300, CaCl2⋅6H2O – 200, CuCl2 – 10, NiCl2·2H2O – 20, Na2MoO4⋅2H2O – 20 [9]. рН питательной среды доводили до 7.0. В качестве источника освещения использовали флуоресцентную лампу мощностью 108 Вт. Ее устанавливали на таком расстоянии, чтобы обеспечивался световой поток в 100 мкмоль фотонов м–2 ⋅ с–1 на освещаемой поверхности ФБР. Барботаж атмосферным воздухом осуществлялся с помощью компрессора с расходом 250 мл/мин. Для первого ФБР (с гелем) организовали адаптивное освещение, внизу ФБР был помещен измеритель ФАР Almemo 2450 с датчиком FLA 623 PS (Ahlborn, Германия), по которому осуществляли досветку до необходимого уровня освещенности растущей культуры с помощью светодиодов (smd 2835 IP 23). При культивировании измеряли рН с помощью рН-метра Seven Compact (Mettler Toledo, Швейцария) и оптическую плотность при 750 нм на спектрофотометре Varioscan LUX (Thermo Fisher Scientific, США).
Приготовление гидрогеля. В качестве оптического материала синтезировали гель с содержанием диоксида титана (TiO2) 0.25% (с кристаллической структурой рутил, размер частиц 84 ± 20 нм) по модифицированной методике [10]: ПВС (2.5%) и каррагинан (2.5%) гомогенизировали при 70°С и перемешивали на магнитной мешалке 400 об./мин 240 и 45 мин соответственно, затем смешивали на магнитной мешалке при 400 об./мин 60 мин, добавляли диоксид титана и гомогенизировали на магнитной мешалке при 400 об./мин 60 мин, затем заливали в чистую плоскую емкость для образования плоского геля, остужали при комнатной температуре, затем выполняли четыре цикла замораживание/оттаивание –24/+24°С в течение четырех суток, затем сушили при 35°С двое суток. Из полученного геля вырезали квадрат со стороной 200 мм, толщиной 5 мм и помещали в первый ФБР.
Определение плавучести гидрогеля. Плавучесть гидрогелей определяли путем помещения их в цилиндр на 100 мл со средой для культивирования микроводорослей и измерения глубины погружения. Измерения начинали проводить через 100 мин после помещения гидрогелей в цилиндр, давая им набухнуть.
Анализ состава метиловых эфиров жирных кислот (МЭЖК). Для анализа содержания МЭЖК необходима лиофильно высушенная биомасса. Сбор биомассы проводили центрифугированием при 7500 об./мин (центрифуга Awel MF 20, ротор AMF 20–8 RFID, Франция) в течение 10 мин при 20°C, дважды промывали дистиллированной водой для удаления адсорбированных солей. Собранную влажную биомассу лиофильно сушили на лиофильной сушилке FreeZone 2.5 (Labconco, США) в течение 12 ч.
Получение МЭЖК проводили прямым метанолизом согласно методу [11].
Анализ МЭЖК проводили методом газовой хроматографии на газовом хроматографе Bruker 430 GC (Varian Inc. США), снабженном пламенно-ионизационным детектором и кварцевой капиллярной колонкой Select TM Biodiesel (30 м × × 0.32 мм × 0.25 мкм). Количество вводимой пробы – 1 мкл [12].
МЭЖК идентифицировали по относительному времени удерживания на колонке компонентов смеси в сравнении со стандартом, количественное содержание индивидуальных жирных кислот (ЖК) определяли методом нормализации площадей.
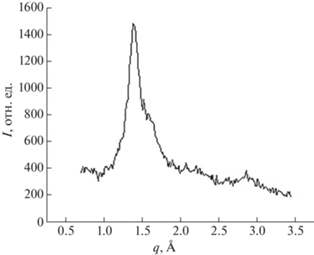
Проведение рентгеновских исследований. Измерения проводили на Курчатовском специализированном источнике синхротронного излучения (“КИСИ-Курчатов”). Использовали методику записи кривых дифракционного отражения на просвет. Длина волны используемого синхротронного излучения составляла 1.5 Å.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Плавучесть гидрогеля является одним из основных факторов, определяющих его положение в ФБР, результаты данного параметра представлены в табл. 1.
Таблица 1.
Результаты измерений плавучести гидрогелей
| Образец гидрогеля | Результаты измерения глубины погружения гидрогелей, см | ||
|---|---|---|---|
| 100 мин | 200 мин | 300 мин | |
| Каррагенан + ПВС + частицы TiO2 | 0.2 | 0.3 | 0.3 |
| Каррагенан + ПВС | 0.2 | 0.3 | 0.3 |
В ходе исследования выявлено, что гидрогель как без частиц, так и с частицами диоксида титана погружается на небольшую глубину до 0.3 см. При этом наличие наночастиц в геле концентрацией 0.25% не способствовало увеличению глубины погружения гидрогеля. Гидрогели изучали в высушенном и набухшем состоянии (рис. 1).
Рис. 1.
Микрофотографии гидрогеля в проходящем свете до и после культивирования, увеличение ×400: а – приготовленный высушенный гель, б – набухший гель до культивирования, в – гель после культивирования, г – высушенный гель после культивирования.

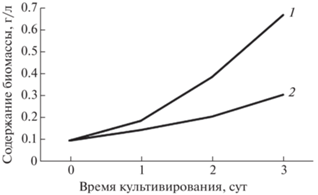
Продуктивность C. vulgaris при культивировании с использованием гидрогеля и адаптивного освещения была выше на 53.4% по сравнению с контролем (рис. 2).
Рис. 2.
Изменение концентрации биомассы C. vulgaris в фотобиореакторах со временем при культивировании: 1 – с гелем, 2 – без геля.
Это можно объяснить несколькими факторами: применением адаптивного освещения, позволяющего поддерживать необходимый уровень освещенности независимо от плотности культуры (рис. 3), и оптического материала (гидрогеля) с высоким альбедо, что создает еще две отражающих поверхности в толще растущей культуры, что в совокупности увеличивает освещенность (рис. 4).
Рис. 3.
Изменение выходного напряжения с датчика фотосинтетически активной радиации и управляющего напряжения на диоды при культивировании C. vulgaris в фотобиореакторе: 1 – выходное напряжение с ФАР-датчика, 2 – управляющее напряжение на диодах.
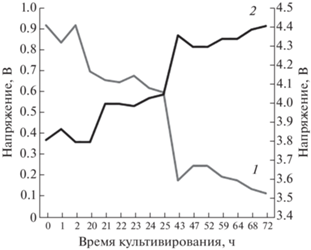
Согласно приведенным на рис. 3 данным с ростом плотности растущей суспензии микроводорослей уменьшается проникающая способность света, что приводит к возрастанию управляющего напряжения на диодах и, соответственно, увеличению интенсивности освещения от светодиодов, расположенных в нижней камере ФБР.
Отметим, что при культивировании с гидрогелем он выступает в роли “механической мешалки”, препятствующей образованию “застойных зон” и оседанию клеток, наблюдаемых в центре и углах ФБР без геля, и способствует лучшему перемешиванию растущей культуры в ФБР.
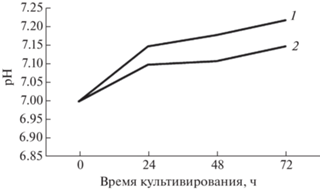
Изменение рН было не сильным, хотя в случае с гидрогелем, защелачивание выше из-за более интенсивного роста культуры (рис. 5).
В составе липидов выявлены восемь ЖК (табл. 2 ). Ненасыщенные ЖК составляли более 70% как при культивировании с гидрогелем, так и в его отсутствие, причем почти 40% составляли полиненасыщенные жирные кислоты (ПНЖК): линолевая и линоленовая. Интересен тот факт, что содержания как отдельных ЖК, так и насыщенных и ненасыщенных ЖК в обоих вариантах культивирования различаются незначительно.
В европейских стандартах на биодизель прописаны четкие ограничения на содержание ПНЖК, доля которых не должна превышать 12% для линоленовой кислоты, 1% для четырех и более двойных связей. В проведенном исследовании установлено, что содержание линоленовой кислоты в количестве ЖК в липидах биомассы C. vulgaris было на уровне 16%.
На рис. 6 виден характерный дифракционный пик при 1.4 Å–1 для гидрогеля, состоящего из каррагинана, ПВС и наночастиц TiO2 [5].
Талбица 2. Состав МЭЖК биомассы C. vulgaris
| Жирная кислота | Содержание ЖК, % (от суммы ЖК) | |
|---|---|---|
| С гелем | Без геля | |
| Пентадеценовая кислота (15:1) | 15.34 | 14.15 |
| Пальмитиновая кислота (16:0) | 14.20 | 12.29 |
| Пальмитолеиновая кислота (16:1) | 4.86 | 5.83 |
| Гептадеценовая кислота (17:1) | 11.79 | 12.82 |
| Стеариновая кислота (18:0) | 11.23 | 10.03 |
| Олеиновая кислота (18:1) | 4.38 | 5.54 |
| Линолевая кислота (18:2) | 22.64 | 23.24 |
| Линоленовая кислота (18:3) | 15.56 | 16.10 |
| Сумма насыщенных ЖК | 25.43 | 22.32 |
| Сумма ненасыщенных ЖК | 74.57 | 77.68 |
| Сумма мононенасыщенных ЖК | 36.37 | 38.34 |
| Сумма полиненасыщенных ЖК | 38.20 | 39.34 |
ЗАКЛЮЧЕНИЕ
Получены данные о возможности эффективного использования гидрогеля на основе каррагинана, ПВС и наночастиц диоксида титана и адаптивного освещения для увеличения продуктивности микроводоросли C. vulgaris, которая повысилась более чем на 50% по сравнению с контролем. Установлено, что содержание наночастиц диоксида титана в гидрогеле в количестве 0.25% не влияет на его плавучесть. Присутствие гидрогеля в культуральной среде при выращивании также дает положительный эффект с точки зрения создания более подходящего гидродинамического режима в фотобиореакторе. Состав ЖК биомассы, полученной при культивировании с гидрогелем, и контроля различался незначительно. С помощью специализированного источника синхротронного излучения подтверждено присутствие наночастиц диоксида титана в гидрогеле.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках соглашения № 075-15-2021-1357.
Список литературы
Wiatrowski M., Klein B., Davis R. et al. // Biofuel. Bioprod. 2022. P. 1. https://doi.org/10.1186/s13068-021-02098-3
Gotovtsev P., Komova A., Gorin K. et al. // Energy Technol. Assessm. 2019. V. 31. P. 132. https://doi.org/10.1016/J.SETA.2018.12.0
Huang Q., Jiang F., Wang L. et al. // Engineer. 2017. V. 3. P. 318. https://doi.org/10.1016/J.ENG.2017.03.020
Quan Y., Pehkonen S., Ray M. // Ind. Eng. Chem. Res. 2004. V. 43. P. 948. https://doi.org/10.1021/ie0304210
Benner P., Meier L., Pfeffer A. et al. // Bioproc. Biosyst. Eng. 2022. V. 45. P. 791. https://doi.org/10.1007/s00449-022-02711-1
Fuchs T., Arnold N., Garbe D. et al. // Front. Bioeng. Biotechnol. 2021. V. 9. P. 1. https://doi.org/10.3389/fbioe.2021.697354
Senatore V., Buonerba A., Zarra T. et al. // Chemosph. 2021. V. 273. P. 129682. https://doi.org/10.1016/j.chemosphere.2021.129682
Martin N., Bernat T., Dinasquet J. et al. // J. Appl. Phycol. 2021. P. 2805. https://doi.org/10.1007/s10811-021-02528-7
Gorin K., Badranova G., Gotovtsev P et al. // IOP Conf. Ser. Mater. Sci. Eng. 2018. P. 293. https://doi.org/10.1088/1757-899X/292/1/012051
Badranova G., Gotovtsev P., Zubavichus Y. et al. // J. Mol. Liq. 2016. V. 223. P. 16. https://doi.org/10.1016/j.molliq.2016.07.135
Liu J., Liu Y., Wang H. et al. // Technol. 2015. V. 176. P. 284. https://doi.org/10.1016/j.biortech.2014.10.094
Сергеева Я.Э., Мостова Е.Б., Горин К.В. и др. // Биотехнология. 2017. Т. 33. № 1. С. 53.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии