Российские нанотехнологии, 2023, T. 18, № 1, стр. 63-71
НАНОКОМПОЗИТЫ НА ОСНОВЕ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ
В. В. Ревин 1, Е. В. Лияськина 1, *, А. О. Богатырева 1, Н. Б. Назарова 1, Е. С. Упыркина 1, И. В. Кургаева 1, Р. Г. Василов 2
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва
Саранск, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: liyaskina@yandex.ru
Поступила в редакцию 08.06.2022
После доработки 26.10.2022
Принята к публикации 29.10.2022
Аннотация
Получены биокомпозиты с антибактериальным действием на основе бактериальной целлюлозы (БЦ), хитозана и фузидовой кислоты в виде пленок, гидрогелей и аэрогелей. Исследована их структура методами атомно-силовой микроскопии, сканирующей электронной микроскопии, ИК-спектроскопии и компьютерной микротомографии. Показано, что толщина волокон БЦ, образуемой штаммом Komagataeibacter sucrofermentans B-11267 на среде с мелассой, составляет 50–60 нм. Полученные нанокомпозиты имеют высокую антибактериальную активность в отношении грамположительных бактерий Staphylococcus aureus и Bacillus lichenoformis и могут быть использованы в качестве материалов медицинского назначения, в том числе в тканевой инженерии и в качестве раневых покрытий с антибактериальными свойствами.
ВВЕДЕНИЕ
Сегодня функциональные носители биологически активных соединений и абсорбенты с высокой удельной поверхностью широко используются в биомедицине [1, 2]. Особое внимание привлекают биосовместимые и биоразлагаемые фибриллярные наноматериалы, к числу которых относится бактериальная целлюлоза (БЦ).
Целлюлоза хорошо известна как один из самых распространенных биоразлагаемых материалов в природе. Ее традиционно получают из растений, но она также может образовываться благодаря определенным видам бактерий [3, 4]. БЦ в основном продуцируется микроорганизмами, принадлежащими роду Komagataeibacter [5, 6].
БЦ имеет уникальную наноразмерную сетчатую структуру и состоит из агрегатов целлюлозных фибрилл диаметром ~20–60 нм, поэтому ее часто называют бактериальной наноцеллюлозой и наряду с микрофибриллярной и нанокристаллической целлюлозой относят к наноцеллюлозным материалам [6–10]. Такая уникальная микроморфология обеспечивает БЦ большую площадь поверхности, высокую водоудерживающую способность, пористость, механическую прочность (200–300 MPa), влажность (>90%), кристалличность (84–89%), термостабильность (до 300°C) и степень полимеризации (до 8000) [7].
Бактериальная наноцеллюлоза в последние 10 лет привлекает огромное внимание исследователей как биоматериал для тканевой инженерии [8, 11, 12], создания раневых покрытий [7, 13–16] и систем контролируемой доставки лекарственных средств [9, 17–20].
В отличие от синтетических полимеров она является биологически совместимой, не токсична, не вызывает аллергии и физического отторжения. Гель-пленка БЦ поддерживает оптимальный баланс влажности, стимулирующий заживление; отлично пропускает жидкости и газы; активно насыщается лекарственными препаратами и свободно отдает их в поврежденную зону; поглощает продукты распада тканей; служит почти непреодолимым физическим барьером для инфекции, создает благоприятные условия для свободной миграции и пролиферации клеток в трехмерном пространстве.
Однако БЦ в нативном состоянии не проявляет антимикробного действия. Существует несколько успешных попыток придания БЦ антимикробных свойств. Созданы композиты с антибактериальной активностью на основе БЦ, серебра, меди и цинка [21–25]. Получены материалы медицинского назначения с антибактериальным действием на основе БЦ и антибиотиков (тетрациклин, гентамицин, амоксициллин, амоксиклав, цефтриаксон и др.) [25–29].
Особый интерес к БЦ вызван возможностью получения на ее основе новых функциональных и конструкционных материалов [30–32]. Получены биокомпозиты на основе БЦ и хитозана для использования в качестве раневых покрытий [32, 33]. Хитозан в биокомпозите оказывает антибактериальное действие в отношении Escherichia coli и Staphylococcus aureus, обладает ранозаживляющим действием и ускоряет эпителизацию. Разработаны гибридные нанокомпозиты на основе БЦ и альгината для использования в качестве матриц для тканевой инженерии, пленок для раневых покрытий и средств доставки лекарственных препаратов [34, 35].
Цель данного исследования – получение и исследование биокомпозитов с антибактериальным действием на основе БЦ, хитозана и фузидовой кислоты в виде пленок, гидрогелей и аэрогелей как функциональных материалов широкого спектра применения, в частности в медицине.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение БЦ. БЦ получена с помощью штамма бактерии Komagataeibacter sucrofermentans Н-110, который был выделен из чайного гриба, идентифицирован на основании анализа 16S рРНК и депонирован во Всероссийской коллекции промышленных микроорганизмов под номером K. sucrofermentans ВКПМ B-11267 [5]. Для получения БЦ использовали среду с мелассой в концентрации 55 г/л, рН 4.5. Инокулят выращивали на шейкере-инкубаторе ES-20/60 (BIOSAN, Латвия) при скорости перемешивания 250 об./мин и температуре 28°С в течение одних суток. Полученным инокулятом в количестве 10% от объема среды засевали контейнеры, содержащие 500 мл среды, и осуществляли культивирование в статических условиях при температуре 28°С в течение пяти суток. Полученную БЦ трехкратно обрабатывали 0.1 Н раствором NaOH при 80°С в течение 30 мин для удаления клеток и компонентов среды. От раствора щелочи целлюлозу отмывали 0.5%-ным раствором уксусной кислоты и дистиллированной водой до нейтральной реакции. Гель-пленки БЦ высушивали до постоянной массы при температуре 60°С.
Получение композитов на основе БЦ и фузидина натрия. Сухие пленки БЦ разрезали на круги диаметром 10 мм и погружали в 10 мл водного раствора фузидина натрия в концентрации 200 мкг/мл на 1 ч. Затем высушивали их при температуре 60°C в течение 24 ч.
Получение композитов на основе гидрогелей БЦ и хитозана. Полученную, предварительно очищенную, гель-пленку БЦ механически измельчали в течение 10 мин с получением гидрогеля БЦ с гидромодулем 1:3. Гидрогели БЦ-хитозан получали путем смешивания гидрогеля БЦ с 2%-ным раствором хитозана в 1%-ной уксусной кислоте в соотношении 50 : 50 и сшиванием 25%-ным глутаровым альдегидом, добавленным в количестве 2% к массе гидрогеля. Для придания антимикробных свойств в композит добавляли антибиотик фузидин натрия в концентрации 200 мкг/г гидрогеля. Полученную смесь нагревали при 80°С в течение 1 ч. Полученный гидрогель несколько раз промывали деионизированной водой.
Получение композитов на основе аэрогелей БЦ и хитозана. Для получения аэрогелей полученные гидрогели замораживали в низкотемпературном холодильнике MDF-U53V (SANYO, Япония) при –50°С в течение суток и высушивали на лиофильной сушилке Freeze Dryer (Labconco, США).
Атомно-силовая микроскопия. Морфологию поверхности БЦ исследовали с помощью атомно-силовой микроскопии (АСМ) с использованием сканирующего зондового микроскопа SPM 9600 (Shimadzu, Japan).
Сканирующая электронная микроскопия. Исследование микроструктуры композитов осуществляли при помощи многофункционального растрового электронного микроскопа QuantaTM 3D 200i (FEI Company, США).
ИК-спектроскопия. ИК-фурье-спектры регистрировали на ИК-спектрометрe IRPrestige-21 (Shimadzu, Япония) в средней ИК-области 4000–400 см–1.
Метод компьютерной микротомографии. Для морфологического анализа полученных биокомпозитов использовали микрорентгеновский томограф Skyscan 1172 (Bruker, Бельгия).
Антибактериальную активность композитов исследовали диффузионным методом дисков в отношении грамположительных бактерий Staphylococcus aureus 209 P и Bacillus lichenoformis В-7847. Газоны тест-микроорганизма (1 × 105 КОЕ/чашку) были получены на среде № 1 ГРМ для культивирования бактерий. Образцы помещали на газоны и в качестве контроля использовали раствор фузидина натрия в концентрации 200 мкг/мл. Чашки инкубировали в термостате при температуре 37°C в течение 24 ч. Затем ингибирующее действие тестируемых образцов на рост бактерий определяли путем измерения зон отсутствия роста.
Также антибактериальную активность биокомпозитов изучали путем подсчета КОЕ тест-микроорганизма S. aureus 209 после инкубирования с исследуемым материалом. Стерильные образцы биокомпозитов массой 0.5 г помещали в 20 мл бактериальной суспензии. Затем инкубировали их в шейкере-инкубаторе при 37°C в течение 24 ч. В исследуемое время отбирали 0.1 мл суспензии и проводили серийное разведение. Затем 0.1 мл разведения наносили на чашки с агаром в трех экземплярах и инкубировали при 37°C для образования колоний. Через 24 ч подсчитывали единичные колонии. Эксперимент повторяли трижды для каждого штамма и регистрировали средние значения. Процент снижения жизнеспособности клеток рассчитывали по формуле
где t0 – время 0 ч, tx – время, в которое процент снижения жизнеспособности рассчитывается.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Бактериальная целлюлоза имеет уникальную наноразмерную сетчатую структуру, состоящую из тонких волокон диаметром, в 100 раз меньшим, чем у растительных волокон [6–9]. На рис. 1 представлена микроморфология БЦ, полученной с помощью штамма K. sucrofermentans B-11267 на среде с мелассой. Толщина фибрилл БЦ составляет 50–60 нм.
Рис. 1.
АСМ-изображение БЦ, полученной с помощью штамма K. sucrofermentans B-11267 на среде с мелассой.

Благодаря уникальным свойствам БЦ является идеальным биоматериалом для использования в тканевой инженерии, для получения раневых покрытий с регенерационными и антибактериальными свойствами. Однако БЦ сама по себе не обладает антибактериальным действием. Для решения этой проблемы были получены композиты в виде пленок (рис. 2а), гидрогелей (рис. 2б) и аэрогелей (рис. 2в), где в качестве антимикробных компонентов выступали хитозан и фузидовая кислота (ФК).
Хитозан – это катионный аминополисахарид природного происхождения, сополимер глюкозамина и N-ацетилглюкозамина, получение которого осуществляют путем частичного деацетилирования хитина. Согласно [36] хитин и хитозан обладают антибактериальными свойствами в отношении многих бактерий, микроскопических грибов, вирусов, а также в отношении некоторых штаммов дрожжей.
Фузидовая кислота – антибиотик, образуемый грибом Fusidium coccineum, принадлежит к классу стероидов, но не обладает гормональной активностью [37]. Согласно [38] ФК обладает бактериостатической, а в высоких дозах и бактерицидной активностью преимущественно против грамположительных бактерий (особенно по отношению к стафилококкам и стрептококкам). Механизм действия связан с быстрым подавлением синтеза белка микроорганизмов [37]. В последние годы появились сообщения о том, что ФК оказывает ингибирующее действие на образование биопленок S. aureus и может эффективно снижать вирулентность S. aureus путем ингибирования экспрессии α-токсина [38]. Помимо антибактериального ФК обладает слабым иммуномодулирующим действием, которое связывают с подавлением продукции и секреции цитокинов, особенно интерлейкинов, фактора некроза опухолей. В клинических концентрациях ФК является ингибитором хемотаксиса нейтрофилов и подавляет функцию Т-лимфоцитов [39].
Фузидовая кислота широко используется в системном и местном лечении стафилококковых инфекций, включая штаммы, резистентные к пенициллину и другим антимикробным препаратам, являясь альтернативой для лечения заболеваний, вызванных метициллинорезистентными штаммами (MRSA) [40]. Кроме того, она гиппоаллергенна, имеет низкую токсичность, резистентность и не имеет перекрестной резистентности с другими клинически используемыми антибиотиками.
Получены гидрогели на основе БЦ и хитозана в соотношении БЦ–хитозан 50:50 при использовании в качестве сшивающего агента глутарового альдегида. Методом компьютерной микротомографии показано, что все полученные гидрогели имели однородную плотную структуру (рис. 3а).
Для получения аэрогелей гидрогели замораживали и лиофильно высушивали. Методом компьютерной микротомографии показано, что полученные аэрогели представлены микропористыми структурами (рис. 3б). При сканировании этих образцов установлено, что поры присутствуют по всей толщине материала аэрогеля.
Морфологию поперечного сечения аэрогелей изучали с помощью сканирующей электронной микроскопии (СЭМ). Как показано на рис. 4, все аэрогели представлены микропористыми структурами, что справедливо для всех видов лиофилизированных аэрогелей [38]. Однако размер их пор различается. Аэрогель хитозана характеризуется наибольшим размером пор (рис. 4а). Так, основное количество пор находится в диапазоне 66–220 мкм. Наибольшее количество пор имеют диаметр ~110 мкм. В композите хитозана с БЦ наблюдаются меньшие размеры пор (рис. 4б) с диапазоном 20–110 мкм. В среднем размер пор композита составляет 80 мкм. Наиболее тонкая и упорядоченная структура характерна для аэрогеля БЦ (рис. 4в). Размер пор аэрогелей на основе БЦ составляет 11–35 мкм, при этом наибольшее количество пор имеет диаметр 27 мкм.
Рис. 4.
СЭМ-изображения структуры аэрогелей на основе хитозана (а), композитов на основе БЦ и хитозана (б) и БЦ (в).

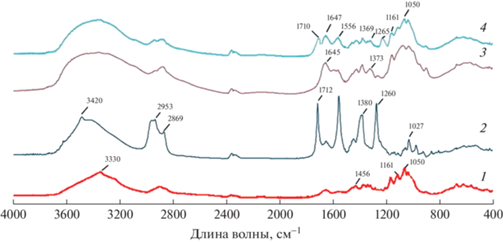
Полученные биокомпозиты исследовали методом ИК-спектроскопии (рис. 5). На ИК-спектрах пленок БЦ обнаружена область поглощения при 3200–3500 см–1 с пиком при 3330 см–1, которая соответствует валентным колебаниям гидроксильных групп, связанных межмолекулярными и внутримолекулярными водородными связями. Поглощение в областях 1161 и 1050 см–1 вызвано асимметричными колебаниями C–O–C группы и вибрациями C–C-, C–OH-, C–H-групп пиранозного кольца глюкозы. Характерные полосы при 1456, 1161 и 894 см–1 указывают на целлюлозу I в качестве основного компонента [41]. Другой интенсивный пик при 1650 см–1 был отнесен к карбонилу глюкозы целлюлозы.
На ИК-спектре чистой ФК можно выделить три выраженных пика при 3420, 1712 и 1260 cм–1 (рис. 5, кривая 2). Поглощение при 3420 cм–1 вызвано валентными колебаниями гидроксильных групп ФК, связанных межмолекулярными водородными связями. Поглощение при 1712 см–1 вызвано присутствием в молекуле ФК карбоксильной группы.
В спектре хитозана обнаружены полосы поглощения при 1645 см–1 (амид I) и 1380 см–1 (амид III). Полосы поглощения при 1153 см–1 (антисимметричное растяжение мостика С–О–С), 1086 и 1035 см–1 (скелетные колебания, связанные с растяжением С–О) характерны для структуры хитозана.
Композиты демонстрировали все пики, описанные для БЦ, и дополнительные пики, указывающие на присутствие хитозана в контакте с сетью БЦ. В ИК-спектре композита обнаружены пики при 1647, 1556 и 1369 см–1, принадлежащие хитозанамиду I, амиду II и амиду III соответственно. Кроме того, пик, относящийся к растяжению O–H, стал шире, что позволяет предположить, что молекулы хитозана вмешиваются в водородные связи между цепями целлюлозы [42]. Кроме того, у полученного композитного материала появились пики, характерные для ФК, а именно пики в области 1710 и 1265 cм–1. Полосы поглощения в хитозане, находящиеся при 1645 и 1373 см–1, в композитах были сдвинуты в область 1647 и 1369 см–1, что может свидетельствовать о взаимодействии между цепями БЦ и хитозана, что подтверждает межмолекулярную связь аминогрупп хитозана и гидроксильных остатков БЦ посредством водородных связей.
Изучение структуры и физико-химических свойств полученных биокомпозитов является важным с точки зрения поведения лекарственных препаратов в матрице БЦ и кинетики их высвобождения. Известно, что, когда размер пор композита превышает молекулярный размер лекарственного средства, коэффициент диффузии может быть связан с пористостью и извилистостью материала. Для композитов с размерами пор, близкими к размеру молекулы лекарственного средства, или непористых материалов коэффициенты диффузии лекарств снижаются из-за стерического препятствия полимерных цепей. В таких случаях средний свободный объем молекул лекарственного средства уменьшается, а гидродинамическое сопротивление лекарственному средству увеличивается, что приводит к увеличению длины пути диффузии лекарственного средства по сравнению с композитами с размерами пор, намного большими, чем у инкапсулированного лекарственного средства. Большая площадь поверхности пор у полученных в настоящей работе композитов позволила загрузить в матрицу большое количество лекарственного средства. Однако микропористая структура композита БЦ способствует медленному высвобождению лекарственного вещества, что обеспечивает пролонгированное действие материала. Кроме того, размеры пор биокомпозита очень важны при использовании материалов в тканевой инженерии и регенеративной медицине [43]. 3D-каркасы БЦ обеспечивают почти идеальную среду для роста клеток и развития тканей в отличие от 2D-материалов, где происходит только поверхностный рост. Таким образом, создавая биокомпозиционные материалы с заданной пористостью, можно влиять на скорость высвобождения лекарственного препарата или на рост клеток и развитие тканей в случае использования в тканевой инженерии и регенеративной медицине.
Исследовалась антибактериальная активность полученных композитов. В настоящее время наблюдается возрастание резистентности болезнетворных бактерий к антибиотикам. В связи с этим особое внимание уделяется ФК, активной в отношении множественно резистентных грамположительных возбудителей [38–40].
В данной работе исследовали антибактериальную активность композитов на основе пленок БЦ и фузидовой кислоты, гидрогелей на основе БЦ, хитозана и ФК и аэрогелей на основе БЦ, хитозана и ФК. Поскольку ФК обладает преимущественной активностью в отношении грамположительных бактерий, в качестве тест-микроорганизмов использовали бактерии S. aureus и B. licheniformis. Эффективность антибактериального действия композитов определяли по размеру зон ингибирования роста бактерий вокруг исследуемых образцов и путем подсчета КОЕ тест-микроорганизма S. aureus 209 после инкубирования с исследуемым материалом.
При использовании композитов на основе пленок БЦ и фузидовой кислоты диаметры зоны задержки роста S. aureus составили 33 ± 2 мм (рис. 6а), B. licheniformis – 22 ± 2 мм (рис. 6б). Полученные результаты свидетельствуют о высокой антибактериальной активности композитных пленок в отношении тест-культур.
Рис. 6.
Антибактериальная активность композитов на основе пленок БЦ и фузидовой кислоты (а, б), на основе БЦ, хитозана и ФК в виде гидрогеля (в, г) и аэрогеля (д, е) в отношении S. aureus и B. lichenoformis.
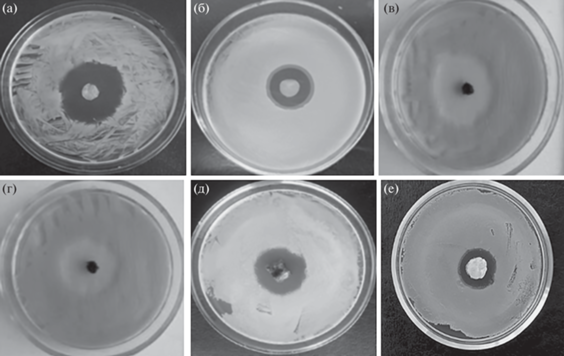
При исследовании антибактериальных свойств композитов БЦ, хитозана и ФК в виде гидрогелей выявлено, что они также обладают высокой активностью в отношении грамположительных бактерий S. aureus и B. licheniformis. Диаметр зон отсутствия роста S. aureus составил 32 ± 2 мм, B. licheniformis – 23 ± 2 мм (рис. 6в, 6г).
При исследовании антибактериальных свойств композитов БЦ, хитозана и ФК в виде аэрогелей выявили, что диаметр зон отсутствия роста тест-микроорганизмов немного меньше и составляет 25 ± 2 мм для S. aureus (рис. 6д) и 18 ± 2 мм для B. licheniformis (рис. 6е), что, вероятно, связано с пористой структурой материала.
Поэтому в целях дополнительного определения антибактериальной активности и скорости высвобождения лекарственного препарата у различных форм композитов использовали метод определения КОЕ тест-микроорганизма после инкубирования с исследуемым материалом (табл. 1).
Таблица 1.
Количество жизнеспособных клеток (КОЕ/мл) и снижение жизнеспособности клеток микроорганизмов (%) при динамическом контакте с композитами
| Исследуемый материал | Время выдержки, ч | Тест-культура S. aureus | |
|---|---|---|---|
| Снижение жизнеспособности клеток, % | КОЕ/мл | ||
| Аэрогель БЦ : хитозан : ФК | 0 | 0 | 183 × 106 |
| 1 | 2.8 | 178 × 106 | |
| 3 | 18.9 | 148 × 106 | |
| 8 | 23.8 | 139 × 106 | |
| 24 | 47.7 | 96 × 106 | |
| Гидрогель БЦ : хитозан : ФК | 0 | 0 | 126 × 106 |
| 1 | 34.0 | 83 × 106 | |
| 3 | 72.0 | 35 × 106 | |
| 8 | 88.8 | 14 × 106 | |
| 24 | 100 | 0 | |
| Пленка БЦ : ФК | 0 | 0 | 20 × 106 |
| 1 | 37.6 | 12 × 106 | |
| 3 | 85.9 | 3 × 106 | |
| 8 | 90.9 | 2 × 106 | |
| 24 | 100 | 0 | |
Согласно представленным данным при использовании композитов в форме пленки и гидрогелей снижение количества микроорганизмов происходит с большей скоростью по сравнению с аэрогелями, что, вероятно, связано со структурой материала и процессом диффузии антибиотика.
ЗАКЛЮЧЕНИЕ
Получены и исследованы биокомпозиты с антибактериальным действием на основе бактериальной целлюлозы, хитозана и фузидовой кислоты в виде пленок, гидрогелей и аэрогелей. Полученные композиты имеют высокую антибиотическую активность в отношении грамположительных бактерий Staphylococcus aureus и Bacillus lichenoformis и могут быть использованы как биоматериалы в тканевой инженерии и в качестве раневых покрытий с антибактериальными свойствами. Создавая биокомпозиты на основе БЦ и других биосовместимых полисахаридов, в частности хитозана, можно получать материалы с определенной структурой и свойствами, оказывая соответствующее влияние на скорость высвобождения лекарственного препарата или на рост клеток и развитие тканей в случае использования в тканевой инженерии и регенеративной медицине.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 19-515-80002) и Министерства науки и высшего образования РФ (грант FZRS-2020-0003).
Список литературы
Карпова С.Г., Ольхов А.А., Лобанов А.В. и др. // Российские нанотехнологии. 2019. Т. 14. № 3–4. С. 46. https://doi.org/10.21517/1992-7223-2019-3-4-46-58
Dubey K.A., Chaudhari C.V., Bhardwaj Y.K., Varshney L. // Adv. Struct. Mater. 2017. V. 66. P. 1. https://doi.org/10.1007/978-981-10-3328-5_1
Ревин В.В., Лияськина Е.В. Биотехнология бактериальных экзополисахаридов: учеб. пособие. Саранск: Изд-во Мордов. ун-та, 2019. 192 с.
Xue Y., Mou Z., Xiao H. // Nanoscale. 2017. V. 9. № 39. P. 14758. https://doi.org/10.1039/c7nr04994c
Revin V.V., Liyas’kina E.V., Sapunova N.B., Bogatyreva A.O. // Microbiology. 2020. V. 14. № 1. P. 86. https://doi.org/10.1134/S0026261720010130
Sharma C., Bhardwaj N.K. // Mater. Sci. Eng. C. 2019. V. 104. P. 109963. https://doi.org/10.1016/j.msec.2019.109963
Teixeira M.A., Paiva M.C., Amorim M.T.P., Felgueiras A.H.P. // Nanomaterials. 2020. V. 10 (3). P. E557. https://doi.org/10.3390/nano10030557
Luo H., Cha R., Li J. et al. // Carbohydr. Polym. 2019. V. 224. P. 115144. https://doi.org/10.1016/j.carbpol.2019.115144
Fahimirad S., Ajalloueian F. // Int. J. Pharm. 2019. V. 566. P. 307. https://doi.org/10.1016/j.ijpharm.2019.05.053
Ullah M.W., Rojas O.J., McCarthy R.R., Yang G. // Front. Bioeng. Biotechnol. 2021. V. 9. P. 738779. https://doi.org/10.3389/fbioe.2021.738779
Chen C., Xi Y., Weng Y. // Polymers. 2022. V. 14. P. 3335. https://doi.org/10.3390/polym14163335
Tsiklin I.L., Shabunin A.V., Kolsanov A.V. et al. // Polymers. 2022. V. 14. P. 3222. https://doi.org/10.3390/polym14153222
Kushwaha A., Goswami L., Kim B.S. // Nanomaterials. 2022. V. 12. P. 618. https://doi.org/10.3390/nano12040618
Niculescu A.G., Grumezescu A.M. // Polymers. 2022. V. 14. P. 421. https://doi.org/10.3390/polym14030421
Moradpoor H., Mohammadi H., Safaei M. et al. // Int. J. Polymer Sci. 2022. V. 1. P. 1. https://doi.org/10.1155/2022/1214734
Jankau J., Błażyńska-Spychalska A., Kubiak K. et al. // Front. Bioeng. Biotechnol. 2022. V. 9. P. 805053. https://doi.org/10.3389/fbioe.2021.805053
Pötzinger Y., Kralisch D., Fischer D. // Ther. Deliv. 2017. V. 8. P. 753. https://doi.org/10.4155/tde-2017-0059
Huo Y., Liu Y., Xia M. et al. // Polymers. 2022. V. 14. P. 2648. https://doi.org/10.3390/polym14132648
Das S., Ghosh B., Sarkar K. // Sens. Int. 2022. V. 3. P. 100135. https://doi.org/10.1016/j.sintl.2021.100135
Mensah A., Chen Ya, Christopher N. et al. // Bioengineering. Basel. 2022. V. 9 (1). P. 3. https://doi.org/10.3390/bioengineering9010003
Baker S., Prudnikova S.V., Shumilova A.A. et al. // J. Microbiol. Meth. 2019. V. 159. P. 42. https://doi.org/10.1016/j.mimet.2019.02.009
Ma B., Huang Y., Zhu C. et al. // Mater. Sci. Eng. C. 2016. V. 62. P. 656. https://doi.org/10.1016/j.msec.2016.02.011
Jebel F.S., Almasi H. // Carbohydr. Polym. 2016. V. 149. P. 8. https://doi.org/10.1016/j.carbpol.2016.04.089
Luo Z., Liu J., Lin H. et al. // Int. J. Nanomed. 2020. V. 15. P. 1. https://doi.org/10.2147/IJN.S231556
Volova T.G., Prudnikova S.V., Kiselev E.G. et al. // Nanomaterials. 2022. V. 12. P. 192. https://doi.org/10.3390/nano12020192
Shao W., Liu H., Wang S. et al. // Carbohydr. Polym. 2016. V. 145. P. 114. https://doi.org/10.1016/j.carbpol.2016.02.065
Ye S., Jiang L., Wu J. // ACS Appl. Mater. Interfaces. 2018. V. 10. P. 5862. https://doi.org/10.1021/acsami.7b16680
Громовых Т.И., Садыкова В.С., Луценко С.В. и др. // Прикл. биохим. микробиол. 2017. Т. 53. № 1. С. 69. https://doi.org/10.7868/S0555109917010093
Volova T.G., Shumilova A.A., Shidlovskiy I.P. et al. // Polymer Testing. 2018. V. 65. P. 54. https://doi.org/10.1007/s00253-018-9198-8
Ullah H., Wahid F., Santos H.A., Khan T. // Carbohydr. Polym. 2016. V. 150. P. 330. https://doi.org/10.1016/j.carbpol.2016.05.029
Rajwade J.M., Paknikar K.M., Kumbhar J.V. // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 2491. https://doi.org/10.1007/s00253-015-6426-3
Zang P., Chen L., Zhang Q., Hong F.F. // Front. Microbiol. 2016. V. 7. P. 260. https://doi.org/10.3389/fmicb.2016.00260
Cacicedo M.L., Pacheco G., Islan G.A. et al. // Int. J. Biol. Macromol. 2020. V. 147. P. 1136. https://doi.org/10.1016/j.ijbiomac.2019.10.082
Shao W., Liua H., Liub X. et al. // Carbohydr. Polym. 2015. V. 132. P. 351. https://doi.org/10.1016/j.carbpol.2015.06.057
Sulaeva I., Hettegger H., Bergen A. et al. // Mater. Sci. Eng. C. 2020. V. 110. P. 110619. https://doi.org/10.1016/j.msec.2019.110619
Kravanja G., Primožič M., Knez Z., Leitgeb M. // Molecules. 2019. V. 24. P. 1960. https://doi.org/10.3390/molecules24101960
Curbete M.M., Salgado H.R. // Crit. Rev. Anal. Chem. 2016. V. 46. № 4. P. 352. https://doi.org/10.1080/10408347.2015.1084225
Revin V.V., Nazarova N.B., Tsareva E.E. et al. // Front. Bioeng. Biotechnol. 2020. V. 8. P. 603407. https://doi.org/10.3389/fbioe.2020.603407
Liyaskina E., Revin V., Paramonova E. et al. // J. Phys.: Conf. Ser. 2017. V. 784. P. 012034. https://doi.org/10.1088/1742-6596/784/1/012034
Fernandes P. // Cold Spring Harb. Perspect. Med. 2016. V. 6. P. a025437. https://doi.org/10.1101/cshperspect.a025437
Casaburi A., Rojo U.M., Cerrutti P. et al. // Food Hydr. 2017. V. 75. P. 147. https://doi.org/10.1016/j.foodhyd.2017.09.002
Wahid F., Hu X.H., Chu L.Q. et al. // Int. J. Biol. Macromol. 2018. V. 122. P. 63. https://doi.org/10.1016/j.ijbiomac.2018.10.105
Xun X., Li Y., Zhu X. et al. // Macromol. Biosci. 2021. V. 21. № 11. P. 2100167. https://doi.org/10.1002/mabi.202100167
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии