Российские нанотехнологии, 2023, T. 18, № 2, стр. 253-259
Микроэмульсии в системах с лецитином и олеиновой кислотой для медицинского применения
Н. М. Мурашова 1, *, Е. С. Трофимова 1, Л. А. Гагуева 1
1 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: namur_home@mail.ru
Поступила в редакцию 09.06.2022
После доработки 15.10.2022
Принята к публикации 15.10.2022
Аннотация
Разработаны обратные микроэмульсии для применения в медицине и косметике в системах, содержащих лецитин (смесь фосфолипидов с содержанием лецитина ~22 мас. %), олеиновую кислоту, вазелиновое масло, растительное масло, эфирное масло (в количестве менее 5 мас. %) и воду. Гидродинамический диаметр капель микроэмульсий лежит в диапазоне от 15 до 80 нм. Микроэмульсии стабильны при нагревании до температуры 45°С: потеря массы составляет менее 1%, наблюдается отсутствие фазовых переходов и химических реакций, сопровождающихся поглощением или выделением тепла. Микроэмульсии обладают замедленным высвобождением водорастворимых веществ: за 7 ч диализа из микроэмульсии выделилось 3.6% водорастворимого красителя Родамина С.
ВВЕДЕНИЕ
В медицине одной из актуальных задач является разработка носителей для адресной доставки лекарственных веществ. Перспективными носителями являются самоорганизующиеся структуры в системах вода–масло–поверхностно-активные вещества (ПАВ), такие как мицеллы, микроэмульсии и лиотропные жидкие кристаллы. Микроэмульсии – термодинамически устойчивые изотропные дисперсии масла и воды, содержащие капли наноразмера, стабилизированные одним или несколькими ПАВ. На основе микроэмульсий можно создавать препараты, предназначенные для перорального приема и для нанесения на кожу и слизистые оболочки [1–5]. Для получения микроэмульсий можно использовать ПАВ природного происхождения – лецитин в сочетании с другими поверхностно-активными веществами (соПАВ). Микроэмульсии лецитина обладают такими достоинствами, как биосовместимость, возможность солюбилизации биологически активных веществ с сохранением их активности, способность ускорять транспорт через кожу, возможность включения как водо-, так и маслорастворимых лекарственных веществ [6–11]. Микроэмульсии на основе лецитина можно применять, например, для создания ранозаживляющих средств, содержащих белково-пептидный экстракт из иммунокомпетентых органов свиньи [12].
Для разработки микроэмульсий лецитина в качестве нетоксичного биосовместимого соПАВ предложена олеиновая кислота. Было показано, что при соотношении молярных концентраций олеиновой кислоты и лецитина Сол/Слец > 0.6 в системе лецитин–олеиновая кислота–додекан–вода существует обратная микроэмульсия с размером капель в единицы нанометров, определена область ее существования при Сол/Слец = 0.8 [13]. В составе носителей для трансдермальной доставки лекарственных веществ олеиновая кислота может играть роль “энхансера” – вещества, усиливающего проницаемость кожи [14]. Например, олеиновую кислоту в небольших количествах (массовое соотношение лецитин:олеиновая кислота равно 19:1) вводили в состав микроэмульсии в системе лецитин–н-бутанол–триглицериды (масло Migliol 812 N)–вода для улучшения проницаемости кожи при трансдермальном введении кетопрофена [6].
Для того чтобы разработать состав микроэмульсии для широкого применения в медицине и косметике, нужно заменить дорогой высокоочищенный лецитин на более дешевый фосфолипидный концентрат и заменить додекан на масла, пригодные для медицинского применения.
Цель исследования – разработка микроэмульсий в системах с лецитином и олеиновой кислотой, содержащих лецитин (фосфолипидный концентрат) и различные масла, предназначенные для нанесения на кожу.
МЕТОДЫ
Для разработки состава микроэмульсии выбраны соевый лецитин производства “Acros Organics”, общее содержание фосфолипидов – 97.7 мас. %, в том числе 22 мас. % лецитина, и пищевая добавка соевый лецитин “Мослецитин”, содержание фосфолипидов – не менее 97 мас. %, в том числе 22 мас. % лецитина (“Витапром”, Россия). Использовали олеиновую кислоту квалификации “ч” (“Химмед”, Россия), медицинское вазелиновое масло (ОАО “Казанская фармацевтическая фабрика”, Россия), масло авокадо (Persea gratissima), арганы (Argania spinosa), жожоба (Simmondsia chinensis) и масло из косточек винограда (Vitis vinifera), а также эфирные масла: чайного дерева (Melaleuca alternifolia), лаванды (Lavandula latifolia) и розовое масло (Rosa damascena Mill) (ООО “Ботаника”, Россия). Бидистиллированная вода получена стандартным методом.
Для получения микроэмульсии навеску лецитина растворяли в смеси масел вазелинового и авокадо при температуре 40°С и механическом перемешивании в течение 1–1.5 ч в закрытом сосуде. Затем образец охлаждали до комнатной температуры, добавляли олеиновую кислоту и масло чайного дерева. В полученный органический раствор вводили необходимое количество воды. Солюбилизацию воды проводили под действием ультразвука (УЗ) с частотой 22 кГц и мощностью 26.2 Вт (для образца объемом 20 мл) в течение 1 мин, затем образец охлаждали до комнатной температуры. УЗ-обработку проводили 3–4 раза до полной солюбилизации воды. Гомогенность образца, отсутствие капель воды и частиц жидкокристаллической фазы контролировали с помощью поляризационного оптического микроскопа “Axiostar plus” (Zeiss, Германия) при комнатной температуре.
Максимальное содержание воды в образцах микроэмульсий, выраженное в виде отношения молярных концентраций воды и лецитина Wкр = $C_{{{\text{воды}}}}^{{{\text{max}}}}$/Cлец, определяли путем внесения порций воды в образец с шагом ΔW = 0.5.
Гидродинамический диаметр капель микроэмульсии определяли методом динамического рассеяния света (ДРС) с помощью анализатора размера частиц Zetasizer Nano ZS (Malvern, Великобритания). Каждое измерение проводили не менее 3 раз, расчет распределения по размеру проводили относительно числа частиц с использованием программного обеспечения прибора. Перед измерением образец термостатировали в течение 10 мин.
Дифференциальную сканирующую калориметрию (ДСК) и термогравиметрический (ТГ) анализ образцов проводили параллельно на синхронном термическом анализаторе STA 449 F5 Jupiter (“Netzsch – Geratebau GmbH”, Германия). Образцы нагревали от 25 до 130°C при скорости нагрева 1 К/мин. Результаты обрабатывали с помощью программного обеспечения прибора.
Обратную эмульсию получали путем растворения лецитина и олеиновой кислоты в смеси масел и последующего перемешивания с водой под действием УЗ с частотой 22 кГц и мощностью 26.2 Вт (УЗ-диспергатор УЗГ 13-0.1/22) в течение 30 с с последующим охлаждением до комнатной температуры. УЗ-воздействие проводили 7 раз до получения однородного образца. Полученная эмульсия не расслаивалась в течение минимум 140 дней.
Изучение кинетики высвобождения водорастворимых веществ из микроэмульсии и эмульсии проводили методом диализа на модели водорастворимого красителя Родамина С. Навеску красителя вносили в готовые образцы, концентрация красителя в них составляла 0.2 мас. %. Для диализа применяли регенерированную целлюлозную трубчатую мембрану Cellu·Sep (MFPI, США) с размером пор 3.5 кДа. Размер диализного мешка составлял 4.6 × 3.9 см, масса образца, помещенного в диализный мешок, была равна 5.0 г, объем физиологического раствора, в который переносили краситель – 1000 мл. Диализ проводили при температуре 37°С и постоянном механическом перемешивании принимающего раствора со скоростью 120 об./мин. Определение концентрации Родамина С в принимающем растворе проводили с помощью спектрофотометра Cary 50 (Varian, США) при длине волны 553 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены зависимости Wкр = = $C_{{{\text{воды}}}}^{{{\text{max}}}}$/Cлец от мольных соотношений олеиновой кислоты и лецитина для образцов микроэмульсий. Показано, что замена высокоочищенного лецитина (Lipoid S100, 96 мас. % лецитина) на смесь фосфолипидов (Acros Organics, 22 мас. % лецитина) приводит к снижению максимального содержания воды в микроэмульсии ($W_{{{\text{кр}}}}^{{{\text{max}}}}$) от 38 до 19 (4.4 мас. % воды), при этом положение $W_{{{\text{кр}}}}^{{{\text{max}}}}$ сдвигается в сторону меньшей концентрации олеиновой кислоты – от Сол./Слец = 0.9 до 0.6 (рис. 1, кривые 1, 2). Полученные данные подтверждают возможность применения лецитина с низкой степенью очистки (фосфолипидного концентрата, содержащего 22 мас. % лецитина) для получения микроэмульсий.
Рис. 1.
Зависимость Wкр от мольного соотношения олеиновой кислоты и лецитина для систем лецитин–олеиновая кислота–масло–вода. Лецитин 1 – “Lipoid S100” (96 мас. % лецитина), 2–6 – “Acros Organics” (22 мас. % лецитина). Масло 1, 2 – додекан, 3 – вазелиновое масло, 4 – смесь вазелинового масла и масла чайного дерева (4.5 мас. % в органической фазе), 5 – смесь масел вазелинового, авокадо (1:1 по массе) и эфирного масла чайного дерева (4.5 мас. % в органической фазе), 6 – вазелиновое масло и α-терпинеол (4.5 мас. % в органической фазе). Концентрация лецитина в органической фазе 10 мас. %. T = 25°C.
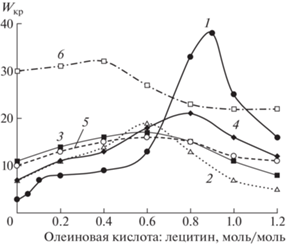
Для того чтобы подтвердить возможность замены в составе микроэмульсии додекана на биосовместимый растворитель, для системы лецитин–олеиновая кислота– масло–вода были определены величины Wкр при использовании таких масел, как вазелиновое, смесь вазелинового масла и эфирного масла чайного дерева, смесь вазелинового масла, авокадо и эфирного масла чайного дерева (рис. 1, кривые 3–5). Эфирные масла и содержащиеся в них терпены усиливают проникновение лекарственных веществ через кожу [14, 15], масло чайного дерева обладает дезинфицирующим действием [16]. Поскольку эфирные масла имеют сильный запах и при высоких концентрациях могут вызвать раздражение кожи, их концентрация в микроэмульсиях не превышала 5%.
Полученные кривые имеют схожий вид: при увеличении мольного соотношения Сол/Слец значения Wкр возрастают, проходят через максимум и затем снижаются, но положение этого максимума немного меняется. Максимальные значения Wкр составили для вазелинового масла – 17 (4.0 мас. % воды), для смеси вазелинового масла и эфирного масла чайного дерева 18 (5.2 мас. % воды), для смеси вазелинового масла, авокадо и эфирного масла чайного дерева 16 (3.7 мас. % воды). Полученные максимальные значения Wкр являются достаточными, чтобы рекомендовать изученные системы для разработки микроэмульсий для медицинского применения.
Отметим, что при полной замене додекана маслом авокадо микроэмульсия не образуется, максимальное значение Wкр составило 2.5, что соответствует обратным мицеллам. Для получения микроэмульсии в масле авокадо требуется, вероятно, присутствие в качестве соПАВ короткоцепочечного алифатического спирта в достаточно высокой концентрации. Например, описаны микроэмульсии в системах лецитин–н-пропанол–растительное масло–вода при массовом соотношении лецитин:н-пропанол, равном 1:1, для получения микроэмульсий использовали соевое, оливковое, рапсовое или подсолнечное масло [17–20]. Массовое соотношение н-пропанол:лецитин 1:1 соответствует мольному соотношению, равному 12.88:1, в то время как в настоящем исследовании соотношение соПАВ:лецитин не превышало 1.2:1.
Введение эфирного масла чайного дерева в систему с вазелиновым маслом приводит к повышению $W_{{{\text{кр}}}}^{{{\text{max}}}}$, при этом положение $W_{{{\text{кр}}}}^{{{\text{max}}}}$ немного сдвигается: от Сол/Слец = 0.6 до 0.8 (рис. 1, кривые 3, 4). Можно предположить, что эфирное масло чайного дерева играет роль еще одного соПАВ, способствующего образованию обратной микроэмульсии, так как имеет в своем составе монотерпеновые спирты, например терпинен-4-ол, 1,8-цинеол, a-терпинеол и др. [16]. Молекулы указанных спиртов имеют изогнутый или циклический углеводородный “хвост”, что приводит к увеличению гибкости монослоя ПАВ и изменению спонтанной кривизны монослоя в сторону отрицательных значений. Это способствует образованию капель обратных микроэмульсий.
Предположение о том, что монотерпеновые спирты, входящие в состав масла чайного дерева, играют роль соПАВ, было проверено на примере α-терпинеола (рис. 1, кривая 6). При введении в микроэмульсию α-терпинеола максимальное значение Wкр выше, чем при введении эфирного масла чайного дерева, и смещено в сторону меньших соотношений Сол/Слец. Аналогичное действие на микроэмульсию было показано для гераниола. В системе октил моноголюкозид–гераниол–циклогексан–вода гераниол встраивается в межфазный слой и изменяет спонтанную кривизну монослоя октил моноголюкозида с положительных значений в сторону отрицательных, способствуя образованию обратной микроэмульсии [21]. Расположение молекул олеиновой кислоты и монотерпеновых спиртов на границе масло–вода в обратной микроэмульсии лецитина в виде схемы показано на рис. 2.
Рис. 2.
Схема строения капли обратной микроэмульсии в системе лецитин–олеиновая кислота–монотерпеновые спирты–масло–вода.

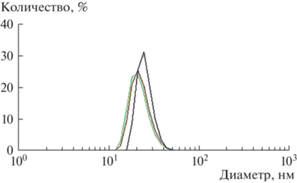
С помощью метода ДРС было изучено влияние различных масел на размер капель обратных микроэмульсий в системе лецитин–олеиновая кислота–масло–вода. Для всех образцов микроэмульсий наблюдались значения гидродинамического диаметра, лежащие в области менее 100 нм, капли микронного размера отсутствовали. В качестве примера на рис. 3 приведены результаты трех повторных экспериментов по анализу гидродинамического диаметра капель для образца микроэмульсии в системе лецитин–олеиновая кислота–вазелиновое масло–масло авокадо–масло чайного дерева–вода. Полученные кривые (рис. 3) практически сливаются, что свидетельствует о хорошей воспроизводимости результатов.
Рис. 3.
Гидродинамический диаметр капель обратной микроэмульсии (три повторных эксперимента). Состав образца, мас. %: лецитин (“Acros Organics”) – 9.7, олеиновая кислота – 2.1, вазелиновое масло – 40.4, масло авокадо – 40.4, масло чайного дерева – 4.4, вода – 3.0. Т = 25°С.
Замена додекана на вазелиновое масло или смесь масел привела к увеличению гидродинамического диаметра капель от 7 до 21–28 нм (табл. 1). Размер капель в единицы и десятки нанометров является характерным для обратных микроэмульсий [22]. Например, для обратной микроэмульсии, содержащей 23.30 мас. % лецитина, 11.67 мас. % этанола, 52.45 мас. % изопропилмиристата и 12.58 мас. % воды, гидродинамический диаметр составлял ~57 нм [10].
Таблица 1.
Гидродинамический диаметр капель обратных микроэмульсий
| Образец | Состав микроэмульсии, мас. % | Гидродинамический диаметр, нм |
|---|---|---|
| 1 | Додекан – 85.2, лецитин – 9.7, ОК – 2.1, вода – 3.0 | 7.0 ± 0.5 |
| 2 | ВМ – 85.2, лецитин – 9.7, ОК –2.1, вода – 3.0 | 28 ± 4 |
| 3 | ВМ – 80.8, МЧД – 4.4, лецитин – 9.7, ОК – 2.1, вода – 3.0 | 21.5 ± 1.5 |
| 4 | ВМ – 40.4, масло авокадо – 40.4, МЧД – 4.4, лецитин – 9.7, ОК – 2.1, вода – 3.0 | 21.5 ± 1.5 |
| 5 | ВМ – 32.5, масло арганы – 32.5, лецитин – 19.0, ОК – 6.6, МЧД – 4.3, вода – 5.1 | 24 ± 0.8 |
| 6 | ВМ – 32.0, масло авокадо – 16.0, масло из косточек винограда – 16.0, лецитин – 18.8, ОК – 6.5, масло лаванды – 4.2, вода – 6.5 | 40 ± 1.4 |
| 7 | ВМ – 32.5, масло жожоба – 32.5, лецитин – 19.0, ОК – 6.6, розовое масло – 2.15, масло лаванды – 2.15, вода – 5.1 | 79 ± 3 |
| 8 | ВМ – 32.9, масло авокадо – 32.9, лецитин – 19.3, ОК – 6.8, МЧД – 4.2, вода – 4.0 | |
| – исходная микроэмульсия | 15.0 ± 0.6 | |
| – после нагревания до 80°С и охлаждения до 25°С | 24.4 ± 0.6 | |
| – после замораживания (–20°С) и оттаивания | 18.7 ± 0.7 |
Таким образом, для разработки микроэмульсий для медицины в системах с лецитином и олеиновой кислотой можно использовать фосфолипидный концентрат с содержанием лецитина ~22 мас. %, вазелиновое масло, смесь вазелинового масла и эфирного масла чайного дерева и смесь нескольких масел: вазелинового, растительного и эфирного. Для примера были получены образцы микроэмульсий в системах с различными растительными и эфирными маслами (табл. 1), в зависимости от использованных масел гидродинамический диаметр капель микроэмульсий менялся от 15 до 79 нм.
Чтобы доказать, что предложенная система является термодинамически стабильной микроэмульсией, был определен гидродинамический диаметр капель образца после его нагревания до 80°С и охлаждения до 25°С, а также после замораживания и оттаивания (табл. 1). После нагревания до 80°С и охлаждения до 25°С размер капель менялся незначительно: от 15 до ~25 нм. Это может быть связано с частичным окислением компонентов микроэмульсии; при нагревании до 80°С наблюдалось незначительное потемнение образца. После замораживания при –20°С и последующего оттаивания структура микроэмульсии восстанавливалась, размер капель практически не менялся. Такое поведение отличает полученную микроэмульсию от традиционных эмульсий, в том числе наноэмульсий (эмульсий с размером капель менее 100 нм). Размер капель наноэмульсий после нагревания–охлаждения и замораживания–оттаивания не восстанавливается до исходных значений.
Для применения в качестве носителя биологически активных веществ (БАВ) микроэмульсия должна быть стабильной в диапазоне температур 25–45°С, она должна быть устойчивой при температуре человеческого тела и транспортабельной без специальных охладительных установок в жаркую погоду. Для того чтобы подтвердить температурную стабильность и отсутствие фазовых переходов при нагревании, был проведен синхронный термический анализ (ДСК и ТГ) разработанной микроэмульсии. Результаты представлены на рис. 4.
Рис. 4.
Кривые ДСК и ТГ образца микроэмульсии. Состав образца, мас. %: лецитин (“Мослецитин”) – 19.3, вазелиновое масло – 32.9, масло авокадо – 32.9, олеиновая кислота – 6.8, масло чайного дерева – 4.2, вода – 4.0.
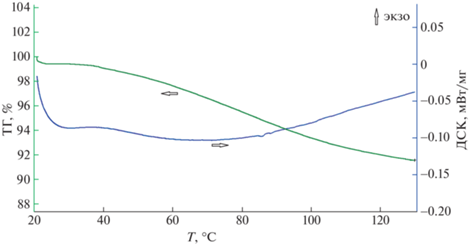
Как видно из рис. 4, при нагревании образца микроэмульсии от комнатной температуры до 130°С фазовые переходы и химические реакции, сопровождающиеся поглощением или выделением тепла, отсутствуют. При нагревании до 45°С происходит потеря массы менее 1%. Плавная потеря массы образца, наблюдающаяся при повышении температуры до 130°С, составляет ~8.4 мас. %. Это изменение объясняется испарением воды (4 мас. %) и компонентов эфирного масла чайного дерева. При температуре 45°С гидродинамический диаметр капель микроэмульсии составлял 18.5 ± 0.6 нм. Таким образом, разработанная микроэмульсия стабильна в интервале температур 25–45°С, что позволяет использовать ее в медицине и косметике.
Методом диализа было изучено высвобождение водорастворимых БАВ из разработанной микроэмульсии в сравнении с эмульсией с похожим составом. Исследование проводили на модели водорастворимого красителя Родамина С, его концентрация в образцах составляла 0.2 мас. %, принимающая среда – физиологический раствор.
Микроэмульсия и эмульсия имели одинаковый состав органической фазы (мас. %): лецитин (“Acros Organics”) – 20.0, олеиновая кислота – 7.0, вазелиновое масло – 34.3, масло авокадо – 34.3, масло чайного дерева – 4.4. В микроэмульсии воды было 4.8 мас. %, в эмульсии – 20.0 мас. %. Средний гидродинамический диаметр капель при Т = 25°С для микроэмульсии составил 43 ± 7 нм, для эмульсии – 3.4 ± 0.2 мкм. Перед измерением гидродинамического диаметра эмульсию разбавляли в 10 раз смесью масел.
Результаты экспериментов по высвобождению красителя представлены на рис. 5. Зависимости процента выделившегося красителя от времени имеют линейный характер. Это может объясняться малым количеством (не более 3.5%) выделившегося вещества, т.е. были получены только начальные участки кинетических кривых. Проводить эксперименты продолжительностью несколько суток было нецелесообразно, поскольку при длительном поступлении воды из принимающей среды в микроэмульсию возможно ее разрушение. Была рассчитана скорость переноса вещества по формуле
где m – масса выделившегося вещества, t – промежуток времени, S – площадь поверхности, через которую идет диализ.Рис. 5.
Высвобождение красителя Родамина С (процент выделившегося вещества) в физиологический раствор из микроэмульсии (1) и эмульсии (2). Т = = 37°С.

Скорость высвобождения красителя из обратной микроэмульсии составляла 14.3 × 10–3 г/(м2 ч), из обратной эмульсии – 9.9 × 10–3 г/(м2 ч). Эти результаты сопоставимы с полученными ранее данными по скоростям переноса Родамина С из аналогичной обратной микроэмульсии и из жидких кристаллов в системе лецитин–масло авокадо–масло чайного дерева–вода [23].
Несмотря на то что эмульсия содержит 20 мас. % воды, а микроэмульсия – 4.8, из наноструктурированной системы высвобождение идет примерно в 1.5 раза быстрее, чем из микроструктурированной. Это можно считать проявлением размерного эффекта. В обратной микроэмульсии и обратной эмульсии диффузия водорастворимого красителя будет происходить за счет столкновения и слияния капель. Микроэмульсии являются динамичными системами, в которых происходит интенсивное движение наноразмерных капель, их столкновение и обмен содержимым, в то время как эмульсии являются относительно статичными системами. Поэтому диффузия водорастворимого красителя, локализованного в каплях обратной микроэмульсии, будет происходить с более высокой скоростью, чем красителя в каплях эмульсии, и перенос красителя из объема образца к диализной мембране для микроэмульсии будет быстрее, чем для эмульсии.
За 7 ч диализа из эмульсии выделилось 2.1%, из микроэмульсии – 3.6% Родамина С. Такие низкие значения скорости высвобождения водорастворимых веществ характерны для обратных микроэмульсий. Например, показано, что что за 7 ч диализа из обратной микроэмульсии, содержащей 36 мас. % вазелинового масла, 54 мас. % смеси полиглицерил полирицинолеат:Tween 80 и 10 мас. % водной фазы, выделился ~1% доксорубицина [24]. Из обратной микроэмульсии в системе Span 80–Tween 80–пропиленгликоль–этанол–изопропилмиристат–2 мас. %-ный водный раствор БАВ за 7 ч диализа в принимающую среду переносится ~1.5% гиалуроновой кислоты и 2.3% коллагена [25].
Полученные результаты позволяют рекомендовать разработанные обратные микроэмульсии в системах лецитин (смесь фосфолипидов с содержанием лецитина ~22 мас. %)–олеиновая кислота–вазелиновое масло–растительное масло–эфирное масло–вода для создания препаратов c замедленным высвобождением БАВ, обладающих пролонгированным действием.
ЗАКЛЮЧЕНИЕ
В качестве носителей БАВ для медицины и косметики предложены обратные микроэмульсии в системах, содержащих лецитин (фосфолипидный концентрат), олеиновую кислоту и различные масла, предназначенные для нанесения на кожу. Показано, что для разработки таких микроэмульсий можно использовать фосфолипидный концентрат с содержанием лецитина ~22 мас. %, вазелиновое масло, смесь вазелинового масла и эфирного масла чайного дерева и комбинацию нескольких масел: вазелинового, растительного и эфирного (в количестве менее 5 мас. %). Для всех изученных микроэмульсий в системах лецитин–олеиновая кислота–смесь масел–вода наблюдались значения гидродинамического диаметра капель, лежащие в диапазоне от 15 до 80 нм. После нагревания до 80°С и охлаждения до 25°С размер капель микроэмульсии менялся незначительно, после замораживания при –20°С и последующего оттаивания – практически не изменялся, что свидетельствует о термодинамической стабильности изученной системы. При повышении температуры от комнатной до 130°С фазовые переходы и химические реакции, сопровождающиеся поглощением или выделением тепла, отсутствуют; при нагревании до 45°С происходит потеря массы менее 1% за счет испарения компонентов. Показано, что из наноструктурированной системы (обратной микроэмульсии с содержанием воды 4.8 мас. %) высвобождение водорастворимого красителя Родамина С идет примерно в 1.5 раза быстрее, чем из микроструктурированной (обратной эмульсии с содержанием воды 20 мас. %). Микроэмульсии обладают замедленным высвобождением водорастворимых веществ: за 7 ч диализа из микроэмульсии выделилось 3.6% водорастворимого красителя Родамина С.
Предложенные микроэмульсии, предназначенные для нанесения на кожу и слизистые оболочки, перспективны для создания ранозаживляющих, антимикробных и противогрибковых композиций. Они могут содержать комбинацию эфирных масел, обладающих антисептическим, регенерирующим и противовоспалительным действием, с водорастворимыми иммуностимулирующими, противомикробными и противогрибковыми средствами, в том числе с антибиотиками.
Список литературы
Fanun M. // Curr. Opin. Colloid In. 2012. V. 17. № 5. P. 306. https://doi.org/10.1016/j.cocis.2012.06.001
Lawrence M.J., Rees G.D. // Adv. Drug. Deliver Rev. 2012. V. 64. P. 175. https://doi.org/10.1016/j.addr.2012.09.018
Callender S.P., Mathews J.A., Kobernyk K., Wettig S.D. // Int. J. Pharm. 2017. V. 526. № 1–2. P. 425. https://doi.org/10.1016/j.ijpharm.2017.05.005
Shukla T., Upmanyu N., Agrawal M. et al. // Biomed. Pharmacother. 2018. V. 108. P. 1477. https://doi.org/10.1016/j.biopha.2018.10.021
Alves L.P., da Silva Oliveira K., da Paixao Santos J.A. et al. // J. Drug. Deliv. Sci. Tec. 2020. V. 60. P. 102008. https://doi.org/10.1016/j.jddst.2020.102008
Paolino D., Ventura C.A., Nistico S. et al. // Int. J. Pharm. 2002. V. 244. № 1–2. P. 21.
Changez M., Varshney M., Chander J., Dinda A.M. // Colloids Surf. B. 2006. V. 50. № 1. P. 18. https://doi.org/10.1016/j.colsurfb.2006.03.018
Yuan J.S., Ansari M., Samaan M., Acosta E.M. // Int. J. Pharm. 2008. V. 349. № 1–2. P. 130. https://doi.org/10.1016/j.ijpharm.2007.07.047
Das A., Mitra R.K. // Colloid Polym. Sci. 2014. V. 292. № 3. P. 635. https://doi.org/10.1007/s00396-013-3110-y
Xu M., Yu Q., Zhao Q. et al. // Drug. Dev. Ind. Pharm. 2016. V. 42. № 2. P. 280. https://doi.org/10.3109/03639045.2015.1047849
Savic V., Todosijevic M., Ilic T. et al. // Int. J. Pharm. 2017. V. 529. № 1–2. P. 491. https://doi.org/10.1016/j.ijpharm.2017.07.036
Basov A., Fedulova L., Vasilevskaya E. et al. // Saudi J. Biol. Sci. 2021. V. 28. № 3. P. 1826. https://doi.org/10.1016/j.sjbs.2020.12.028
Murashova N.M., Prokopova L.A., Trofimova E.S., Yurtov E.V. // J. Surfactants Deterg. 2018. V. 21. № 5. P. 635. https://doi.org/10.1002/jsde.12170
Кузнецова Е.Г., Рыжикова В.А., Саломатина Л.А., Севастьянов В.И. // Вестник трансплантологии и искусственных органов. 2016. Т. 18. № 2. С. 152. https://doi.org/10.15825/1995-1191-2016-2-152-162
Herman A., Herman A.P. // J. Pharm. Pharmacol. 2015. V. 67. № 4. P. 473. https://doi.org/10.1111/jphp.12334
Lam N.S., Long X., Su X., Lu F. // Biomed. Pharmacother. 2020. V. 130. P. 110624. https://doi.org/10.1016/j.biopha.2020.110624
Aboofazeli R., Patel N., Thomas M., Lawrence M.J. // Int. J. Pharm. 1995. V. 125. № 1. P. 107.
Abbasi S., Radi M. // Food Chem. 2016. V. 194. P. 972. https://doi.org/10.1016/j.foodchem.2015.08.078
Amiri-Rigi A., Abbasi S. // Food Chem. 2019. V. 272. P. 568. https://doi.org/10.1016/j.foodchem.2018.08.080
Jalali-Jivan M., Abbasi S. // Innov. Food Sci. Emerg. 2020. V. 66. P. 102505. https://doi.org/10.1016/j.ifset.2020.102505
Stubenrauch C., Paeplow B., Findenegg G.H. // Langmuir. 1997. V. 13. № 14. P. 3652.
Мурашова Н.М., Полякова А.С., Юртов Е.В. // Коллоидный журнал. 2018. Т. 80. № 5. С. 541. https://doi.org/10.1134/S1061933X18050101
Мурашова Н.М., Трофимова Е.С., Костюченко М.Ю. и др. // Российские нанотехнологии. 2019. Т. 14. № 1–2. С. 69. https://doi.org/10.1134/S1995078019010075
Sedyakina N.E., Krivoshchepov A.F., Zasypko A.Ya. et al. // Mendeleev Commun. 2019. V. 29. № 3. P. 320. https://doi.org/10.1016/j.mencom.2019.05.027
Szumala P., Jungnickel C., Kozlowska-Tylingo K. et al. // Int. J. Pharm. 2019. V. 572. P. 118738. https://doi.org/10.1016/j.ijpharm.2019.118738
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


