Российские нанотехнологии, 2023, T. 18, № 2, стр. 260-267
Исследование и сравнительная оценка токсичности наночастиц оксида молибдена(VI) при многократной ингаляционной экспозиции крыс
Н. В. Зайцева 1, М. А. Землянова 1, 2, 3, *, М. С. Степанков 1, А. М. Игнатова 1, 4, А. Е. Николаева 1, О. В. Пустовалова 1
1 Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения
Пермь, Россия
2 Пермский государственный национальный исследовательский университет
Пермь, Россия
3 Пермский национальный исследовательский политехнический университет
Пермь, Россия
4 Институт механики сплошных сред УрО РАН
Пермь, Россия
* E-mail: zem@fcrisk.ru
Поступила в редакцию 16.02.2022
После доработки 27.05.2022
Принята к публикации 08.06.2022
Аннотация
Наночастицы оксида молибдена(VI) (НЧ МоО3) при многократной ингаляционной экспозиции накапливаются преимущественно в сердце, легких, почках, головном мозге и крови крыс. Воздействие тестируемых материалов приводит к развитию патоморфологических изменений тканей легких, головного мозга и печени, что, предположительно, вызывает нарушение их функций и приводит к изменению биохимических параметров крови и поведенческих реакций. НЧ МоО3 обладают более выраженной степенью бионакопления и токсическим действием в сравнении с микроразмерным аналогом. Результаты исследования позволяют расширить теоретические представления и получить новые знания в области нанотоксикологии об особенностях токсического действия наноразмерных оксидсодержащих материалов при различных уровнях воздействия и способах поступления в организм.
ВВЕДЕНИЕ
В настоящее время расширяется рынок наноматериалов и продукции, произведенной с их применением и/или в состав которой они входят. Значительная востребованность наноразмерных материалов обусловлена уникальными, отличающими их от материалов микронной размерности, физико-химическими свойствами, связанными с малыми размерами, большой удельной площадью поверхности, высокой реакционной способностью частиц. Однако благодаря данным свойствам наноматериалы способны эффективно проникать через защитные барьеры организма, накапливаться в органах и тканях, вызывая различные нарушения на клеточно-молекулярном уровне, что в дальнейшем может приводить к развитию патологических изменений морфологии и функций органов и тканей [1, 2].
Примером такого наноматериала являются наночастицы оксида молибдена(VI) (НЧ МоО3), применяющиеся в оптических приборах, электрохимических конденсаторах, пластике, текстиле, покрытиях и смазочных материалах [3, 4]. В перспективе рассматривается возможность применения НЧ МоО3 в газовых сенсорах, процессах переработки сырой нефти [4] и в составе анодов литий-ионных батарей [5].
По результатам ранее проведенных исследований установлено, что НЧ МоО3 при проникновении в клетку продуцируют активные формы кислорода (АФК) [6], разрушают мембраны митохондрий [6], вызывают экспрессию генов, инициирующих синтез провоспалительных цитокинов [7], изменяют протеомный [8] и метаболомный профили [9], что, вероятно, является основой развивающихся патоморфологических изменений тканей органов [10, 11]. Стоит отметить недостаточность информации, представленной в научной литературе о токсических эффектах НЧ МоО3in vivo.
Принимая во внимание широкий спектр применения в различных отраслях хозяйственной деятельности человека, имеющиеся сведения о токсичности и недостаточную проработку вопроса о негативных эффектах НЧ МоО3in vivo в научной литературе, исследования, направленные на изучение токсических свойств данного наноматериала при различных путях поступления в организм, приобретают особую актуальность.
Цель данной работы – изучение и сравнительная оценка токсичности НЧ МоО3 при многократной ингаляционной экспозиции крыс.
МЕТОДЫ
В качестве тестируемого материала использовали коммерческий образец НЧ МоО3 в виде порошка (CAS 1313-27-5, номер продукта 775703) производства компании Sigma-Aldrich (США). Для сравнительного анализа использовали порошок микрочастиц оксида молибдена(VI) (МЧ МоО3) (CAS 1313-27-5, номер продукта 203815) производства той же компании.
Размер частиц в составе нативного порошка определяли методом растровой электронной микроскопии (РЭМ) на сканирующем микроскопе высокого разрешения S-3400N (HITACHI, Япония). Форму и коэффициент округлости частиц определяли методом анализа РЭМ-изображений с использованием универсального программного обеспечения ImageJ-FiJi. Исследование и оценка удельной площади поверхности частиц МоО3 выполнены методом Брунауэра, Эммета и Теллера на приборе ASAP 2020 (Micromeritics, США).
Исследование негативных эффектов тестируемых материалов осуществляли на 36 самках крыс линии Wistar средней массой 265 ± 11.82 г в соответствии с требованиями этического комитета ФНЦ медико-профилактических технологий управления рисками здоровью населения и Руководством по уходу и использованию лабораторных животных [12]. Экспериментальных животных случайным образом распределили на три группы по 12 особей: опытная группа – животные, получавшие ингаляционно аэрозоль водной суспензии НЧ МоO3; группа сравнения – животные, получавшие ингаляционно аэрозоль водной суспензии МЧ МоO3; контрольная группа – животные, содержавшиеся в аналогичных условиях, получавшие бидистиллированную воду без тестируемых веществ. Моделирование ингаляционного воздействия веществ на крыс осуществляли в ингаляционной системе с интегрированным программным обеспечением с использованием камеры для всего тела (TSE Systems GmbH, Германия). Для генерации аэрозолей использовали водные суспензии НЧ и МЧ МоО3 в концентрации 125 мг/см3. Экспозиции проводили ежедневно по 4 ч в течение 10 сут. Во время экспозиций корм животные не получали. Характеристика воздушных потоков в камере во время экспозиций: приток воздуха – 10 дм3/мин (концентрация кислорода не менее 19%, углекислого газа не менее 1%); скорость подачи водных суспензий НЧ и МЧ МоО3 – 0.4 см3/мин; отток воздуха – 10 дм3/мин; колебания давления внутри камеры – 0.4 мбар; температура в камере – 22–25°С. Отбор проб воздуха из камеры для определения концентрации тестируемых веществ осуществляли на фильтры АФА-ХП-10-1 на протяжении всего времени экспозиции со скоростью подачи 2 дм3/мин. Фактическая концентрация НЧ МоО3 в воздухе ингаляционной камеры составила 1.84 ± 0.41 мг/м3, МЧ МоО3 – 1.43 ± 0.42 мг/м3.
Перед началом первой и после окончания десятой экспозиции проводили исследование и оценку основной активности и поведенческих реакций экспериментальных животных. Исследование выполнено на установке “Открытое поле” TS0501, (ООО “НПК Открытая наука”, Россия), предназначенной для изучения поведения грызунов в новых (стрессогенных) условиях. Установка “Открытое поле” представляет собой круглую арену из белого неламинированного вспененного поливинилхлорида диаметром 97 см и высотой стенок 42 см. Пол арены разделен неглубокими узкими желобами на сектора, имеет отверстия 1.5 см в диаметре. Оценку основной активности и поведенческих реакций проводили в затемненном, звукоизолированном помещении при неярком свете красной лампы мощностью 40 Вт, расположенной над ареной на высоте 2 м. Изменение поведения фиксировали с помощью видеосистемы “Открытая арена” (ООО “НПК Открытая наука”, Россия), включающей в себя камеру высокого разрешения, закрепленную на высоте 2 м при помощи настенного штатива. Видеозапись осуществляли в течение 2 мин. В начале эксперимента каждое животное из каждой группы индивидуально помещали в центр установки. После окончания видеорегистрации активности животного пол установки обрабатывали спиртовыми салфетками, следующее животное помещали на арену через 20 мин. Для учета данных использовали программу RealTimer v.1.2.1. Расчет основной активности осуществляли суммированием количества пересеченных секторов и стоек с опорой и без опоры на стенку арены. При исследовании поведенческих реакций учитывали количество актов дефекации, обнюхивания отверстий, продолжительности груминга и замирания.
Через 24 ч после последней экспозиции у крыс для изучения биохимических показателей проводили забор крови из подъязычной вены в объеме 3 см3. Уровни активности аланинаминотрансферазы (АЛТ), аспартатаминотрасферазы (АСТ), щелочной фосфатазы (ЩФ), гамма-глутамилтранспептидазы (γ-ГТ), α-амилазы, лактатдегидрогеназы (ЛДГ), концентрации билирубина общего, билирубина прямого, креатинина, мочевины и С-реактивного белка (СРБ) определяли в сыворотке крови на биохимическом анализаторе Keylab (BPC BioSed, Италия).
После отбора крови животных выводили из эксперимента методом цервикальной дислокации и отбирали сердце, легкие, печень, почки и головной мозг. Половину отобранных органов использовали для изучения бионакопления тестируемых материалов, другую половину – для гистологического исследования патоморфологических изменений тканей.
Изучение бионакопления проводили по показателю концентрации молибдена в перечисленных выше органах и крови. Отобранные образцы подвергали термическому озолению в течение 9 ч в муфельной печи при температуре 450–500°С. Количественное определение содержания молибдена в образцах осуществляли методом масс-спектрометрии с индуктивно связанной плазмой на масс-спектрометре Agilent 7500cx (Agilent, США) с октопольной реакционной/столкновительной ячейкой. В качестве газа-реактанта использовали гелий.
Для проведения гистологического исследования извлеченные образцы фиксировали в 10%-ном растворе нейтрального формалина с добавлением фосфатного буфера. Дегидратацию фиксированных кусочков тканей проводили в автоматическом гистологическом процессоре “Excelsior ES” (Thermo Scientific, Германия). Гистологические препараты изготавливали из парафиновых срезов толщиной 3–4 мкм, окрашивая в роботе-окрашивателе “Varistain Gemini ES” (Thermo Scientific, Германия) гематоксилином и эозином (ООО “ЭргоПродакшн”, Россия) в соответствии с методикой [13]. Микрофотографии сделаны с помощью камеры “Mikroskopkamera AxioCam ERc 5s” (Carl Zeiss, Германия).
Статистическую обработку результатов исследования для выявления различий между экспериментальными группами по поведенческим реакциям, биохимическим показателям крови, степени бионакопления осуществляли по U-критерию Манна–Уитни, рассчитанному в программе STATISTICA 10. Различия полученных результатов считали статистически значимыми при р ≤ 0.05.
РЕЗУЛЬТАТЫ
Методом РЭМ установлено, что изучаемый нанопорошок на 84.17% состоит из частиц размером ≤100 нм, их средний диаметр составил 58.80 нм, что в 57.99 раза меньше среднего размера частиц микропорошка (3410.00 нм) (рис. 1). Частицы нанопорошка имеют сферическую форму с коэффициентом округлости 0.94; микропорошка – призматическую форму с коэффициентом округлости 0.59. Значение их удельной площади поверхности – 3.66 м2/г, что в 1.17 раза больше данного показателя у микрочастиц (3.14 м2/г). На поверхности частиц нанопорошка зафиксировано наличие пор суммарным объемом 0.0133 см3/г, что в 1.18 раза больше, чем у микрочастиц (0.0113 см3/г).
По результатам исследования показателей основной активности и поведенческих реакций экспериментальных крыс статистически значимых различий между животными групп опыта, сравнения и контроля перед началом эксперимента не установлено. На 10-е сутки после проведения последней экспозиции у животных, экспонированных НЧ МоО3, относительно контроля отмечены увеличение продолжительности груминга в 13.66 (р < 0.01), продолжительности замирания в 6.03 (р < 0.01) и снижение количества актов обнюхивания отверстий в 2.68 раза (р < 0.01) относительно контроля. Крысы группы сравнения после последней экспозиции демонстрируют увеличение продолжительности груминга и замирания в 3.51 (р < 0.01) и 6.23 раза (р < 0.01) соответственно относительно контроля. У крыс опытной группы относительно группы сравнения продолжительность груминга на 10-е сутки выше в 3.89 раза (р < 0.01) (табл. 1).
Таблица 1.
Основная активность и поведенческие реакции крыс
| Группа | M ± m | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Первые сутки | Десятые сутки | |||||||||
| Основная активность | Актов обнюхивания отверстий, шт. | Актов дефекации, шт. | Продолжи-тельность груминга, с | Продолжи-тельность замирания, с | Основная активность | Актов обнюхивания отверстий, шт. | Актов дефекации, шт. | Продолжи-тельность груминга, с | Продолжи-тельность замирания, с | |
| Контроль | 60.00+ ± 3.04 | 2.50 ± 0.76 | 1.00 ± 0.26 | 0.38 ± 0.07 | 1.67 ± 0.27 | 47.83 ± 3.04 | 4.83 ± 0.31 | 1.33 ± 0.33 | 0.35 ± 0.06 | 1.55 ± 0.11 |
| Сравнение | 58.33+ ± 4.01 | 2.17± 0.60 | 1.50 ± 0.34 | 0.32+ ± 0.06 | 1.40+ ± 0.38 | 42.67 ± 1.46 | 2.67 ± 0.76 | 0.83 ± 0.17 | 1.23* ± 0.32 | 9.66* ± 0.72 |
| Опыт | 61.00+ ± 8.38 | 5.40+ ± 1.50 | 1.40 ± 0.40 | 0.54+ ± 0.13 | 1.39+ ± 0.11 | 39.20 ± 1.88 | 1.80* ± 0.49 | 0.80 ± 0.20 | 4.78*^ ± 0.21 | 9.34* ± 0.90 |
Сравнение исследуемых показателей, измеренных до начала и после окончания периода экспозиций, позволило установить снижение основной активности крыс групп опыта, сравнения и контроля в 1.56 (р < 0.01), 1.37 (р < 0.01) и 1.25 (р < 0.05) раза соответственно на 10-е сутки эксперимента. Крысы опытной группы на 10-е сутки совершают в 3.00 раза (р < 0.05) меньше актов обнюхивания отверстий, более продолжительные акты груминга в 8.85 (р < 0.05) и замирания в 6.72 раза (р < 0.05) относительно начала эксперимента. В группе сравнения после экспозиций продолжительности груминга и замирания увеличиваются в 3.84 (р < 0.01) и 6.90 раза (р < 0.01) соответственно (табл. 1).
Многократная ингаляционная экспозиция НЧ МоО3 вызывает изменение биохимических параметров крови крыс в виде увеличения активности ЩФ, ЛДГ, концентрации креатинина, билирубина общего и прямого в 1.85 (р < 0.05), 2.06 (р < 0.01), 1.43 (р < 0.05), 1.39 (р < 0.05) и 1.40 раза (р < 0.05) соответственно относительно контроля. Воздействие микродисперсного аналога приводит к увеличению активности ЛДГ в 1.59 (р < 0.05) и концентрации билирубина прямого в 1.71 раза (р < 0.05) относительно контрольных значений. Отличие воздействия НЧ МоО3 на биохимические показатели крови в сравнении с МЧ МоО3 заключается в более высокой активности ЩФ, концентрации билирубина общего и креатинина в 2.11 (р < 0.05), 1.35 (р < 0.05) и 1.57 раза (р < 0.05) соответственно (табл. 2).
Таблица 2.
Биохимические показатели крови крыс
| Группа | M ± m | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| АЛТ, Е/дм3 | АСТ, Е/дм3 | ЩФ, Е/дм3 | γ-ГТ, Е/дм3 | Амилаза, Е/дм3 | Билирубин общий, мкмоль/дм3 | Билирубин прямой, мкмоль/дм3 | Креатинин, мкмоль/дм3 | ЛДГ, Е/дм3 | Мочевина, ммоль/дм3 | СРБ, мг/дм3 | |
| Контроль | 48.00 ± ± 5.40 | 231.50 ± ± 40.45 | 380.67 ± ± 68.51 | 0.50 ± ± 0.22 | 988.50 ± ± 104.25 | 1.87 ± ± 0.17 | 0.63 ± ± 0.03 | 89.83 ± ± 4.99 | 855.50 ± ± 103.01 | 4.20 ± ± 0.27 | 0.24 ± ± 0.05 |
| Сравнение | 38.50 ± ± 2.05 | 179.50 ± ± 20.37 | 333.00 ± 70.60 | 1.00 ± ± 0.26 | 1008.00 ± ± 77.54 | 1.93 ± ± 0.12 | 1.08* ± ± 0.15 | 81.67 ± ± 2.44 | 1361.17* ± ± 180.57 | 4.95 ± ± 0.43 | 0.28 ± ± 0.04 |
| Опыт | 53.17 ± ± 3.30 | 228.17 ± ± 39.81 | 702.50*+ ± ± 83.65 | 0.83 ± ± 0.40 | 1035.00 ± ± 67.99 | 2.60*+ ± ± 0.27 | 0.88* ± ± 0.08 | 128.17*+ ± ± 12.76 | 1758.53* ± ± 234.00 | 4.70 ± ± 0.28 | 0.18 ± ± 0.08 |
После многократной ингаляционной экспозиции НЧ МоО3 зафиксировано увеличение концентрации молибдена в сердце, легких, почках, головном мозге и крови крыс в 4.50 (р < 0.05), 15.85 (р < 0.05), 2.27 (р < 0.05), 2.50 (р < 0.05) и 10.50 раза (р < 0.01) относительно контрольных значений данного показателя. Экспозиция МЧ МоО3 приводит к повышению концентрации молибдена в легких в 5.29 (р < 0.05) и крови в 3.75 раза (р < 0.01) относительно контроля. Содержание молибдена при воздействии нанодисперсного материала выше, чем при воздействии микродисперсного аналога в сердце, легких, почках, головном мозге и крови в 3.00 (р < 0.05), 3.00 (р < 0.05), 2.51 (р < 0.05), 1.67 (р < 0.05) и 2.80 раза (р < 0.05) соответственно (табл. 3).
Таблица 3.
Концентрация молибдена в органах и тканях крыс
| Группа | M ± m, мг/кг | |||||
|---|---|---|---|---|---|---|
| Сердце | Легкие | Печень | Почки | Мозг | Кровь | |
| Контроль | 0.04 ± 0.003 | 0.07 ± 0.01 | 0.79 ± 0.03 | 0.41 ± 0.04 | 0.04 ± 0.003 | 0.04 ± 0.01 |
| Сравнение | 0.06 ± 0.02 | 0.37* ± 0.02 | 0.85 ± 0.04 | 0.37 ± 0.01 | 0.06 ± 0.02 | 0.15* ± 0.02 |
| Опыт | 0.18*^ ± 0.02 | 1.11*^ ± 0.15 | 0.76 ± 0.07 | 0.93*^ ± 0.15 | 0.10*^ ± 0.01 | 0.42*^ ± 0.08 |
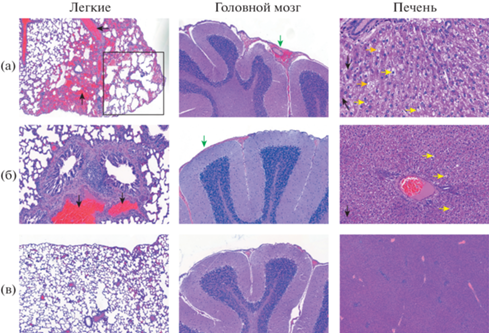
По результатам гистологического исследования органов крыс, экспонированных НЧ и МЧ МоО3, установлено развитие патоморфологических изменений тканей легких, головного мозга и печени. В легких в отличие от контрольной группы зафиксировано развитие острой очаговой интерстициальной пневмонии, острого бронхита, васкулитов, гиперплазии лимфоидной ткани, острого полнокровия, геморрагических инфарктов; в головном мозге – очагового субарахноидального кровоизлияния; в печени – распространенной гидропической и гиалиново-капельной дистрофии. Отличительными особенностями действия наноматериала на морфологию исследованных органов сравнительно с действием микродисперсного аналога являются компенсаторная эмфизема легких, очаговый микровезикулярный стеатоз гепатоцитов и острое полнокровие печени (рис. 2).
Рис. 2.
Микрофотографии гистологических препаратов органов крыс (окраска гематоксилином-эозином, масштаб 100 : 1): а – опытная группа, б – группа сравнения, в – контрольная группа; черная стрелка – геморрагические инфаркты, черный квадрат – участок с эмфиземой, зеленая стрелка – субарахноидальное кровоизлияние, оранжевая стрелка – стеатоз, темно-синяя стрелка – гиалиново-капельная дистрофия, желтая стрелка – гидропическая дистрофия.
ОБСУЖДЕНИЕ
Установлено, что тестируемый образец МоО3 по совокупности физических параметров является наноматериалом.
НЧ МоО3, поступившие в организм ингаляционным путем, накапливаются в сердце, легких, почках, головном мозге и крови, в то время как экспозиция микроматериалом вызывает увеличение концентрации молибдена в легких и крови. Больший перечень органов, в которых депонирует молибден, и более высокие концентрации изучаемого элемента указывают на большую степень бионакопления наноматериала по сравнению с микродисперсным химическим аналогом. Наноразмерный МоО3 частично растворяется в кислой, нейтральной и щелочной средах с наибольшей долей растворенных частиц при значениях рН, близких к 10 [14]. Это указывает на возможность образования ионов Мо6+ в результате диссоциации НЧ МоО3, попавших в клетки легких. В связи с этим можно сделать предположение, что как НЧ МоО3, так и ионы Мо6+ участвуют в процессе бионакопления, распространяясь по организму через кровеносное русло.
При ингаляционном пути поступления частицы контактируют с эпителиальными клетками дыхательных путей, генерирующими АФК и провоспалительные цитокины. Цитокины способствуют выделению арахидоновой кислоты из липидов в составе мембраны, что приводит к выработке эйконазоидов, способствующих секреции слизи бокаловидными клетками и воспалению тканей [15]. Кроме того, внутриклеточные АФК увеличивают продукцию провоспалительных цитокинов [16] и вызывают окислительный стресс, способствующий развитию воспалительной реакции в тканях легких [17, 18]. В ранее проведенных исследованиях установлена способность НЧ МоО3 при взаимодействии с клетками увеличивать генерацию свободных радикалов [6–8, 19] и повышать экспрессию генов, отвечающих за продукцию провоспалительных цитокинов [7]. Таким образом, установленный воспалительный процесс в тканях легких может являться реакцией на воздействие тестируемых материалов. В легких экспонированных крыс установлена гиперплазия лимфоидной ткани, что характерно при развитии воспаления [20]. Геморрагические инфаркты тканей легких можно объяснить повреждением тканей сосудов, подверженных васкулиту [21]. Такие цитокины, как фактор некроза опухоли-α (ФНО‑α) и интрелейкин-1, образующиеся в тканях сосудов в ходе воспалительного процесса, способны напрямую повреждать эндотелиальные клетки, что, вероятно, связано с индукцией апоптоза [22]. Повреждения тканей легких крыс опытной группы приводят к появлению компенсаторной эмфиземы, которая необходима для восстановления нормального функционирования органа через гиперплазию и/или гипертрофию ткани, не подверженной патоморфологическим изменениям [23]. В мозжечке крыс зафиксировано развитие субарахноидального кровоизлияния. Развитие данной патологии может быть спровоцировано нарушением целостности стенок сосудов [24]. Имеются сведения об увеличении экспрессии гена, отвечающего за генерацию ФНО-α, при субарахноидальном кровоизлиянии [25]. Таким образом, можно предположить, что развитие кровоизлияния в головном мозге имеет схожий механизм с развитием данной патологии в легких. Субарахноидальное кровоизлияние способствует развитию депрессивных и тревожных состояний как у крыс, так и у человека [26, 27]. Увеличение продолжительности актов груминга и замирания, отмеченное у экспонированных животных, может являться проявлением стрессовой реакции [28], инициированной субарахноидальным кровоизлиянием. Паренхиматозные диспротеинозы, отмеченные в тканях печени экспонированных крыс в виде гиалиново-капельной и гидропической дистрофии, могут быть связаны с нарушением процесса синтеза белка [29] и/или разрушением мембран клеток и органоидов, обусловленных воздействием НЧ МоО3 [30]. Тело гепатоцитов, подверженных гиалиново-капельной дистрофии, заполняется белковыми каплями, происходит деструкция органоидов клеток и в конечном итоге развивается коагуляционный некроз [29, 31]. Фанероз клеточной мембраны может привести к массовому притоку воды и ионов Na+ в клетку, сопровождаемому активацией гидролитических ферментов лизосом, разрывающих внутримолекулярные связи с присоединением воды, что способствует формированию “вакуолей”, и развитию гидропической дистрофии [29, 32]. При прогрессировании гидропической дистрофии “вакуоли” могут слиться в одну, занимающую почти весь объем клетки, что является проявлением баллонной дистрофии и расценивается как колликвационный некроз [31]. Только у крыс опытной группы установлена жировая дистрофия (стеатоз) паренхиматозной ткани печени. Развитие жировой дистрофии при воздействии токсических веществ связывают с увеличением синтеза триглицеридов в результате окислительных процессов [29]. Внутриклеточное накопление триглицеридов в дальнейшем чревато разрушением лизосом, в результате чего в цитоплазму высвобождается катепсин B, который, в свою очередь, способствует развитию митохондриальной дисфункции, что усиливает генерацию АФК [33]. Кроме того, накопление липидов в клетках может происходить по механизму фанероза липопротеидных комплексов мембран [29]. Прогрессирование стеатоза предполагает развитие фиброза и цирроза печени [34]. Развитие патоморфологических изменений печени установлено на фоне отсутствия увеличения концентрации молибдена в данном органе. Период полувыведения отложенного в печени молибдена оценивается от нескольких часов до трех суток [35]. В связи с этим можно предположить, что избыток молибдена полностью элиминировался из печени, но активировал механизмы развития дистрофических изменений гепатоцитов. При экспозиции НЧ МоО3 в органах крыс проявляются более выраженные изменения морфологии тканей легких и печени по сравнению с экспозицией микродисперсным аналогом, что указывает на большую токсичность наноматериала. В сердце и почках крыс опытной группы патоморфологических изменений не установлено, несмотря на бионакопление НЧ МоО3. Вероятно, данный факт можно объяснить начальным этапом развития изменений морфологии, происходящим на субклеточном уровне, что невозможно установить с помощью световой микроскопии или из-за недостаточной концентрации вещества для инициации токсического процесса в данных органах.
Выявленные патоморфологические состояния тканей подтверждают развитие функциональных нарушений со стороны критических органов. Увеличение активности ЩФ, ЛДГ и концентрации билирубина общего и прямого может быть следствием дистрофических процессов в гепатоцитах и нарушений их функций [36]. Кроме того, патологические изменения морфологии головного мозга и легких могут способствовать увеличению уровня активности ЛДГ, содержащейся практически во всех клетках организма [36]. Более выраженные изменения биохимических показателей крови крыс опытной группы относительно группы сравнения указывают на большую степень токсичности наноматериала.
ЗАКЛЮЧЕНИЕ
По результатам выполненных исследований установлено, что НЧ МоО3 обладают большей степенью бионакопления относительно микродисперсного химического аналога, депонируя преимущественно в сердце, легких, почках, головном мозге и крови. Изученный наноматериал токсичнее микроматериала, что отмечено по более выраженным патоморфологическим изменениям тканей легких и печени, сопровождающим их нарушениям биохимического состава крови и поведенческих реакций. Результаты исследования позволяют расширить теоретические представления и получить новые знания в области нанотоксикологии об особенностях токсического действия наноразмерных оксидсодержащих материалов при различных уровнях воздействия и способах поступления в организм.
Список литературы
Sukhanova A., Bozrova S., Sokolov P. et al. // Nanoscale Res. Lett. 2018. V. 13. № 44. P. 1.https://doi.org/10.1186/s11671-018-2457-x
Khan Ib., Saeed K., Khan Id. // Arab. J. Chem. 2019. V. 12. № 7. P. 908. https://doi.org/10.1016/j.arabjc.2017.05.011
Паренаго О.П., Бакунин В.Н., Кузьмина Г.Н. и др. // Докл. РАН. 2002. Т. 383. № 1. С. 84.
Sobańska Z., Zapór L., Szparaga M., Stȩpnik M. // Int. J. Occup. Med. Environ. Health. 2020. V. 33. № 1. P. 1. https://doi.org/10.13075/ijomeh.1896.01411
Lee S.H., Kim Y.H., Deshpande R. et al. // Adv. Mater. 2008. V. 20. № 19. P. 3627. https://doi.org/10.1002/adma.200800999
Indrakumar J., Korrapati P.S. // Biol. Trace Elem. Res. 2020. V. 194. № 1. P. 121. https://doi.org/10.1007/s12011-019-01742-2
Božinović K., Nestić D., Centra U.G. et al. // Toxicology. 2020. V. 444. P. 11. https://doi.org/10.1016/j.tox.2020.152564
Tran T.A., Krishnamoorthy K., Song Y.W. et al. // ACS Appl. Mater. Interfaces. 2014. V. 6. № 4. P. 2980. https://doi.org/10.1021/am405586d
Assadi F., Amirmoghadami H.R., Shamseddin M. et al. // JHEHP. 2016. V. 1. № 4. P. 189. https://doi.org/10.29252/jhehp.1.4.189
Сизова Е.А., Мирошников С.А., Калашников В.В. // Сельскохозяйственная биология. 2016. Т. 51. № 6. С. 929. https://doi.org/10.15389/agrobiology.2016.6.929rus
Fazelipour S., Assadi F., Tootian Z. et al. // Com. Clin. Path. 2020. V. 29. № 6. P. 991. https://link.springer.com/article/10.1007/s00580-020-03137-5
National Research Council of the national academies. Guide for the care and use of laboratory animals. Washington: The national academies press, 2011. 248 p.
Routine Mayer’s Hematoxylin and Eosin Stain (H&E). http://tvmouse.ucdavis.edu/bcancercd/52/prcl_HandE.html
Peña-Bahamonde J., Wu C., Fanourakis S.K. et al. // J. Catal. 2020. V. 381. № 1. P. 508. https://doi.org/10.1016/j.jcat.2019.11.035
Moldoveanu B., Otmishi P., Jani P. et al. // J. Inflamm. Res. 2009. V. 2. P. 1.
Naik E., Dixit V.M. // J. Exp. Med. 2011. V. 208. № 3. P. 417. https://doi.org/10.1084/jem.20110367
Pham-Huy L.A., He H., Pham-Huy C. // Int. J. Biomed. Sci. 2008. V. 4. № 2. P. 89.
Azad N., Rojanasakul Y., Vallyathan V. // J. Toxicol. Environ. Health. B. 2008. V. 11. № 1. P. 1. https://doi.org/10.1080/10937400701436460
Lebedev S., Yasheva E., Galaktionova L., Sizova E. // Environ. Sci. Pollut. Res. Int. 2016. V. 23. № 18. P. 18099. https://doi.org/10.1007/s11356-016-6916-6
Sirajuddin A., Raparia K., Lewis V.A. et al. // Radiographics. 2016. V. 36. № 1. P. 53. https://doi.org/10.1148/rg.2016140339
Kaptein F.H.J., Kroft L.J.M., Hammerschlag G. et al. // Thromb. Res. 2021. V. 202. P. 162. https://doi.org/10.1016/j.thromres.2021.03.022
Lentsch A.B., Ward P.A. // J. Pathol. 2000. V. 190. № 3. P. 343. https://doi.org/10.1002/(SICI)1096-9896(200002)190:3<343::AID-PATH522>3.0.CO;2-M
Hsia C.C.W. // J. Appl. Physiol. 2004. V. 97. № 5. P. 1992. https://doi.org/10.1152/japplphysiol.00530.2004
Fuller G., Manford M. Neurology (Third edition). London: Elsevier Inc, 2010. 144 p.
Weng Y. // Open Life Sci. 2021. V. 16. № 1. P. 1377. https://doi.org/10.1515/biol-2021-0138
Boyko M., Azab A.N., Kuts R. et al. // Brain Res. 2013. V. 1491. P. 109. https://doi.org/10.1016/j.brainres.2012.10.061
Wermer M.J.H., Kool H., Albrecht K.W., Rinkel G.J.E. // Neurosurgery. 2007. V. 60. № 1. P. 91. https://doi.org/10.1227/01.neu.0000249215.19591.86
Celis M.E., Torre E. // Methods in Neurosciences. 1993. V. 14. P. 378.
Струков А.И., Серов В.В. Патологическая анатомия: учебник. М.: Литтерра, 2010. 880 с.
Braydich-Stolle L., Hussain S., Schlager J.J., Hoffman M.-C. // Toxicol. Sci. 2005. V. 88. № 2. P. 412. https://doi.org/10.1093%2Ftoxsci%2Fkfi256
Цыркунов В.М., Прокопчик Н.И., Андреев В.П., Кравчук Р.И. // Гепатология и гастроэнтерология. 2017. Т. 1. № 2. С. 140.
Abdelhalim M.A.K., Jarrar B.M. // Lipids Health Dis. 2011. V. 10. P. 1. https://doi.org/10.1186/1476-511x-10-166
Li Z.Z., Berk M., McIntyre T.M. et al. // Hepatology. 2008. V. 47. № 5. P. 1495. https://doi.org/10.1002/hep.22183
Carvajai S., Perramón M., Oró D. et al. // Sci. Rep. 2019. V. 9. № 1. P. 1. https://doi.org/10.1038/s41598-019-49262-2
Kapp Jr. R.W. // Encyclopedia of toxicology (Third edition) / Eds. Wexler P. London: Elsevier Inc., 2014. P. 383.
Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. М.: Медицина, 2006. 543 с.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии



