Российские нанотехнологии, 2023, T. 18, № 2, стр. 241-252
Ryngo 1-23 усиливает поглощение инкапсулированных полимером наночастиц нефагоцитирующими клетками
Т. И. Терпинская 1, *, А. В. Радченко 2, Т. Л. Янченко 1, В. А. Грибовская 2, Е. Ф. Полукошко 1, М. В. Артемьев 2
1 Институт физиологии НАН Беларуси
Минск, Беларусь
2 Научно-исследовательский институт физико-химических проблем Белорусского государственного университета
Минск, Беларусь
* E-mail: terpinskayat@mail.ru
Поступила в редакцию 06.06.2022
После доработки 25.07.2022
Принята к публикации 25.07.2022
Аннотация
Показано, что Ryngo 1-23, активатор динамина, значительно усиливает поглощение наночастиц (НЧ), инкапсулированных амфифильным полимером, клетками глиомы C6, Hela и асцитной карциномы Эрлиха, но не клетками моноцитарно-макрофагального ряда – U-937, KG-1, THP-1. В то же время ингибитор динамина – динасор – слабо влияет на поглощение НЧ клетками глиомы С6 и Hela, но значительно подавляет поглощение клетками U-937. Ингибитор АДФ-рибозилирующего фактора 1 – брефельдин А – снижает поглощение НЧ клетками глиомы С6 и Hela, но не U-937. Таким образом, в поглощении клетками НЧ участвуют механизмы, зависимые от динамина и АДФ-рибозилирующего фактора 1. Роль этих механизмов значительно различается в различных типах клеток. Химические модуляторы процессов эндоцитоза могут использоваться для усиления селективности взаимодействия НЧ с определенными типами клеток.
ВВЕДЕНИЕ
Разработка наноносителей рассматривается как один из перспективных подходов для повышения селективности и усиления терапевтического эффекта лекарств [1–3]. Исходя из этого, особую актуальность представляет вопрос о механизмах и возможностях регуляции поглощения наночастиц (НЧ) клетками.
Основным путем проникновения в клетку подавляющего большинства НЧ, так же как высокомолекулярных соединений, является эндоцитоз – способ поглощения различных веществ с помощью образования эндосом. Эндоцитоз является сложным процессом. Он реализуется с участием большого числа молекул, служащих субъединицами для образования необходимых структур и/или регуляторами процесса эндоцитоза. К таким молекулам относятся ГТФазы динамин и АДФ-рибозилирующий фактор 1 (Arf 1 – ADP-ribosylation factor 1).
У позвоночных известны три типа динамина: динамин 1, высокий уровень которого выявляется в нейронах, динамин 2, присутствующий во всех клетках, и динамин 3, выявляемый в яичках, легких и мозге [4, 5]. В то же время при значительном превышении мРНК динамина 1 в нейронах в остальных клетках и тканях уровни мРНК динаминов 1 и 2 существенно не различаются. Полагают, что динамин 1 неактивен в большинстве не нейрональных клеток и в покоящихся синапсах из-за фосфорилирования конститутивно активной киназой гликогенсинтазы 3β (GSK3β – glycogen synthase kinase 3β) [6].
Динамин задействован в нескольких типах эндоцитоза. Установлено, что он играет значительную роль в клатрин-опосредованном эндоцитозе [4, 7] и фагоцитозе [8, 9]. Вероятно, динамин участвует в кавеолин-опосредованном эндоцитозе [10, 11], хотя убедительных доказательств, что какое-либо вещество поглощается только кавеолин-опосредованным путем и что динамин необходим для кавеол-опосредованного эндоцитоза, до сих пор не представлено [12].
Наиболее изученная функция динамина в эндоцитозе связана с отщеплением от плазматической мембраны образовавшегося эндоцитозного пузырька. Это обусловлено олигомеризацией диамина в спиральный полимер, ключевым свойством которого является способность сжиматься в присутствии гуанозинтрифосфата (ГТФ) [4, 7]. Имеются экспериментальные данные, свидетельствующие об участии динамина и в более ранних этапах эндоцитоза, в частности регулировании формирования и созревания клатрин-покрытых ямок [5, 13–15].
Основным динамин-клатрин-независимым путем эндоцитоза считают CLIC/GEEC-эндоцитоз, осуществляемый с помощью гликофосфатидил-заякоренных белков. Этот тип поглощения не зависит от клатрина и кавеолина и связан с образованием эндосом, обогащенных гликофосфатидил-заякоренными белками (GEEC – GPI-anchored-protein-enriched endosomal compartment) или клатрин-независимыми носителями (CLIC – clathrin-independent carriers) [16–18]. Эндоцитируемое вещество быстро передается в аппарат Гольджи. В реализации процесса участвует малая ГТФаза Arf 1 [19–21].
Наряду с тем, что уже признана роль динамина и Arf 1 в эндоцитозе различных молекул, участие этих ГТФаз в эндоцитозе НЧ изучено гораздо хуже. Поэтому цель настоящей работы – исследование роли динамина и Arf 1 в поглощении флуоресцентных полупроводниковых НЧ, покрытых полимерной оболочкой, различными типами клеток.
Низкомолекулярные модуляторы динамина, такие как динасор или Ryngo 1-23, широко используются для изучения эндоцитоза и других аспектов мембранной динамики. Эти небольшие молекулы способны проникать сквозь клеточные мембраны, влиять на олигомеризацию, ГТФазную активность динамина и на процесс эндоцитоза [22–25].
Как указывали выше, негативным регулятором динамина является GSK3β, фосфорилирующая динамин 1 в покоящихся синапсах [15] и клетках, не являющихся нейронами [26]. Ингибирование GSK3β способствовало активации динамина и быстрому усилению интенсивности эндоцитоза в нейронах [27] и клетках немелкоклеточного рака легкого [28]. Для повышения активности динамина использовали ингибитор GSK3β – SML1046 (также известный как CHIR99021). Для выявления роли Arf 1 использовали брефельдин А – ингибитор активности Arf 1 и транспорта между эндоплазматической сетью и аппаратом Гольджи [29, 30].
МЕТОДЫ
Клетки. Использовали клетки Hela, глиомы С6, U-937, THP-1, KG-1 из “Белорусской коллекции культур клеток человека и животных” Республиканского научно-практического центра эпидемиологии и микробиологии, Беларусь, клетки асцитной карциномы Эрлиха (АКЭ) из Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина, Россия. Культивируемые клетки выращивали в питательной среде DMEM (Sigma-Aldrich, Великобритания), дополненной 10% эмбриональной телячьей сыворотки (ЭТС) (Thermo Fisher Scientific, Gibco, Бразилия) и антибиотиком (пенициллин, стрептомицин, амфотерицин) (Sigma-Aldrich, Германия), при 37°С в СО2-инкубаторе (Shellab, США) с 5%-ным уровнем СО2. Клетки АКЭ получали из перитонеальной полости мышей на 10-е сутки после внутрибрюшинной прививки опухоли.
Наночастицы. Полупроводниковые квантовые точки (QDs – quantum dots) CdSe/ZnS типа “ядро–оболочка” c максимумом испускания 584 нм (в CHCl3) синтезировали согласно [31, 32]. Инкапсуляцию в производные амфифильного полимера поли(малеиновый ангидрид альт-1-тетрадецен) (ПМАТ) проводили согласно [33]. Квантовые точки в хлороформе обрабатывали октантиолом, после чего добавляли химически модифицированный ПМАТ. После испарения растворителя при комнатной температуре образовывалась твердая стеклообразная фаза, которую растворяли в воде или соответствующем буфере.
Модификацию ПМАТ проводили по стандартной карбодиимидной методике [34], в которой в реакцию сочетания вводили в присутствии 10-кратного избытка 1-этил-3-(3-диметиламинопропил)карбодиимида 30 мг (0.1 ммоль) ПМАТ (Mw = 9000 г/моль) и низкомолекулярные модификаторы: 0.11 моль (2-аминоэтил)-триэтиламмония хлорида (QD3) или 0.11 ммоль (2-аминоэтил)-триэтиламмония хлорида и 0.09 ммоль таурина (QD4). Модифицированный полимер очищали посредством процедуры диализа против дистиллированной воды в течение 24 ч в ацетатцеллюлозной мембране.
Оптические свойства коллоидных растворов НЧ исследовали с помощью спектрометра (HR-2000+, Ocean Optics, Германия) и спектрофлуориметра (Agilent Cary Eclipse, США). Квантовый выход фотолюминесценции определяли относительно раствора красителя Rhodamine 6 G (Merk, Германия) в этаноле на длине волны возбуждения λ = 488 нм [35].
ζ-потенциал и гидродинамический диаметр инкапсулированных коллоидных НЧ измеряли с помощью прибора Malvern Zetasizer Nano ZS90 (Великобритания) в фосфатном буфере с рН = 7.0 и I = 10 мМ или в среде DMEM c феноловым красным с добавлением 10% ЭТС.
Проведение экспериментов. К клеткам, культивируемым в среде DMEM c 10% ЭТС, добавляли динасор (Sigma-Aldrich, Великобритания) в конечной концентрации (С) 80 мкМ или Ryngo 1-23 (Abcam, Великобритания), С = 5–80 мкМ; SML1046 (Sigma-Aldrich, Нидерланды), С = 3 мкМ; брефельдин А (Sigma-Aldrich, Германия), С = = 10 мкМ; окситетрациклина гидрохлорид (Биофармгарант, Россия), С = 500 мкМ. Клетки инкубировали с перечисленными выше препаратами 30 мин, вносили НЧ, С = 0.02 мкМ, инкубировали 1–24 ч при 37°С в СО2-инкубаторе. Затем получали клеточные пробы и анализировали связывание НЧ с клетками методом проточной цитометрии с использованием цитофлуориметра “BD FACSCanto II” с программным обеспечением Diva 7.0 (Becton Dickinson, США). Интенсивность связывания (ИС) наночастиц с клетками оценивали по интенсивности флуоресценции (ИФ) клеток с учетом квантового выхода люминесценции (КВЛ) наночастиц, используя формулу
Определение жизнеспособности клеток. Пробы клеток, культивируемых с НЧ, окрашивали 7-аминоактиномицином (7-ААД) (Sigma-Aldrich, Германия) согласно рекомендациям производителя и анализировали методом проточной цитометрии.
Оптическая микроскопия. Использовали микроскоп ЛЮМ 1 LED (Альтами, Россия) со встроенными системами возбуждения, регистрации и цифровой обработки изображения. Для визуализации ядер клетки окрашивали красителем Hoechst 33342 (Sigma-Aldrich, Германия) в концентрации 10–5 М (20°С, 10 мин). Затем готовили препараты типа “давленая капля”, позволяющие исследовать живые клетки [36]. Наносили 20 мкл клеточной суспензии на обезжиренное предметное стекло и накрывали покровным стеклом. Сразу анализировали препараты и делали снимки при увеличении объектива ×100.
Статистический анализ данных выполнен с использованием пакетов программ Excel и Statistica 7. Отличия считали статистически значимыми при p < < 0.05 согласно тесту Манна–Уитни. Данные представлены в виде средней и ее ошибки.
РЕЗУЛЬТАТЫ
Среда DМЕМ изменяет ζ-потенциал и квантовый выход наночастиц. Исследование физико-химических свойств НЧ показало, что в фосфатном буфере они характеризуются слабым положительным ζ-потенциалом: +4.5 и +5.2 мВ для НЧ с карбоксильными и сульфонатными группами соответственно, табл. 1. В среде DМЕМ с 10% ЭТС наночастицы приобретали отрицательный поверхностный заряд за счет формирования “протеиновой короны”; средний ζ-потенциал белков ЭТС в среде DМЕМ (10% ЭТС) составлял –9.6 мВ. Из-за наличия красителя фенолового красного в среде инкубирования наблюдалось значительное тушение люминесценции НЧ, и квантовый выход фотолюминесценции снижался в 2.9–3.0 раза, табл. 1.
Таблица 1.
Влияние среды культивирования на физико-химические и оптические свойства наночастиц
| Образец | Тип функциональных групп | Среда | ζ-потенциал, мВ | Гидродинамический диаметр, нм | Квантовый выход фотолюминесценции, % |
|---|---|---|---|---|---|
| QD3 | ${\text{N}}\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{\text{3}}}^{{\text{ + }}}{\text{/СО}}{{{\text{О}}}^{--}}$ | Фосфатный буфер | +4.5 | 36.8 | 22.0 |
| DMEM | –9.4 | 37.1 | 7.3 | ||
| QD4 | ${\text{N}}\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{\text{3}}}^{{\text{ + }}}{\text{/SO}}_{{\text{3}}}^{{\text{--}}}$ | Фосфатный буфер | +5.2 | 37.6 | 26.0 |
| DMEM | –9.3 | 37.7 | 9.1 |
В присутствии Ryngo 1-23 квантовый выход НЧ снижался в 1.25 и 1.37 раза по отношению к квантовому выходу в среде DMEM и составлял 5.8 и 6.6% для QD3 и QD4 соответственно; другие препараты существенно не влияли на квантовый выход (данные не представлены). Исходя из этого, при оценке интенсивности связывания НЧ с клетками вносили соответствующие поправки в полученные на проточном цитофлуориметре значения интенсивности флуоресценции клеток (разд. Материалы и методы).
Агрегации НЧ в среде культивирования не наблюдали, что подтверждается данными о гидродинамическом диаметре НЧ в фосфатном буфере и среде DMEM. Используемые препараты также не вызывали агрегации НЧ.
Ryngo 1-23 усиливает поглощение НЧ нефагоцитирующими клетками. На клетках С6, Hela и U-937 исследовали влияние модуляторов активности динамина – динасора и Ryngo 1-23, ингибитора GSK-3 – SML1046, ингибитора Arf 1 – брефельдина А на клеточную жизнеспособность и эндоцитоз. Перечисленные выше препараты не влияли на жизнеспособность клеток в течение 24 ч культивирования (данные не показаны).
Как видно из рис. 1а, НЧ проявляли слабую цитотоксичность в отношении клеток глиомы С6. QD3 и QD4 снижали жизнеспособность клеток на 10 и 14% соответственно. Динасор несколько усиливал, а Ryngo 1-23 – снижал цитотоксичность QD3, остальные препараты не повлияли на эффект НЧ. Что касается QD4, то динасор не повлиял на их цитотоксические свойства, остальные использованные препараты ослабляли цитотоксичность этих НЧ на 8–14%.
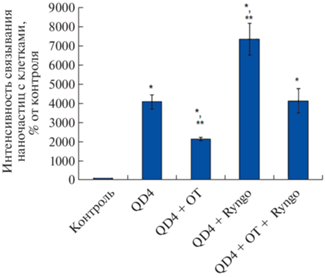
Рис. 1.
Жизнеспособность клеток (а) и интенсивность связывания НЧ с клетками (б) глиомы С6 в присутствии динасора (Dyn, 80 мкМ), Ryngo 1-23 (Ryngo, 80 мкМ), SML1046 (SML, 3 мкМ) или брефельдина А (Br, 10 мкМ) при 24-часовом культивировании; *р < 0.05 при сравнении с серией “Без QD”, **р < 0.05 при сравнении с серией “QD3”, ***р < < 0.05 при сравнении с серией “QD4”.

Рисунок 1б отражает интенсивность поглощения НЧ клетками и изменения этого параметра, вызванные применением модуляторов эндоцитоза. Представлены показатели, характеризующие живые клетки, не окрасившиеся 7-ААД. При применении динасора наблюдалась слабая тенденция к снижению связывания НЧ с клетками. Брефельдин А снижал связывание QD3 и QD4 с клетками на 35 и 34% соответственно. SML1046 повышал связывание клеток с QD3 и QD4 на 17 и 26%, но при этом усиливал ингибирующее действие динасора – при совместном действии динасора и SML1046 снижение связывания QD3 и QD4 с клетками составило 15 и 26%. Наиболее значительное влияние на поглощение НЧ оказал Ryngo 1-23, повысивший связывание QD3 с клетками в 2.6 раза, QD4 – в 3.5 раза. Динамин не изменил эффект Ryngo 1-23 в отношении QD3 и несколько снизил в отношении QD4.
Закономерности поглощения, характерные для пула жизнеспособных клеток, наблюдались для всей совокупности клеток как в данном эксперименте, так и в других описанных ниже экспериментах. В ряде случаев выявленные изменения связывания клеток с НЧ были несколько более выражены в жизнеспособных клетках, поэтому здесь и далее представлены графики только для пула жизнеспособных клеток.
В экспериментах с клетками Hela наночастицы QD3 и QD4 снижали жизнеспособность клеток на 12 и 8% соответственно (рис. 2а). Ryngo 1-23 и его сочетание с динасором ослабляли цитотоксичность обоих типов НЧ на 7–12%. Остальные препараты существенно не изменили эффект НЧ на жизнеспособность клеток, исключая сочетание SML1046 с динасором, а также брефельдин А, которые усиливали цитотоксичность QD4 на 3–6%, рис. 2а.
Рис. 2.
Жизнеспособность клеток (а) и интенсивность связывания НЧ с клетками (б) Hela в присутствии динасора (Dyn, 80 мкМ), Ryngo 1-23 (Ryngo, 80 мкМ), SML1046 (SML, 3 мкМ) или брефельдина А (Br, 10 мкМ) при 24-часовом культивировании; *р < 0.05 при сравнении с серией “Без QD”, **р < 0.05 при сравнении с серией “QD3”, ***р < 0.05 при сравнении с серией “QD4”.
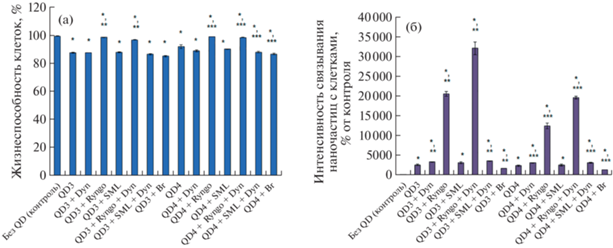
Исследование связывания НЧ с клетками Hela показало, что действие препаратов в данном случае проявлялось более выраженно, чем в клетках глиомы С6. Ryngo 1-23 повышал связывание QD3 и QD4 с клетками Hela в 7.9 и 5.2 раза соответственно, динасор усиливал этот эффект, в присутствии динасора и Ryngo 1-23 клетки связывались с наночастицами QD3 и QD4 в 12.4 и в 8.3 раза интенсивнее, чем в серии без добавления препаратов. Брефельдин А снижал связывание с QD3 и QD4 на 34 и 45% соответственно. Динасор усилил связывание с НЧ на 29 и 30%, SML1046 не повлиял на связывание НЧ с клетками Hela и не изменил эффект динасора, рис. 2б.
В опытах с клетками U-937 статистически значимого влияния QD3 и QD4 на жизнеспособность клеток не выявлено. При применении исследуемых препаратов вариации по жизнеспособности клеток в сериях составляли ~1–2%, рис. 3а.
Рис. 3.
Жизнеспособность клеток (а) и интенсивность связывания НЧ с клетками (б) U-937 в присутствии динасора (Dyn, 80 мкМ), Ryngo 1-23 (Ryngo, 80 мкМ), SML1046 (SML, 3 мкМ) или брефельдина А (Br, 10 мкМ) при 24-часовом культивировании; *р < 0.05 при сравнении с серией “Без QD”, **р < 0.05 при сравнении с серией “QD3”, ***р < 0.05 при сравнении с серией “QD4”.

Показано в 1.3 раза более интенсивное связывание QD3 с клетками по сравнению с QD4. Динасор снижал связывание обоих типов НЧ с клетками в 1.8 раза. SML 1046 не оказывал влияния на поглощение НЧ и не изменял эффект динасора (рис. 3б). Ryngo 1-23 снижал поглощение QD3 в 1.1 раза и не влиял на поглощение QD4, несколько ослабляя эффект динасора – сочетание Ryngo 1-23 с динасором подавляло связывание QD3 с клетками в 1.5 раза, QD4 – в 1.4 раза. Брефельдин А слабо влиял на маркировку клеток U-937 наночастицами.
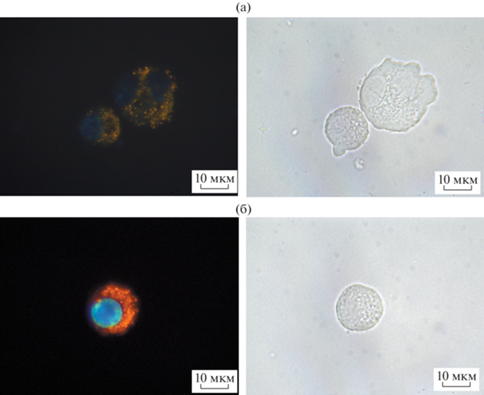
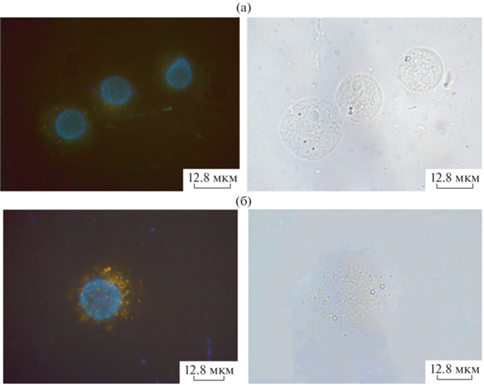
Флуоресцентная микроскопия показала, что НЧ не образовывали агломератов снаружи клеток. При анализе образцов флуоресцентные гранулы были четко видны в разных оптических сечениях клетки при вращении микровинта. Не выявлено яркого свечения по границе клеток, которое могло бы наблюдаться при оседании НЧ на мембране. Все это свидетельствует в пользу того, что НЧ большей частью присутствовали в цитоплазме клеток и выявлялись в виде гранул (возможно, накапливаясь в эндосомах). Репрезентативные фото показаны на рис. 4, 5.
Рис. 4.
Клетки Hela, инкубированные 24 ч с QD3 без добавления (а) и с добавлением (б) Ryngo 1-23 (80 мкМ), флуоресцентная микроскопия (слева – флуоресценция, справа – белое поле).

Рис. 5.
Клетки Hela, инкубированные 24 ч с QD4 без добавления (а) и с добавлением (б) Ryngo 1-23 (80 мкМ), флуоресцентная микроскопия (слева – флуоресценция, справа – белое поле).
Согласно описанным выше результатам Ryngo 1-23 усиливает поглощение НЧ нефагоцитирующими клетками – глиомы С6 (происходящими из глии и имеющими морфологию фибробластов) и Hela (происходящими из эпителия и имеющими соответствующую морфологию), но не клетками U-937 (полученными из плеврального выпота больного гистиоцитарной лимфомой и имеющими морфологию моноцитов и способность к фагоцитозу).
Дополнительно исследовали влияние Ryngo 1-23 на поглощение QD3 или QD4 клетками АКЭ (карцинома молочной железы, мышь) с морфологией эпителиальных клеток, а также клетками KG-1 (острая миелогенная лейкемия, человек) или THP-1 (острая моноцитарная лейкемия, человек), представляющими собой клеточные типы макрофагов и моноцитов. Выявлено, что Ryngo 1-23 в 3 раза усиливает поглощение QD3 клетками АКЭ (рис. 6а, 7) и только на 16% – клетками KG-1 (рис. 6а). Сходные данные получены в экспериментах с QD4, где Ryngo 1-23 на треть усиливал поглощение НЧ клетками АКЭ, но не влиял на поглощение НЧ клетками KG-1, рис. 6б. Усиления поглощения QD4 клетками THP-1 в присутствии Ryngo 1-23 также не выявлено (данные не показаны). Это свидетельство в пользу того, что Ryngo 1-23 значительно усиливает поглощение НЧ нефагоцитирующими клетками, но не оказывает подобного эффекта на клетки моноцитарного ряда, которым присущ фагоцитоз.Рис.7
Рис. 6.
Влияние Ryngo 1-23 на поглощение QD3 (а) и QD4 (б) клетками KG-1 и асцитной карциномы Эрлиха (EAC) при 24-часовом культивировании; *р < 0.05 при сравнении с клетками без НЧ.
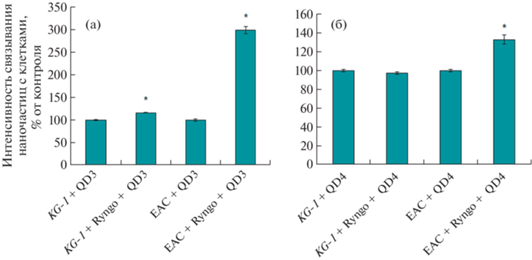
Рис. 7.
Клетки асцитной карциномы Эрлиха, инкубированные 24 ч с QD3 без добавления (а) и с добавлением (б) Ryngo 1-23 (80 мкМ), флуоресцентная микроскопия (слева – флуоресценция, справа – белое поле).
Эффект Ryngo 1-23 зависит от дозы – Ryngo 1-23 в дозе 80 мкМ повышает поглощение QD3 и QD4 клетками глиомы С6 в 3.1 и 3.4 раза соответственно. Снижение концентрации Ryngo 1-23 в 4 раза практически не повлияло на эффект препарата – Ryngo 1-23 повышал связывание с клетками QD3 и QD4 в 2.9 и 3.3 раза соответственно. При дозах 10 и 5 мкМ эффект Ryngo 1-23 снижался – связывание с QD3 повышалось в 2.2 и 1.5 раза, с QD4 – в 2.4 и 1.6 раза, рис. 8а.
Рис. 8.
Влияние Ryngo 1-23 (Ryngo) в различных дозах на связывание НЧ с клетками глиомы С6 (а) и Hela (б) при 24-часовом культивировании; *р < 0.05 при сравнении с серией “QD3”; **р < 0.05 при сравнении с серией “QD4”.

В экспериментах с клетками Hela Ryngo 1-23 в дозе 80 мкМ повышал поглощение QD3 и QD4 в 2.5 и 3.2 раза соответственно. При снижении дозы эффект снижался – при 20 мкМ наблюдалось повышение связывания в 1.8 и 2.2 раза, при дозах 10 и 5 мкМ Ryngo 1-23 связывание с QD3 повышалось в 1.3 и 1.1 раза, с QD4 – в 1.5 и 1.4 раза, рис. 8б.
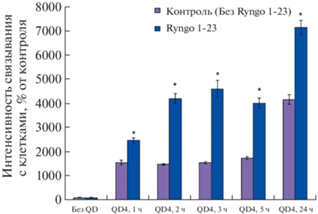
Эффект Ryngo 1-23 на поглощение НЧ зависит от времени культивирования. Эксперимент на клетках глиомы С6 показал, что эффект Ryngo 1-23 развивается постепенно. Влияние Ryngo 1-23 на поглощение НЧ заметно уже через 1 ч, когда Ryngo 1-23 повышал накопление НЧ в клетках в 1.6 раза. Через 2–5 ч эффект усиливался, и наблюдалось усиление поглощения в 2.3–3.0 раза (рис. 9). Эффект сохранялся через 24 ч, превышение составляло 2.1 раза.
Рис. 9.
Влияние Ryngo 1-23 (Ryngo, 10 мкМ) на связывание НЧ с клетками глиомы С6 при различном времени культивирования; *р < 0.05 при сравнении с клетками, не обработанными Ryngo 1-23.
Окситетрациклин снижает поглощение НЧ и отменяет эффект Ryngo 1-23. На модели клеток глиомы С6 показано, что окситетрациклин снижает поглощение НЧ как в отсутствие, так и в присутствии Ryngo 1-23, рис. 10. Образования конгломератов НЧ при микроскопии не выявлено.
ОБСУЖДЕНИЕ
В проведенных опытах исследовали флуоресцентные полупроводниковые НЧ (квантовые точки) QD3 и QD4, инкапсулированные амфифильным полимером. В оболочке наночастиц QD3 и QD4 присутствовали положительно заряженные четвертичные аммонийные группы и отрицательно заряженные группы (в QD3 – карбоксильные, в QD4 – сульфонатные). Соотношение положительных и отрицательных групп в полимерной оболочке обеспечивало ζ-потенциал НЧ в фосфатном буфере +4.5 (QD3) и +5.2 мВ (QD4). В среде DMEM с феноловым красным и 10% ЭТС QD3 и QD4 уже через 1 ч приобретали отрицательный ζ-потенциал, практически не изменяющийся в течение следующего часа и составляющий –9.4 и –9.3 мВ.
Оба типа НЧ связывались с различными типами клеток, причем QD3 (c карбоксильными группами) интенсивнее примерно в 1.2–1.3 раза, чем QD4 (c сульфонатными группами). Фотографии флуоресцентной микроскопии показывают, что НЧ не образуют агломератов снаружи клеток, они проникали внутрь и наблюдались в виде гранул. Для более точного представления о распределении НЧ на мембране и внутри клетки требуются дальнейшие исследования.
Полученные данные показали, что ингибитор динамина динасор сильно подавлял поглощение клетками U-937, в то же время слабо снижая или не влияя на связывание НЧ обоих типов с клетками глиомы С6 и Hela. Следовательно, в первом случае динамин необходим для поглощения НЧ, а во втором – играет незначительную роль в поглощении.
SML1046 (ингибитор GSK3β – негативного регулятора динамина 1) слабо повышал (глиома С6) или не влиял (Hela и U-937) на поглощение НЧ. Отсутствие усиления поглощения НЧ клетками U-937 при ингибировании GSK3β может свидетельствовать о том, что активность динамина 1 не играет роли в процессе поглощения или что его экспрессия в этих клетках слишком низка. Поскольку при ингибировании GSK3β несколько усиливалось поглощение НЧ клетками глиомы С6, вероятно, в этих клетках динамин 1 при его активации может вносить вклад в эндоцитоз.
Наибольший эффект на поглощение НЧ клетками глиомы С6 и Hela оказал препарат Ryngo 1-23. При исследовании кинетики процесса наблюдалось двухчасовое развитие действия Ryngo 1-23. Однако Ryngo 1-23 не оказывал такого влияния на поглощение НЧ клетками с фенотипом моноцитов и макрофагов: U-937, KG-1 и THP-1.
Таким образом, выявлено, что препараты динасор и Ryngo 1-23, структурно сходные (динасор напоминает мономерную форму Ryngo 1-23) [37], оказали различный эффект на поглощение НЧ. Оба препарата влияют на динамин, играющий существенную роль в процессах эндоцитоза. Динамин существует в трех основных состояниях: базальном, кольцевом и спиральном, ГТФaзная активность которых ступенчато возрастает при переходе в каждое последующее состояние. В своем “базальном” состоянии динамин находится в равновесии между мономерами, димерами и гомотетрамерами [38]. Димеры или тетрамеры динамина могут в дальнейшем самоорганизовываться в структуры более высокого порядка, напоминающие “кольца”, которые имеют внешний диаметр ~50 нм и внутреннее отверстие ~30 нм [39]. Образование кольца примерно в 10 раз стимулирует ГТФазную активность динамина [37]. Увеличение скорости гидролиза ГТФ происходит из-за активации внутримолекулярного домена активации ГТФaзы внутри динамина, который становится активным только тогда, когда тетрамеры динамина объединяются [40].
Для объяснения эффектов динасора и Ryngo 1-23 на эндоцитоз следует рассмотреть влияние их на самоорганизацию динамина и его ГТФазную активность.
Согласно ряду источников характерной чертой динасора является неконкурентное ингибирование гидролиза ГТФ без влияния на самосборку динамина. Динасор ингибирует ГТФазную активность динамина после его рекрутирования на плазматические мембраны [13, 22, 23, 41], что приводит к ингибированию отделения эндоцитических пузырьков от плазматической мембраны и незавершенному эндоцитозу [23].
Показано, что Ryngo 1-23 (также называемый Bis-T-23) является мощным ингибитором стимулированной фосфолипидами ГТФазной активности динамина 1 [42]. В дальнейшем при исследовании свойств Ryngo 1-23 было обнаружено, что он усиливает ГТФазную активность, олигомеризацию динамина, образование колец, частичных колец [24], блокирует динаминовые петли до негибкого и однородного диаметра, замедляет разборку динаминового кольца или спирали [37]. Полагают, что ингибирующий эффект Ryngo 1-23 на динамин может объясняться конкуренцией между образованием динаминовых колец при его воздействии (что приводит к ~5-кратному увеличению ГТФазной активности) и формированием динаминовых спиралей при фосфолипидной стимуляции (что приводит к ~50-кратному увеличению ГТФазной активности). Следовательно, в последнем случае преобладающее образование динаминовых колец уменьшало бы общую наблюдаемую активацию динамина [17]. На астроцитах крысы продемонстрировано, что Ryngo 1-23 является активатором эндоцитоза и способствует интернализации везикул [25].
Таким образом, динасор и Ryngo 1-23 оказывают различное влияние на функции динамина в клетках. Динасор в клетках ингибирует ГТФазную активность динамина и эндоцитоз, а Ryngo 1-23 стабилизирует кольцевые структуры динамина, активирует ГТФазную активность и усиливает эндоцитоз.
Исходя из изложенного выше, в усилении поглощения НЧ при действии Ryngo 1-23, вероятно, основную роль играла способность этого агента стабилизировать кольцевые структуры динамина. Так как динасор, ингибирующий ГТФазную активность динамина, не отменял, а в опытах на клетках Hela даже усиливал накопление НЧ в клетках, можно предполагать, что ГТФазная активность динамина не играет тут решающей роли.
На модели клеток Cos-1 (фибробласты почки обезьяны) [24] и подоцитов [24, 43] показана стимуляция актин-зависимой олигомеризации динамина с помощью Ryngo 1-23. Окситетрациклин, разрушающий филаменты актина и стабилизирующий их мономерную форму [44], в проведенных экспериментах способствовал снижению поглощения НЧ клетками как обработанными, так и не обработанными Ryngo 1-23. По-видимому, действие Ryngo 1-23 на клеточное поглощение НЧ связано с полимеризацией актина и актин-зависимой олигомеризацией динамина, описанной в [24, 43]. Вместе с тем окситетрациклин и Ryngo 1-23 не являются высокоспецифичными соединениями, взаимодействующими только с одной молекулярной мишенью, поэтому нельзя исключить, что они оказывают противоположные эффекты на клеточное поглощение через различные пути.
Из представленных данных следует, что механизмы поглощения НЧ являются различными в разных типах клеток. Для нефагоцитирующих клеток глиомы С6, Hela, АКЭ эти механизмы зависят от сборки динамина в кольцевые структуры, что активируется Ryngo 1-23, а динасор, ингибирующий ГТФазную активность, но не сборку динамина, практически не влияет на поглощение. В способных к фагоцитозу клетках моноцитарно-макрофагального происхождения (U-937, KG-1, THP-1) в процессах эндоцитоза играет роль активность динамина как ГТФазы.
Отметим, что динасор оказывает и динамин-независимые эффекты, которые могут быть важны для эндоцитоза в клетках моноцитарного ряда. Так, на клетках с тройным нокаутом динамина была показана способность динасора к ингибированию эндоцитоза и изменению формы клеток вследствие влияния на актин [45, 46]. В клетках Hela и макрофагах динасор динамин-независимым образом снижал лабильный пул холестерина плазматической мембраны и разрыхлял липидные рафты [47].
Снижение накопления НЧ в клетках под действием брефельдина А указывает на то, что в эндоцитозе НЧ участвует Arf 1. Наиболее выраженный ингибирующий эффект брефельдина А выявлен на клетках глиомы С6 и Hela. Arf 1 контролирует формирование как клатринового, так и неклатринового покрытия [1, 48] и участвует в осуществлении клатрин-динамин-независимого CLIC/GEEC-эндоцитоза. Известно, что клатрин-зависимый эндоцитоз происходит с участием динамина [4, 7]. В проведенных опытах с клетками глиомы С6 и Hela при ингибировании динамина значительного подавления эндоцитоза не наблюдали. По-видимому, в поглощении НЧ в данном случае играет роль не клатриновый путь, а динамин-клатрин-независимый CLIC/GEEC-эндоцитоз.
Химические модуляторы процессов поглощения могут использоваться для усиления селективности взаимодействия НЧ с определенными типами клеток. Так, Ryngo 1-23 способствует поглощению НЧ нефагоцитирующими клетками, слабо влияя на их поглощение фагоцитами, а динасор препятствует поглощению НЧ клетками фагоцитарного типа, практически не влияя на нефагоцитирующие клетки. Так как одной из проблем при создании высокоспецифичных наноформ лекарств является неспецифической захват НЧ фагоцитами [49–51], представленные в работе результаты не только вносят вклад в понимание механизмов эндоцитоза, но и могут иметь практическое значение.
ЗАКЛЮЧЕНИЕ
Показано, что в поглощении клетками НЧ, инкапсулированных амфифильным полимером, участвуют динамин-зависимые и Arf 1-зависимые механизмы. Эффект препаратов, влияющих на активность участвующих в эндоцитозе молекул, зависит от типа клеток. Ryngo 1-23, стабилизирующий кольцевые структуры динамина и активирующий его ГТФазную активность, значительно усиливает накопление НЧ в нефагоцитирующих клетках, таких как С6, Hela, АКЭ, но не в клетках моноцитарно-макрофагального фенотипа. Ингибитор динамина – динасор – подавляет поглощение НЧ фагоцитирующими клетками U-937. Таким образом, регуляторы активности динамина могут обеспечивать селективное усиление поглощения НЧ нефагоцитирующими клетками. Ингибитор Arf 1 – брефельдин А – снижает поглощение НЧ клетками глиомы С6 и Hela.
Результаты свидетельствуют о том, что химические модуляторы процессов эндоцитоза могут использоваться для регуляции интенсивности поглощения НЧ и усиления селективности их взаимодействия с определенными типами клеток.
Работа выполнена при поддержке ГПНИ “Химические процессы, реагенты и технологии, биорегуляторы и биооргхимия”, задание 2.1.04 НИР 1.
Список литературы
Martin J.D., Cabral H., Stylianopoulos T., Jain R.K. // Nat. Rev. Clin. Oncol. 2020. V. 4. P. 251. https://doi.org/10.1038/s41571-019-0308-z
Xia W., Tao Z., Zhu B. et al. // Int. J. Mol. Sci. 2021. V. 22. № 17. P. 9118. https://doi.org/10.3390/ijms22179118
Ramírez-García P.D., Retamal J.S., Shenoy P. et al. // Nat. Nanotechnol. 2019. V. 14. № 12. P. 1150. https://doi.org/10.1038/s41565-019-0568-x
Ferguson S.M., De Camilli P. // Nat. Rev. Mol. Cell. Biol. 2012. V. 13. № 2. P. 75.https://doi.org/10.1038/nrm3266P
Srinivasan S., Dharmarajan V., Reed D.K. et al. // EMBO J. 2016. V. 35. № 4. P. 443. https://doi.org/10.15252/embj.201593477
Reis C.R., Chen P.H., Bendris N., Schmid S.L. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 3. P. 504. https://doi.org/10.1073/pnas.1615072114
Daumke O., Roux A., Haucke V. // Cell. 2014. V. 156. № 5. P. 882. https://doi.org/10.1016/j.cell.2014.02.017
Gold E.S., Underhill D.M., Morrissette N.S. et al. // J. Exp. Med. 1999. V. 190. № 12. P. 1849. https://doi.org/10.1084/jem.190.12.1849
Otsuka A., Abe T., Watanabe M. et al. // Biochem. Biophys. Res. Commun. 2009. V. 378. № 3. № 478. https://doi.org/10.1016/j.bbrc.2008.11.066
Ju Y., Guo H., Edman M., Hamm-Alvarez S.F. // Adv. Drug. Deliv. Rev. 2020. V. 157. P. 118. https://doi.org/10.1016/j.addr.2020.07.026
Meister M., Zuk A., Tikkanen R. // FEBS J. 2014. V. 281. № 13. P. 2956. https://doi.org/10.1111/febs.12834
Matthaeus C., Taraska J.W. // Front. Cell. Dev. Biol. 2021. V. 8. P. 614472. https://doi.org/10.3389/fcell.2020.614472
Kirchhausen T., Macia E., Pelish H.E. // Methods Enzymol. 2008. V. 438. P. 77. https://doi.org/10.1016/S0076-6879(07)38006-3
Linares-Clemente P., Rozas J.L., Mircheski J. et al. // J. Physiol. 2015. V. 593. № 13. P. 2867. https://doi.org/10.1113/JP270112
Mettlen M., Chen P.H., Srinivasan S. et al. // Annu Rev. Biochem. 2018. V. 87. P. 871. https://doi.org/10.1146/annurev-biochem-062917-012644
Inokawa Y., Nomoto S., Hishida M. et al. // Onco Targets Ther. 2013. V. 6. № 1417. https://doi.org/10.2147/OTT.S51913
Sabharanjak S., Sharma P., Parton R.G., Mayor S. // Dev. Cell. 2002. V. 4. P. 411. https://doi.org/10.1016/s1534-5807(02)00145-4
Kirkham M., Parton R.G. // Biochim. Biophys. Acta. 2005. V. 1746. № 3. P. 349. https://doi.org/10.1016/j.bbamcr.2005.11.007
Kumari S., Mayor S. // Nat Cell Biol. 2008. V. 10. № 1. P. 30. https://doi.org/10.1038/ncb1666
Kühling L., Schelhaas M. // Methods Mol. Biol. 2014. V. 1174. P. 19. https://doi.org/10.1007/978-1-4939-0944-5_2
Lundmark R., Doherty G.J., Howes M.T. et al. // Curr. Biol. 2008. V. 18. № 22. P. 1802. https://doi.org/10.1016/j.cub.2008.10.044
Hill T., Odell L.R., Edwards J.K. et al. // J. Med. Chem. 2005. V. 48. № 24. P. 7781. https://doi.org/10.1021/jm040208l
Macia E., Ehrlich M., Massol R. et al. // Dev. Cell. 2006. V. 10. № 6. P. 839. https://doi.org/10.1016/j.devcel.2006.04.002
Gu C., Chang J., Shchedrina V.A. et al. // Traffic. 2014. V. 15. № 8. P. 819. https://doi.org/10.1111/tra.12178
Hyman B.T., Bacskai B.J., Sever S. // Traffic. 2014. V. 15. № 8. P. 819. https://doi.org/10.1111/tra.12178
Bhave M., Mettlen M., Wang X., Schmid S.L. // Mol. Biol. Cell. 2020. V. 31. № 18. P. 2035. https://doi.org/10.1091/mbc.E20-06-0363
Clayton E.L., Sue N., Smillie K.J. et al. // Nat Neurosci. 2010. V. 13 (7). P. 845. https://doi.org/10.1038/nn.2571
Reis C.R., Chen P.H., Srinivasan S. et al. // EMBO J. 2015. V. 34. № 16. P. 2132. https://doi.org/10.15252/embj.201591518
Niu T.K., Pfeifer A.C., Lippincott-Schwartz J., Jackson C.L. // Mol. Biol. Cell. 2005. V. 16. № 3. P. 1213. https://doi.org/10.1091/mbc.e04-07-0599
Nonnenmacher M., Weber T. // Cell. Host Microbe. 2011. V. 10. № 6. P. 563. https://doi.org/10.1016/j.chom.2011.10.014
Sukhanova A., Devy J., Venteo L. et al. // Anal. Biochem. 2004. V. 324. № 1. P. 60. https://doi.org/10.1016/j.ab.2003.09.031
Radchanka A., Iodchik A., Terpinskaya T. et al. // Nanotechnology. 2020. V. 31. № 43. P. 435102. https://doi.org/10.1088/1361-6528/aba5b5
Radchanka A., Hrybouskaya V., Antanovich A. et al. // ChemNanoMat. 2022. V. 8. № 4. P. e202100538. https://doi.org/10.1002/cnma.202100538
Hermanson G.T. // Bioconjugate Techniques. Amsterdam; Netherlands: Academic Press, 2008. P. 216.
Grabolle M., Spieles M., Lesnyak V. et al. // Anal. Chem. 2009. V. 81. P. 6285. https://doi.org/10.1021/ac900308v
Streiblová E, Hasek J. // Methods Mol. Biol. 1996. V. 53. P. 383. https://doi.org/10.1385/0-89603-319-8:383
Warnock D.E., Hinshaw J.E., Schmid S.L. // J. Biol. Chem. 1996. V. 271. № 37. P. 22310. https://doi.org/10.1074/jbc.271.37.22310
Muhlberg A.B., Warnock D.E., Schmid S.L. // EMBO J. 1997. V. 16. № 22. P. 6676. https://doi.org/10.1093/emboj/16.22.6676
Hinshaw J.E., Schmid S.L. // Nature. 1995. V. 374. № 6518. P. 190. https://doi.org/10.1038/374190a0
Sever S., Skoch J., Newmyer S. et al. // EMBO J. 2006. V. 25. № 18. P. 4163. https://doi.org/10.1038/sj.emboj.7601298
Mazumdar S., Chitkara D., Mittal A. // Acta Pharm. Sin B. 2021. V. 11. № 4. P. 903. https://doi.org/10.1016/j.apsb.2021.02.019
Odell L.R., Chau N., Mariana A. // ChemMedChem. 2009. V. 4. №. 7. P. 1182. https://doi.org/10.1002/cmdc.200900054
Gu C., Lee H.W., Garborcauskas G. et al. // J. Am. Soc. Nephrol. 2017. V. 28. № 2. P. 446. https://doi.org/10.1681/ASN.2016010008
Pathak S., Tripathi S., Deori N. // J. Biomol. Struct. Dyn. 2021. V. 39. № 1. P. 236. https://doi.org/10.1080/07391102.2020.1717629
Grimmer S., van Deurs B., Sandvig K. // J. Cell. Sci. 2002. V. 115. Pt. 14. P. 2953. https://doi.org/10.1242/jcs.115.14.2953
Park R.J., Shen H., Liu L. // J. Cell. Sci. 2013. V. 126. Pt. 22. P. 5305. https://doi.org/10.1242/jcs.138578
Preta G., Cronin J.G., Sheldon I.M. // Cell. Commun. Signal. 2015. V. 13. P. 24. https://doi.org/10.1186/s12964-015-0102-1
Ooi C.E., Dell’Angelica E.C., Bonifacino J.S. // J. Cell. Biol. 1998. V. 142. № 2. P. 391. https://doi.org/10.1083/jcb.142.2.391
Blanco E., Shen H., Ferrari M. // Nat. Biotechnol. 2015. V. 33. № 9. P. 941. https://doi.org/10.1038/nbt.3330
Sousa de Almeida M., Susnik E., Drasler B. et al. // Chem. Soc. Rev. 2021. V. 50. № 9. P. 5397. https://doi.org/10.1039/d0cs01127d
Thomas O.S., Weber W. // Front Bioeng. Biotechnol. 2019. V. 7. P. 415. https://doi.org/10.3389/fbioe.2019.00415
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии