Российские нанотехнологии, 2023, T. 18, № 6, стр. 810-816
Содержание железа и молибдена в иммунопривилегированных органах крыс при введении нанокластерных пористых сферических полиоксометаллатов кеплератного типа {Mo72Fe30}
А. А. Остроушко 1, *, И. Ф. Гетте 2, И. Г. Данилова 1, С. Ю. Медведева 2, Е. В. Ковеза 1, М. А. Андреева 1, М. В. Морозова 1, М. О. Тонкушина 1
1 Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
2 Институт иммунологии и физиологии УрО РАН
Екатеринбург, Россия
* E-mail: alexander.ostroushko@urfu.ru
Поступила в редакцию 20.09.2022
После доработки 27.01.2023
Принята к публикации 10.02.2023
Аннотация
Проведены исследования содержания железа и молибдена в иммунопривилегированных органах крыс без патологии и после моделирования постгеморрагической анемии, получавших внутримышечные инъекции нанокластерного пористого сферического полиоксометаллата (ПОМ) кеплератного типа {Mo72Fe30}. Наиболее устойчивым к проникновению компонентов ПОМ является гематотестикулярный барьер, меньшей устойчивостью обладают гематоэнцефалический и гематоофтальмический барьеры (накопление железа после 30 введений ПОМ), наименее устойчив гематотимусный барьер. В ранние сроки (1-е–7-е сутки) постгеморрагической анемии происходит заимствование железа из иммунопривилегированных органов: головного мозга, глазных яблок, тимуса. Постгеморрагическая анемия снижает устойчивость гематоэнцефалического барьера и сопровождается избыточным накоплением железа после семи инъекций ПОМ.
ВВЕДЕНИЕ
Исследование возможности проникновения наночастиц (НЧ) через гистогематические барьеры иммунопривилегированных органов привлекает внимание исследователей, поскольку, с одной стороны, необходимо знание о возможных токсических эффектах НЧ в органах, имеющих особые охранные барьеры, а с другой стороны, гистогематические барьеры забарьерных органов являются препятствием для проникновения лекарственных препаратов, что затрудняет терапевтическое воздействие.
Головной мозг, глазные яблоки, тимус и семенники относятся к иммунопривилегированным или забарьерным органам, которые при отсутствии повреждения защищены гистогематическими барьерами от проникновения иммунных комплексов, аутоиммунной агрессии и воспаления [1]. Особенности структуры гистогематических барьеров определяются строением органов и различаются своими специфическими чертами в зависимости от их морфологических и физиологических характеристик [2].
Наиболее изученным является гематоэнцефалический барьер (ГЭБ). К его структурным элементам относятся эндотелий кровеносных капилляров, базальная мембрана, мембраны нейронов и глиальных клеток, протеогликаны межклеточного вещества, сосудистые сплетения, оболочки мозга [1, 2]. Гематоофтальмический барьер рассматривают как совокупность трех гистогематических систем: иридоцилиарной, хориоретинальной и папиллярной [3]. Гематотимусный барьер в корковом веществе представлен эндотелиальными клетками кровеносных капилляров и их базальными мембранами, периваскулярным пространством с единичными лимфоцитами, макрофагами, фибробластами, а также межклеточным веществом с ретикулярными эпителиоцитами, также опирающимися на базальную мембрану [4]. Гематотестикулярный барьер включает в себя эндотелий и базальные мембраны капилляров, оплетающих извитые семенные канальцы; находящиеся в расслоении базальной мембраны перициты; прослойки рыхлой интерстициальной соединительной ткани с макрофагами; оболочки извитого семенного канальца, базальную мембрану эпителиоспермального слоя, плотные контакты между клетками Сертоли [1].
Проницаемость гистогематических барьеров избирательна, имеет видовую и возрастную специфику и зависит от потребностей и состояния организма. Так, барьеры могут становиться проницаемыми при некоторых патологических процессах, например при стрессе, воспалительных процессах [1], при железодефицитной анемии [5], старении [6]. Таким образом, изоляция всех рассмотренных забарьерных органов относительна, так как может быть нарушена при действии внешних и внутренних факторов.
Несмотря на возможные токсические эффекты НЧ, широко проводятся исследования преодоления гистогематических барьеров и доставки лекарственных препаратов в забарьерные органы посредством наноконтейнеров: доставка НЧ в головной мозг для лечения паркинсонизма [7], болезни Альцгеймера [8], туберкулеза [9], глиобластомы [10].
К НЧ, которые были использованы в экспериментах в качестве транспортных средств для направленной доставки биоактивных молекул в забарьерные органы, относятся неорганические и органические полимерные НЧ [7], липосомы [8], дендримеры, мицеллы, пептидные векторы, квантовые точки, различающиеся составом, строением и размерами [11, 12].
Фосфолипидные НЧ с флуоресцентным красителем были эффективны для визуализации опухоли мозга [13]. Показана возможность преодоления гематоофтальмического барьера НЧ, содержащими полиакриловую кислоту, альбумин, поли-ε-капролактон и хитозан, для доставки лекарственных препаратов [14].
Системы доставки лекарственных препаратов, преодолевающие гистогематические барьеры забарьерных органов, должны быть нетоксичны, биоразлагаемы и биосовместимы. В качестве транспортных средств доставки лекарственных препаратов в иммунопривилегированные органы могут быть использованы нанокластерные пористые сферические полиоксометаллаты (ПОМ) кеплератного типа.
Понятие кластера было впервые введено Ф. Коттоном в 60-х гг. прошлого века. Кластерами первоначально именовали металлические частицы, с ограниченным числом атомов металлов, связанных друг с другом ковалентной связью, с возможным присутствием лигандов [15]. Позднее к нанокластерам стали относить и другие объекты, такие как ПОМ соответствующего размера. Нанокластерные ПОМ – соединения переходных металлов (обычно W, Mo, V, Nb), кислорода и стабилизирующих лигандов, размер молекул (ионов) которых составляет несколько нанометров.
Интерес к биохимическим свойствам ПОМ [16–18] связан с образованием ими в водных растворах многозарядных анионов, которые могут транспортироваться электрофоретически [19, 20] в том числе чрескожно. При этом ионы ПОМ способны образовывать ассоциаты (конъюгаты) с биологически активными веществами, также транспортируемые под действием электрического поля [19, 21]. Важным моментом является низкая токсичность [16, 18] ПОМ кеплератного типа ({Mo72Fe30}), кристаллографический радиус которого составляет 2.5 нм, а полная формула выглядит следующим образом: [Mo72Fe30O252 (CH3COO)12 {Mo2O7(H2O)}2 {H2Mo2O8 (H2O)} (H2O)91] ~150H2O.
Показано, что организм животных способен адаптироваться к воздействию ПОМ в течение 30 сут их воздействия, что также способствует снижению их токсичности.
В более ранних исследованиях было установлено, что при разных способах введения ПОМ в организм увеличивается содержание их неорганических компонентов, в частности молибдена, в крови, однако существенного аккумулирования в течение длительного времени не происходит [16, 18], например, в костях и таких органах, как печень, почки, через которые выводится его избыток. Тем не менее неорганические компоненты ПОМ (молибден, железо) способны избирательно накапливаться в культурах живых клеток [22], где поглощение железа и молибдена зависит от типа клеток и состава ПОМ: {Mo72Fe30} и {Mo132} – (NH4)42[${\text{Mo}}_{{72}}^{{{\text{VI}}}}$ ${\text{Mo}}_{{60}}^{{\text{V}}}$ O372(CH3COO)30(H2O)72]⋅ 300H2O⋅10CH3COONH4. Имеются основания полагать о возможности стабилизации ПОМ в средах организма, например в кровеносной системе, за счет ассоциации {Mo72Fe30} с белковыми молекулами [21].
Учитывая сказанное выше, представляет интерес изучение уровня содержания неорганических компонентов ПОМ {Mo72Fe30} и в органах, обладающих особыми гистогематическими барьерами. Повышение в них одновременно количества молибдена и железа могло бы косвенно свидетельствовать о проникновении в эти органы ПОМ. Целесообразно включение в круг изучаемых объектов органов с разной возможной степенью васкуляризации. Таким образом, в число изученных в настоящей работе органов исследуемых животных (крыс) входят глазные яблоки, семенники, тимус и головной мозг, масса которых позволяет достоверно провести анализ содержания неорганических компонентов ПОМ.
Патологический процесс может изменить проницаемость гистогематических барьеров. Так, установлены снижение содержания железа в головном мозге и увеличение этого элемента в глазных яблоках животных при экспериментальной железодефицитной анемии [5]. Коррекция дефицита железа в крови введением изомальтозата железа сопровождалась восстановлением уровня железа в головном мозге мышей [23]. Однако при интраназальном введении липосом с ионами железа обнаружено накопление железа в головном мозге и глазных яблоках крыс [24]. Как дефицит, так и избыточное накопление железа в головном мозге могут провоцировать нарушение когнитивных функций [5, 6, 25]. Если проницаемости ГЭБ посвящено достаточно много работ, то проницаемость гистогематических барьеров глазных яблок, семенников и тимуса исследована недостаточно.
Цель исследования – выявить возможность проникновения железо-молибденовых ПОМ в головной мозг, семенники, тимус, глазные яблоки крыс в норме и после моделирования постгеморрагической анемии.
МЕТОДЫ
Полиоксометаллат {Mo72Fe30} впервые был синтезирован в Германии в лаборатории профессора А. Мюллера (университет Билефельда). Структура и состав ПОМ были подробно изучены комплексом методов, включая монокристальную рентгенографию (позволившую представить 3D-модель молекулы ПОМ), динамическое рассеяние света, элементный анализ, ИК-спектроскопию, спектроскопию комбинационного рассеяния света (КРС) и другие. Было показано, что более экспрессные по сравнению с криогенной монокристальной рентгенографией методы идентификации нанокластерных ПОМ (такие как ИК-спектроскопия и КРС) являются достаточно надежными, так как ПОМ обладают уникальными спектрами.
Согласно методике [26, 27] в настоящей работе провели синтез ПОМ. Первоначально из водных растворов выделили твердый ПОМ {Mo132} [26]. Из него путем замещения ионов Mo(V) на Fe(III) получили также твердый конечный продукт {Mo72Fe30} [27]. Для введения животным ПОМ растворяли в дистиллированной воде. При синтезе использовали гептамолибдат аммония (NH4)6Mo7O24·4H2O квалификации “х.ч.”, гидразин сернокислый N2H4∙H2SO4 квалификации “ч.д.а.”, уксусную кислоту ледяную CH3COOH “х.ч.”, хлорид железа(III) шестиводный FeCl3⋅6H2O Panreac (содержание основного вещества 97–102%), ацетат аммония CH3COONH4 квалификации “х.ч.”, соляную кислоту НСl квалификации “ос.ч.” и хлорид натрия NaCl квалификации “ч.д.а.”.
Подтверждение идентичности полученного соединения описанному в литературе было проведено комплексом методов. Регистрацию ИК-спектров порошкового образца ПОМ проводили в режиме нарушенного полного внутреннего отражения на ИК-фурье-спектрометре Nicolet 6700 (Thermo Fisher Scientific, США). Спектры КРС порошкового образца ПОМ были получены (633 нм) с помощью микроскопа Alpha 300 AR (WiTec, Германия), оснащенного He–Ne-лазером. Элементный анализ на легкие элементы проводили на автоматическом элементном анализаторе CHNS РЕ 2400, серия II (Perkin Elmer Instruments, США). Элементный анализ содержания молибдена и железа проводили на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP-6500 Duo (Thermo Scientific, США), предварительно ПОМ был растворен в дистиллированной воде (концентрация раствора 0.1 г/л). Анализ размера частиц в свежеприготовленном растворе {Mo72Fe30} в дистиллированной воде осуществляли методом динамического рассеяния света (ДРС) на анализаторе ZetaPlus/BI 90 (Brookhaven Instruments, США) (концентрация раствора 1 мг/мл).
Инъекционные водные растворы содержали 1 мг/мл {Mo72Fe30}.
Эксперимент выполнен на 50 крысах-самцах линии Wistar. Содержание животных и все манипуляции соответствовали Директиве Совета ЕС 2010/63/EU. Крысы были разделены на следующие группы: 1 – интактная, 2 – введение ПОМ, 3 – постгеморрагическая анемия (ПГА), 4 – ПГА и введение ПОМ. Группы 2, 3 и 4 были разделены на подгруппы по 5 крыс, находившиеся в эксперименте 1, 7 и 30 сут. В группах 3 и 4 под эфирным наркозом осуществляли кровопотерю, забирая кровь из хвостовой вены в количестве 1.5% от массы тела (м.т.). Крысы групп 2 и 4 получали соответственно 1, 7 и 30 внутримышечных инъекций ПОМ. Однократная доза раствора ПОМ в дистиллированной воде (1 мг/мл) составляла 0.15 мг/100 г м.т. крысы и соответствовала предполагаемой терапевтической дозе НЧ. Количество железа в ПОМ составляет 9%, т.е. 0.0135 мг/100 г м.т. крысы в однократной инъекции. Крысы группы 3 получали 1, 7 и 30 внутримышечных инъекций дистиллированной воды объемом, соответствующим объему раствора ПОМ. Животных выводили из эксперимента передозировкой диэтилового эфира.
Образцы органов, предварительно взвешенные на аналитических весах ACCULAB (Sartorius group), помещали в термостойкий химический стакан объемом 50 мл. Растворение органов проводили с использованием смеси концентрированных серной и азотной кислот с нагреванием на кварцевой электроплитке EVS. Первоначально к каждому образцу добавляли по 2 мл азотной концентрированной кислоты квалификации ос.ч. и нагревали, установив на регуляторе плитки температуру 100°С. В ходе растворения на стенках стакана образовывался налет жира, после этого добавляли 2 мл серной концентрированной кислоты ос.ч. и продолжали нагревать при 250°С с сопутствующим выделением бурого газа (диоксид азота) до обугливания пробы в жидкой среде и возникновения в стакане черной окраски среды. Далее добавляли по 0.5 мл перекиси водорода медицинского назначения (36–38%), не содержащей соединений железа и молибдена, до получения прозрачного раствора, который количественно переносили в мерную колбу на 10 или 25 мл и доводили в ней до метки водой, приливая ее маленькими порциями.
Анализ содержания молибдена и железа проводили на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP-6500 Duo (Thermo Scientific).
Статистический анализ данных проводили с помощью программ Statistica 6.0 (Stаt. Soft.Inc.) и Microsoft Exel 2003. Данные представлены в виде среднего ± ошибка среднего. Оценку статистической значимости различий данных, полученных в сравниваемых выборках, осуществляли с использованием непараметрического критерия (U) Манна–Уитни и Краскела–Уоллиса. При проверке статистических гипотез использовали уровень значимости 5% (Р < 0.05).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
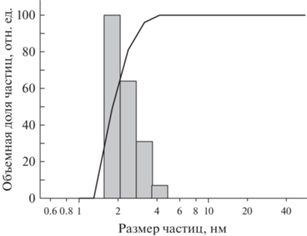
Синтезированный по методике [27] ПОМ анализировали комплексом методов. В ИК-спектре наблюдали следующие колебания: 1616, 1532, 1406, 970, 859, 780, 625, 670, 570, 439 см–1; в спектре КРС: 952, 909, 842, 717, 586, 518, 452, 370, 240 см–1. Совокупность спектров ИК и КРС позволяет получить наиболее полный и уникальный для химического соединения набор колебаний. Полученный для ПОМ набор колебаний соответствует приведенным в [27] данным, подробное описание и расшифровка спектров ИК и КРС представлены в [28, 29]. Результаты элементного анализа соответствуют расчетным значениям: С 1.5 ± 0.2% (1.5); H 2.4 ± 0.5% (2.8), Mo 39.8 ± 0.4% (40.1), Fe 8.6 ± ± 0.5% (8.9), в скобках указаны расчетные данные исходя из формулы соединения. Анализ свежеприготовленного раствора {Mo72Fe30} в дистиллированной воде (концентрация 1 мг/мл, равная вводимой животным) методом ДРС показал узкое распределение частиц по размерам, среднее значение составило 2.7 нм (рис. 1), что согласуется с размерами гидратированных ионов ПОМ (данные [27] по монокристальной рентгенографии 2.5 нм). Соответствие результатов анализа эталонным данным подтвердило получение нанокластерного ПОМ {Mo72Fe30}.
Рис. 1.
Объемное распределение частиц ПОМ по размерам в водном растворе (концентрация 1 мг/мл) по данным исследования методом ДРС. Средний диаметр частиц – 2.7 нм.
Введение ПОМ здоровым животным сопровождалось увеличением содержания железа в тимусе почти в 1.5 раза уже после однократной инъекции и в 2.3 раза после 30 инъекций (табл. 1). Данные о накоплении железа в тимусе после инъекций ПОМ согласуются с данными [17], где было показано увеличение количества тимоцитов, экспрессирующих белки теплового шока, что, возможно, было вызвано изменением гомеостаза в тимусе вследствие проникновения ПОМ.
Таблица 1.
Содержание железа в забарьерных органах после внутримышечных инъекций ПОМ ({Mo72Fe30}), мкг/г влажной ткани
| Группа | Головной мозг | Глаза | Тимус | Семенники | |
|---|---|---|---|---|---|
| 1 Контроль | 17.6 ± 1.5 | 48.0 ± 7.6 | 92.6 ± 13.5 | 21.0 ± 2.8 | |
| 2 ПОМ | 1-е сутки | 19.2 ± 5.8 | 54.3 ± 10,6 | 134.3 ± 3.1* | 24.4 ± 1.8 |
| 7 сут | 16.0 ± 2.8 | 59.9 ± 5.0 | 131.7 ± 1.5* | 19.4 ± 7.3 | |
| 30 сут | 34.3 ± 4.1* | 88.2 ± 10.2* | 213.7 ± 5.9* | 30.3 ± 2.6 | |
| 3 Анемия | 1-е сутки | 7.9 ± 0.9* | 26.6 ± 2.0* | 45.7 ± 8.6* | 25.4 ± 8.7 |
| 7 сут | 20.5 ± 2.5 | 26.6 ± 3.0* | 81.0 ± 16.3 | 25.9 ± 10.6 | |
| 30 сут | 19.1 ± 4.5 | 43.0 ± 2.8 | 69.3 ± 18.8 | 26.9 ± 3.8 | |
| 4 Анемия + ПОМ | 1-е сутки | 23.8 ± 9.4 | 31.3 ± 9.2 | 55.5 ± 13.82 | 20.5 ± 8.5 |
| 7 сут | 42.4 ± 6.3* 2,3 | 31.7 ± 5.7 2 | 105.0 ± 10.72 | 23.5 ± 0.7 | |
| 30 сут | 72.1 ± 8.6* 3 | 60.3 ± 7.5* | 81.4 ± 17.92 | 23.7 ± 3.5 | |
В головном мозге и глазных яблоках здоровых крыс накопление железа происходило только после 30 инъекций ПОМ, а в семенниках содержание железа не отличалось достоверно от уровня показателя интактных крыс после однократной инъекции и многократных инъекций ПОМ (табл. 1). Различие в поступлении железа из ПОМ в иммунопривилегированные органы может быть связано с разной скоростью кровотока и с разными механизмами прямого и обратного транспорта железа, которые недостаточно исследованы [30, 31].
Дефицит железа в крови крыс был получен путем моделирования ПГА и подтвержден гематологическими анализами и определением содержания железа в крови [32]. После моделирования ПГА уровень железа снижался в тимусе, головном мозге и глазных яблоках через сутки и оставался ниже нормы в глазных яблоках через 7 сут (табл. 1). В то же время ПГА не оказывала влияния на уровень железа в семенниках. К 30-м суткам после моделирования анемии количество железа во всех исследованных органах нормализовалось, что согласуется с ранее полученными данными о самопроизвольной коррекции количества эритроцитов, содержании гемоглобина и железа в крови через 30 сут после моделирования ПГА [32].
Однократное введение ПОМ после моделирования ПГА предотвращало потерю железа на первые сутки в головном мозге, тимусе и глазных яблоках, а 7- и 30-кратное введение ПОМ вызывало избыточное накопление железа в головном мозге через 7 и 30 сут и в глазных яблоках через 30 сут эксперимента (табл. 1). В тимусе инъекции ПОМ на фоне анемии не сопровождались увеличением уровня железа, вероятно, вследствие более эффективного выведения этого элемента. В семенниках уровень железа достоверно не отличался от нормы как при кровопотере, так и при введении ПОМ после кровопотери (табл. 1). Вероятно, гематотестикулярный барьер позволяет поддерживать уровень железа как при дефиците, так и при избытке этого элемента в организме.
В отличие от содержания железа уровень молибдена достоверно увеличивался только в головном мозге здоровых крыс и только после 30 инъекций ПОМ (табл. 2).
Таблица 2.
Содержание молибдена в забарьерных органах после внутримышечных инъекций ПОМ ({Mo72Fe30}) и продуктов деструкции ПОМ (Mo, Fe), мкг/г влажной ткани
| Группа | Головной мозг | Глаза | Тимус | Семенники | |
|---|---|---|---|---|---|
| 1 Контроль | 0.61 ± 0.21 | 0.73 ± 0.13 | 0.84 ± 0.30 | 0.72 ± 0.16 | |
| 2 ПОМ | 1-е сутки | 0.56 ± 0.24 | 0.47 ± 0.04 | 0.75 ± 0.13 | 1.00 ± 0.40 |
| 7 сут | 1.05 ± 0.23 | 0.44 ± 0.14 | 1.15 ± 0.20 | 0.51 ± 0.03 | |
| 30 сут | 3.70 ± 0.68* | 1.24 ± 0.43 | 0.90 ± 0.11 | 1.01 ± 0.10 | |
| 3 Анемия | 1-е сутки | 0.53 ± 0.09 | 0.18 ± 0.08* | 0.50 ± 0.07 | 0.63 ± 0.18 |
| 7 сут | 0.67 ± 0.27 | 0.15 ± 0.05* | 0.67 ± 0.27 | 1.10 ± 0.38 | |
| 30 сут | 0.55 ± 0.14 | 1.08 ± 0.24 | 0.71 ± 0.07 | 0.95 ± 0.45 | |
| 4 Анемия + ПОМ | 1-е сутки | 0.62 ± 0.29 | 0.78 ± 0.40 | 0.77 ± 0.23 | 1.05 ± 0.35 |
| 7 сук | 0.40 ± 0.062 | 0.50 ± 0.113 | 1.17 ± 0.18 | 0.50 ± 0.07 | |
| 30 сут | 0.60 ± 0.182 | 1.38 ± 0.11* | 1.05 ± 0.43 | 0.68 ± 0.142 | |
Обнаружено снижение уровня молибдена в глазных яблоках крыс на 1-е и 7-е сутки после моделирования ПГА. Вероятно, ПГА может сопровождаться потерей не только железа, но и других микроэлементов, недостаток которых может быть восполнен заимствованием из забарьерных органов. При коррекции ПГА введением ПОМ содержание молибдена превышало норму к 30-м суткам только в глазных яблоках (табл. 2).
Различия в изменении содержания железа и молибдена при однократном и многократном введении ПОМ, при кровопотере, а также кровопотере и введении ПОМ, вероятно, связаны с проникновением в органы не только целых НЧ, но и продуктов их деструкции, а также с различными механизмами прямого и обратного транспорта для железа и молибдена. В головной мозг железо поступает преимущественно при взаимодействии трансферрина с трансферриновыми рецепторами на эндотелии сосудов ГЭБ, а покидает мозг с ликвором, поэтому скорость поступления и выведения железа может быть различной [30]. Известно, что проникновение железа в головной мозг возможно при повышенной концентрации железа в крови [23, 24]. Вероятно, 30-кратная процедура нагрузки железом превышает барьерные возможности ГЭБ у здоровых крыс. В то же время однократное и семикратное введение ПОМ крысам с ПГА способствует коррекции дефицита железа. Возможно, коррекция дефицита железа у крыс на 1-е сутки после кровопотери происходит за счет большей проникающей способности железа в составе ПОМ по сравнению с ионами железа.
Изменения содержания железа в тимусе возможны при достаточно свободном переходе через гематотимусный барьер. Согласно данным о содержании железа в тимусе крыс при ПГА и введении ПОМ также можно заключить, что нет необходимости в 30-кратном введении ПОМ.
Устойчивость гематотестикулярного барьера к проникновению ПОМ и отдельных компонентов ПОМ, а также к потере железа при ПГА может быть связана с обеспечением постоянных условий, необходимых для сперматогенеза. Избыточное количество ионов с переменной валентностью, таких как железо и молибден, в семенниках может способствовать усилению свободнорадикального окисления, а развитие оксидативного стресса опасно усилением спонтанных мутаций. Дефицит железа также нежелателен, поскольку железо в качестве кофактора входит в состав каталазы, пероксидазы, цитохромов, участвующих в реакциях антиоксидантной защиты и энергетического обмена.
При терапевтическом применении ПОМ для коррекции кровопотери необходим контроль содержания железа и эритроцитарных показателей крови, чтобы не вызвать избыточного накопления железа в забарьерных органах.
Отметим, что имеются дополнительно моменты в виде предварительных результатов, указывающих на то, что в некоторых случаях гистогематические барьеры являются более проницаемыми для ионов ПОМ по сравнению с железом в более простых формах. Так, содержание железа в глазных яблоках было ниже при введении животным с ПГА вместо раствора ПОМ продуктов его деструкции, полученных после подщелачивания раствора, {Mo72Fe30} через 1, 7 и 30 сут: 19.5 ± 3.9, 17.4 ± 4.7, 35.0 ± 3.1 соответственно. Данный аспект представляет интерес для дальнейших исследований с целью установления возможных преимуществ адресной доставки лекарственных препаратов, конъюгированных с ПОМ.
ЗАКЛЮЧЕНИЕ
Наиболее устойчивым к проникновению компонентов железо-молибденовых ПОМ является гематотестикулярный барьер, меньшей степенью устойчивости обладают гематоэнцефалический и гематоофтальмический барьеры (накопление железа после 30 введений ПОМ), наименее устойчив гематотимусный барьер.
В ранние сроки (1-е–7-е сутки) ПГА происходит заимствование железа из иммунопривилегированных органов: головного мозга, глазных яблок, тимуса.
Устойчивость ГЭБ снижается при моделировании постгеморрагической анемии после семи инъекций ПОМ.
Различие в проникновении железа и молибдена в забарьерные органы здоровых и анемичных животных позволяет сделать предположение, что значительная часть ПОМ распадается на отдельные компоненты до поступления в органы.
Работа выполнена при частичной финансовой поддержке в рамках Государственного задания Министерства науки и высшего образования РФ (проект № 123031300049-8).
Список литературы
Arck P.C., Gilhar A., Bienenstock J., Paus R. // Curr. Opin. Pharmacol. 2008. V. 8. № 4. P. 480. https://doi.org/10.1016/j.coph.2008.06.003
Черешнев В.А., Шилов Ю.И., Черешнева М.В. и др. Экспериментальные модели в патологии: учебник. Пермь: Перм. гос. нац. исслед. ун-т, 2014. 324 с.
Морозов В.И., Яковлев А.А. Фармакотерапия глазных болезней. 6-е изд., перераб. и доп. М.: МЕДпрессинформ, 2009. 512 с.
Pearse G. // Toxicol. Pathol. 2006. V. 34. № 5. P. 504. https://doi.org/10.1080/01926230600865549
Mudd A.T., Fil J.E., Knight L.C. et al. // Nutrients. 2018. V. 10. № 2. P. 135. https://doi.org/10.3390/nu10020135
Chen M., Xu E., Zeng C. et al. // J. Nutrition. 2021. V. 151. № 9. P. 2835. https://doi.org/10.1093/jn/nxab189
Chen T., Li C., Li Y. et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. № 11. P. 9516. https://doi.org/10.1021/acsami.7b01171
Loureiro J.A., Andrade S., Duarte A. et al. // Molecules. 2017. V. 22. № 2. P. 277. https://doi.org/10.3390/molecules22020277
Marcianes P., Negro S., García-García L. et al. // Int. J. Nanomedicine. 2017. V. 12. P. 1959. https://doi.org/10.2147/IJN.S130908
Wen L., Tan Y., Dai S. et al. // Drug Delivery. 2017. V. 24. № 1. P. 1843. https://doi.org/10.1080/10717544.2017.1386731
Patel M.M., Patel B.M. // CNS Drugs. 2017. V. 31. № 2. P. 109. https://doi.org/10.1007/s40263-016-0405-9
Rueda F., Cruz L.J. // Curr. Pharm. Design. 2017. V. 23. № 13. P. 1879. https://doi.org/10.2174/1381612822666161221153228
Li S., Johnson J., Peck A., Xie Q. // J. Transl. Med. 2017. V. 15. № 18. P. 1. https://doi.org/10.1186/s12967-016-1115-2
Alhalafi A.M. // Oman J. Ophthalmology. 2017. V. 10. № 1. P. 3. https://doi.org/10.4103/0974-620X.200692
Adams R.D., Fedin V.P. // J. Clust. Sci. V. 2015. V. 26. № 1. P. 1. https://doi.org/10.1007/s10876-014-0792-3
Остроушко А.А., Гетте И.Ф., Медведева С.Ю. и др. // Российские нанотехнологии. 2013. Т. 8. № 9–10. С. 87.
Данилова И.Г., Гетте И.Ф., Медведева С.Ю. и др. // Российские нанотехнологии. 2016. Т. 11. № 9–10. С. 108.
Ostroushko A.A., Danilova I.G., Gette I.F. et al. // J. Biomater. Nanobiotechnol. 2011. № 2. P. 557. https://doi.org/10.4236/jbnb.2011.225066
Остроушко А.А., Данилова И.Г., Гетте И.Ф. и др. // Журн. неорган. химии. 2015. Т. 60. № 4. С. 561.
Остроушко А.А., Гетте И.Ф., Данилова И.Г. и др. // Российские нанотехнологии. 2014. Т. 9. № 9–10. С. 101.
Остроушко А.А., Гагарин И.Д., Тонкушина М.О. и др. // Журн. физ. химии. 2017. Т. 91. № 9. С. 1594.
Остроушко А.А., Улитко М. В., Тонкушина М.О. и др. // Российские нанотехнологии. 2014. Т. 13. № 1–2. С. 3.
Unger E.L., Earley C.J., Thomsen L.L. et al. // Neuroscience. 2013. V. 246. № 29. P. 179. https://doi.org/10.1016/j.neuroscience.2013.04.049
Guo X., Zheng H., Guo Y. et al. // Nanobiotechnol. 2017. V. 15. № 42. P. 1. https://doi.org/10.1186/s12951-017-0277-2
Huebner S.M., Blohowiak S.E., Kling P.J. et al. // J. Nutrition. 2016. V. 146. № 6. P. 1180. https://doi.org/10.3945/jn.115.227983
Müller A., Krickemeyer E., Bögge H. et al. // Angew. Chem. Int. Ed. 1998. V. 37. № 24. P. 3359. https://doi.org/10.1002/(SICI)1521-3773(19981231)37:24<3359::AID-ANIE3359>3.0.CO;2-J
Mueller A., Sarkar S., Nazir Shah S.Q. et al. // Angew. Chem. Int. Ed. 1999. 38. 21. P. 3238. https://doi.org/10.1002/(SICI)1521-3773(19991102)38:21<3238::AID-ANIE3238>3.0.CO;2-6
Grzhegorzhevskii K.V., Zelenovskiy P.S., Koryakova O.V. et al. // Inorgan. Chim. Acta. 2019. V. 489. P. 287. https://doi.org/10.1016/j.ica.2019.01.016
Ostroushko A., Gagarin I., Tonkushina M. et al. // J. Clust. Sci. 2018. V. 29. P. 111. https://doi.org/10.1007/s10876-017-1304-z
Белова А.Н., Соловьева В.С., Бойко А.Н. // Журнал неврологии и психиатрии им. С.С. Корсакова. 2018. Т. 118. № 8–2. С. 10. https://doi.org/10.17116/jnevro201811808210
Шумакова А.А., Апрятин С.А., Шипелин В.А. и др. // Вопросы питания. 2020. Т. 89. № 5. С. 17. https://doi.org/10.24411/0042-8833-2020-10062
Остроушко А.А., Гетте И.Ф., Бриллиант С.А., Данилова И.Г. // Российские нанотехнологии. 2019. Т. 14. № 3–4. С. 75.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


