Российские нанотехнологии, 2024, T. 19, № 1, стр. 103-111
Улучшение биодоступности труднорастворимых препаратов путем переосаждения на наноструктурированных поверхностях
О. Д. Смирнова 1, *, В. Ю. Мусатова 2, И. В. Калашникова 1, С. В. Алешин 1, С. А. Семенов 2, Л. В. Кострюкова 3, Г. Е. Морозевич 3
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
Москва, Россия
3 Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
Москва, Россия
* E-mail: smirnova0ksana@ya.ru
Поступила в редакцию 12.06.2023
После доработки 11.10.2023
Принята к публикации 11.10.2023
Аннотация
Предлагаются пути улучшения биодоступности труднорастворимых препаратов переосаждением из растворов в универсальных растворителях на наноструктурированных поверхностях, включающих в себя наночастицы (НЧ): SiO2, Fe3O4. Этот же эффект был обнаружен на металлополимерных композитах, содержащих Со, Ni и Fe, полученных из ненасыщенных дикарбоксилатов. В обоих случаях это достигается за счет увеличения суммарной поверхности десорбции. На примерах ресвератрола и препарата суммы фурокумаринов “Аммифурина” показано увеличение доли удельной десорбции препаратов с поверхности наноструктурированных CaCO3-частиц в водные растворы на 2 порядка. Результаты МТТ-тестов на клетках рака шейки матки HeLa и карциномы печени HepG2 человека показали схожее влияние “Аммифурина” и использованных для исследований металлополимерных нанокомпозитов Co, Ni и Fe, тем самым делая их совместное применение потенциально возможным. Таким образом, предлагается способ улучшения биодоступности широкого класса препаратов, потенциально применимый для всех случаев, когда токсичность несущих НЧ не превышает самостоятельной токсичности целевого вещества. Возможность взаимного усиления токсичности требует отдельного исследования и здесь не рассматривается.
ВВЕДЕНИЕ
Понятие биологической доступности определяется долей поступившего в кровь лекарственного вещества от общего его содержания в соответствующей лекарственной форме, скоростью появления в кровеносном русле и продолжительностью нахождения его определенной концентрации в организме [1].
К числу препаратов, которые, по мнению ВОЗ, требуют повышения биодоступности, относят стероидные гормоны, сердечные гликозиды, препараты гипогликемического действия, противосудорожные, кумариновые антикоагулянты, антибиотики, химиотерапевтические препараты и многие другие [1, 2]. Например, антиоксидантные агенты чаще всего имеют низкую растворимость и плохую химическую стабильность, при этом быстро разрушаются в пищеварительном тракте [2]. Часто проблему недостаточной растворимости решают введением в результирующую терапевтическую смесь специальных растворителей (диметилсульфоксид (ДМСО), этанол, глицерин и некоторые другие), имеющих множественные самостоятельные побочные эффекты и ограничения.
Рассмотрим способ увеличения эффективной концентрации в водных растворах препарата за счет увеличения суммарной площади поверхности его десорбции. Предполагаем, что существует ненулевое время запаздывания конденсации относительно процесса десорбции в водный раствор с наноструктурированных носителей. Действительно, процесс конденсации из пресыщенного раствора должен занимать конечное время и изначально должен иметь место факт превышения предельной растворимости. С учетом того что некоторые достаточно малые размеры конденсированных частиц могут быть биодоступными для клеточного фаго- и пиноцитоза, любая положительная разница скоростей десорбции и конденсации может обеспечить увеличение эффективной концентрации препарата в водных смесях над поверхностью десорбции при увеличении площади поверхности, а значит, и биодоступности. Поэтому наноструктурированные поверхности при покрытии конденсированным труднорастворимым препаратом могут улучшить его биодоступность [2].
Центральным объектом проводимого исследования является препарат суммы фурокумаринов “Аммифурин”, получаемый ФГБНУ “ВИЛАР” экстракцией из корневищ Ammi majus L. и представляющий собой сухой желтый порошок с размером частиц поликристаллов 20–120 мкм (рис. 1а). Итоговая сумма кумаринов (изопимпинеллина, бергаптена и ксантотоксина) [3, 4] обладает неудовлетворительной биодоступностью, равной 0.55 мас. % в 96%-ном этаноле при 25°С [5], из-за плохой растворимости в водных средах и неполярных растворителях. Препарат принимают перорально в виде таблеток 0.02 г (рег. номер ЛС-002598), а также наносят трансдермально в виде спиртового раствора (рег. номер ЛСР-001964/07) в качестве фотосенсибилизирующего средства при витилиго, гнездной и тотальной плешивости, псориазе [4, 6, 7]. При этом в первом случае затруднительно ожидать полного растворения препарата в желудочно-кишечном тракте (ЖКТ) и, наоборот, велика вероятность возникновения побочных эффектов, вызванных токсично высоким содержанием фурокумаринов внутри ЖКТ. Спиртовые растворы сами по себе имеют широкий ряд побочных эффектов и ограничений применимости.
Фармакологическая роль кумаринов обширна, но исследована не полным образом. Многие фурокумарины обладают фотосенсибилизирующей активностью [6–10]. Известны их бактериостатическая, широкая противовирусная и антимитозная активность [6, 7, 11–13], антикоагулирующие свойства [6, 7, 9, 11, 14, 15], спазмолитическая [6, 7, 9, 16], противоязвенная [6, 9, 17] и желчегонная активности, коронарорасширяющие и бета-блокирующие действия [6, 9, 11, 17], а также блокирование кальциевых каналов [18]. Фурокумарины рассматривают как противоопухолевые [6, 9, 19–22] и иммуностимулирующие препараты [7, 11, 12], а также как препараты, обладающие фотодинамической активностью с ингибированием системы цитохрома CYP3A4 [23].
Второй препарат, рассмотренный в работе, – ресвератрол (рис. 1б) – растительный полифенол (фитоалексин), синтезируемый некоторыми растениями в качестве защитной реакции против паразитов, широко известен как один из лучших антиоксидантов и гепатопротекторов и также обладает низкой самостоятельной растворимостью в воде (~10–5) [24].
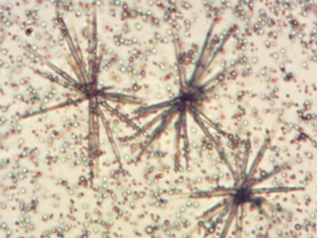
Хорошими растворителями для фурокумаринов являются ДМСО и N-метилпирролидон, в которых они растворяются при 25°С до 0.15 и 0.2 массовых долей соответственно. Но такие композиции не нашли широкого применения в медицине, возможно, в силу вероятности получения локальных токсичных эффектов, а также в силу того, что при разбавлении водными средами со временем происходит конденсация фурокумаринов в колючкообразные кристаллы (рис. 2) [1, 5, 14].
Проверена возможность переосаждения препаратов фурокумаринов и ресвератрола из растворов в ДМСО и N-метилпирролидоне на поверхностях ватерита, дополнительно структурированного наночастицами (НЧ), и на поверхности самих НЧ в водной среде. Ватерит является аморфной формой СаСО3, формируемой в водном растворе при эквимолярном смешении CaCl2 и Na2CO3, в виде шарообразных частиц микронного размера, имеющих сложную наноструктурированную поверхность. Однако ватерит постепенно перекристаллизуется в водных средах в кристаллический СаСО3 (кальцит) в виде ромбоэдрических кристаллов. Проведенные исследования показали, что дополнительная модификация частиц ватерита биорезорбируемыми полимерами изменяет темпы перекристаллизации (в зависимости от баланса катионных и анионных групп в полимерах: анионные, как правило, стабилизируют ватерит) и улучшает десорбцию иммобилизированных на нем препаратов вследствие понижения поверхностной энергии [25]. При этом стабилизировать структуру ватерита от дальнейшей перекристаллизации можно включением в состав НЧ на стадии формирования СаСО3 при конденсации из реакции CaCl2 с Na2CO3: в результате получается стабильная суспензия, которую можно пропускать сквозь микронные дозаторы без их закупорки. Область потенциального применения препаратов, иммобилизированных рассматриваемыми способами, – транс-дермальные, пероральные и, возможно, интраназальные введения.
МАТЕРИАЛЫ И МЕТОДЫ
Использованные НЧ SiO2 – частицы кремнезема, выделенные ультрафильтрационным мембранным концентрированием гидротермального раствора, полученного из скважин Мутновского вулкана в НИГТЦ ДВО РАН, с размерами частиц 5–16 нм, с максимумом распределения 9–10 нм.
НЧ магнетита Fe3О4, имеющие размеры 5–16 нм, были синтезированы осаждением с общей формулой
Использованные в работе магнитоактивные металлополимерные нанокомпозиты кобальта(II), никеля(II) и железа (d = 4–8 нм), полученные в результате контролируемого термолиза ряда ненасыщенных дикарбоксилатов этих металлов в атмосфере аргона (малеинатов кобальта, никеля и железа, а также итаконата и цитраконата железа), – порошки, состоящие из двух структурных элементов: в органическую полимерную матрицу, содержащую фрагменты –СН–, =СН– и =С=, внедрены сферические НЧ Co3O4/CoО, NiO/Ni или γ-Fe2O3 в полимерной оболочке структуры “ядро–оболочка” по данным рентгенофазового анализа, мессбауэровской спектроскопии, просвечивающей электронной микроскопии высокого разрешения, энергодисперсионного и элементного анализов, ИК-спектроскопии. Все указанные нанокомпозиты обладают собственным магнитным моментом и магнитной восприимчивостью, причем наибольшая коэрцитивная сила (Hc) наблюдается у нанокомпозита Со, полученного в результате термолиза малеината Со (25.39 кА/м). Hc нанокомпозитов на основе малеинатов Ni и Fe, а также итаконата и цитраконата Fe составляют 7.56, 6.76, 9.47 и 8.04 кA/м [26, 27].
Для краткости будем использовать следующие обозначения металлополимерных нанокомпозитов Co, Ni и Fe, полученных в результате термического разложения ненасыщенных дикарбоксилатов этих металлов, а именно: малеината кобальта – Со33, малеината никеля – Ni33, малеината железа – Fe13, итаконата железа – Fe23, цитраконата железа – Fe33.
Метод спектрофотометрического определения концентрации. Содержание кумаринов в частицах определяли спектрофотометрически на приборе Shimadzu 3600 UV-Vis-NIR после растворения сухих навесок в ДМСО по соотношению площадей интегрального спектра от 235 до 350 нм характеристического поглощения растворов с соответствующими предварительно полученными калибровочными зависимостями растворов исходного порошка кумаринов в ДМСО. Аналогично определяли количество фурокумаринов, десорбированных с поверхности частиц-носителей при их экспозиции в водных растворах в соотношении 1 : 20 (для попадания в область линейной калибровочной зависимости спектрофотометрически анализируемые растворы разбавляли). При анализе величин оптических плотностей спектры нормировали на аналогичные бескумариновых растворов.
Электронная микроскопия. Морфологию поверхности поликристаллов изучали с помощью сканирующего электронного микроскопа (СЭМ) Versa 3D DualBeam (FEI, США) в режиме высокого вакуума. Изображения получены с использованием детектора вторичных электронов ETD при ускоряющих напряжениях 2 и 10 кВ и значениях тока в диапазоне 30–50 пА, что позволило минимизировать накопление электрического заряда на образцах, усилить топографический контраст, а также увеличить пространственное разрешение полученных изображений.
Размеры и ζ-потенциалы частиц в водных суспензиях исследовали методом динамического рассеяния света на приборе Malvern Zetasizer Nano ZSP. Полученные результаты отражены в табл. 1.
Таблица 1.
Значения размеров dcр и ζ-потенциалов использованных суспензий НЧ с содержанием 10–4 массвых долей
| Тип частиц | dcр, нм | ζ, мВ |
|---|---|---|
| Fe3O4 | 70 | –10.0 ± 3.0 |
| Fe13 | 44 | –16.0 ± 4.2 |
| Fe23 | 22 | –17.4 ± 4.8 |
| Fe33 | 52 | –10.4 ± 4.1 |
| Co33 | 63 | –33.0 ± 13.0 |
| Ni33 | 44 | –12.6 ± 3.7 |
| SiO2 | 10 | –11.0 ± 3.0 |
Определение содержания доли препаратов в иммобилизированных формах. Оценку содержания фурокумаринов и ресвератрола в наноструктурированных частицах проводили двумя параллельными методами: высокоэффективной жидкостной хроматографии (ВЭЖХ) и спектрофотометрически (после выдерживания в ДМСО с перемешиванием в течение 2 сут 0.1 г частиц в 2 мл и оценки количества препарата в приближении полного растворения в ДМСО).
ВЭЖХ-анализ образцов, содержащих ресвератрол, осуществляли на хроматографе Agilent 1200 с УФ-детектированием при длине волны 306 нм после растворения сухих навесок СаСО3-частиц и известного количества стандартной субстанции ресвератрола в ДМСО и метаноле, количественное содержание определяли по соотношению площадей пиков. Использовали изократический режим элюирования: компоненты подвижной фазы – ацетонитрил и вода в соотношении 30 на 70% соответственно, объем вводимой пробы 20 мкл, хроматографическая колонка Kromasil: 100–C18 250 × 4.6, время анализа – 15 мин.
ВЭЖХ-анализ образцов, содержащих “Аммифурин”, осуществляли на хроматографе Agilent 1200 с УФ-детектированием при длине волны 310 нм после растворения сухих навесок СаСО3-частиц и известного количества стандартной субстанции “Аммифурина” в ДМСО и метаноле, количественное содержание определяли по соотношению площадей пиков. Использовали градиентный режим элюирования: компоненты подвижной фазы – ацетонитрил и вода, содержание ацетонитрила в составе подвижной фазы от начала анализа до 5-й минуты 40–45%, от 5-й до 20-й – 45–80%, объем вводимой пробы – 20 мкл, хроматографическая колонка Kromasil: 100–C18 250 × 4.6, время анализа 20 мин.
Исследования десорбции препаратов. Для оценки десорбции сопоставляемых веществ навески брали по 0.1 г полученных сухих частиц заливали 2 мл воды с рН = 3, 6.5 и 9 и инкубировали при перемешивании 300 об./мин. Через различные временные интервалы проводили отбор проб по 350 мкл, которые осаждали в течение 2 мин при 5000 g, а полученные супернатанты подвергали спектрофотометрическому исследованию.
Оценка цитотоксического действия нанокомпозитов и “Аммифурина”. В экспериментах по определению цитотоксичности нанокомпозитов использовали два вида раковых клеток человека: гепатоцеллюлярную карциному печени НерG2 и опухоль шейки матки HeLa, полученные из Американской коллекции типовых культур и поддерживаемые в коллекции клеточных культур НИИ биомедицинской химии имени В.Н. Ореховича. Клетки культивировали в среде DMEM (ПанЭко, Россия) с добавлением 10% фетальной бычьей сыворотки (FBS; Gibco), 2 мкМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина (Thermo Scientific, Waltham, MA, USA) при температуре 37°C в присутствии 5% СО2.
Клетки рассеивали в стерильные 96-луночные культуральные планшеты плотностью 105 клеток на лунку и инкубировали при 37°С в атмосфере 5% CO2 (СО2-инкубатор “Sanyo”, Япония) в течение 24–26 ч. Далее в планшеты вносили исследуемые вещества (металлополимерные нанокомпозиты Сo, Ni и Fe, полученные из ненасыщенных дикарбоксилатов Ni33, Fe33, Со33 или сумму фурокумаринов “Аммифурин”) в концентрациях по 0.1–1000 мкМ (разведение с шагом 10); разведения образцов осуществляли культуральной средой без сыворотки. Клетки инкубировали с образцами 96 ч при 37°С в атмосфере 5% CO2. Оценку жизнеспособности клеток проводили с использованием колориметрического МТТ-теста (“Sigma”). Регистрировали поглощение при 570 нм на планшетном фотометре со спектрофотометрической и флюорометрической детекцией GENios Plus (Tecan, Австрия) и нормировали на необработанный контроль. Уровень ингибирования роста клеток вычисляли по формуле
где GI – доля ингибирования роста клеток в культуре (growth inhibition) в %, ODо и ODk – оптическая плотность раствора формазана (при проведении МТТ-теста) в опытных и контрольных лунках соответственно.Приготовление СаСО3-частиц. Исходные сухие субстанции (“Аммифурин” либо ресвератрол) растворяли в ДМСО либо в N-метилпирролидоне до 10 мас. %. Готовили взвесь 10–3 массовых долей НЧ либо металлополимерных нанокомпозитов в воде с диспергированием ультразвуком в режиме 24 кГц мощностью 280 Вт в течение 2 мин. Затем к НЧ вводили 1% лизоцима, перемешивая механически до полного растворения белка. Следом в эту смесь вводили равную объемную долю 1 М CaCl2 в деионизированной воде и оставляли перемешиваться на магнитной мешалке. Раствор кумаринов в ДМСО смешивали с двукратным объемом этанола (для растворов в N-метилпирролидоне этанол не использовали) и вливали в перемешиваемую смесь с НЧ одновременно с эквимолярным CaCl2 количеством Na2CO3. Общую смесь перемешивали 20 мин, затем полученные частицы осаждали центрифугированием при 2000 g, супернатанты сливали, а частицы дважды промывали 20-кратным объемом деонизированной воды. Полученные частицы подвергали лиофильной сушке. Вид получившихся частиц представлен на рис 3.
Рис. 3.
Внешний вид получаемых СаСО3-частиц с лизоцимом и смесью фурокумаринов: а – Ammi/Fe23/Lys/СаСО3, б – Ammi(DMSO)/Fe3O4/ Lys/СаСО3, в – Res/Lys/SiO2/СаСО3 .

Иммобилизация фурокумаринов на наночастицах SiO2. “Аммифурин” растворяли в N-метилпирролидоне в соотношении 1 : 10. Полученный раствор инкубировали в течение суток (5 : 1) с частицами SiO2, на поверхности которых “Аммифурин” адсорбировался из раствора в ДМСО, в четырех вариантах: частицы чистого SiO2 (Ammi/SiO2); частицы SiO2, покрытые лизоцимом (Ammi/SiO2/Lys); частицы SiO2, покрытые хитозаном (Ammi/SiO2/Chit); частицы SiO2, покрытые последовательно хитозаном и декстран сульфатом (Ammi/SiO2/Chit/DS). Нанесение лизоцима, хитозана и декстран сульфата осуществлялось предварительной двухчасовой инкубацией частиц SiO2 в 3%-ном растворе соответствующего полимера осаждением центрифугированием при 20 000 g c последующей сушкой осадка при 60°C в течение 6 ч.
После инкубации в растворе “Аммифурина” частицы осаждали центрифугированием при 20 000 g, промывали деионизированной водой с аналогичным осаждением и последующей сушкой осадка при 60°C. Полученные частицы исследовали на десорбцию фурокумаринов в воду в сопоставлении с “Аммифурином”. Для этого навески частиц инкубировали в деионизированной воде в соотношении 1 : 100 при 25°С и постоянном перемешивании в режиме 500 об./мин. Через 5 и 100 мин отбирали пробы суспензии частиц, осаждали центрифугированием и исследовали супернатант на содержание фурокумаринов методом ВЭЖХ. Массовую долю препарата от его содержания в частицах-носителях, перешедшую в раствор, будем называть удельной десорбцией, а ее отношение к таковой у чистого препарата – кратностью улучшения десорбции. Полученные результаты представлены в табл. 2, 3.
Таблица 2.
Параметры полученных частиц
| Тип частиц | Содержание фурокумаринов, % | dср, нм | ζ-потенциал, мВ |
|---|---|---|---|
| Аmmi | 98.00–100.00 | >20 000 | –12.0 ± 3.0 |
| Ammi/SiO2 | 44.02 | 230 ± 50 | 1.5 ± 0.5 |
| Ammi/SiO2/Lys | 14.47 | 290 ± 30 | 3.0 ± 1.0 |
| Ammi/SiO2/Chit | 41.78 | 270 ± 60 | 12.0 ± 3.0 |
| Ammi/SiO2/Chit/DS | 21.14 | 280 ± 80 | –15.0 ± 3.0 |
Таблица 3.
Сравнение водных растворов при десорбции фурокумаринов с SiO2-частиц
| Тип частиц | Содержание фурокумаринов, ×10–6 мас. доля | Удельная раство-римость фуроку- маринов, г/г | Относительное увеличение удельной растворимости | |
|---|---|---|---|---|
| Кратность | τ десорбции, мин | |||
| Ammi | 78.7 | 0.0078 | 1.00 | 5 |
| 136.0 | 0.0137 | 1.00 | 100 | |
| Ammi/SiO2 | 152.0 | 0.0346 | 4.40 | 5 |
| 190.0 | 0.0432 | 3.20 | 100 | |
| Ammi/SiO2/Lys | 409.0 | 0.2831 | 36.00 | 5 |
| 371.0 | 0.2564 | 18.80 | 100 | |
| Ammi/SiO2/Chit | 148.0 | 0.0353 | 4.50 | 5 |
| 182.0 | 0.0435 | 3.19 | 100 | |
| Ammi/SiO2/Chit/DS | 131.0 | 0.0618 | 7.9 | 5 |
| 147.0 | 0.0697 | 5.1 | 100 | |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты исследования размеров и ζ-потенциалов водных суспензий использованных НЧ приведены в табл. 1. Очевидно, что проведенного ультразвукового диспергирования не достаточно для образования стабильных дисперсий одиночных НЧ, тем не менее внедрение их в состав частиц ватерита по описанной методике способствует формированию устойчивых к перекристаллизации длительное время эллипсоидальных СаСО3-частиц, форма которых тем более близка к шарообразной, чем выше по модулю ζ-потенциал исходной суспензии НЧ и чем меньше их динамические размеры. Оптимумы соотношения компонентов были выбраны в условиях узких концентрационных диапазонов.
Не все исследованные металлополимерные нанокомпозиты, содержащие Co, Ni и Fе, полученные из ненасыщенных дикарбоксилатов этих металлов, оказались удобны для введения в частицы ватерита по ряду комплексных причин. В итоге сконцентрировали внимание на нанокомпозитах Co, Ni и Fe, прекурсорами которых были малеинаты Сo и Ni и цитраконат Fe.
Для возможности использования НЧ в качестве компонентов носителей препаратов стоит учитывать данные самостоятельной токсичности этих НЧ. Вероятно, она должна быть существенно ниже токсичности основного целевого лекарственного вещества в выбранном соотношении для готовой терапевтической формы. Интерес для исследования в связи с отсутствием открытых данных представляли использованные металлополимерные нанокомпозиты, содержащие Co, Ni и Fe, а также сама смесь фурокумаринов. Результаты МТТ-тестов на раковых клетках шейки матки HeLa и карциномы печени HepG2 человека (рис. 4а, 4б) показали схожее влияние использованных нанокомпозитов и “Аммифурина”: по динамике изменения доли ингибирования роста c концентрацией выбранных нанокомпозитов вплоть до 10–5 массовых долей НЧ не токсичнее самого целевого препарата фурокумаринов. В предположении отсутствия взаимного усиления токсичности это делает их совместное применение потенциально возможным.
Рис. 4.
Сопоставление долей ингибирования клеток (по данным МТТ-тестов) НЧ металлополимерных композитов, содержащих Ni, Fe и Co, а также “Аммифурина” для клеток рака шейки матки HeLa (а) и карциномы печени HepG2 (б), где 1 – HeLa/HepG2-Fe33, 2 – HeLa/HepG2-Co33, 3 – HeLa/HepG2-Ni33, 4 – HeLa/HepG2-Ammi.
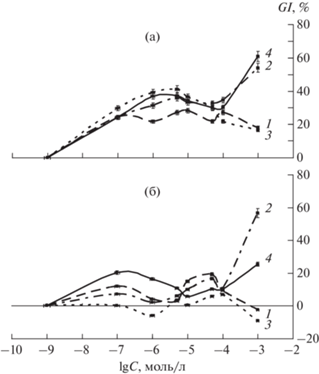
Также прослеживается влияние физико-химических свойств данных металлополимерных нанокомпозитов, содержащих Co, Ni и Fe, на процесс ингибирования исследованных раковых клеток в области С = 10–4–10–3 моль/л, выражающееся в зависимости доли ингибирования от величины Hc нанокомпозитов. Полученные результаты позволяют предположить перспективность нанокомпозитов из синтезированного ряда для дальнейших исследований. Интересно, что доля ингибирования раковых клеток карциномы печени в случае исследованного нанокомпозита, полученного из малеината Со, выше, чем доля ингибирования для “Аммифурина”.
Для самостоятельного использования в качестве носителей кумаринов и ресвератрола исследованные методом переконденсации НЧ металлополимерных композитов, содержащих Со, Ni и Fe, оказались мало пригодны вследствие образования крупных агрегатов. В то время как отдельно НЧ SiO2 показали лучшую применимость с точки зрения получаемых механо-химических свойств водных суспензий. Поэтому для сравнительных исследований использовали просто НЧ SiO2 с покрытием несколькими вариантами биорезорбируемых полимеров: хитозаном и декстран сульфатом, а также белком лизоцимом. Результаты исследований размеров и ζ-потенциалов полученных частиц представлены в табл. 2. Покрытие полимерами улучшило стабильность получаемых суспензий и десорбцию иммобилизированных препаратов, вероятно, за счет уменьшения поверхностной энергии НЧ.
Результаты сравнительного анализа супернатантов после десорбции с поверхности кремниевых НЧ с различными вариантами покрытия полимерами, полученные с помощью метода ВЭЖХ, приведены в табл. 3.
Динамика изменения концентрации фурокумаринов в растворах десорбции показала в целом схожие темпы их высвобождения из всех наноструктурированных форм (рис. 5) с достижением максимума уже в течение первых минут инкубации в воде. Наилучшие показатели по доле десорбированного вещества (от его общего исходного содержания в иммобилизированной форме) и его итоговому эффективному (измеряемому спектофотометрически) содержанию в растворе десорбции получили для НЧ SiO2, покрытых лизоцимом и слоями хитозана и декстран сульфата, а также для частиц ватерита, структурированных SiO2 совместно с лизоцимом. Для частиц ватерита, структурированных НЧ металлополимерных композитов, содержащих Co, Ni и Fe, наилучшие показатели десорбции фурокумаринов выявлены для нанокомпозита, полученного из малеината никеля, в то время как механо-химические характеристики наиболее стабильны для нанокомпозита, прекурсором которого был итаконат железа. Сопоставление данных десорбции фурокумаринов из разных форм препарата на основании спектроскопии растворов представлено в табл. 4. Вероятно, иммобилизационный потенциал рассмотренных нанокомпозитов изучен нами в недостаточной степени и возможно достижение лучших показателей, для чего необходимы дальнейшие исследования.
Рис. 5.
Изменение содержания фурокумаринов из частиц в растворе десорбции со временем при pH = 3, 7 и 9: 1, 2, 3 – Ammi; 4, 5, 6 – Ammi/CaCo3/Lys; 7, 8, 9 – Ammi/Fe23/Lys/CaCO3 при соотношении частицы : H2O = 1 : 20.
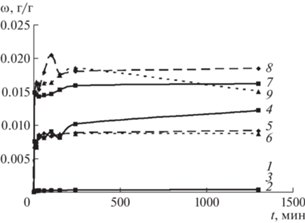
Таблица 4.
Сравнение водных растворов при десорбции фурокумаринов из частиц за 24 ч при 25°С с массовым соотношением частицы : H2O = 1 : 20
| Тип частиц | Массовая доля кумаринов | Удельная десорбция кумаринов | Массовая доля кумаринов в растворе десорбции, ×10–3 | ||||
|---|---|---|---|---|---|---|---|
| рН = 3 | рН = 6.5 | рН = 9 | рН = 3 | рН = 6.5 | рН = 9 | ||
| Ammi | 1.000 | 0.0003 | 0.0003 | 0.0003 | 0.0065 | 0.0055 | 0.0064 |
| Ammi/СаСО3/Lys | 0.005 | 0.0120 | 0.0090 | 0.0090 | 0.0010 | 0.0010 | 0.0010 |
| Ammi/Fe3O4/Lys/СаСО3 | 0.166 | 0.0160 | 0.0180 | 0.0170 | 0.0530 | 0.0610 | 0.0580 |
| Ammi/Fe23/Lys/СаСО3 | 0.071 | 0.0330 | 0.0340 | 0.0350 | 0.0480 | 0.0490 | 0.0490 |
| Ammi/Ni33/Lys/СаСО3 | 0.208 | 0.0120 | 0.0140 | 0.0140 | 0.0480 | 0.0590 | 0.0570 |
| Ammi/SiO2/Lys/СаСО3 | 0.021 | 0.2700 | 0.3300 | 0.4300 | 0.2900 | 0.3490 | 0.4520 |
| Ammi/SiO2/СаСО3 | 0.031 | 0.3900 | 0.4700 | 0.4200 | 0.6090 | 0.7270 | 0.6540 |
В целом показано, что с поверхности наноструктурированных СаСО3-частиц фурокумарины десорбируются в десятки раз большем количестве, чем с поверхности исходного порошка “Аммифурина”.
Сравнение влияния использованных промежуточных растворителей на десорбцию. Дополнительно сравнили влияние исходного растворителя, используемого для переосаждения, на наблюдаемые показатели десорбции фурокумаринов. Результаты представлены в табл. 5. Для исследованных вариантов композиций использование N-метилпирролидона в качестве промежуточного растворителя видится оптимальным.
Таблица 5.
Сравнение водных растворов при десорбции фурокумаринов из частиц за 1 ч при 25°С с массовым соотношением частицы : H2O = 1 : 20
| Тип частиц | Удельная десорбция × 10–3 | Кратность улучшения десорбции фурокума-ринов |
|---|---|---|
| Ammi | 0.004 | 1 |
| Ammi(DMSO)/SiO2/CaCO3 | 0.072 | 18 |
| Ammi(DMSO)/Lys/SiO2/CaCO3 | 0.077 | 19 |
| Ammi(N-MP)/SiO2/CaCO3 | 0.109 | 27 |
| Ammi(N-MP)/Lys/SiO2/CaCO3 | 0.173 | 43 |
Иммобилизация ресвератрола. Аналогичные исследования по иммобилизации ресвератрола показали, что наиболее удобным вариантом для улучшения десорбции в водный раствор является система иммобилизации на ватерите СаСО3, структурированном НЧ SiO2 и лизоцимом. В табл. 6 приведены значения удельной десорбции ресвератрола, полученные методом ВЭЖХ.
Таблица 6.
Сравнение водных растворов при десорбции ресвератрола
| Тип частиц | Содержание ресвератрола в растворе над частицами, ×10–3 | Удельная десорбция с частиц, мас. доля | ||||
|---|---|---|---|---|---|---|
| рН = 3 | рН = 6.5 | рН = 9 | рН = 3 | рН = 6.5 | рН = 9 | |
| Res | 0.026 | 0.027 | 0.028 | 0.00052 | 0.00054 | 0.00055 |
| Res/Lys/SiO2/СаСО3 | 0.043 | 0.073 | 0.063 | 0.02100 | 0.03500 | 0.03000 |
| Кратность улучшения десорбции | 1.7 | 2.7 | 2.3 | 39 | 64 | 54 |
Видно, что иммобилизация на наноструктурированном СаСО3 существенно улучшает десорбцию ресвератрола в водные среды. При этом десорбция ресвератрола с поверхности порошка чистой субстанции после 15 мин не зависит от времени, в то время как десорбция с поверхности частиц, модифицированных SiO2 и лизоцимом, плавно нарастает в кислой среде, а наибольшие значения принимает в нейтральной. Суммарное содержание ресвератрола в растворе над его содержащими частицами ватерита, сформированными в смеси с SiO2-суспензией в растворе лизоцима, в 2.5 выше, чем над чистым ресвератролом, а удельная десорбция эффективнее в 50–60 раз.
ЗАКЛЮЧЕНИЕ
Таким образом, иммобилизация фурокумаринов и ресвератрола на наноструктурированном СаСО3, включающем в себя НЧ SiO2, Fe3O4 и металлополимерных композитов, содержащих Со, Ni и Fe, полученных из ненасыщенных дикарбоксилатов этих металлов, при соосаждении в водных растворах из растворов в ДМСО или N-метилпирролидоне повышает удельную (в расчете на общее содержание активного вещества) десорбцию в водных растворах, эффективное содержание в водных растворах и результирующую биодоступность. Описанная методика переосаждения труднорастворимых препаратов на наноструктурированных поверхностях может быть предложена для широкого круга иных препаратов, предлагаемых для перорального и трансдермального применения. Можно также предположить, что динамическое увеличение содержания десорбируемых с наноструктурированных поверхностей веществ над их поверхностью относительно их предельной растворимости в ряде случаев может являться одной из причин токсичности НЧ с наличием тяжелых металлов в оболочках в виде отравления этими металлами. Исходя из полученных результатов МТТ-тестов на раковых клетках шейки матки HeLa и карциномы печени HepG2 представляют интерес дальнейшие исследования возможного совместного применения “Аммифурина” и нанокомпозитов, содержащих Со, Ni и Fe, полученных из ненасыщенных дикарбоксилатов этих металлов, в качестве потенцильных противоопухолевых препаратов.
Авторы выражают благодарность К.В. Паламарчуку за синтез НЧ Fe3O4 и предоставление НЧ SiO2 для экспериментов, Р.А. Камышинскому (Ресурсный центр “Нанозонд” НИЦ “Курчатовский институт”) за получение СЭМ-изображений, С.Н. Малахову (Ресурсный центр “Оптика” НИЦ “Курчатовский институт”) за помощь в спектрофотометрии.
Результаты получены с использованием Ресурсных центров “Оптика”, “Полимер” и “Нанозонд” НИЦ “Курчатовский институт”.
Работа выполнена при частичной поддержке НИЦ “Курчатовский институт”, Приказ 116 от 30.01.2018.
Список литературы
Сариев А.К., Абаимов Д.А., Сейфулла Р.Д. // Эксп. клин. фармакол. 2010. Т. 73. № 11. С. 34. https://doi.org/10.30906/0869-2092-2010-73-11-34-38
Алексеев К.В., Тихонова Н.В., Блынская Е.В. и др. // Вестник новых медицинских технологий. 2012. Т. ХIХ. № 4. С. 43.
Крутов П.В. Научное обоснование технологии совместного получения аммифурина и анмарина плодов амми большой (Ammi Majus L.). Дис. … канд. фарм. наук. Москва, 2015. 114 с.
Государственный реестр лекарственных средств. https://grls.minzdrav.gov.ru/grls.aspx?s=Аммифурин&m=TradeName
Крутов П.В., Громакова А.И. // Вопр. биол., мед. и фарм. химии. 2014. № 12. С. 21.
Кузнецова Г.А. Природные кумарины и фурокумарины. Л.: Наука, 1967. 248 с.
Абышев А.З., Агаев Э.М., Керимов Ю.Б. Химия и фармакология природных кумаринов. Баку: Сaspian Supplies, 2003. 112 с.
Георгиевский В.П., Комисаренко И.Ф., Дмитрук С.Д. Биологически активные вещества лекарственных растений. Новосибирск: Наука, 1990. 333 с.
Хаджай Я.И. Фармакологическое исследование природных флавоноидов, фурокумаринов и кумаринов. Автореф. дис. … докт. мед. наук. Харьков: [б. и.], 1969. 24 с.
Yeruham I., Bar D., Nafan A. et al. // Israel J. Vet. Med. 1989. V. 45. № 4. P. 260.
Котовский Б.К., Саканян Е.И., Лесновская Е.Е. и др. // Противоишемический растительный препарат мелилотин и способ его получения. Пат. 2223110 (Россия). 2002.
Абышев А.З., Нгуен К.Б., Штро А.А. и др. // Иммуномодулирующее и противовирусное средство на основе (2-((кумарин_7_ил)окси)этил)3_гидрокси_20(29)_лупен_28_ОАТА. Пат. 2686743 (Россия). 2018.
Selim Y.A., Ouf N.H. // Med. Chem. Lett. 2012. № 2. P. 1. https://doi.org/10.1186/2191-2858-2-1
Ложкин А.В., Саканян Е.И. // Химико-фармацевтический журнал. 2006. Т. 40. № 6. С. 47. https://doi.org/10.30906/0023-1134-2006-40-6-47-56
Лакин К.М., Смирнова Т.В., Вишнякова Г.М. и др. // Химико-фармацевтический журнал. 1989. Т. 23. № 10. С. 1212.
Хаджай Я.И., Оболенцева Г.В., Прокопенко А.П. // Фармакол. и токсикол. 1996. Т. 29. № 2. С. 160.
Kleemann A., Engel J. // Pharmaceutical Substances: Syntheses, Patents, Applications. Thieme: Stuttgart, New York, 2001. P. 280, 346, 530, 1035.
Абышев А.З., Агаев Э.М., Семенов Е.В. Антагонисты ионов кальция нового поколения. Баку: Изд-во Азербайдж. мед. ун-та, 2003. 236 с.
Luo K., Sun J., Chan J.Y. et al. // Chemotherapy. 2011. V. 57. № 6. P. 449. https://doi.org/10.1159/000221641
Marshall M.E., Mohler J.L., Edmonds K. et al. // Cancer Res. Clin. Oncol. 1994. № 120. P. 39. https://doi.org/10.1007/BF01377124
Babudri N., Pani B., Venturini S. et al. // Environ. Pathol. Toxicol. Oncol. 1986. № 7. P. 123.
Kofmas C., Chinou I., Loukis A. et al. // Planta Med. 1998. № 64. P. 174.
Myung K., Manthey J.A., Narciso J.A. // Appl. Microbiol. Biotechnol. 2008. V. 78. № 3. P. 401. https://doi.org/10.1007/s00253-007-1326-9
Кречетов С.П., Масленникова М.С., Куксин А.Ю. и др. // Рос. биотерапевт. журн. 2023. Т. 22. № 2. С. 65. https://doi.org/10.17650/1726-9784-2023-22-2-65-73
Марченко И.В., Смирнова О.Д., Калашникова И.В. и др. // Acta Naturae. 2017. V. 9. P. S173.
Мусатова В.Ю., Семенов С.А., Дробот Д.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1168. https://doi.org/10.7868/S0044457X16090166
Семенов С.А., Дробот Д.В., Мусатова В.Ю. и др. // Журн. неорган. химии. 2015. Т. 60. № 8. С. 991. https://doi.org/10.7868/S0044457X15080176
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии