Российские нанотехнологии, 2024, T. 19, № 2, стр. 251-263
Агломераты золотых наночастиц на основе системы биотин–стрептавидин для латерального проточного иммуноанализа
Ж. В. Самсонова 1, *, И. Д. Лыпенко 1, Н. Ю. Саушкин 1, А. П. Осипов 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: jvs@enz.chem.msu.ru
Поступила в редакцию 07.11.2023
После доработки 04.12.2023
Принята к публикации 04.12.2023
Аннотация
Сферические наночастицы золота (НЧЗ) различного размера (10–30 нм), полученные восстановлением золотохлористоводородной кислоты аскорбиновой кислотой, использовали для получения конъюгатов с нативными и биотинилированными антителами (Ат, бАт). Процесс образования наноагломератов конъюгатов НЧЗ–бАт с участием свободного стрептавидина (Ствд) в растворе исследован в диапазоне стехиометрических соотношений [Ствд] : [НЧЗ] от 0 : 1 до 3200 : 1. Методом динамического рассеяния света показано, что при 19–50-кратном избытке свободного Ствд по отношению к НЧЗ в растворе конъюгаты НЧЗ–бАт образуют наноагломераты с эффективным диаметром, в 1.5–3 раза превышающим размеры исходного конъюгата. Изучена эффективность взаимодействия детектирующего реагента, приготовленного из конъюгата НЧЗ–бАт в присутствии различных концентраций свободного Ствд, в латеральном потоке с сорбированными на мембране Ствд или бАт. Показано, что интенсивность окрашивания реакционных зон претерпевает значительное изменение в области соотношения концентраций НЧЗ–бАт и Ствд, соответствующих образованию наноагломератов, и зависит от состава и размера образующегося комплекса и наличия в его составе доступных для связывания с сорбированным компонентом молекул Ствд или биотиновых остатков. Основываясь на математическом моделировании предполагаемого кинетического механизма образования комплексов НЧЗ с участием биотин-стрептавидинового взаимодействия, показано преимущественное образование наноагломератов, состоящих из двух или трех НЧЗ, связанных между собой молекулами линкера Ствд. Использование наноагломератов в качестве метки в латеральном иммуноанализе может приводить к снижению предела обнаружения в анализе в несколько раз.
ВВЕДЕНИЕ
Коллоидные наночастицы золота (НЧЗ) часто используют в латеральном проточном иммуноанализе (ЛПИА) в качестве визуальных меток. ЛПИА – аналитический экспресс-метод определения соединений, сочетающий в себе принципы хроматографического и иммунологического методов – в первую очередь активно применяют в медицинской диагностике, поскольку экспресс-тестирование можно проводить у постели больного или на приеме у врача [1]. Результаты анализов регистрируются, как правило, визуально, по изменению интенсивности окрашивания реакционных зон, обусловленного локальным концентрированием НЧЗ вследствие иммунохимических реакций, проходящих в аналитической зоне мембраны. Метки, генерирующие аналитический сигнал без проведения дополнительных манипуляций, являются предпочтительными, так как в этом случае процедура анализа ускоряется и упрощается [2, 3]. Схемы проведения ЛПИА постоянно совершенствуются главным образом в плане повышения чувствительности и воспроизводимости, а также создания полуколичественных и количественных визуальных и инструментальных методов [1–3]. Наиболее распространенный метод ЛПИА на основе НЧЗ в качестве визуальной метки имеет ограничения в тех случаях, когда от анализа требуется высокая чувствительность [4, 5]. Одним из подходов к повышению чувствительности ЛПИА является увеличение числа связавшихся в аналитической зоне тест-полоски меток за счет их предварительной модификации или увеличения их эффективного размера [6]. Реализация данного подхода возможна, например, при использовании системы биотин–стрептавидин (Ствд), где указанные молекулы вводят в состав НЧЗ, что приводит к связыванию частиц между собой с образованием агломератов. Ствд имеет высокое сродство к биотину (Kd = 10–14 М) и четыре центра связывания, расположенные попарно, что позволяет белку прочно связываться с молекулами биотина и биотинилированными соединениями [7].
Изучены общие закономерности взаимодействия биотинилированных НЧЗ с Ствд/авидином в растворе [8–13]. Для этого использовали НЧЗ, поверхность которых была полностью насыщена остатками биотина, а Ствд/авидин выступал в качестве линкера между частицами. Для получения биотинилированных частиц проводили ковалентное связывание биотина с НЧЗ (Au), используя серосодержащие производные биотина, либо последовательно модифицировали поверхность НЧЗ посредством серосодержащего линкера и производного биотина. Согласно [8, 9] максимальная агрегация таких частиц наблюдается при избытке Ствд в растворе, составляющем около половины от насыщающей концентрации, необходимой для образования монослоя на биотин-функционализированных НЧЗ. При добавлении в систему свободного биотина агрегация приобретала обратимый характер, что подтверждалось спектральными данными, но проходила намного медленнее, чем прямое взаимодействие [9]. Хотя в [11] сообщалось о двух концентрационных диапазонах свободного Ствд в растворе, которые вызывают образование комплексов биотинилированных НЧЗ, соединенных Ствд как линкером, и преимущественном образовании комплексов из двух НЧЗ. Описан также способ получения комплексов биотинилированных НЧЗ в виде цветка с использованием авидина в качестве линкера, основанный на последовательном добавлении биотинилированных НЧЗ к аналогичным частицам, на первом этапе обработанным избыточным количеством авидина [12].
Для использования в биоаналитике, как правило, НЧЗ функционализируют Ствд, а остатки биотина вводят в другие белковые молекулы, выступающие в качестве линкера между НЧЗ [14, 15]. Так, было показано, что агрегация НЧЗ, покрытых Ствд (НЧЗ–Ствд), с выпадением осадка происходит в определенном концентрационном диапазоне биотинилированного реагента, вводимого в раствор [14]. На основе этого принципа был разработан гомогенный метод определения Ствд и Escherichia coli, основанный на сдвиге диапазона образования агрегатов в присутствии в системе свободного Ствд или E. coli. В [15] подробно изучался процесс агрегации и было выявлено, что более предпочтительными для использования в таком типе анализа являются золи с более крупными НЧЗ и меньшим удельным количеством частиц.
При использовании комбинации системы биотин–стрептавидин и НЧЗ в ЛПИА целью исследователей являлось усиление окраски (аналитического сигнала) в зоне специфического взаимодействия за счет концентрирования НЧЗ, т.е. участия в анализе не в виде индивидуальных частиц, а в виде агломератов или комплексов различного состава [16–21]. Данный подход позволяет снизить предел обнаружения при использовании такой же концентрации метки (НЧЗ), как и в немодифицированном варианте анализа. Одним из вариантов создания укрупненного комплекса НЧЗ является одновременное использование в анализе частиц, функционализированных Ствд или биотином, которые образуют комплексы между собой [16, 17, 21]. При определении тропонинов и прокальцитониа в качестве меченого реагента в [16, 17] комбинировали три вида функционализированных НЧЗ (с бАт, биотинилированным белком и Ствд), которые помещали на отделенные друг от друга мембраны при компоновке детектирующей тест-полоски. Комплексный подход позволил снизить предел обнаружения аналита по сравнению с немодифицированной схемой анализа в 10–30 раз [16, 17], при этом концентрацию модифицированных НЧЗ для достижения описанного эффекта подбирали эмпирически. Следующим шагом в модификации описанного подхода послужило использование комбинированного меченого реагента, состоящего из предварительно смешанных Ствд и функционализированных специфическими биотинилированными антителами НЧЗ [18–20], использование которого позволило снизить предел обнаружения ЛПИА прокальцитонина и ЛПИА бактерии Listeria monocytogenes. При таком подходе НЧЗ участвовали в анализе в виде готовых наноагломератов, где использовали один вид биотин-функционализированных НЧЗ и Ствд в качестве линкера. Кроме того, при использовании данного детектирующего реагента компоновка мембран на тест-полоске не требовала использования дополнительных элементов. Однако концентрационные и стехиометрические закономерности образования наноагломератов подробно не изучали. Описан также подход, где в качестве метки использовали комплекс наночастиц, состоящий из центральной НЧЗ, покрытой Ствд, окруженной биотин-функционализированными НЧЗ, где биотин был введен в состав специфических антител [21]. Наибольший эффект был достигнут при использовании комплексных агломератов крупных частиц (40 нм), предел обнаружения ЛПИА SARS-CoV-2 удалось снизить в 5.9 раза.
Увеличение чувствительности ЛПИА является актуальной задачей, использование системы биотин–стрептавидин для этих целей может позволить проводить анализ без участия дополнительных сложносоставных реактивов и оборудования, поскольку дает возможность концентрировать НЧЗ в зоне специфического иммунохимического взаимодействия. В настоящей работе проведено изучение стехиометрических, концентрационных и кинетических закономерностей образования наноагломератов из нескольких биотин-функционализированных НЧЗ с использованием Ствд в качестве линкера, а также возможности использования комплексов НЧЗ в качестве меток для ЛПИА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали натриевую соль биотин-3-сульфо-N-гидроксисукцинимидного эфира, золотохлористоводородную кислоту (“Sigma”, США); неорганические соли, сахарозу (“Helicon”, Россия); Твин 20 (“MP Biomedicals”, Франция); овальбумин (“Реахим”, Россия); стрептавидин, антитела козы к IgY курицы (“Имтек”, Россия); аскорбиновую кислоту (“Glenmery Biotechnologies”, Кыргызстан), серную кислоту, этанол абсолютный, имеющие классификацию “ос.ч” (“Химмед”, Россия); диметилформамид “хч” (“Лабтех”, Россия).
Использовали следующие буферные растворы: 0.01 М К-фосфатный буфер, рН = 7.4 (ФБ); ФБ, содержащий 0.15 М NaCl, рН = 7.4 (ФБС); ФБС, содержащий 0.1% Твин 20, рН = 7.4 (ФБСТ); “конъюгатный буфер” для разведения функционализированных НЧЗ – ФБ, содержащий 10% сахарозы и 0.25 мг/мл овальбумина. Все растворы готовили на деионизированной воде, полученной на установке Milli-Q (“Merck Millipore”, Германия).
Сыворотки крови кролика и курицы, антитела к прогестерону были предоставлены лабораторией инженерной энзимологии (МГУ им. М.В. Ломоносова, Москва). Выделение иммуноглобулиновой фракции из сыворотки крови кролика (IgG) и курицы (IgY) проводили с использованием безводного сульфата натрия. Для этого к 1 мл сыворотки добавляли 180 мг сульфата натрия, инкубировали при перемешивании в течение 30 мин, после отделяли осадок центрифугированием (5 мин, 10 000 g) и ресуспендировали в 1 мл ФБС. От избытка солей раствор иммуноглобулинов очищали гель-фильтрацией на колонках PD-10 (“GE Healthcare”, США) согласно инструкции.
Для компоновки мультимембранных тест-полосок для ЛПИА использовали аналитические нитроцеллюлозные мембраны CNPC (размер пор – 15 мкм), мембраны для нанесения конъюгата PT-R5, мембраны для образца GFB-R4, абсорбирующие мембраны АР-045 (все производства “MDI”, Индия).
Спектры поглощения растворов коллоидного золота измеряли на приборе Tecan Infinite M200 (“Tecan”, Швейцария) в 96-луночных планшетах. Диаметр частиц и их концентрацию рассчитывали по спектральным данным согласно методике, описанной в [22]. Размер НЧЗ определяли на сканирующем электронном микроскопе (СЭМ) SUPRA 40 (“Carl Zeiss”, Германия). Гидродинамический диаметр НЧЗ определяли с помощью метода динамического рассеяния света (ДРС) на приборе Malvern Zetasizer Nano ZS (“Malvern”, Великобритания). Количественное определение интенсивности окрашивания аналитической зоны тест-полосок проводили с использованием сканера Epson Perfection V700 Photo (“Seiko Epson”, Япония) и программы Scion Image.
Численное моделирование кинетики сложных химических реакций проводили с помощью программы KINET (МГУ им. М.В. Ломоносова, https://www.chem.msu.su/rus/teaching/KINET2012/).
Получение НЧЗ. Сферические НЧЗ диаметром 10–30 нм получали по методу восстановления золотохлористоводородной кислоты аскорбиновой кислотой [23, 24]. К 49 мл 0.4 мМ раствора HAuCl4 при интенсивном перемешивании на магнитной мешалке (750 об./мин) быстро добавляли 1 мл 30 мМ раствора аскорбиновой кислоты и перемешивали в течение 30 мин при комнатной температуре (22–25°С).
Получение биотинилированных антител (бАт). Реакцию биотинилирования проводили с использованием натриевой соли биотин-3-сульфо-N-гидроксисукцинимидного эфира в условиях 10, 15, 20-кратного мольного избытка биотинового реагента к антителу (Ат). К 500 мкл раствора Ат (4.98 мг/мл, 0.033 мМ) добавляли аликвоты раствора эфира биотина (5 мг/мл, 11.3 мM) в смеси воды и диметилформамида (1 : 1), соответствующие 10, 15, 20-кратному мольному избытку биотинового реагента. Смесь инкубировали 1 ч на шейкере, затем низкомолекулярные компоненты реакции удаляли с использованием ультрацентрифужного концентратора Vivaspin 500 (30 000 Да) (“Sartorius Stedim Biotech”, Германия).
Выбор оптимальных условий получения конъюгатов НЧЗ–Ат/бАт. В лунки полистиролового планшета добавляли по 10 мкл растворов Ат в ФБ с концентрациями 0, 50, 100, 150, 200 мкг/мл в горизонтальном направлении и по 100 мкл растворов НЧЗ с различными pH (от 5.0 до 9.0 с шагом 0.5) в вертикальном направлении. После 15-минутной инкубации на шейкере во все лунки добавляли по 20 мкл 10%-ного раствора NaCl и измеряли оптическую плотность при 520 и 580 нм. По полученным данным строили зависимости разности значений оптической плотности (ОП520–ОП580) от концентрации антител и определяли условия для получения стабильного конъюгата (pH и концентрацию антител) как обеспечивающие максимальную разность (ОП520–ОП580) и выход ее значения на плато.
Получение конъюгатов НЧЗ с Ат/бАт. Для получения конъюгатов Ат (в том числе биотинилированных) с НЧЗ к 1 мл раствора НЧЗ с оптимальным pH добавляли 100 мкл раствора Ат/бАт в необходимой концентрации. Смесь инкубировали на шейкере в течение 15 мин, затем добавляли раствор овальбумина до конечной концентрации 0.25 мг/мл и снова инкубировали 15 мин на шейкере. Далее добавляли сахарозу и азид натрия до конечных концентраций 10 и 0.04%. Конъюгаты НЧЗ с Ат/бАт концентрировали путем центрифугирования (8000–14 000 g) в течение 10–20 мин при +4°С и ресуспендирования в 100 мкл аналогичного буфера. Полученные конъюгаты хранили при +4°С либо наносили на мембрану для конъюгата и высушивали для последующего использования в ЛПИА.
Получение наноагломератов конъюгатов НЧЗ–бАт в присутствии Ствд. К 20 мкл концентрированного конъюгата бАт–НЧЗ добавляли 5 мкл Ствд в стехиометрических соотношениях [Ствд] : [НЧЗ] от 0 : 1 до 3200 : 1. Раствор ресуспендировали и инкубировали при комнатной температуре в течение 15 мин. Полученный раствор использовали для приготовления детектирующего реагента, нанося на мембрану для конъюгата (5 × 6 мм) 7 мкл раствора и высушивая при комнатной температуре в течение ночи.
Компоновка тест-полосок ЛПИА. На пластиковую подложку с аналитической мембраной последовательно наклеивали с нахлестом 2 мм впитывающую мембрану, мембрану для конъюгата, мембрану для образца. Размер тест-полоски составлял 5 × 75 мм. На аналитическую мембрану наносили 0.5–1 мкл растворенных в ФБ или ФБС специфических реагентов в необходимой концентрации и высушивали в течение 10 ч при комнатной температуре.
Проведение ЛПИА для оценки связывания конъюгатов НЧЗ–бАт и их наноагломератов с сорбированным Ствд или биотином. На аналитическую мембрану тест-полоски наносили 1 мкл Ствд или биотин (бАт). В качестве детектирующего реагента использовали конъюгаты НЧЗ–Ат или НЧЗ–бАт, приготовленные с использованием различных концентраций Ствд, предварительно высушенные на мембране для конъюгата (5 × 6 мм). По тест-полоскам пропускали 150 мкл ФБСТ и оценивали интенсивность окрашивания аналитической зоны.
Определение концентрации IgY методом ЛПИА. На аналитической мембране были сорбированы IgY кур (0–100 нг) – схема А, либо антивидовые Ат против IgY кур (0.125 мг/мл) – схема Б. Для проведения ЛПИА тест-полоски помещали на горизонтальную поверхность и наносили на мембрану для образца 150 мкл ФБСТ (схема А) или 150 мкл стандартного раствора, содержащего IgY кур (схема Б). Стандартные растворы IgY кур готовили в ФБСТ. Визуальную и инструментальную оценку результатов проводили через 10–15 мин после анализа.
Значение аналитического сигнала, соответствующее пределу обнаружения IgY кур, определяли по формуле
где ymin – значение аналитического сигнала, соответствующее переделу обнаружения, y0 – среднее значение сигнала для “нулевого” стандарта, S – стандартное отклонение.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение и характеристика НЧЗ. Сферические НЧЗ получали методом восстановления золотохлористоводородной кислоты аскорбиновой кислотой [23, 24]. Диаметр и дисперсность таких НЧЗ зависит от pH реакционной смеси, а также порядка внесения реагентов в реакцию [25, 26]. С увеличением концентрации добавляемого в реакционную смесь NaOH диаметр образовавшихся НЧЗ уменьшается от 30 до 5 нм, что позволяет получать частицы разного размера в зависимости от целей исследования. В случае предварительного смешивания с NaOH аскорбиновая кислота вступает в реакцию восстановления в более активной депротонированной форме [24]. В данном случае скорость образования зародышей преобладает над скоростью укрупнения частиц, что приводит к образованию частиц меньшего диаметра (d = 10 нм) (рис. 1в). Если к раствору HAuCl4 последовательно добавляли NaOH и затем аскорбиновую кислоту, получали более крупные НЧЗ (d = 21 нм) (рис. 1б). Полученные НЧЗ были охарактеризованы спектрофотометрически, методом сканирующей электронной микроскопии и методом ДРС (рис. 1, табл. 1). Отметим, что расчетные размеры НЧЗ, вычисленные по методике, описанной в [22], совпадали с данными анализа СЭМ-изображений (табл. 1). Полученные частицы имели форму, близкую к сферической, их коллоидные растворы оставались стабильными при хранении в темноте при +4°С в течение минимум трех месяцев. При проведении последующих реакций функционализации полученных НЧЗ белковым компонентом учитывали влияние ионной силы раствора на их агрегацию, для этого использовали буфер с низкой ионной силой (ФБ).
Рис. 1.
СЭМ-изображения НЧЗ, полученные при использовании различного порядка добавления реагентов: а – d = = 30 нм (HAuCl4 + АК), б – d = 21 нм (HAuCl4 + NaOH) + AK, в – d = 10 нм HAuCl4 + (NaOH + AK); г – спектры поглощения коллоидных растворов НЧЗ. АК – аскорбиновая кислота.
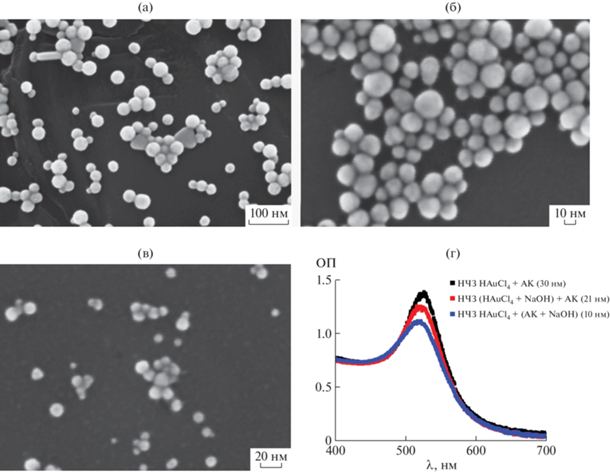
Таблица 1.
Характеристики НЧЗ
| Тип НЧЗ | λmax, нм | dрасчет, нм | dСЭМ, нм | С, нМ | Гидродинамический d (ДРС), нм | |||
|---|---|---|---|---|---|---|---|---|
| H2O | ФБ | ФБС | Буфер для конъюгата | |||||
| HAuCl4 + АК | 524 | 29 | 30 ± 7 | 0.230 | 60 ± 3 | 64.0 ± 0.3 | 107 ± 10 | 72 ± 3 |
| (HAuCl4 + NaOH) + AK | 522 | 23 | 21 ± 4 | 0.857 | 29 ± 4 | 30.5 ± 1.5 | 56 ± 2 | |
| (HAuCl4) + (NaOH + AK) | 518 | 11 | 10 ± 3 | 8.980 | 19.1 ± 2.1 | |||
Функционализация НЧЗ с использованием антител. Для функционализации НЧЗ использовали несколько видов поликлональных Ат, а именно: Ат неиммунизированного кролика в качестве модельной системы, Ат к прогестерону и антивидовые Ат кролика против IgY кур (анти-IgY Ат). При этом для изучения взаимодействия функционализированных наночастиц с Ствд проводили биотинилирование иммуноглобулиновой (IgG) фракции Ат при 10, 12, 15, 20-кратном мольном избытке производного биотина. На следующем этапе для определения оптимальных условий получения стабильного конъюгата НЧЗ–(б)Ат с Ат (в том числе биотинилированными) проводили титрование, варьируя рН реакционной среды и концентрацию белкового компонента. Оптимальные условия получения стабильных конъюгатов аскорбиновых НЧЗ разного диаметра с нативными и биотинилированными Ат были идентичны (табл. 2). При этом для стабилизации НЧЗ диаметром 21 нм требовалась самая высокая концентрация антител (табл. 2), помимо этого, для них была характерна меньшая стабильность при хранении, поэтому в дальнейших опытах их не использовали.
Таблица 2.
Оптимальные условия получения конъюгатов НЧЗ с различными Ат
| бАт кролика | бАт к прогестерону | анти-IgY бАт | ||||
|---|---|---|---|---|---|---|
| d, нм | C, мкг/мл | pH | C, мкг/мл | pH | C, мкг/мл | pH |
| 10 | 15.0 | 9.0 | ||||
| 21 | 22.5 | 9.0 | ||||
| 30 | 8.0 | 7.5 | 10 | 7.5 | 5 | 7.0 |
При сорбции биомолекул (Ат) на поверхность НЧЗ максимум оптического поглощения конъюгата НЧЗ с антителами сдвигался в более длинноволновую область по сравнению с исходными НЧЗ (табл. 1, 3), а гидродинамический диаметр увеличивался на 50–75%. Связывание конъюгатов НЧЗ–бАт с Ствд, сорбированным на поверхности аналитической мембраны для ЛПИА, свидетельствовало об успешном протекания реакции биотинилирования Ат. Интенсивность окраски в зоне взаимодействия сорбированного Ствд и конъюгата НЧЗ–бАт свидетельствовала об эффективности связывания этих компонентов (рис. 2). В контрольном опыте связывания конъюгата небиотинилированных Ат (НЧЗ–Ат) с Ствд на поверхности мембраны не наблюдалось (окраска отсутствовала). Было показано, что с увеличением размера функционализированных частиц от 10 до 30 нм интенсивность регистирируемого аналитического сигнала при взаимодействии НЧЗ–бАт и Ствд увеличивалась вдвое (рис. 2). При этом при увеличении мольного избытка биотина в реакции биотинилирования Ат от 15 к 20 интенсивность окраски в аналитической зоне при взаимодействии конъюгата НЧЗ–бАт с Ствд практически не менялась (рис. 2), что свидетельствует о насыщающем уровне свободных к связыванию остатков биотина в составе антител.
Таблица 3.
Характеристики конъюгатов НЧЗ с различными Ат/бАт
| НЧЗ | Конъюгат с Ат/бАт | λmax, нм | d*, нм (ДРС) | Диапазон переходных соотношений [Ствд] : [НЧЗ] |
|---|---|---|---|---|
| HAuCl4 + (NaOH + АК) (d = 10 нм) | Ат кролика | 527 | ||
| 10 : 1 бАт кролика | 527 | 1 : 1–8 : 1 | ||
| 15 : 1 бАт кролика | 527 | 0.5 : 1–7.5 : 1 | ||
| 20 : 1 бАт кролика | 526 | 2 : 1–8 : 1 | ||
| (HAuCl4 + NaOH) + АК (d = 21 нм) | 20 : 1 бАт кролика | 528 | 73 ± 2 | 12.5 : 1–50 : 1 |
| HAuCl4 + АК (d = 30 нм) | Ат кролика | 529 | 93 ± 3 | |
| 10 : 1 бАт кролика | 529 | 111 ± 4 | 2 : 1–8 : 1 | |
| 15 : 1 бАт кролика | 529 | 114 ± 23 | ||
| 20 : 1 бАт кролика | 529 | 89 ± 10 | 12.5 : 1–50 : 1 | |
| 12 : 1 бАт к прогестерону | 531 | 96 ± 5 | 6.3 : 1–25 : 1 | |
| 15 : 1 анти-IgY бАт | 530 | 108 ± 4 | 50 : 1–100 : 1 |
Рис. 2.
Интенсивность аналитической зоны при связывании различных конъюгатов НЧЗ–бАт с сорбированным Ствд.
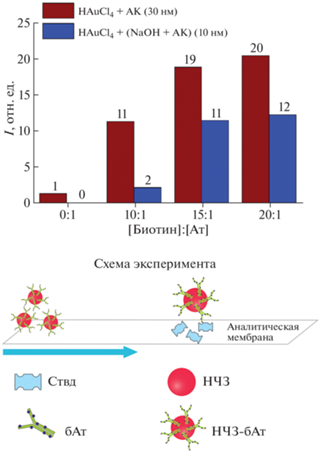
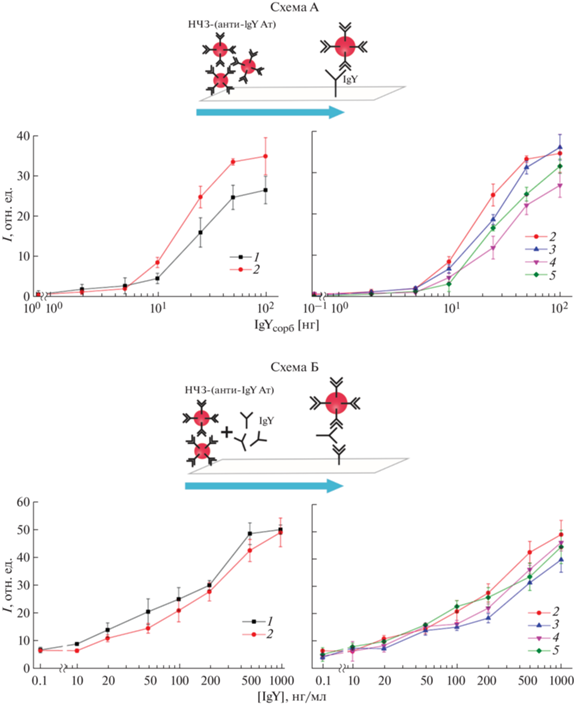
Исследование образования агломератов НЧЗ при использовании системы биотин–стрептавидин. Для исследования стехиометрических и концентрационных закономерностей образования укрупненных наноагломератов, состоящих из нескольких НЧЗ, с использованием системы биотин–стрептавидин к конъюгатам НЧЗ–бАт в постоянной концентрации добавляли различные концентрации Ствд, при этом соотношение [Ствд] : [НЧЗ] варьировали от 0 : 1 до 3200 : 1. Итоговую смесь использовали в качестве детектирующего реагента при проведении ЛПИА. Для этого исследовали связывание данного детектирующего реагента с сорбированными на аналитической мембране Ствд (рис. 3, схема А) или биотином (в составе бАт) (рис. 3, схема Б), пропуская его вдоль мембраны и регистрируя интенсивность окраски соответствующей аналитической зоны. Если в системе отсутствует Ствд (соотношение [Ствд] : [НЧЗ] = 0 : 1), весь биотин на поверхности функционализированных НЧЗ свободен к связыванию с сорбированным Ствд и наблюдается максимальное окрашивание аналитической зоны тест-полоски (схема А). Соответственно, в данном случае взаимодействия НЧЗ–бАт с сорбированным на поверхности мембраны биотином не наблюдается (схема Б). При увеличении концентрации Ствд в составе детектирующего реагента окраска аналитической зоны при изучении его взаимодействия с Ствд на поверхности до определенных соотношений [Ствд] : [НЧЗ] оставалась постоянной, а затем резко снижалась (рис. 3). Изменение интенсивности окрашивания аналитической зоны мембраны свидетельствовало о снижении доступных к взаимодействию остатков биотина в данном комплексе (НЧЗ–бАт–Ствд) за счет экранирования связанным с НЧЗ Ствд. Соотношения [Ствд] : [НЧЗ], для которых было зафиксировано резкое изменение взаимодействия детектирующего реагента с сорбированным Ствд, называли переходными (табл. 3). Отметим, что при переходных соотношениях [Ствд] : [НЧЗ] происходило усиление взаимодействия детектирующего реагента с сорбированным на полоске биотином, что визуализировалось увеличением интенсивности окраски в аналитической зоне до максимума и свидетельствовало об увеличении количества Ствд, связанного с функционализированными НЧЗ через остатки биотина. Известно, что на поверхности Ствд располагаются четыре центра связывания с биотином, расположенные попарно друг напротив друга [7]. Соответственно, одна молекула Ствд может одновременно вступать во взаимодействие с остатком биотина на поверхности конъюгата НЧЗ–бАт и сорбированным биотином. Максимальное связывание комплекса НЧЗ–бАт–Ствд с сорбированным биотином для конъюгатов НЧЗ с различными антителами наблюдалось в диапазоне соотношений [Ствд] : [НЧЗ] от 100 : 1 до 400 : 1, что, по-видимому, свидетельствовало о присутствии на поверхности конъюгата НЧЗ–бАт максимального количества молекул Ствд, способных к связыванию с биотином на поверхности мембраны (рис. 3, 4). При этом покрытие конъюгатов НЧЗ–бАт монослоем Ствд вероятнее всего может приводить к экранированию антител от специфического взаимодействия антител с антигеном. Последующее снижение интенсивности окраски аналитической зоны при изучении взаимодействия детектирующего реагента с сорбированным биотином свидетельствовало об избытке свободного Ствд в системе, который экранировал биотин на поверхности от связывания с комплексом НЧЗ–бАт–Ствд (рис. 3, 4).
Рис. 3.
Схема эксперимента по изучению образования агломератов НЧЗ, функционализированных бАт, в присутствии Ствд. Схема А – на мембране сорбирован Ствд; схема Б – на мембране сорбирован биотин (в составе бАт). Приведены результаты для конъюгата НЧЗ–анти-IgY бАт ([биотин] : [Ат] = 15 : 1).
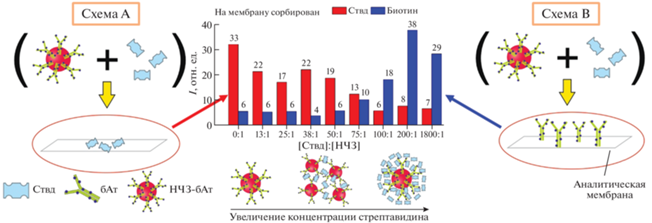
Рис. 4.
Соответствие результатов ДРС и связывающей способности реагента НЧЗ–бАт–Ств к сорбированному Ствд или биотину. Использованные конъюгаты: а – НЧЗ–бАт кролика ([биотин] : [Ат] = 20 : 1), б – НЧЗ–бАт к прогестерону ([биотин] : [Ат] = 12 : 1), НЧЗ–анти-IgY бАт ([биотин] : [Ат] = 15 : 1); d – гидродинамический диаметр.
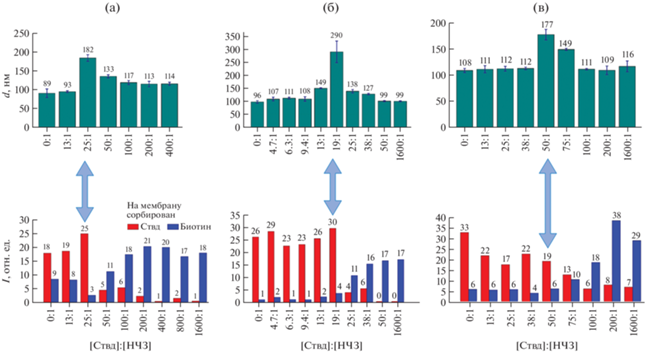
При исследовании методом ДРС функционализированных различными антителами НЧЗ с добавлением свободного Ствд именно в области переходных соотношений [Ствд] : [НЧЗ] было зафиксировано увеличение гидродинамического диаметра частиц в растворе (рис. 4). Результат воспроизводим для конъюгатов НЧЗ с различными Ат. Можно предположить, что при этих соотношениях реагентов Ствд в растворе достаточно, чтобы выступать в качестве линкера между несколькими функционализированными НЧЗ, но его еще не настолько много, чтобы полностью экранировать все остатки биотина на поверхности конъюгата НЧЗ–бАт, доступные к связыванию с сорбированным на поверхности мембраны Ствд. По результатам ДРС укрупнение частиц в растворе (переходные соотношения) для различных биотинилированных антител и НЧЗ наблюдали в области соотношений [Ствд] : [НЧЗ] от 19 : 1 до 50 : 1 (рис. 4). Если принимать площадь, занимаемую одной молекулой антитела при сорбции на поверхность НЧЗ d = 30 нм, равной 25 нм2, и считать, что одна молекула антитела может быть связана только с одной молекулой Ствд через остаток биотина, то для покрытия функционализированных НЧЗ монослоем необходим 100-кратный избыток Ствд [8, 9]. Таким образом, экспериментально показано образование укрупненных агломератов НЧЗ с использованием системы биотин–стрептавидин, в которой Ствд составляет 19–50% от количества, необходимого для образования монослоя, что согласуется с опубликованными ранее данными по изучению комплексообразования биотинилированных НЧЗ [8, 9].
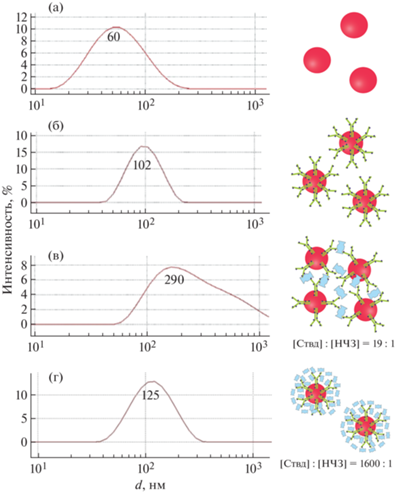
При последовательной функционализации НЧЗ гидродинамический диаметр изменялся следующим образом: исходные частицы (d = 30 нм) имели диаметр ~60 нм, далее при конъюгировании с Ат/бАт он увеличивался в 1.5 раза (рис. 5). При добавлении свободного Ствд к конъюгату НЧЗ–бАт в концентрации, соответствующей области переходных соотношений, наблюдали укрупнение частиц в 1.5–3 раза по сравнению с функционализированными антителами НЧЗ, что свидетельствовало об образовании агломератов НЧЗ. При избытке Ствд в растворе гидродинамический диаметр полностью покрытых Ствд конъюгатов НЧЗ–бАт был на 20% больше гидродинамического диаметра исходного конъюгата. Далее укрупненные агломераты НЧЗ с использованием системы биотин–стрептавидин исследовали методом ЛПИА. Использование наноагломерата частиц позволяет повышать локальную концентрацию НЧЗ, что должно сказываться на интенсивности окрашивания зоны взаимодействия специфических реагентов.
Рис. 5.
Результаты ДРС, распределение частиц в растворе по размеру и предполагаемое строение частиц в растворе: а – НЧЗ, б – конъюгат НЧЗ–бАт, в – смесь конъюгата НЧЗ–бАт с Ствд ([Ствд] : [НЧЗ] = 19 : 1), г – избыток Ствд по отношению к конъюгату НЧЗ–бАт ([Ствд] : [НЧЗ] = 1600 : 1). В эксперименте использовали НЧЗ диаметром 30 нм, конъюгат НЧЗ–бАт к прогестерону; d – гидродинамический диаметр.
Определение IgY методом ЛПИА с использованием системы биотин–стрептавидин. Для определения IgY кур были получены конъюгаты НЧЗ диаметром 30 нм с анти-IgY Ат/бАт ([биотин] : [Ат] = 15 : 1). При этом конъюгаты НЧЗ–анти-IgY бАт использовали для получения детектирующего реагента с Ствд. Для оценки эффективности определения IgY использовали две схемы анализа. В первом случае оценивали связывание детектирующего реагента с IgY, сорбированными на поверхности мембраны (рис. 6, схема А). Во втором проводили оценку связывания детектирующего реагента с IgY в растворе (потоке), где впоследствии образующийся комплекс НЧЗ–анти-IgY бАт–Ствд–IgY взаимодействовал с антивидовыми антителами против IgY кур в сэндвич-схеме (рис. 6, схема Б). Для модификации стандартного ЛПИА готовили детектирующий реагент, используя НЧЗ–бАт и Ствд в широком диапазоне соотношений [НЧЗ] : [Ствд], в том числе тех, для которых в предыдущих опытах детектировали образование наноагломератов частиц. Предел обнаружения ЛПИА для стандартного (НЧЗ–анти-IgY Ат) и модифицированного (НЧЗ–анти-IgY бАт) детектирующего реагента составил 4.7 нг IgY на поверхности мембраны и 3.1 нг/мл в сэндвич-схеме анализа определения IgY в растворе. Отметим, что в обеих схемах анализа с использованием системы биотин–стрептавидин и детектирующего реагента состава НЧЗ–анти-IgY бАт–Ствд для соотношений [НЧЗ] : [Ствд] вплоть до переходных калибровочные кривые были идентичны калибровочной кривой немодифицированного анализа с использованием небиотинилированных анти-IgY Ат (данные не приведены). В то время как при использовании соотношений [НЧЗ] : [Ствд], соответствующих переходным соотношениям (образование агломератов НЧЗ) и выше, наблюдался сдвиг калибровочной кривой в область более высоких концентраций IgY, который увеличивался при повышении концентрации Ствд (рис. 6). Поскольку при выявлении IgY, сорбированных на поверхности мембраны, и в растворе наблюдалась аналогичная картина, можно предположить, что данный факт, по-видимому, связан с некоторым затруднением иммунохимического взаимодействия специфических антивидовых Ат на поверхности агломерата НЧЗ в потоке реагентов латеральной полоски вследствие пространственных затруднений, что привело к снижению интенсивности окраски аналитической зоны. Отметим, что для данного типа анализа применение системы биотин–стрептавидин, позволяющей получать укрупненные комплексы НЧЗ, не привело к повышению чувствительности определения IgY как на поверхности, так и в растворе. Такой результат может быть связан с использованием поликлональных Ат, которые представляют собой смесь молекул разной аффинности и строения, в результате чего образование наноагломератов происходит неупорядоченно и не происходит систематического образования комплексов увеличенного размера. Аналогичный подход (система биотин–стрептавидин) и иммобилизованные на поверхности аналитической мембраны моноклональные Ат в [18, 19] использовали для проведения специфического распознавания антигена (прокальцитонина) в потоке, что позволяло экспонировать его в раствор определенным образом, при этом был достигнут эффект повышения интенсивности окрашивания аналитических зон в 1.5–2 раза и снижения предела обнаружения в 5 раз соответственно. Поскольку на интенсивность окрашивания комплексов оказывают влияние расположение наночастиц друг относительно друга, их форма и расстояние между ними [27], в укрупненных агломератах НЧЗ, возможно, расположены не оптимальным образом, что в результате не приводит к более яркой окраске комплексов. Так как при использовании системы биотин–стрептавидин было зафиксировано укрупнение НЧЗ в 1.5–3 раза, увеличение локальной концентрации НЧЗ, а соответственно, и интенсивности окраски зоны, где происходит специфическое взаимодействие антиген–антитело, скорее всего будет не более чем в 3 раза. В общем, принципы получения конъюгатов НЧЗ с биомолекулами для образования агломератов НЧЗ с использованием линкеров, а также закономерности использования таких наноагломератов в биоаналитике требуют дальнейшей проработки с использованием специфических реагентов однородного состава. Ранее было показано, что несферические НЧЗ обладают более яркой окраской вследствие сложной морфологии и позволяют с более высокой чувствительностью регистрировать иммунохимическое взаимодействие в ЛПИА по сравнению со сферическими НЧЗ [28]. Можно также предположить, что использование НЧЗ несферической формы в составе наноагломератов может привести к более значимому эффекту, чем для аналогичного комплекса сферических частиц.
Рис. 6.
Градуировочные графики определения IgY кур, сорбированных на поверхности аналитической мембраны (схема А) и в растворе (схема Б) методом ЛПИА с использованием системы биотин–стрептавидин. В качестве детектирующего реагента использовали конъюгаты НЧЗ: 1 – с анти-IgY Ат; 2, 3, 4, 5 – анти-IgY бАт. В детектирующем реагенте с использованием конъюгатов 3, 4 и 5 соотношение [Ствд] : [НЧЗ] составляло 50 : 1; 75 : 1 и 100 : 1 соответственно.
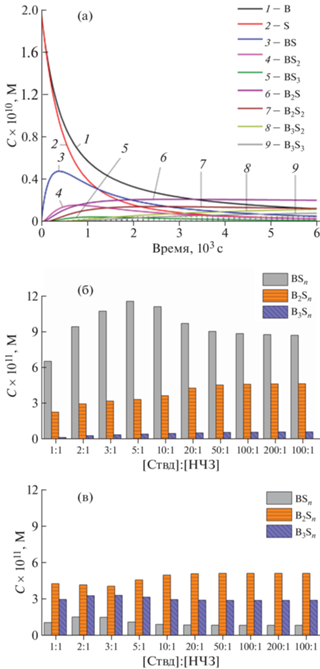
Математическое моделирование предполагаемого кинетического механизма образования агломератов НЧЗ различной стехиометрии на основе системы биотин–стрептавидин. Для оценки возможного стехиометрического состава наноагломератов, образованных биотин-функционализированными НЧЗ в присутствии свободного Ствд, играющего роль линкера между различными НЧЗ, с помощью математической программы KINET было проведено численное моделирование кинетики образования наноагломератов различного состава при варьировании начальной концентрации Ствд в широком диапазоне. Записывали исходную систему уравнений, описывающих кинетику взаимодействия стрептавидина (S) с биотином (B) на поверхности НЧЗ–бАт с образованием всех возможных комплексов состава BnSn (в бимолекулярной реакции А + В → АВ). Считали, что реакция проходит необратимо, так как Ствд имеет высокое сродство к биотину (Kd = 10–14 М). Поскольку общее количество уравнений, вводимых в систему, ограничено программой до 150, максимальное возможное число связанных с одной НЧЗ молекул Ствд принимали равным 6, что в итоге давало 121 дифференциальное уравнение. Начальная концентрация (В) составляла 0.2 нМ (и соответствовала начальной концентрации НЧЗ); концентрацию Ствд варьировали от эквимолярной до превышающей НЧЗ в 1000 раз. Также использовали следующие допущения: константу образования одинарного комплекса B(Sn) + S = BS(n+ 1) принимали равной 107 л/(моль с) в соответствии с данными [29], двойного (BSn + + BSm = B2Sn+m) – 0.5 × 107 л/(моль с), тройного (B2Sn + BSm = B3Sn+m) – 0.3 × 107 л/(моль с), четверного и пятерного – 0.1 × 107 л/(моль с) и ниже (предполагали, что уменьшение константы скорости реакции обусловлено увеличением размера образующегося продукта и доступностью его остатков биотина к взаимодействию с S). Анализ результатов показал, что первоначально происходит образование главным образом одинарного комплекса (т.е. содержащего одну НЧЗ с постепенно увеличивающимся количеством Ствд на поверхности). Затем концентрация одинарного комплекса постепенно снижается, поскольку с течением времени он посредством Ствд в качестве линкера вступает в реакцию с другой наночастицей(ми), содержащей доступный остаток (В) с образованием преимущественно комплексов из двух и трех НЧЗ (рис. 7а). Если через 600 с в растворе присутствуют в основном одинарные комплексы, то через 6000 с в растворе преобладают двойные и тройные наноагломераты НЧЗ (рис. 7б, 7в). В целом расчетные данные показывают, что для системы биотин–стрептавидин, где биотин входит в состав функционализированных биомолекулами НЧЗ, а Ствд присутствует в растворе, НЧЗ преимущественно группируются в наноаглометраты из двух и трех НЧЗ, а не комплексные агломераты из большего числа частиц. Увеличение концентрации свободного Ствд в системе приводит к более быстрому его взаимодействию с остатками биотина и образованию продукта, в котором остатки биотина на НЧЗ экранированы уже связавшимся Ствд и не могут вступать в реакцию с другими наночастицами с образованием наноагломератов сложного состава. Это дает основание предположить, что при использовании таких комплексов в качестве меток для проведения иммунохимического взаимодействия аналитический сигнал скорее всего будет возрастать не более чем в несколько раз за счет незначительного увеличения числа НЧЗ в местах локального взаимодействия в аналитической зоне. Экспериментальные данные по использованию наноагломератов на основе системы биотин–стрептавидин в ЛПИА [18–20] как раз и соответствуют результатам проведенного моделирования.
Рис. 7.
Результаты кинетического расчета реакции комплексообразования НЧЗ–бАт в присутствии Ствд: а – кинетические кривые компонентов реакции комплексообразования для соотношения [Ствд] : [НЧЗ] 1 : 1, где S – стрептавидин, В – биотин (в составе НЧЗ), BnSn – комплексы стрептавидина и биотина (в составе НЧЗ); б – концентрация моно, двойных и тройных комплексов НЧЗ через 600 c от начала реакции; в – концентрация моно, двойных и тройных комплексов НЧЗ через 6000 c от начала реакции.
ЗАКЛЮЧЕНИЕ
Стехиометрические и концентрационные закономерности образования укрупненных наноагломератов, состоящих из функционализированных биотином НЧЗ и Ствд, выступающего в качестве линкера, позволяют определить необходимый концентрационный диапазон используемых реагентов для получения данного эффекта. В такой системе получение детектирующего реагента, состоящего из наноагломератов, которые превышают размер исходных функционализированных НЧЗ в 1.5–3 раза, является воспроизводимым результатом для различных бАт. Укрупненные агломераты НЧЗ с использованием Ствд в качестве линкера за счет одновременного взаимодействия с остатками биотина в составе различных функционализированных НЧЗ могут быть использованы в биоаналитике в качестве детектирующего реагента. В частности, использование наноагломератов перспективно для проточного иммуноанализа и для любых взаимодействий типа лиганд–рецептор, поскольку повышение локальной концентрации окрашенных наночастиц будет приводить к увеличению интенсивности окраски зон, в которых происходит специфическое взаимодействие. Однако в такого рода системах эффект снижения предела обнаружения не может быть чересчур драматическим и, по-видимому, уменьшится всего лишь в несколько раз.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 22-74-00018).
Список литературы
Koczula K., Gallotta A. // Biochem. 2016. V. 60. № 1. P. 111. https://doi.org/10.1042/EBC20150012
Mirica A.C., Stan D., Chelcea I.C. et al. // Front. Bioeng. Biotechnol. 2022. V. 10. P. 922772. https://doi.org/10.3389/fbioe.2022.922772
Di Nardo F., Chiarello M., Cavalera S. et al. // Sensors. 2021. V. 21. P. 5185. https://doi.org/10.3390/s21155185
Панфёров В.Г., Сафенкова И.В., Жердев А.В. и др. // Прикл. биохим. микробиол. 2021. Т. 57. № 2. С. 107. https://doi.org/10.31857/S0555109921020112
Panferov V.G., Zherdev A.V., Dzantiev B.B. // Biosensors. 2023. V. 13. № 9. P. 866. https://doi.org/10.3390/bios13090866
Shirshahi V., Liu G. // Trend. Anal. Chem. 2021. V. 136. 116200. https://doi.org/10.1016/j.trac.2021.116200
Dundas C., Demonte D., Park S. // Appl. Microbiol. Biotechnol. 2013. V. 97. № 21. P. 9343. https://doi.org/10.1007/s00253-013-5232-z
Connolly S., Cobbe S., Fitzmaurice D. // J. Phys. Chem. B. 2001. V. 105. № 11. P. 2222. https://doi.org/10.1021/jp001948i
Kadir A., Luhrs C., Perez-Luna V.H. // J. Phys. Chem. B. 2004. V. 108. № 40. P. 15631. https://doi.org/10.1021/jp036089n
Kohut A., Voronov A., Peukert W. // Part. Part. Syst. Charact. 2005. V. 22. P. 329. https://doi.org/10.1002/ppsc.200500986
Zon V.B., Sachsenhauser M., Rant U. // J. Nanopart. Res. 2013. V. 15. P. 1974. https://doi.org/10.1007/s11051-013-1974-x
Lyu Y., Martinez A., D’Inca F. et al. // Nanomater. 2021. V. 11. P. 1559. https://doi.org/10.3390/nano11061559
Kim W.J., Choi S.H., Yoo D.J. // Bull. Korean Chem. Soc. 2011. V. 32. № 12. P. 4171. https://doi.org/10.5012/BKCS.2011.32.12.4171
Lim S., Koo O.K., You Y.S. et al. // Sci. Rep. 2012. V. 2. № 1. P. 456. https://doi.org/10.1038/srep00456
You Y., Lim S., Gunasekaran S. // ACS Appl. Nano Mater. 2020. V. 3. № 2. P. 1900. https://doi.org/10.1021/acsanm.9b02461
Taranova N.A., Slobodenuyk V.D., Zherdev A.V. et al. // RSC Adv. 2021. V. 11. № 27. P. 16445. https: //doi.org/10.1039/D1RA02212A
Taranova N.A., Urusov A.E., Sadykhov E.G. et al. // Microchim. Acta. 2017. V. 184. № 10. P. 4189. https://doi.org/10.1007/s00604-017-2355-4
Серебренникова К.В., Самсонова Ж.В., Осипов А.П. // Вестн. МГУ. Сер. 2. Химия. 2018. Т. 59. № 3. С. 230.
Серебренникова К.В. Высокочувствительные экспресс-методы латерального проточного иммуноанализа биомаркеров для целей медицинской диагностики. Дис. … канд. хим. наук: 03.01.06. М.: МГУ, 2018.
Lopes-Luz L., Mendonca M., Fogaca M.B. et al. // LWT. 2023. V. 188. P. 115336. https://doi.org/10.1016/j.lwt.2023.115336
Oh H.K., Kim K., Park J. et al. // Biosens. Bioelectron. 2022. V. 205. P. 114094. https://doi.org/10.1016/j.bios.2022.114094
Haiss W., Nguyen T.K., Aveyard J., Fernig D. // Anal. Chem. 2007. V. 79. № 11. P. 4215. https://doi.org/10.1021/ac0702084
Annur S., Hidayt N., Aprilita N. // Asian J. Chem. 2018. V. 30. № 11. P. 2399. https://doi.org/10.14233/ajchem.2018.21386
Luty-Blocho M., Wojnicki M., Fitzner K. // Int. J. Chem. Kinet. 2017. V. 49. P. 789. https://doi.org/10.1002/kin.21115
Annur S., Santosa S.J., Aprilita N.H. // Orient. J. Chem. 2018. V. 34. № 5. P. 2305. https://doi.org/10.13005/ojc/340510
Tyagi H., Kushwaha A., Kumar A., Aslam M. // Int. J. Nanosci. 2011. V. 10. P. 857. https://doi.org/10.1142/S0219581X11009301
Montaño-Priede J.L., Sanromán-Iglesias M., Zabala N. et al. // ACS Sensors. 2023. V. 8. № 4. P. 1827. https://doi.org/10.1021/acssensors.3c00287
Serebrennikova K.V., Samsonova J.V., Osipov A.P. // Nanomicro Lett. 2018. V. 10. № 2. P. 24. https://doi.org/10.1007/s40820-017-0180-2
Delgadillo R.F., Mueser T.C., Zaleta-Rivera K. et al. // PLoS One. 2019. V. 14. № 2. e0204194. https://doi.org/10.1371/journal.pone.0204194
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


