Российские нанотехнологии, 2024, T. 19, № 2, стр. 246-250
Влияние морфологических характеристик и наполнения полилактидных матриксов на пролиферацию клеток линии нек293Т
А. М. Азиева 1, *, Д. А. Кириллова 1, Е. В. Ястремский 2, Р. В. Шариков 1, Н. А. Шарикова 1, К. Г. Антипова 1, Т. Е. Григорьев 1, А. Л. Васильев 1, 2
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова Курчатовского комплекса кристаллографии и фотоники НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: asya.azieva@gmail.com
Поступила в редакцию 07.12.2023
После доработки 07.12.2023
Принята к публикации 01.02.2024
Аннотация
Адгезия, пролиферация, дифференцировка и другие виды взаимодействия клеточной культуры с синтетическими биосовместимыми матриксами полностью зависят от типа клеток, а также от структуры, наполнения и поверхности самого матрикса. Представлены результаты исследования пролиферации клеток HEK293Т на полилактидных матриксах различной архитектуры. Получена оценка скорости пролиферации клеток для ориентированных и неориентированных губчатых и нетканых волокнистых матриксов, а также композитных полилактидных матриксов с коллагеном и хитозаном.
ВВЕДЕНИЕ
Широкое использование имплантатов на основе искусственных синтетических материалов в регенеративной медицине делает разработки в области тканевой инженерии особенно актуальными. Синтетические полимерные матриксы доказали свою эффективность благодаря простоте получения, прочности и высокой степени растяжения [1]. Основными требованиями к таким матриксам являются биосовместимость, биодеградация и высокая клеточная адгезия, которые способствуют пролиферации, дифференцировке и формированию замещенной ткани [1]. В настоящее время для этих целей предложено множество синтетических полимеров, в том числе полистирол, полилактид (PLA), полигликолевая кислота и полилактид-гликолевая кислота [2–4].
Взаимодействие клеточной культуры с поверхностью матрикса полностью зависит от типа клеток [5]: большим нейрональным клеткам может потребоваться поверхность с крупной шероховатостью [6], тогда как мелким эндотелиальным клеткам – с наноразмерной [7].
Эксперименты по регенерации тканей [8] продемонстрировали хорошую биосовместимость матриксов из PLA, несмотря на гидрофобную природу соединения. Они разлагаются в тканях организма до молочной кислоты путем гидролиза и метаболизируются до углекислого газа и воды. Проблема плохой смачиваемости поверхности матриксов, препятствующая адгезии клеток, может быть решена несколькими способами. Например, поверхность может быть предварительно обработана пептидами поли-D-лизина или полиэтиленимина, которые придают положительный поверхностный заряд и способствуют адгезии клеток [9].
К методам перманентной модификации матриксов относится комбинирование PLA с натуральными волоконами, такими как коллаген или хитозан, которые способствуют улучшению биосовместимости и регуляции физико-химических свойств поверхности. Поскольку клеточная мембрана отрицательно заряжена [10], для улучшения адгезии клеток, как правило, необходимы материалы, несущие положительный заряд [11]. Объемная модификация путем сополимеризации мономера гидроксильной кислоты с молекулами, содержащими гидрофильные или заряженные группы, также улучшает свойства поверхности и адгезию клеток [12].
В настоящей работе представлено исследование влияния поверхности матрикса на пролиферацию клеток эмбриональной почки человека HEK293Т (Human Embryonic Kidney 293Т). Клетки данной линии делятся примерно 1 раз в 10 ч, достаточно хорошо изучены, просты в культивировании и в норме обладают хорошей выживаемостью [13]. Проведена оценка скорости пролиферации клеток линии HEK293Т на PLA-матриксах различных типов: ориентированных и неориентированных губчатых, ориентированных и неориентированных нетканых волокнистых, а также композитных материалах с коллагеном и хитозаном.
МАТЕРИАЛЫ И МЕТОДЫ
Изготовление и обработка матриксов. Для получения образцов с различной морфологией использовали полилактид марки 4032D (NatureWorks, США). В качестве растворителей использовали диоксан (ЧДА, “Компонент-Реактив”), хлороформ и этиловый спирт (ХЧ, “Компонент-Реактив”), уксусную кислоту (ледяная, “Компонент-Реактив”). Пропитывали материалы из PLA растворами хитозана (Primex ChitoClear 43040, Iceland) и коллагена (Белкозин, Россия).
Для получения губчатых материалов PLA растворяли в диоксане при постоянном перемешивании на магнитной мешалке в течение 24 ч. Концентрация раствора составила 3 мас. %. Для получения неориентированных губок раствор замораживали при температуре –22°C в рефрижераторе и для равномерного распределения кристаллов растворителя раствор перемешивали 1 раз в процессе заморозки. Для получения вертикально ориентированной структуры губок растворы подвергали однонаправленной заморозке в жидком азоте. Далее образцы лиофилизировали в течение 48 ч на установке Martin Christ Alpha 2‑4LSC.
Для пропитывания всех образцов готовили раствор хитозана (0.5 мас. %) и раствор коллагена (0.25 мас. %) в 2%-ном водном растворе уксусной кислоты. Перед пропитыванием каждый образец погружали в этиловой спирт на 15 мин, затем промывали дистиллированной водой.
Губчатые неориентированные материалы пропитывали, используя вакуумную установку с мембраной. Растворы хитозана или коллагена пропускали через губки, затем губки помещали на 12 ч в соответствующие растворы полимеров. Образцы замораживали в рефрижераторе.
Ориентированные губчатые материалы пропитывали по стандартной методике: 24 ч выдерживали в растворе биополимера, затем извлекали и удаляли излишки раствора фильтровальной бумагой. Затем образцы замораживали в жидком азоте в условиях градиента температуры.
Нетканые материалы получали методом электроформования из раствора PLA (концентрация 9 мас. %) в смеси растворителей: хлороформа и этилового спирта (90 : 10). Электроформование проводили на установке, разработанной в НИЦ “Курчатовский институт”, при комнатной температуре и следующих технологических параметрах: прикладываемое напряжение 12 ± 1 кВ, расстояние между капилляром и осадительным электродом 25 ± 1 см, объемный расход полимерного раствора 5 мл/ч. Характерный геометрический размер нетканого волокнистого материала составлял 50 × 50 мм при толщине 550 ± 50 мкм.
Далее все образцы лиофилизировали в течение 48 ч, сушили в вакуумном шкафу в течение суток для удаления остатков растворителя.
Сшивку материалов, пропитанных хитозаном и коллагеном, проводили в парах глутарового альдегида. Водный раствор глутарового альдегида концентрацией 25 мас. % помещали в эксикатор с образцами на 30 мин.
Культивирование клеток линии НЕК293Т. Клетки линии НEK293T высаживали на предварительно обработанные в течение 20 мин полиэтиленимином (концентрация 0.05%) поверхности матриксов различного типа, помещенные в чашки Петри, из расчета 375 000 клеток на 1 см2 поверхности.
Клетки культивировали в течение двух суток в 2 мл среды DMEM (Dulbecco’s Modified Eagle Medium, GIBCO), содержащей 10% сыворотки FBS (fetal bovine serum, Sigma), 2 мМ добавки GlutaMax-I (GIBCO) и пенициллин-стрептомицин (Life Technologies), в инкубаторе GALAXY 170S (New Brunswick Scientific) при постоянных условиях: температуре 37°C, 100%-ной влажности и содержании 5% CO2 в воздухе.
Через двое суток для получения изображений поверхности матриксы отмывали от культуральной среды и фиксировали с помощью 4%-ного параформальдегида (Sigma P6148) в течение 7–10 мин. После фиксации клетки отмывали 3 раза в течение 5 мин в однократном растворе PBS (Invitrogen 70011036). Далее поверхность образцов матриксов с фиксированными нейронами на поверхности изучали с помощью флуоресцентной микроскопии. После фиксации ядра клеток окрашивали с помощью ДНК-специфического маркера Hoechst 33342 Solution (Thermo Scientific™ 62249) в течение 15 мин при комнатной температуре в темноте, после чего клетки отмывали раствором PBS (Invitrogen 70011036) в течение 3–5 мин. Затем матриксы с клетками переносили на предметные стекла, покрывали водной заливочной средой Fluoromount (Sigma F4680) и накрывали покровными стеклами.
Флуоресцентная микроскопия. Для исследования образцов методом флуоресцентной микроскопии использовали универсальный биологический микроскоп Carl Zeiss Axio Imager.Z1. Микрофотографии всех исследуемых образцов получали в одних и тех же условиях интенсивности возбуждающего света и экспозиции при использовании объектива 60 (увеличение ×600).
Оценка пролиферации. Для сравнения скорости пролиферации на разных матриксах использовали счетчик клеток Bio-Rad TC20 Automated Cell Counter [14]. Через двое суток после посадки матриксы с клетками переносили в новые чашки Петри, чтобы исключить из подсчета адгезированные на поверхности пластика клетки. Затем матриксы дважды промывали буфером PBS (Invitrogen 70011036), добавляли 1 мл 0.05%-ного трипсина (Invitrogen) и оставляли при 37°С на 3 мин. Далее весь объем матрикса с клетками перемещали в пробирку и центрифугировали 4 мин на 800 об./мин. Затем удаляли супернатант и ресуспендировали осадок в 100 мкл культуральной среды. После ресуспендирования отбирали 10 мкл и смешивали с 10 мкл трипанового синего (Bio-Rad), чтобы отделить живые клетки от мертвых, хорошо перемешивали и в количестве 10 мкл наносили на слайд (предметное стекло системы для автоматических счетчиков) [15].
РЕЗУЛЬТАТЫ
В табл. 1 представлены результаты исследования пролиферации клеток линии HEK293T на различных PLA-матриксах: неориентированных губчатых (НГ), ориентированных губчатых (ОГ), неориентированных нетканых (НН) и ориентированных нетканых (ОН). Буквами “к” и “х” отмечены композитные материалы с коллагеном и хитозаном соответственно.
Таблица 1.
Подсчет количества клеток линии HEK293T на различных полилактидных матриксах: неориентированных губчатых (НГ), ориентированных губчатых (ОГ), неориентированных нетканых (НН) и ориентированных нетканых (ОН)
| Количество клеток | НГ | НН | ОГ | ОН | НГк | ННк | ОГк | ОНк | НГх | ННх | ОГх | ОНх |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| При посадке | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 | 375 000 |
| Через 2 сут | 732 000 | 517 667 | 756 466 | 744 000 | 706 667 | 715 000 | 684 000 | 744 000 | 837 333 | 688 333 | 708 000 | 763 000 |
| Прирост клеток, % | 95.2 | 38.0 | 101.7 | 98.4 | 88.4 | 83.4 | 90.7 | 82.4 | 123.3 | 83.6 | 88.8 | 103.5 |
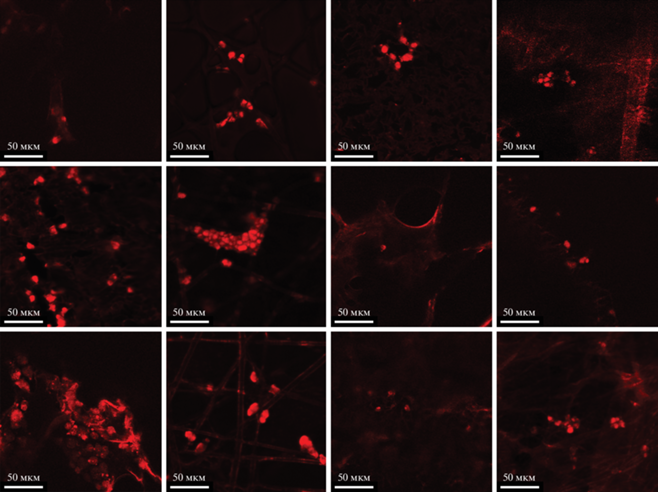
В ходе эксперимента по оценке пролиферации клеток линии HEK293Т выявлено, что, за небольшим исключением, на обоих губчатых матриксах клетки делились в большем количестве по сравнению с неткаными матриксами.
Максимальное увеличение пролиферации клеток линии HEK293Т наблюдали на композитном матриксе НГ с хитозаном (НГх). Обработка хитозаном привела к максимальному увеличению пролиферации клеток на неориентированном губчатом матриксе (НГх), а прирост клеток за двое суток составил 123.3%. Похожую картину наблюдали в отношении ориентированного нетканого матрикса с хитозаном (ОНх). Обработка хитозаном привела к значительному по сравнению с ОН и ОНк увеличению пролиферации, а прирост клеток за двое суток составил 103.5%.
Использование композитных матриксов с коллагеном не привело к максимальному увеличению пролиферации ни на одном из матриксов. Самую низкую пролиферацию клеток линии HEK293Т наблюдали на всех типах неориентированных нетканых матриксов (НН, ННк, ННх), а в случае матрикса ОГ добавление композитных слоев не увеличило, а уменьшило пролиферацию.
Таким образом, использование матриксов на основе PLA с композитным слоем хитозана привело к максимальному увеличению пролиферации клеток линии HEK293Т на самом пористом губчатом матриксе НГх на 123.3% и на матриксе с направленной ориентацией волокон ОНх на 103.5%.
Полученные результаты согласуются с данными по адгезии первичной нейрональной культуры [16].
Результаты исследования методом флуоресцентной микроскопии полностью подтвердили данные количественной оценки клеток линии HEK293Т.
На рис. 1 представлены микрофотографии клеток линии HEK293Т на полилактидных матриксах НГ, НН, ОГ, ОН (сверху), на композитных полилактидных матриксах с коллагеном: НГк, ННк, ОГк, ОНк (посередине) и на композитных полилактидных матриксах с хитозаном: НГх, ННх, ОГх, ОНх (снизу).
ЗАКЛЮЧЕНИЕ
Полученные в ходе эксперимента результаты демонстрируют зависимость скорости пролиферации от архитектуры, типа и наполнения PLA-матрикса. Показано, что на губчатых матриксах клетки делятся лучше, чем на нетканых. Обработка хитозаном приводит к увеличению пролиферации клеток линии HEK293Т на матриксе НГх на 123.3% и на матриксе ОНх на 103.5%, тогда как обработка матриксов коллагеном не приводит к увеличению пролиферации. Минимальная пролиферация клеток наблюдалась на неориентированных нетканых матриксах (НН, ННк, ННх), а матрикс ОГ с композитными слоями продемонстрировал снижение пролиферации относительно исходного образца.
Таким образом, пролиферация клеток линии HEK293Т значительно зависит от наполнения и поверхности PLA-матрикса. Полученные данные полностью согласуются с результатами флуоресцентной микроскопии, а также с полученными ранее данными по адгезии первичной нейрональной культуры.
Работа выполнена при поддержке Российского научного фонда (грант № 21-13-00321 “Деформационное поведение биоразлагаемых матриксов различного типа при механических нагрузках”).
Список литературы
Zhang Y., Venkateswaran S., Higuera G.A. et al. // Adv. Healthc. Mater. 2020. V. 9 (4). P. 1901347. https://doi.org/10.1002/adhm.201901347
Giordano G.G., Thomson R.C., Ishaug S.L. et al. // J. Biomed. Mater. Res. 1997. V. 34. P. 87. https://doi.org/10.1002/(SICI)1097-4636(199701)34:1<87::AID-JBM12>3.0.CO;2-M
Huang H.D., Xu J.Z., Fan Y. et al. // J. Phys. Chem. 2013. V. 117. P. 10641. https://doi.org/10.1021/jp4055796
Huang W., Sunami Y., Kimura H., Zhang S. // Nanomaterials. 2018. V. 8. P. 512. https://doi.org/10.3390/nano8070519
Bu Y., Ma J., Be J., Wang S. // Front Bioeng. Biotechnol. 2019. V. 7. P. 98. https://doi.org/10.3389/fbioe.2019.00098
Donoso M.G., Méndez-Vilas A., Bruque J.M., González-Martin M.L. // Int. Biodeterior. Biodegradation. 2007. V. 59. № 3. P. 245. https://doi.org/10.1016/j.ibiod.2006.09.011
Chung T., Liu D., Wang S., Wang Sh. // Biomaterials. 2003. V. 24. № 25. P. 4655. https://doi.org/10.1016/s0142-9612(03)00361-2
Annunziata M., Nastri L., Cecoro G., Guida L. // Molecules. 2017. V. 22. P. 2214. https://doi.org/10.3390/molecules22122214
Okamura Y., Kabata K., Kinoshita M. et al. // Adv. Mater. 2009. V. 21. P. 4388. https://doi.org/10.1002/adma.200901035
Wen J., Weinhart M., Lai B. et al. // Biomaterials. 2016. V. 86. P. 42. https://doi.org/10.1016/j.biomaterials.2016.01.067
Hoshiba T., Yoshikawa C., Sakakibara K. // Langmuir. 2018. V. 34 (13). P. 4043. https://doi.org/10.1021/acs.langmuir.8b00233
Amani A., Kabiri T., Shafiee S., Hamidi A. // Iran J. Pharm. Res. 2019. V. 18. № 1. P. 125.
Stepanenko A.A., Dmitrenko V.V. // Gene. 2015. V. 569. № 2. P. 182. https://doi.org/10.1016/j.gene.2015.05.065
Gooskens S.L., Klasson T.D., Gremmels H. et al. // Mol. Oncol. 2018. V. 12. № 2. P. 166. https://doi.org/10.1002/1878-0261.12149
Xie H., Heier C., Kien B. et al. // Biochim. Biophys. Acta Mol. Cell. Biol. Lipids. 2020. V. 1865. № 9. P. 158737. https://doi.org/10.1016/j.bbalip.2020.158737
Азиева А.М., Ястремский Е.В., Кириллова Д.А. и др. // Кристаллография. 2023. Т. 68. № 6. С. 983. https://doi.org/10.1134/S1063774523600308
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии